
- •Техническая термодинамика. Определение. Общие сведения.
- •4. Диаграммы термодинамических процессов в pv, ts и hS координатах.
- •5. Уравнение состояния идеального газа.
- •6. Термодинамические процессы изменения состояния идеального газа.
- •8. Теплоемкость газов.
- •9. Истечение газов.
- •10. Теплообмен. Виды теплообмена.
- •11. Теплопроводность газов.
- •12. Конвективный теплообмен. Основы теории подобия.
- •13.Лучистый теплообмен.
- •14.Факторы, влияющие на интенсивность теплообмена.
- •15.Круговой процесс. Цикл Карно.
- •16. Параметры состояния термодинамической системы (давление, температура, удельный объем).
- •17. Энтальпия, Энтропия. Определение, физический смысл, размерность.
- •18. Политропный процесс. Частные случаи политропного процесса.
- •19. Нагрев и охлаждение твердых тел.
- •20. Уравнение состояния реальных газов.
- •21. Параметры и функции состояния воды и водяного пара.
- •22. Процесс преобразования в pv диаграмме.
- •23. Законы термодинамики.
- •24. Принцип работы турбины.
- •25. Паротурбинные установки (пту). Циклы пту.
- •26. Газотурбинные установки ( гту). Циклы гту.
- •27.Методы повышения экономичности работы пту и гту установок.
- •28.Промышленные холодильные установки. Циклы холодильных установок.
- •29.Теплопередача. Общий вид уравнений.
- •30.Цикл Ренкина. Цикл компрессора.
- •31.Циклы двигателей внутреннего сгорания.
- •32.Паросиловые установки. Перегрев пара. Термический кпд. Удельный расход пара.
- •33.Котельные установки. Типы котлов и их конструктивные особенности.
- •34. Котельно-вспомогательное оборудование. Назначение и основные характерстики.
- •35. Тепловой баланс котлоагрегата.
- •36.Конструктивные особенности паровых и водогрейных котлов.
- •37.Водоподготовка и водный режим паровых и водогрейных котлов.
- •38.Топливо. Виды топлива. Условное топливо.
- •39.Процессы горения. Расчет процессов горения.
- •40.Топки котлов и печей. Классификация и характеристика топочных устройств.
- •41. Особенности сжигания твердых и газообразных топлив
- •42.Тепловые электрические станции. Общие сведения.
- •43.Тепловые сети.
- •44.Основные элементы тепловых сетей.
- •45. Расчет тепловых сетей.
- •46.Системы теплоснабжения (водяные сети).
- •47.Системы пароснабжения. Сбор и возврат конденсата.
- •48.Режимы работы систем теплоснабжения.
- •49. Температурные графики систем отопления и горячего водоснабжения.
- •50.Наладка и регулирование систем теплоснабжения.
- •51.Теплообменные аппараты. Основные типы. Конструкция.
- •52.Расчет теплообменных аппаратов.
- •53.Сушильные установки, h-d диаграмма
- •54.Промышленные печи.
18. Политропный процесс. Частные случаи политропного процесса.
До сих пор рассматривались процессы, у которых имелись вполне определенные признаки: изохорный процесс осуществлялся при постоянном объеме; изобарный — при постоянном давлении; изотермический — при постоянной температуре; адиабатный— при отсутствии теплообмена между рабочим телом и внешней средой. Наряду с этими процессами можно представить еще бесконечное множество процессов, у которых имеются другие постоянные признаки.
Условились всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой.
Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный,— если они протекают при постоянной удельной теплоемкости, являются частными случаями политропного процесса. Итак, политропный процесс проходит при постоянной теплоемкости.
Cp=const

19. Нагрев и охлаждение твердых тел.
Когда твердое тело нагревается, его температура повышается, а энергия частиц растет. Наконец наступаем точка плавления. В этот момент частицы обретают достаточно энергии, чтобы разорвать силы притяжения, и твердое тело плавится. Дальнейшее нагревание приводит к тому, что жидкость достигает точки кипения, частицы ее окончательно освобождаются друг от друга, и жидкость превращается в газ. Пламя свечи нагревает воск, и он тает, но застывает вновь, стекая от пламени. Гейзеры выбрасывают на поверхность кипящую воду и пар, разогретые вулканическими процессами в земной коре. Когда вещество остывает, происходит обратный процесс. Когда температура газа падает до точки кипения, газ конденсируется и становится жидкостью. Охладившись до точки плавления, жидкость твердеет (замерзает) и превращается в твердое тело. Есть вещества, например углекислый газ, переходящие из твёрдого состояния в газообразное, минуя жидкое. Такое явление называется возгонкой. Когда вулканические процессы разогревают подземную воду до кипения, появляются гейзеры. Вода превращается в пар, давление возрастает, и кипящая вода и пар устремляются по трещинам вверх и вырываются на поверхность.
20. Уравнение состояния реальных газов.
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса:
(P + a/2)·( – b) = R·T . (6.3)
а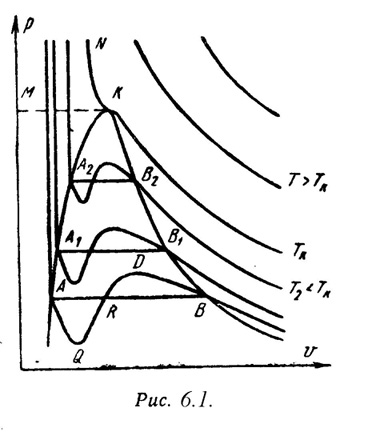 ,
b – постоянные величины, первая учитывает
силы взаимодействия, вторая учитывает
размер молекул.
a/2
– характеризует добавочное давление,
под которым находится реальный газ
вследствие сил сцепления между молекулами
и называется внутренним
давлением.
Для жидких тел это давление имеет большие
значения (например, для воды при 200С
составляет 1050 Мпа), а для газов из-за
малых сил сцепления молекул оно очень
мало. Поэтому внешнее давление, под
которым находится жидкость, оказывает
ничтожное влияние на её объем, и жидкость
считают несжимаемой. В газах в виду
малости значения a/2
внешнее давление легко изменяет их
объем.
Уравнение Ван-дер-Ваальса
качественно верно отображает поведение
жидких и газообразных веществ, для
двухфазных состояний оно неприменимо.
На
PV – диаграмме (рис.6.1) показаны изотермы
построенные по уравнению Ван-дер-Ваальса.
Из кривых видно, что при сравнительно
низких температурах имеются волнообразные
участки. Чем выше температура, тем короче
эти части кривых. Эти волнообразные
кривые указывают на непрерывный переход
от жидкого состояния в парообразное
при данной температуре. Точка А
соответствует состоянии жидкости, точка
В относится парообразному состоянии
вещества.В действительности переход
из жидкого состояния в парообразное
всегда происходит через двухфазное
состояние вещества. При этом при данной
температуре процесс перехода происходит
также и при постоянном давлении. Этот
действительный переход из жидкого
состояния в парообразное изображается
прямой линией АВ.
Практически для
особо чистых веществ возможно осуществление
участков волнообразной кривой AQ и DB. В
первом случае имеют место неустойчивые
состояния перегретой жидкости, а во
втором – переохлажденного пара.
,
b – постоянные величины, первая учитывает
силы взаимодействия, вторая учитывает
размер молекул.
a/2
– характеризует добавочное давление,
под которым находится реальный газ
вследствие сил сцепления между молекулами
и называется внутренним
давлением.
Для жидких тел это давление имеет большие
значения (например, для воды при 200С
составляет 1050 Мпа), а для газов из-за
малых сил сцепления молекул оно очень
мало. Поэтому внешнее давление, под
которым находится жидкость, оказывает
ничтожное влияние на её объем, и жидкость
считают несжимаемой. В газах в виду
малости значения a/2
внешнее давление легко изменяет их
объем.
Уравнение Ван-дер-Ваальса
качественно верно отображает поведение
жидких и газообразных веществ, для
двухфазных состояний оно неприменимо.
На
PV – диаграмме (рис.6.1) показаны изотермы
построенные по уравнению Ван-дер-Ваальса.
Из кривых видно, что при сравнительно
низких температурах имеются волнообразные
участки. Чем выше температура, тем короче
эти части кривых. Эти волнообразные
кривые указывают на непрерывный переход
от жидкого состояния в парообразное
при данной температуре. Точка А
соответствует состоянии жидкости, точка
В относится парообразному состоянии
вещества.В действительности переход
из жидкого состояния в парообразное
всегда происходит через двухфазное
состояние вещества. При этом при данной
температуре процесс перехода происходит
также и при постоянном давлении. Этот
действительный переход из жидкого
состояния в парообразное изображается
прямой линией АВ.
Практически для
особо чистых веществ возможно осуществление
участков волнообразной кривой AQ и DB. В
первом случае имеют место неустойчивые
состояния перегретой жидкости, а во
втором – переохлажденного пара.
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами.
