
- •Механизм мышечного сокращения
- •2. Физиологические свойства мышц.
- •3. Виды мышечных сокращений.
- •4. Структура и иннервация поперечно-полосатых скелетных мышц.
- •Механизм сокращения мышечного волокна.
- •1. Специальные реакции субстратного фосфорилирования
- •2. Гликолиз, гликогенолиз.
- •3. Окислительное фосфорилирование.
Механизм сокращения мышечного волокна.
Механизм мышечного сокращения. В процессе сокращения мышечного волокна в нем происходят следующие преобразования:
А. Электрохимическое преобразование:
1. Генерация ПД.
2. Распространение ПД по Т-системе.
3. Электрическая стимуляция зоны контакта Т-системы и саркоплазматического ретикулума, активация ферментов, образование инозитолтрифосфата, повышение внутриклеточной концентрации ионов Са2+.
Б. Хемомеханическое преобразование:
4. Взаимодействие ионов Са2+ с тропонином, освобождение активных центров на актиновых филаментах.
5. Взаимодействие миозиновой головки с актином, вращение головки и развитие эластической тяги.
6. Скольжение нитей актина и миозина относительно друг друга, уменьшение размера саркомера, развитие напряжения или укорочение мышечного волокна.
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецептором концевой пластинки приводит к активации АХ-чувствительных каналов и появлению потенциала концевой пластинки, который может достигать 60 мВ. При этом область концевой пластинки становится источником раздражающего тока для мембраны мышечного волокна и на участках клеточной мембраны, прилегающих к концевой пластинке, возникает ПД, который распространяется в обе стороны со скоростью примерно 3—5 м/с при температуре 36 oС. Таким образом, генерация ПД является первым этапом мышечного сокращения.
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна. Т-система тесно контактирует с терминальными цистернами саркоплазматической сети двух соседних саркомеров. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта и образованию инозитолтрифосфата. Инозитолтрифосфат активирует кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению внутриклеточной концентрации Са2+ с 107до 105 M. Совокупность процессов, приводящих к повышению внутриклеточной концентрации Са2+ составляет сущность третьего этапа мышечного сокращения. Таким образом, на первых этапах происходит преобразование электрического сигнала ПД в химический — повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
При повышении внутриклеточной концентрации ионов Са2+ тропомиозин смещается в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина. Это смещение тропомиозина обусловлено изменением конформации молекулы белка тропонина при связывании Са2+ . Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
Существенная роль кальция в механизме мышечного сокращения была доказана в опытах с применением белка экворина, который при взаимодействии с кальцием излучает свет. После инъекции экворина мышечное волокно подвергали электрической стимуляции и одновременно измеряли мышечное напряжение в изометрическом режиме и люминесценцию экворина. Таким образом, четвертым этапом электромеханического сопряжения является взаимодействие кальция с тропонином.
Следующим, пятым, этапом электромеханического сопряжения является присоединение головки поперечного мостика к актиновому филаменту к первому из нескольких последовательно расположенных стабильных центров. При этом миозиновая головка поворачивается вокруг своей оси, поскольку имеет несколько активных центров, которые последовательно взаимодействуют с соответствующими центрами на актиновом филаменте. Вращение головки приводит к увеличению упругой эластической тяги шейки поперечного мостика и увеличению напряжения. В каждый конкретный момент в процессе развития сокращения одна часть головок поперечных мостиков находится в соединении с актиновым филаментом, другая свободна, т. е. существует последовательность их взаимодействия с актиновым филаментом. Это обеспечивает плавность процесса сокращения. На четвертом и пятом этапах происходит хемомеханическое преобразование.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга и уменьшению размеров саркомера и общей длины мышцы, что является шестым этапом. Совокупность описанных процессов составляет сущность теории скольжения нитей
Первоначально полагали, что ионы Са2+ служат кофактором АТФазной активности миозина. Дальнейшие исследования опровергли это предположение. У покоящейся мышцы актин и миозин практически не обладают АТФазной активностью. Присоединение головки миозина к актину приводит к тому, что головка приобретает АТФазную активность.
Гидролиз АТФ в АТФазном центре головки миозина сопровождается изменением конформации последней и переводом ее в новое, высокоэнергетическое состояние. Повторное присоединение миозиновой головки к новому центру на актиновом филаменте вновь приводит к вращению головки, которое обеспечивается запасенной в ней энергией. В каждом цикле соединения и разъединения головки миозина с актином расщепляется одна молекула АТФ на каждый мостик. Быстрота вращения определяется скоростью расщепления АТФ. Очевидно, что быстрые фазические волокна потребляют значительно больше АТФ в единицу времени и сохраняют меньше химической энергии во время тонической нагрузки, чем медленные волокна. Таким образом, в процессе хемомеханического преобразования АТФ обеспечивает разъединение головки миозина и актинового филамента и энергетику для дальнейшего взаимодействия головки миозина с другим участком актинового филамента. Эти реакции возможны при концентрации кальция выше 106М.
Описанные механизмы укорочения мышечного волокна позволяют предположить, что для расслабления в первую очередь необходимо понижение концентрации ионов Са2+. Экспериментально было доказано, что саркоплазматическая сеть имеет специальный механизм — кальциевый насос, который активно возвращает кальций в цистерны. Активация кальциевого насоса осуществляется неорганическим фосфатом, который образуется при гидролизе АТФ, а энергообеспечение работы кальциевого насоса также за счет энергии, образующейся при гидролизе АТФ. Таким образом, АТФ является вторым важнейшим фактором, абсолютно необходимым для процесса расслабления. Некоторое время после смерти мышцы остаются мягкими вследствие прекращения тонического влияния мотонейронов. Затем концентрация АТФ снижается ниже критического уровня и возможность разъединения головки миозина с актиновым филаментом исчезает. Возникает явление трупного окоченения с выраженной ригидностью скелетных мышц.
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии.
Структура саркомера и механизм сокращения мышечного волокна
Саркомер (повторяющийся сегмент миофибриллы) состоит из двух половин светлого, оптически изотропного диска (I) и одного темного, анизотропного (H) диска. Электронно-микроскопический и биохимический анализ показывает, что у позвоночных темный диск сформирован параллельным пучком толстых (диаметром порядка 10 нм) миозиновых нитей, имеющих длину около 1,6 мкм. Молекулярная масса белка миозина составляет 500 000 дальтон. На нитях миозина расположены выступы — головки миозиновых молекул длиной 20 нм. В светлых дисках имеются тонкие нити (диаметром 5 нм, длиной 1 мкм), построенные из белка актина (молекулярная масса 42 000 дальтон), а также тропомиозина и тропонина. В районе Z-линии, разграничивающей соседние саркомеры, пучок тонких нитей скреплен Z-мембраной.
Соотношение тонких и толстых нитей в саркомере составляет 2:1. Миозиновые и актиновые нити саркомера расположены так, что тонкие нити могут свободно входить между толстыми, т. е. "задвигаться" в A-диск, что и происходит при сокращении мышцы. В силу этого длина светлой части саркомера — I-диска — может быть разной: при пассивном растяжении мышцы она увеличивается до максимума, при сокращении может уменьшаться до нуля.
Механизм сокращения состоит в перемещении (протягивании) тонких нитей вдоль толстых к центру саркомера за счет "гребных" движений головок миозина, периодически прикрепляющихся к тонким нитям, т. е. за счет поперечных актомиозиновых мостиков.
При исследовании движения мостиков методом дифракции рентгеновских лучей показано, что амплитуда этих движений составляет 20 нм, а частота — 5−50 колебаний/с. Каждый мостик то прикрепляется и тянет нить, то открепляется и "ждет" условий для нового прикрепления. Но огромное множество мостиков работает "вразнобой" и поэтому их общая тяга оказывается равномерной во
Работа головки миозина (актомиозинового мостика): I — в покое головка миозина (1) фосфорилирована, но ее взаимодействие с актином (2) запрещено тропонин-тропомиозиновым комплексом (3); II — при возбуждении волокна и росте концентрации кальция последний связывается с тропонином. Тропонин "отводит" тропомиозин в сторону, разрешая взаимодействие фосфорилмиозина с актином; III-IV — при взаимодействии фосфорилмиозина с актином головка миозина "нагибается", перемещая нить актина; при этом тратится энергия и фосфорилмиозин распадается на миозин, АДФ и фосфат; V — при наличии свободного АТФ в среде головка миозина отрывается от актина; далее происходит фосфорилирование миозина и его блокировка системой тропонин-тропомиозина из-за ухода Са2+ в саркоплазматический ретикулум
Разнообразные исследования привели к следующему представлению о механизме циклической работы миозинового мостика.
В покое мостик заряжен энергией (миозин фосфорилирован), но он не может соединиться с нитью актина, ибо между ними включена система из нити тропомиозина и глобулы тропонина.
При активации мышечного волокна и появлении в миоплазме ионов Са2+ (в присутствии АТФ) тропонин изменяет свою конформацию и отодвигает нить тропомиозина, открывая для миозиновой головки возможность соединения с актином. Соединение головки фосфорилированного миозина с актином приводит к резкому изменению конформации мостика (его "сгибанию") и перемещению нити актина на один шаг (20 нм) с последующим разрывом мостика. Энергию на этот акт дает распад макроэргической фосфатной связи, включенной в фосфорилактомиозин.
После этого в силу падения локальной концентрации Са2+ и отсоединения его от тропонина тропомиозин снова блокирует актин, а миозин снова фосфорилируется за счет АТФ. Последний не только заряжает системы для дальнейшей работы, но и способствует временному разобщению нитей, т. е. пластифицирует мышцу, делает ее способной растягиваться под влиянием внешних сил. Полагают, что на одно рабочее движение одного мостика тратится одна молекула АТФ, причем роль АТФазы играет актомиозин (в присутствии ионов Mg2+ и Са2+). Всего при одиночном сокращении тратится 0,3 мкМ АТФ на 1 г мышцы.
Необходимо еще раз подчеркнуть, что АТФ играет в мышечной работе двоякую роль: фосфорилируя миозин, он обеспечивает энергией сокращение, но, находясь в свободном состоянии, он обеспечивает и расслабление мышцы (ее пластификацию). При исчезновении АТФ из миоплазмы развивается непрерывное сокращение — контрактура.
Все эти феномены могут быть продемонстрированы и на изолированных актомиозиновых комплексах-нитях. Такие нити без АТФ твердеют (ригор), при добавлении АТФ — расслабляются, а при добавлении еще и Са2+ производят обратимое сокращение, аналогичное нормальному.
Основное положение теории скользящих нитей – во время скольжения (сокращения) сами актиновые и миозиновые нити не укорачиваются, так как ширина диска А остается при сокращении постоянной, а І-диски и Н-зоны становятся более узкими или совсем исчезают. Длина протофибрилл не изменяется и при растяжении мышцы. Вместо этого пучки тонких нитей, скользя, выходят из промежутков между толстыми нитями, так что степень их перекрытия уменьшается
Каким же образом осуществляется «разнонаправленное скольжение» актиновых нитей в соседних половинах саркомера?
Во время сокращения каждая головка миозина, или поперечный мостик, связывает миозиновую протофибриллу с актиновой. Наклоны головок создают объединенное усилие, и происходит скольжение (гребок), продвигающий актиновую нить к середине саркомера. Биполярная организация молекул миозина в двух половинах саркомера уже обеспечивает возможность скольжения актиновых нитей в противоположном направлении в левой и правой половине саркомера.
Когда мышца расслабляется, головки миозина отходят от актиновых нитей. Поскольку актиновые и миозиновые нити могут легко скользить относительно друг друга, сопротивление растяжению в расслабленных мышцах оказывается низким, поэтому удлинение мышцы во время расслабления является пассивным.
ЭТАПЫ ГЕНЕРАЦИИ СОКРАЩЕНИЯ.
Стимуляция мышечного волокна: возбуждение мышц обычно происходит при поступлении потенциала действия от иннервирующих мотонейронов через посредство нервно-мышечных синапсов.
В результате на мембране мышечного волокна формируется ПД, который распространяется вглубь мышечного волокна к миофибриллам.
Происходит процесс электромеханического сопряжения: он представляет собой преобразование электрического потенциала действия в механическое «скольжение» протофибрилл по отношению друг к другу. Этот процесс происходит в несколько этапов с обязательным посредством ионов кальция!
Механизм, посредством которого Са2+ активирует волокно, легче понять при рассмотрении структуры актиновых нитей. Актиновая нить длиной около 1 мкм и толщиной 5-7 нм состоит из двух закрученных один вокруг другого и напоминающих нитки бус мономеров актина толщиной каждой по 5 нм. Через регулярные промежутки примерно 40 нм на цепях актина находятся сферические молекулы тропонина, а в желобках между цепями актина лежат нити тропомиозина. В отсутствии Са2+, т.е. при расслаблении миофибрилл, длинные молекулы тропомиозина располагаются так, что блокируют прикрепление поперечных мостиков миозина к актиновым цепям. Под влиянием активирующего начала ионов Са2+ молекулы тропомиозина глубже опускаются в желобки между мономерами актина, открывая участки прикрепления для поперечных мостиков миозина. В результате мостики миозина прикрепляются к актиновым нитям, АТФ расщепляется и развивается мышечная сила. Эти активационные эффекты обусловлены действием Са2+ на тропонин, причем последний работает как «кальциевый переключатель», а именно: при связывании с Са2+ молекула тропонина деформируется так, что она толкает тропомиозин в желобки между нитями актина. При этом концентрация тонов Са2+ должна достигать пороговой величины 10-6 – 10-5 моль/л.
Хранение и высвобождение ионов кальция. В состоянии расслабления мышца содержит более 1 мкмоль Са на 1 г сырого веса. Если бы соли Са не были изолированы в особых внутриклеточных хранилищах, обогащенные кальцием мышечные волокна находились бы в состоянии непрерывного сокращения. Структура внутриклеточных систем хранения кальция следующая: во многих участках мембрана мышечной клетки углубляется внутрь волокна, перпендикулярно его продольной оси, образуя трубки; эта система поперечных трубочек (Т-система) соединяется с внеклеточной средой. Перпендикулярно Т-системе, т.е. параллельно миофибриллам, расположена система продольных трубочек (истинный саркоплазматический ретикулум). Пузырьки на концах этих трубочек, терминальные цистерны, находятся очень близко к мембранам поперечной системы, образуя триады. В этих пузырьках и хранится внутриклеточный Са2+. В отличие от поперечной системы продольная система не соединяется с окружающей средой.
Таким образом, электромеханическое сопряжение происходит посредством распространения потенциала действия по мембранам поперечной системы внутрь клетки. При этом возбуждение быстро проникает во внутрь волокна, переходит к продольной системе и, в конечном счете, вызывает высвобождение ионов Са2+, которые хранятся в терминальных цистернах, во внутриклеточную жидкость около миофибрилл, что ведет к сокращению.
РОЛЬ АТФ В МЕХАНИЗМЕ МЫШЕЧНОГО СОКРАЩЕНИЯ
В процессе взаимодействия миозиновых и актиновых нитей в присутствии Са2+ важную роль играет АТФ.
Энергия АТФ используется во время деятельности скелетной мышцы для трех основных процессов:
работы натрий-калиевого насоса, обеспечивающего поддержание постоянства градиента концентрации ионов натрия и калия по обе стороны мембраны;
процесса скольжения актиновых и миозиновых нитей, ведущего к укорочению миофибрилл;
работы кальциевого насоса, необходимого для расслабления волокна.
В соответствии с этим фермент АТФаза локализован в трех различных структурах мышечного волокна: клеточной мембране, миозиновых нитях, мембранах саркоплазматического ретикулума. АТФ гидролитически арсщепляется и, таким образом, энергетически утилизируется с помощью АТФазы – фермента миозина; причем, процесс активируется актином.
Потребление АТФ при сокращении. Сейчас известно, что головки миозина, которые взаимодействуют с актином, сами содержат каталитические активные центры для расщепления АТФ. АТФаза миозина активируется актином в присутствии ионов Mg2+. Поэтому при физиологическом ионном составе среды, т.е. в присутствии ионов Mg2+, АТФ расщепляется с освобеждением АДФ и фостата только в случае прикрепления головки миозина к активирующему белку – актину. В каждом цикле прикрепления-отсоединения поперечного мостика АТФ расщепляется только один раз (вероятно, 1 молекула АТФ на 1 поперечный мостик). Это означает, что чем больше поперечных мостиков находится в активном состоянии, тем выше скорость расщепления АТФ и сила, развиваемая мышцей. Таким образом, скорость расщепления АТФ (или метаболическая скорость) и сила, развиваемая мышцей, бывают обычно пропорциональны друг другу. Мышечное сокращение происходит тем быстрее, чем скорее передвигаются поперечные мостики, т.е. чем больше гребковых движений они делают в единицу времени. В результате быстрые мышцы потребляют больше АТФ (или энергии) в единицу времени, чем медленные мышцы, и сохраняют меньше энергии во время тонического удержания нагрузки. Поэтому для «изометрической работы» организм использует преимущественно медленные (тонические) «красные» мышцы, тогда как бедные миоглобином «белые» мышцы служат для быстрых движений.
Волокно мышечное медленного сокращения (тип I, тонические)
Волокна скелетной мускулатуры могут быть в целом классифицированы по принципу быстрого или медленного сокращения, основанного на их сократительных и метаболических свойствах и ассоциированных с ними участков экспрессии генов ( Hughes, 1998 ). Окислительные волокна медленного сокращения (тип I) вовлечены в процессы длительного тонического сокращения и поддерживают концентрацию внутриклеточного кальция на относительно высоком уровне (100-300 нМ).
Медленные (тонические) мышечные волокна расположены в глубоких слоях мышц конечностей. Они красного цвета, так как в них присутствует миоглобин и цитохромовые пигменты. Клетки медленных мышечных волокон содержат много митохондрий, а саркоплазматический ретикулум развит слабо, содержание гликогена невелико. Медленные мышечные волокна иннервируются тонкими нервными волокнами 5 мкм в диаметре. На одном мышечном волокне несколько концевых пластинок (мультитерминальная иннервация). Скорость проведения импульса составляет 2 - 8 м/сек. Мембрана медленных волокон не обладает электрической возбудимостью, каждый импульс приводит к высвобождению лишь небольшого количества ацетилхолина. Таким образом, степень деполяризации мембраны зависит от частоты стимуляции.
В ответ на стимуляцию наблюдается медленное сокращение и потом медленное расслабление (в 3 и в 100 раз соответственно медленнее, чем у быстрых волокон.
Источником АТФ в медленных волокнах является аэробное дыхание . Многие волокна при недостатке кислорода продолжают работать за счет анаэробного гликолиза , в этом случае образуется молочная кислота и создается кислородная задолженность. По мере окисления дыхательного субстрата мобилизуются резервные углеводы и жиры. Тепло отводится от мышцы по мере его выработки. Медленные волокна обеспечивают длительное сокращение мышцы, это используется для поддержания позы.
Волокно мышечное быстрое (физическое тип IIb)
Быстрые мышечные волокна располагаются в поверхностных слоях мышц конечностей. Их клетки белого цвета, так как миоглобина и цитохромовых пигментов мало или нет совсем. Клетки быстрых мышечных волокон содержат мало митохондрий, саркоплазматический ретикулум хорошо развит, имеется множество гликогеновых гранул.
Быстрые мышечные волокна иннервируются толстыми нервными волокнами 10 - 20 мкм в диаметре. Обычно на одном мышечном волокне одна или две концевых пластинки. Скорость проведения импульса составляет 8 - 40 м/сек. Мембрана обладает электрической возбудимостью, когда возникает потенциал действия, развивается ответ типа "все или ничего". Наблюдается быстрое сокращение (в 3 раза быстрее, чем у медленных волокон ) и довольно быстрое утомление.
Источником АТФ служат анаэробные процессы ( гликолиз ), быстро создается кислородная задолженность. В качестве дыхательного субстрата интенсивно используется гликоген. Тепло поглощается волокнами, так как кровеносная система не обеспечивает его быстрого отведения. Мышца некоторое время сокращается и тогда, когда кровеносная система не успевает обеспечить дополнительную доставку кислорода.
Быстрые волокна обеспечивают немедленное быстрое сокращение мышц, когда кровеносная система еще только приспосабливается к новому уровню мышечной активности. Гликолитические волокна быстрого сокращения используются для внезапных, взрывных сокращений и характеризуются краткими высокоамплитудными неустойчивыми и низкими концентрациями Ca2+ (меньше 50 нМ). Данные свойства волокон скелетных мышц зависят от вида нейростимуляции двигательной активности таким образом, что тоническая активность мотонейрона обеспечивает возникновение фенотипа медленных волокон, тогда как действие нечастотного (Unfreqent) мотонейрона приводит к формированию быстрых волокон.
Механизм действия АТФ. Молекула АТФ с поперечным мостиком после завершения его «гребкового» движения, и это обеспечивает энергию для разделения компонентов, участвующих в реакции – актина и миозина. После этого головки миозина отсоединяются от актина; затем АТФ расщепляется до АДФ и фосфата с промежуточным образованием комплекса фермент-продукт. Расщепление является обязательным условием для следующего прикрепления поперечного мостика к актину с освобождением АДФ и фосфата и «гребковым» движением мостика. Когда движение мостика завершается, с ним связывается новая молекула АТФ, и начинается новый цикл.
Циклическая активность поперечных мостиков, т.е. ритмическое прикрепление и отсоединение мостиков, которое обеспечивает мышечное сокращение, возможна только до тех пор, пока продолжается гидролиз АТФ, т.е. пока происходит активация АТФазы. Если расщепление АТФ заблокировать, мостики не могут повторно прикрепляться, мышца расслабляется.
После смерти содержание АТФ в мышечных клетках снижается, когда оно переходит критический уровень, поперечные мостики оказываются устойчиво прикрепленными к актиновой нити (пока не произойдет аутолиз). В таком состоянии актиновые и миозиновые нити прочно связаны друг с другом, мышца находится в состоянии трупного окоченения.
Ресинтез АТФ осуществляется двумя основными путями:
ферментативный перенос фосфатной группы от креатинфосфата на АДФ. Ресинтез обеспечивается по этому пути в течение тысячных долей секунды, т.к. запасы КФ значительно больше в клетке, чем АТФ;
гликолитические и окислительные процессы в покоящейся и деятельной мышце – медленный ресинтез АТФ через окисление молочной и пировиноградной кислот.
Нарушение ресинтеза АТФ ядами ведет к полному исчезновению АТФ и креатинфосфата, вследствие чего кальциевый насос перестает работать. Концентрация Са2+ в области миофибрилл значительно возрастает и мышца приходит в состояние длительного необратимого укорочения. Это состояние называется контрактурой.
МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ.
1. Сродство комплекса "миозин-АТФ" к актину очень низкое.
2. Сродство комплекса "миозин-АДФ" к актину очень высокое.
3. Актин ускоряет отщепление АДФ и Ф от миозина и при этом происходит конформационная перестройка - поворот головки миозина.
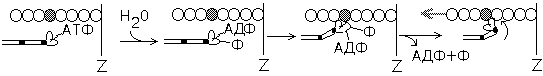
1-я стадия 2-я стадия 3-я стадия 4-я стадия
1-я стадия. Фиксация АТФ на головке миозина.
2-я стадия. Гидролиз АТФ. Продукты гидролиза (АДФ и Ф) остаются фиксированными, а выделившаяся энергия аккумулируется в головке. Мышца готова к сокращению.
3-я стадия. Образование комплекса “актин-миозин”. Он очень прочен. Может быть разрушен только при сорбции новой молекулы АТФ.
4-я стадия Конформационные изменения молекулы миозина, в результате которых происходит поворот головки миозина. Освобождение продуктов реакции (АДФ и Ф) из активного центра головки миозина.
Головки миозина ”работают” циклично, как плавники у рыбы или как весла у лодки, поэтому этот процесс называется “вёсельным механизмом” мышечного сокращения.
Исследователь Дьерди впервые выделил чистые актин и миозин. In vitro были созданы необходимые физиологические условия, при которых наблюдалось спонтанное образование толстых и тонких нитей, затем был добавлен АТФ - в пробирке происходило мышечное сокращение.
РЕГУЛЯЦИЯ СОКРАЩЕНИЯ И РАССЛАБЛЕНИЯ МЫШЦ В ЖИВОЙ КЛЕТКЕ
СОКРАЩЕНИЕ
1. Мышечное сокращение начинается с нервного импульса. Под воздействием ацетилхолина развивается возбуждение клеточной мембраны и резко повышается ее проницаемость для Са2+.
2. Са2+ поступает в цитоплазму мышечной клетки (саркоплазма) из депо - цистерн цитоплазматического ретикулума. Концентрация Са2+ в саркоплазме мгновенно увеличивается в 100 раз (с 10-7М до 10-5М).
3. Кальций связывается с тропонином "С". Это приводит к конформационным изменениям молекулы тропонина, в результате устраняется пространственное препятствие в виде тропонина "I", в результате конформационных изменений тропонина "Т" молекула тропомиозина оттягивается в сторону и открывает на поверхности актина миозин-связывающие центры.
РАССЛАБЛЕНИЕ
Чтобы произошло расслабление мышцы, необходимы следующие условия:
1. Освобождение тропонина "С" от Са2+ - для этого работает мембрано-связанный фермент Са2+-зависимая АТФаза. Этот фермент использует энергию гидролиза АТФ для переноса Са2+ обратно в цистерны против градиента их концентраций. Накоплению ионов кальция в цистернах помогает белок КАЛЬСЕКВЕСТРИН. Кальсеквестрин - связывает Са2+ в цистернах. Когда мышца готова к сокращению, концентрация Са2+ в цистернах велика.
Не только процесс сокращения, но и процесс расслабления нуждается в АТФ, потому что если нет АТФ, то не работает Са2+-зависимая АТФаза. В этих условиях кальций связан с тропонином "С" - вся система находится в активном состоянии, нет распада актомиозинового комплекса - мышца постоянно находится в состоянии сокращения. Такая ситуация наблюдается после смерти человека в состоянии "трупного окоченения".
Запасы АТФ в клетке значительны, но их хватает для обеспечения мышечной работы только в течение 0.1 секунды. Но в мышечной клетке идет очень быстрый ресинтез АТФ.
Особенность мышечной ткани - очень быстрые изменения концентрации АТФ (в 100 и более раз).
МЕХАНИЗМЫ ЭНЕРГООБЕСПЕЧЕНИЯ МЫШЕЧНОЙ РАБОТЫ
ИСТОЧНИКИ ЭНЕРГИИ:
1. Специальные реакции субстратного фосфорилирования.
2. Гликолиз, гликогенолиз.
3. Окислительное фосфорилирование.
