
- •Теория сварочных процессов
- •1. Физическая сущность процесса сварки. Три основные особенности сварочных процессов.
- •2.Классификация способов сварки по видам активации энергии и агрегатному состоянию вещества.
- •3. Основные технические задачи, решаемые с помощью сварки.
- •4. Источники тепла при сварке.
- •5. Методы расчета температур при сварке. Краевые и граничные условия.
- •6. Виды передачи тепла.
- •7. Три стадии распространения тепла при сварке. Их практическое значение.
- •8. Методы решения дифференциального уравнения теплопроводности.
- •9. Схематизация источников тепла и нагреваемых тел, применяемая для расчета температур при сварке.
- •10. Как зависит температурное поле от параметров режима сварки и теплофизических свойств свариваемого материала.
- •11. Сварочная ванна, факторы, определяющие размеры и форму сварочной ванны.
- •12. Этапы затвердевания сварочной ванны.
- •13. Образование первичных кристаллитов. Скорости затвердевания и кристаллизации.
- •14. Сварочная текстура и ее влияние на свойства сварных соединений.
- •15. Механизм образования горячих трещин при сварке.
- •16. Первичная и вторичная структуры сварных соединений.
- •17. Способы борьбы с горячими трещинами при сварке.
- •18. Холодные трещины при сварке.
- •19. Пути уменьшения склонности сварных соединений к образованию холодных трещин.
- •20. Замедленное разрушение, причины, пути уменьшения склонности сварных соединений к замедленному разрушению.
- •21. Свариваемость и методы ее оценки.
- •22. Проверка служебных характеристик сварных соединений.
- •23. Раскройте суть понятий: температурный интервал хрупкости, эффективный интервал кристаллизации, полигонизация.
- •24. Причины образования пористости при сварке. Механизм образования пор при сварке плавлением.
- •25. В чем состоят особенности протекания химических реакций при сварке?
- •26. Что представляют собой сварочные шлаки, их физико-химические характеристики и свойства?
- •27. Закон Нернста и его применение в сварочной практике.
- •28. Закон действующих масс и константа равновесия химических реакций.
- •Закон действующих масс
- •30. Легирование металла при сварке.
- •31. Рафинирование металла при сварке.
- •32. Модифицирование металла при сварке.
- •33. Виды химической неоднородности металла сварного соединения.
- •34. В чем разница между составом покрытий электродов и флюсов, а также шлаками, образующимися в ходе их расплавления при сварке.
- •35. Механизмы образования неоднородности металла шва
- •36. Объясните понятия «ликвация» и «сегрегация».
- •37. Назначение электродных покрытий, типы покрытий. Почему электроды с двухслойным покрытием можно считать перспективным видом электродов?
- •38. Факторы, определяющие характер переноса металла при дуговой сварке плавлением.
- •39. Вязкость жидкости и практическое значение её для сварочных процессов.
- •40. Окисление и диссоциация окислов при сварке.
- •41. Виды электрических дуг, применяемых в сварочных процессах.
- •42. Механизм возникновения остаточных сварочных напряжений и деформаций.
- •43. Методы борьбы со сварочными напряжениями и деформациями.
39. Вязкость жидкости и практическое значение её для сварочных процессов.
Вязкость – ( внутреннее трение ) –сопротивление ,оказываемое средой при перемещении одних ее частиц относительно других .
Из потка выделяют два поверхностных слоя с поверхностью соприкосновения F
F=2Π(r-S)1
Расстояние между ними dS. Тогда величина вязкости между слоями :
P=ηF* dV dV
dS
dS 1/с градиент скорости по нормали ,характеризует изменение скорости перемещения слоев жидкости в направлении ,перпендикулярному их движению.
Η –коэффициент пропорциональности ,зависящий от природы, состава и температуры жидкости ( коэф-т абсолютной вязкости)
При повышении температуры вязкость уменьшается, при температуре кипения равна 0.
В сварочных процессах знание вязкости необходимо для правильного выбора основных и вспомогательных материалов, для оценки гидродинамических процессов в сварочной ванне.
В язкость
(внутреннее трение)
– сопротивление, оказываемое средой
при перемещении одних её частиц
относительно других (характеристика
жидкости и газа).
язкость
(внутреннее трение)
– сопротивление, оказываемое средой
при перемещении одних её частиц
относительно других (характеристика
жидкости и газа).
Из потока выделяют два поверхностных слоя с поверхностью соприкосновения F.
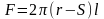
Расстояние между ними – dS. Тогда величина вязкости между этими слоями:

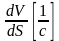 –
градиент
скорости по нормали, характеризует
изменение скорости перемещения слоёв
жидкости в направлении, перпендикулярном
их движению.
–
градиент
скорости по нормали, характеризует
изменение скорости перемещения слоёв
жидкости в направлении, перпендикулярном
их движению.
h – коэффициент пропорциональности, зависящий от природы, состава и температуры жидкости (коэффициент абсолютной вязкости).

hотн – коэффициент относительной вязкости.

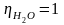 (при
Т = 20°С)
(при
Т = 20°С)
При повышении температуры вязкость уменьшается, а при температуре кипения равна нулю.
В
 сварочных процессах знание вязкости
необходимо для правильного выбора
основных и вспомогательных материалов,
для оценки гидродинамических процессов
в сварочной ванне.
сварочных процессах знание вязкости
необходимо для правильного выбора
основных и вспомогательных материалов,
для оценки гидродинамических процессов
в сварочной ванне.
В

 язкость
шлаков, образующихся на поверхности
жидкого Ме. От этой величины и характера
взаимодействия в процессе сварки зависят
технологические свойства применяемых
покрытий и флюсов, степень завершённости
металлургических процессов. С увеличением
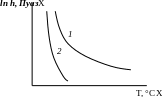
температуры, шлак снижает свою вязкость
и проходит 3 характерных состояния:
хрупкое, вязкое и жидкотекучее.
язкость
шлаков, образующихся на поверхности
жидкого Ме. От этой величины и характера
взаимодействия в процессе сварки зависят
технологические свойства применяемых
покрытий и флюсов, степень завершённости
металлургических процессов. С увеличением
температуры, шлак снижает свою вязкость
и проходит 3 характерных состояния:
хрупкое, вязкое и жидкотекучее.
Длинные шлаки плохо пропускают через себя газ, но могут образовывать толстый слой и замедлять охлаждение Ме. Короткие шлаки хорошо пропускают через себя газ, но не способны образовывать толстый слой.
Подбирая шлак можно регулировать и газовый состав шва, и тепловой режим кристаллизации.
 – жидкотекучесть.
– жидкотекучесть.
Текучесть определяет формирование шва (как положительное, так и отрицательное).
При сварке титановых сплавов необходимо принудительное формирование шва при сварке в лодочку, т.к. ширина шва большая, а рабочее сечение занижено.


40. Окисление и диссоциация окислов при сварке.
Защита расплавленного металла покрытиями, флюсами и газами для предотвращения окисления при сварке не всегда достигает цели, и содержание кислорода в наплавленном металле обычно выше, чем в основном и присадочном металле
Результатом окисления стали при сварке является растворение кислорода в железе, образование окислов железа (FeO, Fe304, Fe203) и окислов других химических элементов. Закись железа FeO, так же как кислород, растворяется в железе. Остальные окислы практически не растворяются в железе и на его свойства оказывают незначительное влияние.
Источниками окисления металла при сварке преимущественно являются газы и шлаки, в меньшей степени — поверхностные окислы (окалина, ржавчина).
Газовая среда, являющаяся источником окисления, может быть различной и зависит от применяемого способа сварки. Окисление металла газами происходит в дуговом промежутке (в процессе переноса капель электродного металла в сварочную ванну) и в сварочной ванне. При сварке стали в первую очередь окисляется железо, другие элементы окисляются с .различной интенсивностью.
Чем больше степень сродства химического элемента с кислородом, тем быстрее идет окисление элемента. Ниже перечислены некоторые химические элементы, содержащиеся в сталях, начиная с элемента с наибольшей степенью сродства с кислородом и кончая элементом с наименьшей ее величиной: Al, Ti, Si, Mn, Cr, Fe, Ni, C, Cu.
Реакции окисления железа при дуговой сварке следующие:
2Fe+ 02 = 2 FeO;
Fe+ СО 2 = FeO+ СО;
Fe+ СО = FeO+ С;
Fe+ Н20= FeO+ Н2.
Марганец и кремний, имеющие высокую степень сродства с кислородом, сильно выгорают при дуговой сварке. Выгорание углерода может идти по реакциям:
Fe3C+ 1/202 = 3Fe+ СО;
Fe3C+ 02 = 3Fe+ С02.
Некоторые шлаки вызывают и окисление металла. Одним из таких шлаков является закись железа FeO. При наличии в покрытии или во флюсе окислов железа часть закиси железа при определенных условиях будет растворяться в металле шва, обогащая его кислородом.
На поверхности основного металла (стали) обычно находятся ржавчина и окалина. При нагреве ржавчины присутствующая в ней влага испаряется, содержащийся в ней кислород повышает окислительную способность газовой среды. Окалина при плавлении металла переходит в закись железа с выделением кислорода:
Выделяющиеся закись железа FeO и кислород окисляют металл шва.,
Диссоциация газов и соединений. При диссоциации происходит распад более сложных компонентов на атомы или составные части. Этому процессу способствуют наличие высоких температур в зоне сварки и каталитическое действие расплавленного металла. При дуговой сварке в первую очередь диссоциации подвергаются молекулы газов как простых - кислород, азот, водород, так и сложных - углекислый газ СО2, пары воды Н2О и др. Диссоциация газов происходит по реакциям
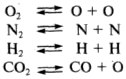
Кислород и водород при температурах дуга практически полностью диссоциируют на атомы, азот диссоциирует в меньшей степени. Диссоциация водяного пара в зависимости от температуры проходит по реакциям
![]()
Следовательно, в зависимости от условий протекания реакций водяной пар может окислять или восстанавливать металл сварочной ванны.
Диссоциации подвергаются и более сложные соединения. Во многих электродных покрытиях и флюсах содержится плавиковый шпат CaF2. При высоких температурах он разлагается по реакции
![]()
Атомы фтора, соединяясь с электронами, превращаются в ионы с малой подвижностью. Это ведет к снижению проводимости дугового промежутка и ухудшению стабильности дуги. Но в то же время атомы фтора способны связывать водород в молекулы HF, не растворяющиеся в металле ванны, уменьшая насыщение металла шва водородом.
В состав многих покрытий электродов входят карбонаты, например СаСО3. Разлагаясь при высоких температурах, они выделяют углекислый газ, который в свою очередь диссоциирует с образованием кислорода:
![]()
Находясь в атомарном состоянии, газы становятся химически активными и, реагируя с металлом, резко ухудшают его качество. Окисление – это реакция образования.
Восстановление – обратимая реакция диссоциации окислов.
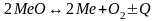
Т.к.
оксид и металл находятся в твёрдом
состоянии то константа равновесия: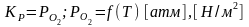
Величина равновесного парциального давления кислорода, зависящая от температуры называется упругостью диссоциации оксида. Упругость диссоциации химического соединения – концентрация единственного газообразного компонента в равновесной системе.
Ч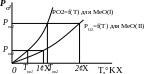 ем
меньше значение упругой диссоциации
оксида, тем прочнее это соединение. При
прочих равных условиях давление
(концентрация) свободного кислорода,
отвеч. сост. равновесия химической
реакции, тем большее его количество
связано в оксид и тем легче он образуется.
Чем больше давление свободного O2,
тем меньше сродство элемента к кислороду.
ем
меньше значение упругой диссоциации
оксида, тем прочнее это соединение. При
прочих равных условиях давление
(концентрация) свободного кислорода,
отвеч. сост. равновесия химической
реакции, тем большее его количество
связано в оксид и тем легче он образуется.
Чем больше давление свободного O2,
тем меньше сродство элемента к кислороду.
Когда
упругость диссоциации оксида сравнивается
с внешним давлением окисление прекращается
и начинается диссоциация. Если в систему
входят 2 Ме, кислород, образующийся при
диссоциации окисла Ме, у которого при
данной температуре упругость диссоциации
оксида выше, будет соединятся с другим
Ме по реакции:
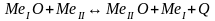 МеII
по отношению к МеI
является раскислителем. Чем меньше
упругость диссоциации оксида, тем больше
сродство Ме с O2,
тем выше его химическая активность.
МеII
по отношению к МеI
является раскислителем. Чем меньше
упругость диссоциации оксида, тем больше
сродство Ме с O2,
тем выше его химическая активность.
Большинство промышленных Ме и сплавов растворяют свои окислы, следовательно очистка Ме сварного соединения от его окислов является актуальной задачей.
При
диссоциации окислов в растворе (сварочная
ванна) возможно изменение концентрации
как окисла, так и самого Ме. Тогда
равновесие системы
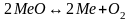
будет
при
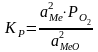 aMe
и aMeO
– активность окисла и Ме в раств. пропорц.
концентрации ???,
aMe
и aMeO
– активность окисла и Ме в раств. пропорц.
концентрации ???,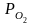 - упругость диссоциации чистого оксида
элемента.
- упругость диссоциации чистого оксида
элемента.
Упругость
диссоциации оксида Ме в растворе
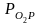 :
:
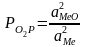
Т.к.
КР
реакции равна упругости диссоциации
того же оксида в чистом виде, то заменяя
КР
на
получим

Если концентрация окислов ® 0, то концентрация окислов в растворе ® 0.
Вывод: это значит, что чистый Ме способен растворять свои оксиды и обладает бесконечным сродством к кислороду. В реальных условиях сварки, большинство конструкционных Ме будет подвергаться окислению, т.е. количество О2 в них можно снизить только металлургическим путём раскисления.
Упругость диссоциации оксида элемента, находящегося в растворе зависит не только от природы оксида и от температуры, но и от активности или концентрации элемента в растворе. С увеличением величины активности элемента упругость диссоциации его оксида уменьшается, а прочность оксида возрастает. Поэтому при сварке, введя в жидкий Ме большее количество раскислителя, мы способствуем более полному связыванию О2 в оксид. Вследствие малого удельного веса и нерастворимости эти оксиды всплывают на поверхность сварочной ванны образуя шлак.
