
- •Теория сварочных процессов
- •1. Физическая сущность процесса сварки. Три основные особенности сварочных процессов.
- •2.Классификация способов сварки по видам активации энергии и агрегатному состоянию вещества.
- •3. Основные технические задачи, решаемые с помощью сварки.
- •4. Источники тепла при сварке.
- •5. Методы расчета температур при сварке. Краевые и граничные условия.
- •6. Виды передачи тепла.
- •7. Три стадии распространения тепла при сварке. Их практическое значение.
- •8. Методы решения дифференциального уравнения теплопроводности.
- •9. Схематизация источников тепла и нагреваемых тел, применяемая для расчета температур при сварке.
- •10. Как зависит температурное поле от параметров режима сварки и теплофизических свойств свариваемого материала.
- •11. Сварочная ванна, факторы, определяющие размеры и форму сварочной ванны.
- •12. Этапы затвердевания сварочной ванны.
- •13. Образование первичных кристаллитов. Скорости затвердевания и кристаллизации.
- •14. Сварочная текстура и ее влияние на свойства сварных соединений.
- •15. Механизм образования горячих трещин при сварке.
- •16. Первичная и вторичная структуры сварных соединений.
- •17. Способы борьбы с горячими трещинами при сварке.
- •18. Холодные трещины при сварке.
- •19. Пути уменьшения склонности сварных соединений к образованию холодных трещин.
- •20. Замедленное разрушение, причины, пути уменьшения склонности сварных соединений к замедленному разрушению.
- •21. Свариваемость и методы ее оценки.
- •22. Проверка служебных характеристик сварных соединений.
- •23. Раскройте суть понятий: температурный интервал хрупкости, эффективный интервал кристаллизации, полигонизация.
- •24. Причины образования пористости при сварке. Механизм образования пор при сварке плавлением.
- •25. В чем состоят особенности протекания химических реакций при сварке?
- •26. Что представляют собой сварочные шлаки, их физико-химические характеристики и свойства?
- •27. Закон Нернста и его применение в сварочной практике.
- •28. Закон действующих масс и константа равновесия химических реакций.
- •Закон действующих масс
- •30. Легирование металла при сварке.
- •31. Рафинирование металла при сварке.
- •32. Модифицирование металла при сварке.
- •33. Виды химической неоднородности металла сварного соединения.
- •34. В чем разница между составом покрытий электродов и флюсов, а также шлаками, образующимися в ходе их расплавления при сварке.
- •35. Механизмы образования неоднородности металла шва
- •36. Объясните понятия «ликвация» и «сегрегация».
- •37. Назначение электродных покрытий, типы покрытий. Почему электроды с двухслойным покрытием можно считать перспективным видом электродов?
- •38. Факторы, определяющие характер переноса металла при дуговой сварке плавлением.
- •39. Вязкость жидкости и практическое значение её для сварочных процессов.
- •40. Окисление и диссоциация окислов при сварке.
- •41. Виды электрических дуг, применяемых в сварочных процессах.
- •42. Механизм возникновения остаточных сварочных напряжений и деформаций.
- •43. Методы борьбы со сварочными напряжениями и деформациями.
Закон действующих масс
С законом действующих масс вы познакомились, изучая равновесие обратимых химических реакций (гл. 9 § 5). Вспомним, что при постоянной температуре для обратимой реакции
aA
+ bB
![]() dD
+ fF
dD
+ fF
закон действующих масс выражается уравнением
![]() (1)
(1)
Вы знаете, что, применяя закон действующих масс важно знать, в каком агрегатном состоянии находятся участвующие в реакции вещества. Но не только это: важно число и соотношение фаз, в данной химической системе. По числу фаз реакции делятся на гомофазные, и гетерофазные. Среди гетерофазных выделяют твердофазные реакции.
Гомофазная реакция – химическая реакция, все участники которой находятся в одной фазе. |
Такой фазой может быть смесь газов (газовая фаза), или жидкий раствор (жидкая фаза). В этом случае все частицы, участвующие в реакции, (A, B, D и F) имеют возможность совершать хаотическое движение независимо друг от друга, и обратимая реакция протекает во всем объеме реакционной системы. Очевидно, что такими частицами могут быть либо молекулы газообразных веществ, либо молекулы или ионы, образующие жидкость. Примерами обратимых гомофазных реакций являются реакции синтеза аммиака, горения хлора в водороде, реакция между аммиаком и сероводородом в водном растворе и т.п.
Если хотя бы одно вещество, участвующее в реакции, находится в иной фазе, чем остальные вещества, то обратимая реакция протекает только на границе раздела и называется гетерофазной реакцией.
Гетерофазная реакция – химическая реакция, участники которой находятся в разных фазах. |
К обратимым гетерофазным реакциям относятся реакции с участием газообразных и твердых веществ (например, разложение карбоната кальция), жидких и твердых веществ (например, осаждение из раствора сульфата бария или реакция цинка с соляной кислотой), а также газообразных и жидких веществ .
Особым случаем гетерофазных реакций являются твердофазные реакции, то есть реакции, все участники которых представляют собой твердые вещества.
Вообще-то уравнение (1) справедливо для любой обратимой реакции независимо от того, к какой из перечисленных групп она относится. Но в гетерофазной реакции равновесные концентрации веществ, находящихся в более упорядоченной фазе являются постоянными величинами и могут быть объединены в константе равновесия (см. гл. 9 § 5).
Так, для гетерофазной реакции
aAг + bBкр dDг + fFкр
закон действующих масс будет выражаться соотношением
![]() (2)
(2)
Вид этого соотношения зависит от того, какие вещества, участвующие в реакции находятся в твердом или жидком состоянии (жидком, если остальные вещества – газы).
В выражениях закона действующих масс (1) и (2) формулы молекул или ионов в квадратных скобках означают равновесную концентрацию этих частиц в газе или растворе. При этом концентрации не должны быть велики (не более 0,1 моль/л), так как эти соотношения справедливы только для идеальных газов и идеальных растворов. (При больших концентрациях закон действующих масс остается справедливым, но вместо концентрации приходится использовать другую физическую величину (так называемую активность), учитывающую взаимодействия между частицами газа или раствораю Активность не пропорциональна концентрации).
Закон действующих масс применим не только для обратимых химических реакций, ему подчиняются и многие обратимые физические процессы, например межфазные равновесия индивидуальных веществ при переходе их из одного агрегатного состояния в другое. Так, обратимый процесс испарения – конденсации воды может быть выражен уравнением
H2Oж H2Oг
Для этого процесса можно записать уравнение константы равновесия:
KC = [H2O]
Полученное соотношение подтверждает, в частности, известное вам из физики утверждение о том, что влажность воздуха зависит от температуры и давления.
.29. Раскисление металла при сварке.
Для получения наплавленного металла с механическими свойствами не ниже, чем у основного металла, необходимы меры по снижению содержания кислорода в наплавленном металле. Такими мерами являются — раскисление наплавленного металла и удаление образовавшихся окислов из сварочной ванны.
Раскисление может быть осуществлено за счет взаимодействия между металлом и шлаком или при помощи раскислителей. Раскисление металла шлаками. При наличии в сварочной ванне кислых шлаков раскисление металла происходит по реакциям:
FeO + Si02 = FeO — Si02;
2FeO + Si02 = 2Fe0-Si02.
Полученные силикаты не растворимы в металле, поэтому количество FeO' в металле уменьшается. Раскисление металла раек целителями. Сталь раскисляют введением в сварочную ванну С, Si, Мп и Аl. Наиболее распространенный метод введения раскислителей — применение сварочной проволоки, содержащей раскислители. Возможно введение раскислителей через покрытия электродов и флюсы.
Раскисление углеродом FeO+ С = Fe+ СО.
Окись углерода практически не растворима в стали. В период " нахождения жидкого металла при высоких температурах образующиеся пузырьки окиси углерода всплывают и удаляются из сварочной ванны. При применении углерода в качестве раскислителя возможно образование пор в наплавленном металле.
Раскисление марганцем FeO+ Mn = Fe+ MnO.
Окись марганца плохо растворима в железе, но способна растворить в себе до 60% FeO, следовательно, она будет уходить в шлак, увлекая за собой значительное количество FeO.
В качестве раскислителя марганец применяют в сплавах с железом и углеродом (ферромарганец), стоимость марганца невысокая.
Раскисление кремнием 2 FeO+ Si= 2Fe+ Si02.
Эта реакция в металле сопровождается реакциями образования силикатов:
Si02 + FeO= FeO-Si02;
Si02 + MnO= MnO- Si02.
Кремний весьма активный раскислитель, Si02 и силикаты практически не растворимы в железе н уходят в шлак.
Раскисление алюминием 3FeO+ 2А1 = Аl203 + 3Fe.
Сталь, раскисленная алюминием, склонна к образованию трещин при ударах в горячем состоянии. Поэтому алюминий применяют только в ограниченных количествах.
Раскисление углеродом происходит в 2 этапа:
Наблюдается одновременное присутствие железа, его закиси, углерода, окиси углерода, двуокиси углерода. Где и при каких условиях будут протекать эти реакции? В условиях равновесия Fe, FeO, C, CO, CO2. Диапазон температур DТ = 400…1200°С.
О
 бласть
I
– область устойчивого существования
восстановленного Fe.
Эта область уменьшается с ростом
температуры. Ей отвечает наличие
преимущественно восстановительной
среды в виде CO.
бласть
I
– область устойчивого существования
восстановленного Fe.
Эта область уменьшается с ростом
температуры. Ей отвечает наличие
преимущественно восстановительной
среды в виде CO.
Область II – устойчивое существование FeO. Она появляется при температуре » 600°С и увеличивается с ростом температуры. В отличие от первой области ей отвечает наличие окислительной среды, заметное количество CO2. В результате начинает развиваться процесс окисления железа по реакции

Или процесс окисления железа с образованием окиси

Если имеется магнетит (Fe3O4), восстановление происходит по реакции

Область III – область устойчивого существования магнетита. При температуре свыше 600°С эта область уменьшается. Ей характерна более сильная окислительная среда, из-за наличия значительного количества CO2. Поэтому в этой области окислительный процесс продолжается

Реальный
сварочный процесс протекает при ещё
более высоких температурах и можно
предположить следующее: При окислении
Ме устойчивой формой оксида железа
будет FeO.
Раскисление Ме углеродом идёт только
по реакции образования окиси углерода.
Т.к. при высокой температуре этот продукт
очень устойчив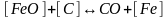

Отсюда определяют равновесную концентрацию закиси Fe в Ме считая, что содержание Fe в стали » 1 и выразив концентрацию окисла углерода через парциальное давление получим

Если полагать, что в процессе сварки в области высоких температур парциальное давление углерода » 1, то



Рассмотрим зависимость содержания растворённой в Ме закиси железа от содержания в нём углерода.
С увеличением содержания углерода в Ме в нём интенсивно уменьшается количество закиси железа. С ростом температуры процесс раскисления углерода убыстряется и раскисление идёт значительно полнее, чем при более низких температурах. Однако, несмотря на очень хорошую раскислительную способность углерод, как раскислитель, находит ограниченное применение. Это объясняется двумя обстоятельствами:
Возможность образования пор в Ме шва, особенно на участках, кристаллизующихся в последнюю очередь, сильно насыщенных углеродом. При сварке будут идти реакции выгорания углерода.
Возможность повышения содержания углерода в Ме шва, а это не всегда допустимо.
Раскисление водородом.
В
общем виде идёт реакция:




Недостатки водорода, как раскислителя:
Высокая растворимость в Ме.
Опасность образования пор и холодных трещин.
Вывод: Говоря об эффективности раскисления на основе обменных реакций следует иметь в виду, что даже когда процесс протекает длительно не достигается равновесия реакции. Поэтому при сварке отклонение от равновесия будет в сторону более высокого содержания закиси железа. В связи с этим на практике часто применяется несколько раскислителей.
Диффузионное раскисление.
Оно основано на частичном переходе закиси железа из жидкого Ме в шлак, т.к. её распределение между шлаком и Ме подчиняется закону распределения Нернста.
 константа
равновесия.
константа
равновесия.
Для развития этого вида раскисления важно, чтобы концентрация свободной закиси Ме уменьшалась, тогда новые порции закиси Ме будут переходить из Ме в шлак. Уменьшение содержания свободной закиси железа в шлаке достигается следующими путями:
С


 вязыванием
её в комплексное соединение – кислотный
оксид (с образованием силикатов или
титанитов).
вязыванием
её в комплексное соединение – кислотный
оксид (с образованием силикатов или
титанитов).Дополнительное применение раскисления на основе обменных реакций.
Разбавление шлаков нейтральными, в химическом смысле, добавками.
Константа распределения, определяющая степень перехода закиси железа из Ме в шлак, с увеличением температуры уменьшается.
При высоких температурах меньшее количество закиси Ме может перейти в шлак, нежели при низких.
При диффузионном раскислении закись железа удаляется из Ме в шлак путём диффузии, следовательно все химические процессы протекают на границе Ме – шлак, или в самом шлаке.
Недостатки: Само раскисление протекает медленно, поэтому, хотя при температурах близких к температуре плавления Ме L высока, скорость диффузии замедляется и общий процесс оказывается не очень высоким.
Процесс диффузионного раскисления наиболее заметен при образовании капли на торце электрода и при переносе её через дугу. Этому способствует очень высокая температура. Ме в капле энергично перемешивается и непрерывно контактирует со свежими порциями шлака. В сварочной ванне процесс диффузионного раскисления протекает лишь в верхнем тонком слое Ме, прилегающем к шлаку. В результате диффузионное раскисление не играет значительной роли при дуговой сварке и наиболее заметно при ЭШС.


