
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •6. Термическая устойчивость соединений элемента.
- •7. Качественные реакции на характеристичные ионы.
- •8. Применение соединений элемента.
- •Календарный план
- •Рекомендуемая литература:
- •Дополнительная литература
- •Учебные пособия кафедры*
- •Балльно-рейтинговая система оценки успеваемости студентов потоков бтп и бтс по дисциплине «Общая и неорганическая химия» во 2 семестре
- •На тему: «Окислительно-восстановительные реакции»
- •На тему: «Гальванический элемент. Электрохимическая коррозия»
- •На тему: «Электролиз водных растворов солей»
- •На тему: «Общие свойства металлов»
- •На тему: «Химические свойства элементов iiia — подгруппы
- •На тему: «Химические свойства металлов iva – подгрупп
- •Отчет по лабораторной работе №11 на тему: «Химические свойства хрома и его соединений»
- •Диаграмма Латимера для хрома:
- •- Отметить цвет раствора после добавления Na2s2o3……………….. - Сделать вывод о свойствах дихромата калия.
- •Отчет по лабораторной работе № 12 на тему: «Химические свойства марганца и его соединений»
- •На тему: «Химические свойства галогенов и их соединений»
- •На тему: «Химические свойства неметалловViа – подгруппы и их соединений (серы и ее соединений)»
- •Диаграмма Латимера для серы
- •На тему: «Химические свойства неметалловVа – подгруппы и их соединений (азота, фосфора и их соединений)»
- •Диаграмма Латимера для азота:
- •На тему: «Химические свойства неметаллов ivа – подгруппы (углерода, кремния) и их соединений»
- •Константы диссоциации некоторых кислот
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы
- •Периодическая таблица д.И.Менделеева
- Отметить цвет раствора после добавления Na2s2o3……………….. - Сделать вывод о свойствах дихромата калия.
Федеральное государственное бюджетное образовательное учреждение высшего
профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
Отчет по лабораторной работе № 12 на тему: «Химические свойства марганца и его соединений»
Выполнил
студент группы__________ ______________ Фамилия И.О.
(Подпись, дата)
Принял
доцент кафедры ОАХ ______________
(Подпись, дата)
Цель работы:
- Изучить свойства металлов VIIБ – подгруппы;
- Изучить свойства характеристичных соединений металлов VIIБ – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны металлов VIIБ- подгруппы:
Степени окисления: VIIБ - подгруппа …………..……..…….
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
φ(Men+/Me) =
- активность металлов:
- пассивирование металлов……..
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) Mn
- взаимодействие с галогенами (хлором):
а) Mn
- взаимодействие с серой:
а) Mn
- взаимодействие с водой термодинамически невозможно для металла…………..
- взаимодействие с водой для металла………….. термодинамически возможно, однако он устойчив в воде так как…………………….
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Mn + HBr →
б) Mn + H2SO4(разб) →
- взаимодействие с концентрированной H2SO4:
а) Mn + H2SO4(конц) → ………….+ S + H2O
б) Mn + H2SO4(конц) → ………….+ H2S + H2O
- взаимодействие с разбавленной и концентрированной HNO3:
а) Mn + HNO3(разб) → ………….+ N2O + H2O
б) Mn + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксисоединений металлов VIIБ - подгруппы:
- формулы оксидов металлов VIIБ - подгруппы ……………………………………….
- формулы гидроксисоединений металлов VIIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксисоединений металлов VIIБ - подгруппы
- диссоциация в водном растворе гидроксида марганца(II):
- диссоциация в водном растворе марганцовой кислоты:
Основные свойства проявляют оксид и гидроксид марганца ………….
Амфотерные свойства проявляют оксид и гидроксид марганца ………….
Кислотные свойства проявляют соединения марганца:………….
- взаимодействие оксидов и гидроксидов металлов VIIБ - подгруппы с кислотами и кислотными оксидами.
а) MnO + H2SO4 →
б) Mn(OH)2 + H2SO4 →
- взаимодействие оксидов и гидроксидов металлов VIIБ - подгрупп с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды
MnO2 + NaOH → ….. + H2O
Mn2O7 + NaOH → NaMnO4 + H2O
HMnO4 + NaOH → NaMnO4 + H2O
4. Растворимость солей, гидролиз солей
Плохо растворимы соли марганца(II)………….
Растворимый сульфат марганца(II) подвергается гидролизу по …………….., среда в растворе …………………….
5. Окислительно-восстановительные свойства соединений металлов VIБ - подгруппы
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений марганца.
Укажите соединения, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
г) диспропорционируют в кислой среде манганаты (MnO42-) и соединения (Mn3+).
3MnO42- + 4H+ → 2MnO4- + MnO2 + 2H2O
2Mn3+ + 2H2O → Mn2+ + MnO2 + 4H+
Диаграмма Латимера для марганца (в кислой среде):
+ 1,51

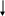
+0,564 2,26 +0,95 +1,51 – 1,18
M
 nO4-
MnO42-
MnO2
Mn3+
Mn2+
Mn
nO4-
MnO42-
MnO2
Mn3+
Mn2+
Mn

 +1,70
+ 1,23
+1,70
+ 1,23
Диаграмма Латимера для марганца (в щелочной среде):
+0,564 +0,60 +0,15 - 0,25 – 1,55
M nO4- MnO42 - MnO2 Mn(OH)3 Mn(OH)2 Mn
 +0,588
- 0,05
+0,588
- 0,05
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. среде
Опыт 1. Получение и свойства гидроксида марганца(II)
В две пробирки внести по 2 капли раствора сульфата марганца.(II) и 2 н раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида марганца(II) добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия:
– охарактеризовать внешний вид осадка…..
- составить уравнения реакции образования гидроксида марганца (II) в молекулярной и ионной форме
MnSO4 + NaOH →
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид марганца (II)….
- составить уравнение реакции гидроксида марганца (II) с соляной кислотой в молекулярной и ионной форме
Mn(OH)2 + HCl →
- отметить, как изменяется внешний вид осадка Mn(OH)2 во второй пробирке при хранении на воздухе……
- составить уравнение реакции окисления гидроксида марганца (II) на воздухе
Mn(OH)2 + O2 + … →
- сделать вывод о свойствах гидроксида марганца (II):
Опыт 2.Восстановительные свойства соединений Mn(II)
а) Внести в пробирку 1-2 капли раствора соли марганца (II), 2-3 капли 2 н. раствора гидроксида натрия и 1-2 капли перекиси водорода.
- отметить, какие изменения происходят с осадком ………….
- Составить уравнение реакции, учитывая, что образуется диоксид марганца:
Mn(OH)2 + H2O2 →
- как изменилась степень окисления марганца …………………………………
- Указать окислитель…………………, восстановитель…………………..
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
- какие свойства проявляет гидроксид марганца (II)……………..
б) В пробирку налить 1-2 капли раствора соли марганца (II) и 1-2 капли перманганата калия.
- отметить, какие изменения происходят в пробирке ………….
- составить уравнение реакции, учитывая, что образуется диоксид марганца:
KMnO4 + MnSO4 + H2O → MnO2 + H2SO4 + ….
- укажите степени окисления марганца в соединениях………………………
- Указать окислитель…………………, восстановитель…………………..
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
- какие свойства проявляет сульфат марганца (II)……………..
- какие свойства проявляет перманганат калия….……………..
- сделать вывод о свойствах сульфата марганца (II) и перманганата калия.
Опыт 3. Растворимость и кислотно-основные свойства оксида марганца (IV)
В три пробирки поместить по 1 микрошпателю оксида марганца (IV). В 1-ю пробирку прилить дистиллированной воды, во 2-ю - раствор азотной кислоты, в 3-ю – концентрированный раствор гидроксида натрия.
- Отметить изменение окраски растворов и
растворимость оксида марганца (IV)в воде ………
растворимость оксида марганца (IV) в кислоте ………
растворимость оксида марганца (IV) в щелочи………
- составить уравнения реакций:
MnO2 + HCl →…
MnO2 + NaOH + H2O →…
- сделать вывод о свойствах оксида марганца (IV).
Опыт 4. Окислительные свойства оксида марганца (IV)
В пробирку поместить 1 микрошпатель диоксида марганца и несколько капель концентрированной хлороводородной кислоты. Пробирку нагреть на спиртовке. Над отверстием пробирки подержать фильтровальную бумагу, смоченную раствором йодида калия (показательный опыт)
- отметить, какие изменения происходят в пробирке при нагревании………….
- определить, какой выделяется газ…..
- на фильтровальной бумаге образуется…..
- составить уравнение реакции, учитывая, что образуется хлорид марганца (II), хлор и вода:
MnO2 + HCl → ………….. + ……. + ……
- как изменилась степень окисления марганца ………………хлора…………………
- Указать окислитель…………., восстановитель…………………..;
- какие свойства проявляет оксид марганца (IV)
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
- возможно ли самопроизвольное протекание реакции при стандартных условиях…
- составить уравнение Нернста для электрохимической системы окислителя:
Проанализируйте, как влияет увеличение концентрации соляной кислоты на величину окислительно-восстановительного потенциала электрохимической системы окислителя:
- составить уравнение Нернста для электрохимической системы восстановителя:
- Проанализируйте, как влияет увеличение концентрации соляной кислоты на величину окислительно-восстановительного потенциала электрохимической системы восстановителя:
- Составить уравнение реакции хлора с йодидом калия:
KI + Cl2 =
- Вывод
Опыт 5.Окислительно–восстановительные свойства
соединений марганца (VI)
а) Поместить в пробирку 2-3 капли темно – зеленого раствора манганата натрия и добавить 2-3 капли 2 н. раствора уксусной кислоты.
- отметить, какие изменения происходят в пробирке ………….
- Составить уравнение реакции диспропорционирования манганата (VI) натрия, учитывая, что образуется перманганат натрия и диоксид марганца:
Na2MnO4 + CH3COOH →
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
- манганат (VI) устойчив в……….……..среде
Вывод:
б) К 2-3 каплям раствора сульфита натрия добавить несколько капель 2 н раствора серной кислоты и манганата (VI) натрия.
- отметить, какие изменения происходят в пробирке ………….
- как изменилась степень окисления марганца ………………серы…………………
- Указать окислитель…………., восстановитель…………………..;
- какие свойства проявляет манганат (VI) натрия…………..
- Составить уравнение реакции, учитывая, что образуется сульфат марганца(II), сульфат натрия:
Na2MnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + H2O
- Рассчитать ЭДС реакции: ЭДС = φок . – φвос. =
Вывод:
Опыт 6.Окислительные свойства перманганата калия (см. ЛР №1)
В три пробирки внести по 1-2 капли раствора перманганата калия. В одну пробирку добавить 2 капли 2 н. раствора серной кислоты, в другую – столько же воды, в третью – 3-4 капли 2 н. раствора щелочи. Во все три пробирки прибавить по одному микрошпателю кристаллического сульфита натрия.
Перманганат калия проявляет свойства………..……….…………за счет…………..
Определите, какие продукты образовались из перманганата калия в каждой из пробирок, учитывая, что перманганат калия – может восстанавливаться до бесцветной соли марганца(II), бурого осадка диоксида марганца(IV) или ярко зеленого манганата(VI)
а) в кислой среде перманганат калия восстановился до …
б) в нейтральной среде перманганат калия восстановился до …
в) в сильнощелочной среде перманганат калия восстановился до …
Составьте уравнения реакций
а) в кислой среде реакция протекает в соответствии со схемой:
Расставить коэффициенты в молекулярном уравнении реакции:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
б) в нейтральной среде реакция протекает в соответствии со схемой:
Расставить коэффициенты в молекулярном уравнении реакции:
KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH
в) в сильнощелочной среде реакция протекает в соответствии со схемой:
Расставить коэффициенты в молекулярном уравнении реакции:
KMnO4 + Na2SO3 + NaOH → Na2MnO4 + K2MnO4 + Na2SO4 + H2O
Сравните окислительные свойства перманганата калия в разных средах:
Вывод о том, как влияет среда на окислительно-восстановительные свойства перманганата калия:
Федеральное государственное бюджетное образовательное учреждение высшего
профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №13
