
- •11. 1 Классификация антиаритмических средств
- •Неблагоприятные исходы фибрилляции предсердий
- •Индекс симптомов фибрилляции предсердий
- •Индекс chads2
- •Индекс cha2ds2-vaSc
- •Клинические характеристики шкалы оценки риска кровотечений has-bled
- •Рекомендуемые стратегии лечения
- •Рекомендации по контролю чсс и ритма при фибрилляции предсердий
- •8 Таблица 8 Средства для контроля частоты сердечных сокращений
- •Средства для контроля часты сердечных сокращений
Государственное бюджетное образовательное
учреждение высшего профессионального образования
«Ставропольская государственная медицинская академия»
Министерства здравоохранения и социального развития
Российской Федерации
Кафедра факультетской терапии
Нарушения сердечного ритма
(аритмии и блокады сердца)
Учебно-методические указания для студентов 4 курса лечебного факультета
по подготовке к практическим занятиям по факультетской терапии
Ставрополь, 2012
УДК
ББК
Нарушения сердечного ритма (аритмии и блокады сердца) : учебно - метод. указания для студентов 4 курса лечебного факультета по подготовке к практическим занятиям / под ред. профессора М.Е. Евсевьевой. – Ставрополь : Из-во СтГМА, 2012. -64 с.
В серии учебно-методических указаниях по различным темам представлены материалы, отражающие современные методологические особенности преподавания студентам 4-го курса лечебного факультета вопросов диагностики и лечения наиболее часто встречающихся внутренних заболеваний с позиций современных компетентностно-ориентированных принципов инновационных образовательных технологий.
Составители:
профессор Евсевьева М.Е., доцент Никулина Г.П., доцент Малыхин Ф.Т.;
ассистенты кандидаты мед. наук Барабаш И.В., Бородина Л.В.,
Горбунова С.И., Сергеева О.В., Джанибекова А.Р., Кумукова З.В, А.В. Русиди и З.А. Исхакова.
Техническая помощь: ассистенты Е.Н.Фурсова и А.Ф.Чимшит.
Рецензенты:
Рекомендовано к печати редакционно-издательским советом СтГМА
УДК
ББК
Ставропольская государственная
медицинская академия, 2012
Тема № Нарушения сердечного ритма (аритмии и блокады сердца)
Занятие №
Место проведения занятия:
Кардиологическое отделение 3й городской больницы
Составитель: доцент кафедры факультетской терапии Никулина Г.П.
Вопросы для подготовки к занятию:
Определение и этиопатогенез нарушений ритма сердца (НРС).
Эпидемиология. Классификация аритмий.
Влияние на гемодинамику. Клинические проявления.
Современные методы диагностики НРС.
ЭКГ-признаки экстрасистолии, мерцательной аритмии, трепетания предсердий, суправентрикулярной и желудочковой тахикардии, мерцания и трепетания желудочков, АВ- блокады I, II и IIIстепени, полной блокады левой и правой ножки п.Гиса.
Прогностическая значимость различных видов НРС.
Медикаментозное лечение в зависимости от этиологии и вида аритмии.
Показания к электрокардиостимуляции.
Возможности хирургического лечения НРС.
Литература основная
Внутренние болезни в 2-х томах, М., 2009г. Под ред. Мартынов А.И., Мухин Н.А., Моисеев В.С.
Рябов С.И. Внутренние болезни. С.-Пб, 2001г.
Внутренние болезни: руководство к практическим занятиям по факультетской терапии. Под ред. В.И. Подзолкова. М.: ГЭОТАР-Медиа. 2010г.
Литература дополнительная
Кардиология: Руководство для врачей. Под ред. Оганова Р.Г., Фоминой И.Г. М.: Медицина, 2005.
Г.Е. Ройтберг, А.В. Струтынский. Внутренние болезни. М.: «Издательство Бином», 2010.
Общая врачебная практика по Джону Нобелю. Под ред. Дж. Нобеля. М. Практика, 2005.
Клинические рекомендации. Стандарты ведения больных. Выпуск 2.- М.: ГЭОТАР-Медиа, 2007.
Вопросы и задания для самоконтроля
Тестовые задания: выберите один правильный ответ.
ЭКГ- КРИТЕРИИ ЖЕЛУДОЧКОВОЙ ЭКТРАСИСТОЛИИ
преждевременный комплекс QRS
преждевременный уширенный комплекс QRS
измененный з. Р перед экстрасистолическим комплексом
СОСТОЯНИЯ, СОПРОВОЖДАЮЩИЕСЯ ПРИСТУПАМИ МОРГАНЬИ- ЭДЕМСА-СТОКСА
желудочковая экстрасистолия
мерцательная аритмия
атриовентрикулярные блокады.
ПОЛНАЯ КОМПЕНСАТОРНАЯ ПАУЗА ВСТРЕЧАЕТСЯ
при желудочковой экстрасистолии
при наджелудочковой экстрасистолии
при предсердной эктрасистолии
Правильные ответы
1 |
2 |
3 |
2 |
3 |
1 |
Ситуационные задания
Задача №1
Больной 54 лет, поступил с жалобами на ощущение перебоев в работе сердца, возникающие во время физической нагрузки и периодически в покое. В течение последних 2х месяцев отмечает появление болей сжимающего характера за грудиной, отдающих под левую лопатку, и одышки во время при любой физической нагрузке. Курит. К врачу до этого не обращался.
Объективно: общее состояние относительно удовлетворительное. Кожные покровы обычной окраски. Периферических отеков нет. Границы сердца: правая – по правому краю грудины в IV межреберье, верхняя в III межреберье по правому краю грудины, левая - на 1 см кнаружи от l. medioclavicularis sinistra. Тоны сердца приглушенные, ритмичные.
Над всей поверхностью легких везикулярное дыхание. Живот мягкий, безболезненный. Нижний край печени определяется по краю реберной дуги.
Вопросы
Какие кардиальные синдромы можно выделить у данного пациента?
Какой предварительный диагноз ?
Какой вид аритмии можно предположить в данном случае?
Какие исследования необходимо выполнить для верификации аритмии?
Какова тактика стационарного лечения ?
Ответы
Синдромы: кардиалгический, кардиомегалический, аритмический, сердечной недостаточности.
ИБС. Впервые выявленная стенокардия. ХСН IIА, ФК II.
Экстрасистолия.
ЭКГ, холтеровское мониторирование ЭКГ, ЭхоКГ. В плановом порядке решить вопрос о коронароангтографии.
Лечение основного заболевания: бета-блокаторы, антиагреганты, антикоагулянты, статины, возможно нитраты, ингибиторы АПФ. В случае выявления частой или парной желудочковой эктрасистолии возможно назначение кордарона.
В результате изучения учебных вопросов студент должен
Знать:
-этиологию, патогенез и меры профилактики часто встречающихся нарушений ритма сердца, их современную классификацию.
-клиническую картину, особенности течения и возможные осложнения у различных возрастных групп.
-современные методы клинического, лабораторного, инструментального обследования больных.
- методы лечения и показания к их применению.
-рациональный выбор конкретных лекарственных средств для лечения нарушений сердечного ритма и блокад, принципы оказания помощи при неотложных состояниях.
-показания к электроимпульсной терапии и хирургическому лечению.
Уметь:
-заподозрить НРС у конкретного больного на основании опроса, сбора анамнеза и осмотра в типичных клинических случаях;
-провести обследование пациента;
-дать клиническую интерпретацию полученным лабораторным и инструментальным данным
-сформулировать клинический диагноз;
-применять методы профилактики;
- заполнить историю болезни, выписать рецепт;
-назначить и обосновать фармакотерапию у конкретного больного, определить показания для электроимпульсного и хирургического методов лечения блокад, оценить эффективность и безопасность проводимого лечения.
Владеть:
- составлением плана обследования больного при выявлении аритмического синдрома;
-алгоритмом развернутого клинического диагноза;
-выполнением основных диагностических и лечебных мероприятий по оказанию первой врачебной помощи при неотложных и угрожающих жизни состояниях (МЭС, отек легких, кардиогенный шок);
-составлением плана лечения больного с аритмическим синдромом.
Владеть
- алгоритмом обследования больного для объективизации НРС;
- формулировкой развернутого диагноза основного заболевания и аритмического синдрома;
- составлением плана неотложной помощи и планового медикаментозного лечения, мероприятий по вторичной профилактике.
АННОТАЦИЯ
Предисловие
Среди общей смертности в России значительную часть составляют сердечно-сосудистые заболевания. Нарушения ритма сердца являются частым проявлением этих заболеваний. В год от сердечно-сосудистых заболеваний в России умирают 1 млн. 300 тысяч человек, аритмическая смерть настигает более 100000 человек. Основная роль принадлежит ишемической болезни сердца и артериальной гипертонии с их осложнениями инфарктами миокарда и инсультами. Некоторые аритмии являются реакцией сердца на патологию других органов и систем, на прием алкоголя, курение. Большое количество аритмий (фибрилляция предсердий, синдром слабости синусового узла, ат- риовентрикулярные и внутрижелудочковые блокады и др.), которые также не связаны с определенными заболеваниями, и имеют явную наследственную предрасположенность. Риск развития инсульта у больных с фибрилляцией составляет 3-8% в год и зависит от наличия других факторов риска. Примерно у половины пожилых больных с мерцательной аритмией имеется артериальная гипертензия, а у 12% - стеноз каротидной артерии. Образование тромба, которое является следствием стаза крови в ушке левого предсердия, считают основной причиной ишемического инсульта у пациентов с фибрилляцией предсердий.
Последние десятилетия ознаменовались большими успехами в диагностике и лечении сердечных аритмий. Появление в 60-х годах электрофизиологического исследования сердца позволило точно определять вид аритмии, но и в настоящее время эта патология остаётся важнейшей медицинской и социальной проблемой. Наблюдается очевидный кризис в области фармакотерапии и фармакологической профилактики нарушений сердечного ритма. Клинические исследования показали, что опасный аритмогенный эффект антиаритмических препаратов зачастую превышает их эффект. Все это делает необходимым дальнейшее изучение этиологии и патогенеза аритмий, заставляет тщательно взвешивать пользу и потенциальный риск специфической антиаритмической терапии и побуждает к поиску немедикаментозных методов лечения. Внедрение и стремительное усовершенствование в хирургии на проводящих путях сердца резко повысило возможности диагностики и лечения нарушений ритма сердца.
Этиология нарушений ритма сердца
Нарушения ритма сердца (НРС) - это изменения частоты, регулярности и источника возбуждения сердца, а также последовательности возбуждений камер сердца. Это чаще всего синдром, осложняющий течение того или иного заболевания, и только в случае врожденной аномалии развития проводящей системы сердца НРС могут быть основным заболеванием.
Основные причины возникновения НРС:
1. Функциональные — при относительно здоровом сердце
Психогенные (кортиковисцеральные);
Рефлекторные (висцеро - кардиальные);
II. Органические - при различных заболеваниях сердца
Ишемическая болезнь сердца (ИБС), артериальная гипертония (АГ);
Кардиомиопатии (КМП) (заболевания миокарда, сопровождающиеся нарушением функции сердца, ВОЗ, 1995) - гипертрофическая КМП, дилятационная, рестриктивная, "околородовая КМП", аритмогенная дисплазия миокарда, специфические КМП - алкогольная, ишемическая, постмиокардитическая, анемическая, эндокринная (дисфункции щитовидной железы, феохромоцитома, гиперальдостеронизм, климакс и т.д.)
Миокардиты;
Пороки сердца;
Токсические аритмии - при интоксикации наперстянкой, анестетиками, адреналином, кофеином и др.;
Электролитный дисбаланс;
Механические повреждения - при интракардиальной катетеризации, при операциях, травмах сердца и легких;
Наследственные - синдром удлиненного Q-T, синдром Бругада, синдром Вольф-Паркинсон-Уайта (Wolff - Parkinson - White -WPW), синдром слабости синусового узла (СССУ), наследственные атриовентрикулярные блокады (АВБ), наследственные блокады ножек пучка Гиса (БНПГ) (синдром Ленегра, синдром Лева), синдром Кернса-Сейра.
Кроме этиологии НРС необходимо учитывать так называемые пусковые факторы, которые являются обычно непосредственной причиной "срыва" ритма. Для различных НРС характерны различные пусковые факторы:
для атриовентрикулярных тахикардий - это прыжок с высоты, внезапный поворот тела;
для пароксизмальной фибрилляции предсердий (ФП) - это употребление алкоголя, чая, кофе, эмоциональный стресс;
для желудочковой тахикардии (ЖТ) - это физическая нагрузка, эмоциональный стресс, алкоголь.
В лечении больных необходимо учитывать эти пусковые факторы.
Обследование больного с нарушениями ритма сердца
При обследовании больного с НРС решают 3 основные задачи:
Максимально точная идентификация НРС, оценка его тяжести по клиническим и электрофизиологическим параметрам и оценка состояния проводящей системы сердца.
Диагностика основного заболевания, вызвавшего возникновение НРС, диагностика сопутствующих заболеваний. Особое значение могут иметь остеохондроз и аномалии развития позвоночника, болезни желудочно-кишечного тракта (желчнокаменная болезнь, грыжа пищеводного отверстия диафрагмы, язвенная болезнь двенадцатиперстной кишки).
Установить "пусковые" факторы аримии.
Методы обследования больных с нарушениями ритма сердца. Общеклинические методы: Анамнез. Жалобы больных с НРС:
Кратковременные потери сознания;
Кратковременные эпизоды потемнения перед глазами;
Кратковременные головокружения;
Приступы сердцебиения;
Перебои, "кувырки" сердца, "замирание" сердца
При сборе анамнеза необходимо выяснить, чем провоцируются эти состояния: физическая нагрузка, стресс, резкое движение, кашель, алкоголь и т.д. Четко определить продолжительность этих состояний и частоту их возникновения. Выяснить характер начала и конца приступов (внезапный, постепенный), чем купируется это состояние (глубокое дыхание с натуживанием, седативные средства, антиаритмические препараты), оценить состояние больного во время приступа сердцебиения (выраженность синдромов сердечной недостаточности, коронарной недостаточности, цереброваскулярной недостаточности, состояние гемодинамики). При сборе анамнеза обратить внимание на занятия спортом, вредные привычки, профессиональные вредности и данные наследственного анамнеза.
Осмотр больного предполагает выявление признаков НРС, если они имеют место в данное время (аритмичность пульса, дефицит пульса при ФП, редкий пульс с паузами при блокадах, дополнительные преждевременные сокращения сердца и паузы после них при экстрасистолии и т.д.). Кроме того, при осмотре больного возможно выявление признаков различных заболеваний, которые могут быть причиной возникновения НРС.
Инструментальное обследование больного с НРС.
ЭКГ покоя;
ЭКГ при стресс-тесте (велоэргометрия, тредмил);
Эхокардиоскопия (ЭХО-КС);
Длительное мониторирование ЭКГ (ЭКГ-МТ) с оценкой вариабельности ритма сердца, дисперсии интервала Q-T, поздних потенциалов.
Оценка щитовидной железы (уровень гормонов, УЗИ)
Исследования, необходимые в диагностике основных и сопутствующих заболеваний;
Электрофизиологическое исследование сердца (ЭФИ), чреспищевод- ное и эндокардиальное, во время которого оценивают состояние проводящей системы сердца (синусовый узел, атриовентрикулярное соединение), наличие аномалий ее развития (дополнительные пути проведения).
Специально провоцируют различными методами электрокардиостимуляции аритмию, регистрируют чреспищеводную электрокардиограмму (ЧПЭКГ) или внутриполостную ЭКГ во время НРС, тестируют аритмию различными методами купирования - от электростимуляции до фармакологических препаратов. ЭФИ сердца показано больным, у которых подозревают пароксизмальные тахикардии, дисфункцию синусового узла и/или атриовентрикулярного соединения.
Классификация нарушений ритма сердца
В зависимости от нарушенной функции сердца выделяют группы аритмий:
Нарушения автоматизма
Номотопные (водитель ритма - в синусовом узле)
синусовая тахикардия (СТ);
синусовая брадикардия (СБ);
синусовая аритмия (СА);
синдром слабости синусового узла (СССУ).
Гетеротопные (водитель ритма - вне синусового узла)
нижнепредсердный ритм;
атриовентрикулярный ритм;
идиовентрикулярный ритм;
Нарушения возбудимости
Экстрасистолии:
по источнику: предсердные, атриовентрикулярные, желудочковые;
по количеству источников: монотопные, политопные;
по времени возникновения: ранние, интерполированные, поздние;
по частоте: единичные (до 5 в минуту), множественные (более 5 в минуту), парные, групповые;
по упорядоченности: неупорядоченные, аллоаритмии (бигеминия, тригеминия, квадригеминия).
Пароксизмальные тахикардии (предсердная, АВ, желудочковая).
Нарушения проводимости
увеличение проводимости (WPW синдром);
уменьшение проводимости (блокады: синоаурикулярная, внутрипредсердная, атриовентрикулярная, блокада ножек пучка Гиса).
Смешанные (трепетание/мерцание предсердий/желудочков).
Все нарушения ритма сердца можно условно (в упрощенном варианте) разделить на 4 большие группы:
Экстрасистолии;
Тахикардии;
Блокады;
Аритмические синдромы.
ЭКСТРАСИСТОЛИЯ
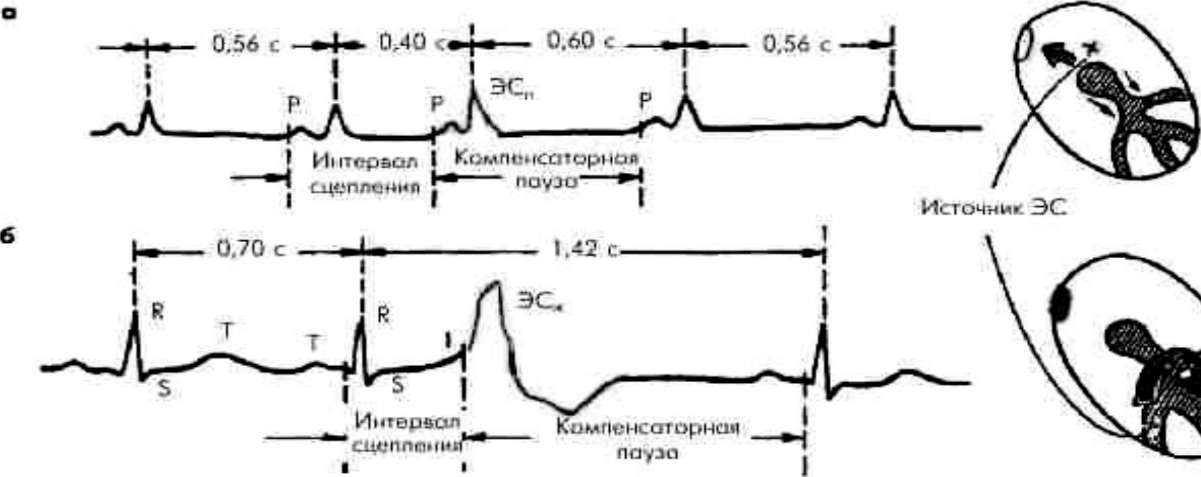
Неполная
и полная компенсаторные паузы
Интервал сцепления - это расстояние от предшествующего ЭС очередного цикла P-QRST основного ритма до ЭС. Компенсаторная пауза - расстояние от ЭС до следующего за ней цикла P-QRST основного ритма.
Неполная компенсаторная пауза - пауза, возникающая после предсердной ЭС или ЭС из атриовентрикулярного соединения (АВС), длительность которой чуть больше обычного интервала P-P (R-R) основного ритма. Неполная компенсаторная пауза включает время, необходимое для того, чтобы эктопический импульс достиг синусного узла (СУ) и "разрядил» его, а также время, которое требуется для подготовки в нем очередного синусового импульса. Полная компенсаторная пауза - пауза, возникающая после желудочковой ЭС, причем расстояние между двумя синусовыми комплексами P-QRST (предэкстрасистолическим и постэкстрасистолическим) равно удвоенному интервалу R-R основного ритма.
Суправентрикулярные экстрасистолы (НЖЭ) обычно имеют узкий QRS и неполную компенсаторную паузу (сумма предэстрасистолического и постэкстрасистолического интервалов меньше 2-х R-R) [рисунок 1].
НЖЭ могут быть редкими (< 5 в 1 минуту), средними по частоте (от 6 до 15 в 1 минуту) и частыми (>15 в 1 минуту). Кроме того, они могут быть одиночными и парными (спаренными), а также спорадическими или регулярными. Возможна также явная регулярность в появлении НЖЭ: бигеминия (НЖЭ после каждого основного комплекса) или три геминия (НЖЭ после каждых двух основных комплексов). Эти данные указываются в диагнозе, так как эти разновидности НЖЭ имеют различное клиническое значение.
У здоровых людей при ЭКГ-МТ в 43-63% находят НЖЭ. Чаще это редкая НЖЭ (менее 30 в час) и возникает во время урежения синусового ритма. При различных заболеваниях сердечно-сосудистой системы НЖЭ бывает средней частоты и частой, она может появляться на фоне синусовой тахикардии, характерна аллоритмия. Возможна спорадическая НЖЭ, появляющаяся во время приступов стенокардии или гипертонических кризов. Аллоритмия—это правильное чередование ЭС и синусовых сокращений:
бигеминия (после каждого нормального сокращения следует ЭС);
тригеминия (ЭС следует после каждых двух нормальных сокращений);
квадригимения и др.
Клиническое значение НЖЭ заключается в том, что она провоцирует более тяжелые НРС: ФП, суправентрикулярные реципрокные тахикардии и т.д. Кроме того, НЖЭ довольно часто плохо субъективно переносится больными.
Предсердная экстрасистолия. При ЭС из верхних отделов предсердий зубец Р' мало отличается от нормы. При ЭС из средних отделов - зубец Р' деформирован, а при ЭС из нижних отделов - отрицательный.
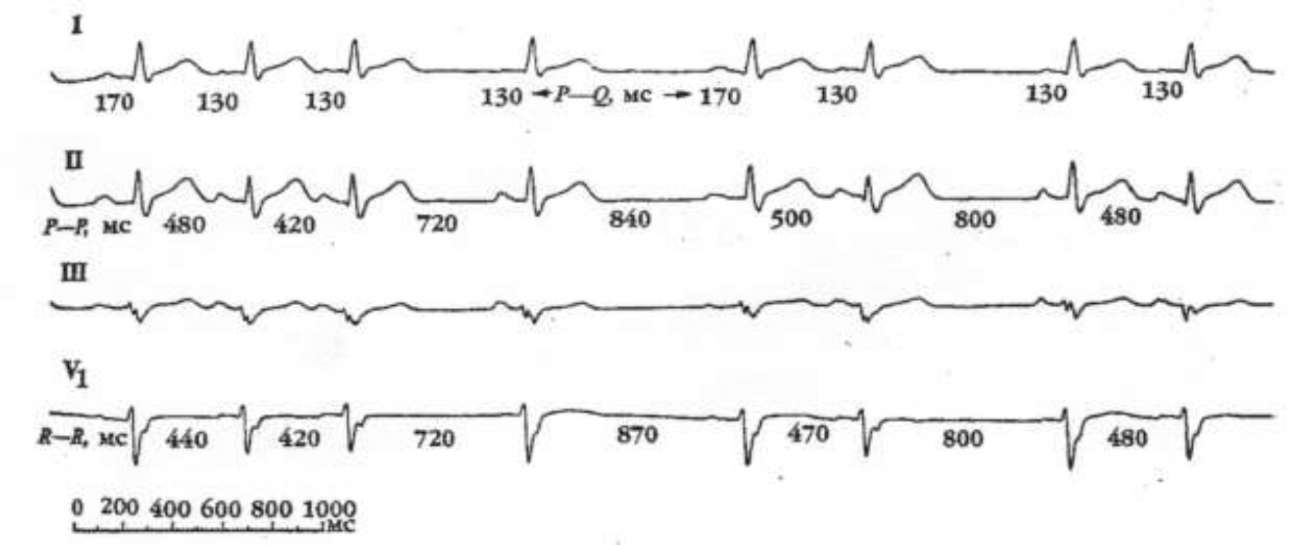
Рисунок 2. Предсердная эстрасистолия
Монотопные ЭС - исходящие из одного эктопического источника. Политопные ЭС, исходящие из разных эктопических очагов. Групповая (залповая) экстрасистолия - наличие на ЭКГ трех и более экстрасистол. Примеры диагнозов при НЖЭ:
Гипертоническая болезнь II ст., 1 ст. повышения АД. Гипертрофия левого желудочка, ангиопатия сосудов сетчатки 11ст. Суправентрикулярная экстрасистолия средней частоты. ХСН II А ст., 11ФК. Гр. риска 3.
Синдром Марфана, пролапс митрального клапана I ст., частая, регулярная суправентрикулярная экстрасистолия. ХСН I ст., I ФК.
Лечение больных с НЖЭ обусловлено клинической значимостью экстрасистолии. Необходимо адекватное лечение основного заболевания. Специфической терапии подлежат НЖЭ, которые тяжело субъективно переносятся больным или НЖЭ, провоцирующие пароксизмы тахикардии.
Наиболее часто используются бета-адреноблокаторы (БАБ) и антагонисты кальция (группа верапамила и дилтиазема). Однако, если доказано, что НЖЭ вызывает пароксизмы тахикардии, то для лечения используется антиаритмический препарат (ААП) для предупреждения приступов тахикардии.
ЖЕЛУДОЧКОВАЯ ЭКСТРАСИСТОЛИЯ
При желудочковой экстрасистолии (ЖЭ) комлексы QRS расширены и деформированы, имеется полная компенсаторная пауза (сумма предэкстрасистолического и постэкстрасистолического интервалов равна двум R-R). Правожелудочковые ЭС имеют вид блокады левой ножки пучка Гиса, левожелудочковые ЭС - блокады правой ножки пучка Гиса.
Для оценки прогноза используют систему градаций ЖЭ, разработанную В. Lown и М. Wolf (1971). Сначала ее использовали для оценки прогноза при ЖЭ на фоне инфаркта миокарда, затем эта система была распространена на ЖЭ при хронических формах ИБС и других заболеваниях сердца.
Градации ЖЭ по В. Lown (1971)
- отсутствие ЖЭ;
- 3 0 или меньше ЖЭ за 1 час;
- больше 30 ЖЭ за 1 час;
- полиморфные ЖЭ;
- (А) парные ЖЭ;
- (Б) три подряд и больше ЖЭ;
- ЖЭ типа R на Т ЖЭ могут быть также спорадическими или регулярными.
Возможна явная регулярность в появлении ЖЭ: бигеминия (ЖЭ после каждого основного комплекса) или тригеминия (ЖЭ после каждых двух основных, комплексов). Все эти данные необходимо указывать в диагнозе, так как все эти разновидности ЖЭ имеют различное клиническое значение.
У 2/3 здоровых людей при суточном ЭКГ-МТ возможна регистрация ЖЭ. Чаще всего это редкая экстрасистолия (менее 24 ЖЭ за сутки у 80% здоровых людей). Почти всегда это правожелудочковая экстрасистолия.
Функциональные ЖЭ не влияет на физическую активность человека и не отражаются на его гемодинамике. Конечно, нужно быть уверенным, что за функциональной ЖЭ не скрывается какое -либо органическое заболевание сердца, в особенности миокардит.
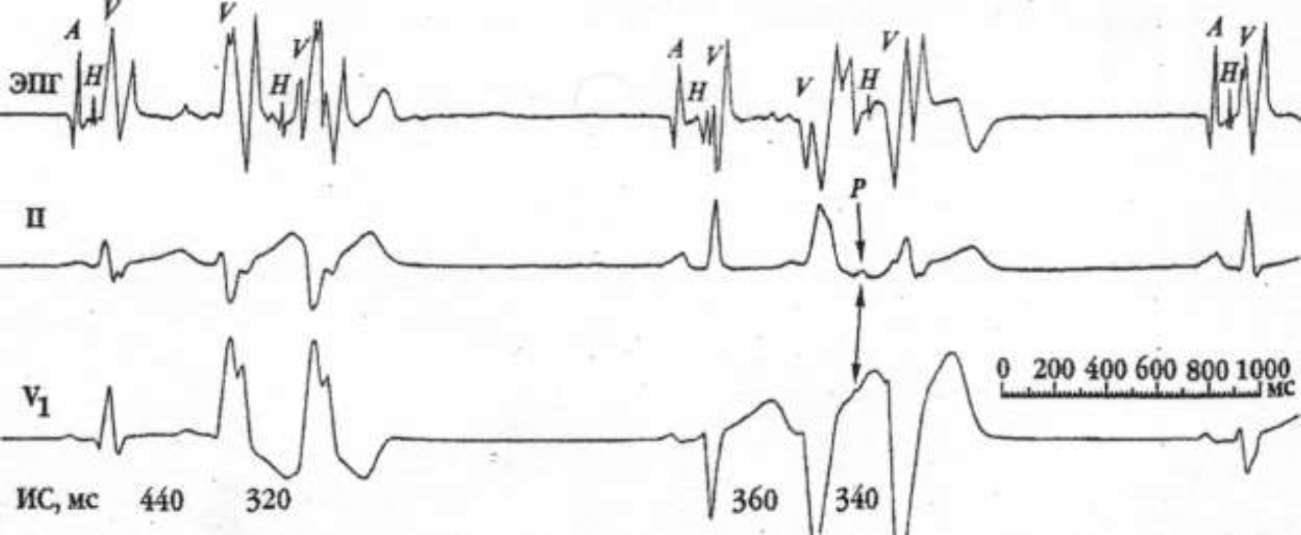
Рисунок 3 . Парная желудочковая экстрасистолия
Если ЖЭ регистрируется у практически здорового (в особенности молодого человека и не вызывает неприятных субъективных ощущений, то абсолютных показаний к проведению антиаритмической терапии (ААТ) нет. Если ЖЭ частая и плохо переносится, то возможно проведение определенного лечения. Если у больного наклонность к симпатикотонии, ЖЭ возникает в дневное время, во время стресса, при физической нагрузке, ему показана терапия БАБ (метопролол - БЕТАЛОК- ЗОК, ЭГИЛОК, бисопролол КОНКОР) в сочетании с седативной терапией. Желательно ограничить кофе, чай, спиртные напитки, курение. Если у больного склонность к парасимпатикотонии, ЖЭ возникают ночью, в покое, на фоне брадикардии, рефлекторно при болезнях желудочно-кишечного тракта. Таким больным рекомендуют адекватное лечение сопутствующей патологии и применение седативных средств, транквилизаторов. Возможна консультация психотерапевта, адекватная терапия депрессивных и тревожных состояний.
При органических заболеваниях сердечно-сосудистой системы клиническое значение ЖЭ определяется их способностью провоцировать приступы ЖТ и ФЖ. Прогностическая значимость ЖЭ (чаще 10 в час) практически полностью зависит от наличия и степени выраженности основного заболевания сердца. ЖЭ может долгое время быть единственным проявлением хронического миокардита или КМП, ИБС.
Риск внезапной смерти (ВС) в данной группе больных очень варьирует и трудно поддается оценке. Эффективность лечения, которое само по себе подвергает пациентов значительному риску и весьма дорогостоящее, чаще всего неопределенна. Адекватное ведение пациента зависит не только от решения вопроса, как лечить, но и нужно ли лечить.
Риск ВС можно оценить по 3 основным факторам риска:
ОИМ в анамнезе,
Фракция выброса (ФВ) < 40%,
ЖЭ (> 10/час).
При наличии 1-го ФР (ИМ или ФВ < 40%) риск ВС за 1 год - 5%, при сочетании каждого из этих ФР с ЖЭ риск ВС ~ 10%, при сочетании 3-х ФР риска - ВС ~ 15%. Для существенного снижении частоты ВС необходимо идентифицировать и лечить именно этих больных. К сожалению ни один из антиаритмических препаратов (ААП) не настолько эффективен, чтобы оправдать риск ААТ таких пациентов. В связи с этим ЖЭ лучше всего рассматривать как индикатор повышенного риска, а не как цель терапии. Это связано с тем, что ни в одном из многоцентровых исследований не зафиксировано, что эффективное лечение ААП улучшает прогноз жизни этой категории больных. Напротив, в ряде исследований было показано, что устранение ЖЭ у больных с постинфарктным кардиосклерозом (ПИКС) сопровождалось повышением смертности (исследование CAST для энкаинида и флекаинида). Аналогичные данные получены в отношении многих препаратов IА и IIIС класса (хинидин, ритмилен, этацизин, этмозин).
При лечении больных с ЖЭ необходимо соблюдать ряд правил:
Самое важное направление ведения таких больных — активная терапия основного заболевания сердца;
Не назначать больным с факторами риска ВС для постоянного приема ААП I класса;
Больным с острым инфарктом миокарда (ОИМ) в анамнезе, ФВ < 40% и ЖЭ IV В градации (неустойчивая ЖТ) показано эндокардиальное ЭФИ. Если при ЭФИ провоцируется ЖТ, устойчивая к ААП, пациенту показана имплантация кардиовертера-дефибриллятора (КВ-ДФ).
Если при ЭФИ не провоцируется устойчивая к ААП ЖТ, возможна профилактическая терапия амиодароном.
ТАХИКАРДИИ И БРАДИАРИТМИИ
Тахикардии могут возникать по механизму re-entry (циркуляция волны возбуждения), а также при нарушениях автоматизма и при триггерных механизмах (ранние и поздние постдеполяризации). Тяжесть аритмии определяется: частотой приступов тахикардии, состоянием больного во время приступа, степенью потенциальной опасности аритмии, видом и тяжестью основного заболевания. Тяжесть состояния больного во время приступа аритмии можно оценить по степени выраженности таких синдромов, как сердечная, коронарная, цереброваскулярная недостаточность, а также по состоянию гемодинамики.
Легкими считают приступы, сопровождающиеся небольшими кардиалгиями, АД - нормальное или слегка повышенное, ЧСС меньше 150 в минуту, одышка и головокружение отсутствуют, больной может выполнять обычные физические нагрузки, не испытывая особого дискомфорта.
Приступы средней тяжести сопровождаются ангинальными болями, одышкой, головокружением, АД - повышается, ЧСС около 150 в минуту, больной не может выполнять обычные физические нагрузки без дискомфорта, в покое явления дискомфорта значительно уменьшаются.
При тяжелых приступах возможно развитие затянувшегося ангинального приступа, сердечной астмы, пресинкопальных состояний, АД пониженное (менее 90 мм рт.ст.), ЧСС больше 150 в минуту, выраженный дискомфорт в покое.
При фатальных приступах может возникнуть инфаркт миокарда, отек легких, синкопальные состояния, значительное снижение АД, ЧСС более 180 в минуту. Частоту приступов и степень тяжести пароксизмов тахикардии следует указать в диагнозе.
Синусовая тахикардия
В норме СУ генерирует от 60 до 90 импульсов в мин и отвечает на автономные воздействия. Нарушение механизмов контроля синусового ритма может привести к синусовой тахикардии (СТ). ЭКГ - признаки СТ: ЧСС больше 90 в мин., сохранение правильного синусового ритма (положительный зубец Pi, п aVF, v4—V6). При выраженной СТ наблюдаются: укорочение интервала P-Q(R) (не < 0,12 с) и продолжительности интервала Q-T, увеличение амплитуды PI; п, aVF, увеличение или снижение амплитуды з.Т, косовосходящая депрессия - сегмента ST (не > 1,0 мм ).
Лечение аномальной СТ в основном симптоматическое. Клиническое значение имеет синусовая тахикардия, сохраняющаяся в покое. Нет данных о развитии аритмогенной кардиомиопатии, вызванной этой тахикардией.
БАБ могут быть эффективны и должны назначаться в качестве препаратов первой линии (класс показаний ГС). В настоящее время нет рандомизированных, плацебо-контролируемых клинических исследований. Есть данные, что также эффективны верапамил и дилтиазем. Модификация СУ методом катетерной абляции потенциально может быть использована в случаях рефрактерной аномальной СТ. Перед тем как выполнить радиочастотную аблацию (РЧА), необходимо исключить диагноз синдрома постуральной ортостатической тахикардии (СТ возникает при переходе тела из горизонтального положения в вертикальное).
Синусовая брадикардия
Синусовая брадикардия (СБ) - это урежение ЧСС меньше 60 уд. в мин при сохранении правильного синусового ритма. СБ обусловлена понижением автоматизма СУ.
ЭКГ - признаки синусовой брадикардии: уменьшение ЧСС до 59 и ниже в мин., сохранение правильного синусового ритма, (+) зубец Pi, ц, aVF,V4—V6.
У здоровых людей СБ обычно свидетельствует о хорошей тренированности сердечно-сосудистой системы и часто встречается у спортсменов. Причинами экстракардиалъной формы СБ, обусловленной токсическими воздействиями на СУ или преобладанием активности парасимпатической нервной системы (вагусные воздействия), являются: гипотиреоз; повышение внутричерепного давления; передозировка БАБ, сердечных гликозидов, верапамила и др.); некоторые инфекции (вирусный гепатит, грипп, брюшной тиф, сепсис); гиперкальциемия или выраженная гиперкалиемия; метаболический алкалоз; обтурационная желтуха; гипотермия и другие причины.
Интракардиалъная форма СБ возникает при органическом или функциональном повреждении СУ и встречается при ПИКС и других заболеваниях сердца. Интракардиальная форма СБ нередко сопровождается другими признаками СССУ.
Для СБ экстракардиального происхождения, развившейся вследствие ваготонии, характерно увеличение ЧСС при физической нагрузке и введении атропина и частое сочетание с синусовой дыхательной аритмией. При органической СБ (интракардиалъная форма) дыхательная аритмия отсутствует, после введения атропина ритм не учащается, а при физической нагрузке ЧСС увеличивается незначительно.
СБ следует дифференцировать с другими НРС, для которых также характерно уменьшение ЧСС и сохранение регулярных сердечных сокращений: медленный (замещающий) ритм из АВС; медленный (замещающий) идиовентрикулярный ритм; САБ II степени 2:1; АВБ III степени.
Синусовая аритмия
Синусовой аритмией (СА) называют неправильный синусовый ритм, характеризующийся периодами учащения и урежения ритма [рисунок 10 (г)]. СА вызывается нерегулярным образованием импульсов в САУ в результате: рефлекторного изменения тонуса блуждающего нерва в связи с фазами дыхания, самопроизвольного изменения тонуса n.vagus вне связи с дыханием, органического повреждения СУ. Различают дыхательную и недыхательную формы СА.
Дыхательная СА часто встречается у молодых здоровых людей и детей. Она характеризуется учащением ЧСС на вдохе и урежением на выдохе, причем колебания интервалов R-R на ЭКГ превышают 0,15 сек. и ритм сердца становится неправильным.
Напомним, что у здорового взрослого человека также постоянно наблюдаются небольшие колебания ритма сердца, связанные с дыхательными движениями (рефлекс Бейера-Геринга) и обусловленные физиологическим изменением тонуса вегетативной нервной системы. Появление дыхательной СА (т.е. более выраженных дыхательных колебаний ЧСС) отражает некоторый дисбаланс вегетативной нервной системы с преобладанием активности парасимпатической нервной системы. Поэтому дыхательная СА нередко сочетается с СБ, также обусловленной преобладанием вагусных воздействий.
Наличие дыхательной формы СА у больных с органическими заболеваниями сердца в целом является неплохим признаком. Прогноз становится более тяжелым, если у больного с органическим поражением сердца исчезает дыхательная вариация вагусных влияний и начинает превалировать симпатическая активность, гиперактивация которой, наряду со снижением ФВ ЛЖ, ассоциируется с более высоким риском ИМ и ВС.
ЭКГ- признаки дыхательной формы СА: дыхательные колебания длительности интервалов R-R >0,15 сек., сохранение синусового ритма, исчезновение аритмии при задержке дыхания.
Недыхательная форма СА обусловлена органическим повреждением СУ, что приводит к апериодичности образования импульсов, не зависящей от дыхательных движений.
ЭКГ- признаки недыхательной аритмии: задержка дыхания ведет к исчезновению дыхательной формы СА, тогда как недыхательная форма СА сохраняется. СА, обусловленная функциональной ваготонией, усиливается при приеме БАБ и прекращается под влиянием атропина. При органическом повреждении СУ, сопровождающемся недыхательной формой СА, эти фармакологические тесты оказываются отрицательными.
Атриовентрикулярные блокады
Атриовентрикулярные блокады (АВБ) - это нарушения проведения электрического импульса от предсердий к желудочкам. Можно выделить несколько причин возникновения АВБ: ИБС, ОИМ, миокардиты, пороки сердца, КМП, передозировка БАБ, верапамила, выраженная ваготония (для части случаев АВБ I степени). Диагноз АВ-блокады по возможности должен включать три классификационных признака:
Устойчивость АВ-блокады: преходящая (транзиторная), перемежающаяся (интермиттирующая), хроническая (постоянная).
Топографический уровень блокирования: проксимальный (на уровне предсердий или АВУ, дистальный (ствол пучка Гиса или его ветви); этот тип блокад является наиболее неблагоприятным в прогностическом отношении.
Степень блокады: I степень АВБ (неполной) — это замедление проводимости на любом уровне проводящей системы сердца, II степень АВБ (неполной) — это постепенное или внезапное ухудшение проводимости на любом участке проводящей системы сердца с периодически возникающим полным блокированием одного (реже 2-3-х) электрических импульсов, III степень АВБ (полной) - полное прекращение АВ-проводимости и функционирование эктопических центров II и III порядка.
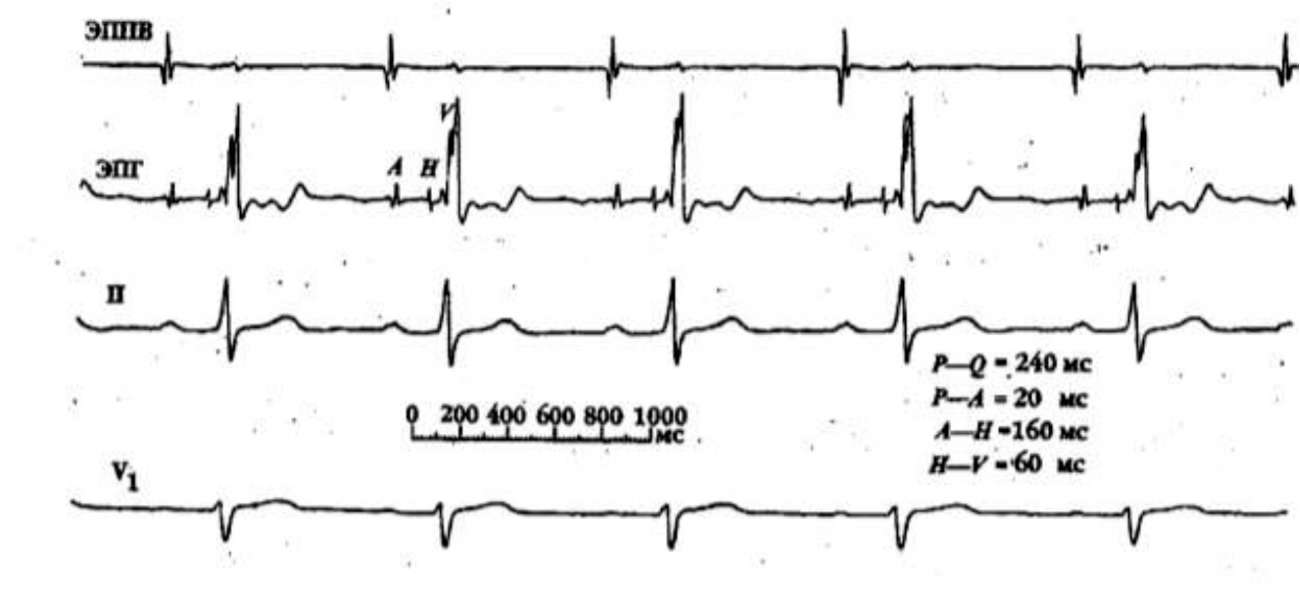
Рисунок 4. Атриовентрикулярная блокада I степени
Признаки АВБ I степени:
Сохраняется правильный синусовый ритм;
Наличие увеличения интервала P-Q(R) более 0,20 с (больше 0,22 с - при брадикардии или больше 0,18 с - при тахикардии).
АВ-блокада II степени. При всех формах АВ-блокады II степени:
сохраняется синусовый, но в большинстве случаев неправильный, ритм;
периодически полностью блокируется проведение отдельных электрических импульсов от предсердий к желудочкам (после зубца Р отсутствует комплекс QRST).
АВБ II степени Мобитц 1: постепенное, от одного комплекса к другому, увеличением длительности интервала P-Q(R), которое прерывается выпадением желудочкового комплекса QRST (при сохранении на ЭКГ зубца Р). После выпадения комплекса QRST вновь регистрируется нормальный или слегка удлиненный интервал P-Q(R), периодика Самойлова-Венкебаха. АВБ II степени Мобитц 2 чаще встречается при дистальной форме блокады. ЭКГ-признаки этого типа блокады следующие: регулярное (по типу 3:2; 4:3; 5:4; 6:5 и т.д.) или беспорядочное выпадение комплекса QRST (при сохранении зубца Р); наличие постоянного (нормального или удлиненного) интервала P-Q(R) без прогрессирующего его удлинения, иногда - расширение и деформация комплекса QRS.
Наибольшую опасность представляют АВБ II ст. тип Мобитц II (без периодики). Важным понятием в отношении АВБ является то, что они могут быть проксимальными и дистальными. Проксимальные блокады возникают выше ствола пучка Гиса, а дистальные ниже. Наиболее прогностически неблагоприятными являются дистальные блокады, они требуют более агрессивного лечения. Если степень АВБ обычно хорошо распознается по данным ЭКГ, а их устойчивость - по результатам ЭКГ-МТ по Холтеру, то для достоверной верификации уровня блокирования необходимо проведение внутрисердечного ЭФИ, в частности электрографии пучка Гиса.
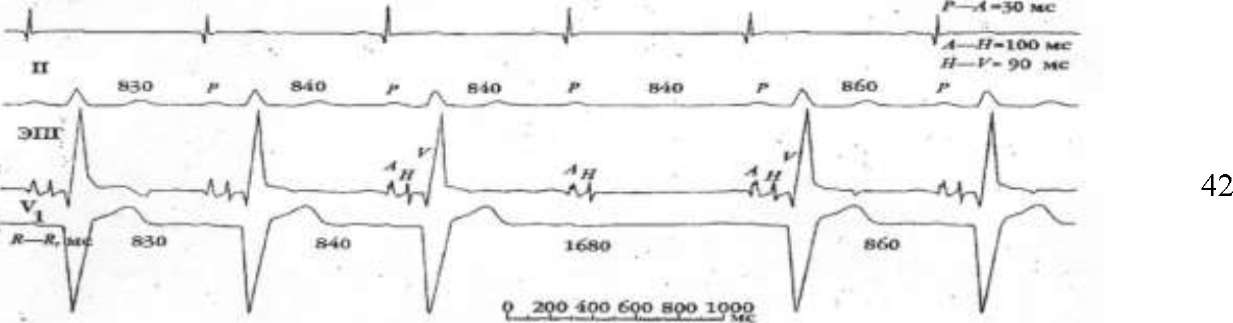
Рисунок 5. Атриовентрикулярная блокада II степени Мобитц II.
К дистальным блокадам относится АВБ II ст. тип Мобитц II, АВБ с QRS 0.12 сек и более. При дистальных АВБ часто имеет место быстрое прогресси-рование нарушения проводимости, вплоть до АВБ III с редким замещающим ритмом.
АВ-блокада II степени типа 2: 1 характеризуется: выпадением каждого второго комплекса QRST при сохранении правильного синусового ритма; нормальным или удлиненным интервалом P-Q(R); при дистальной форме блокады возможно расширение и деформация желудочкового комплекса QRS (непостоянный признак).
Выпадение двух и более подряд QRST при сохранении на месте выпадения предсердного зубца Р называется прогрессирующей АВБ II степени. Выпадения могут быть регулярными (по типу АВ-блокады 3:1; 4:1; 5:1; 6:1 и т.п.) или беспорядочными.
Атриовентрикулярная блокада III степени (полная). При всех формах АВБ III степени: полное разобщение предсердного и желудочкового ритмов (атриовентрикулярная диссоциация) и регулярный желудочковый ритм.
При проксимальной форме АВБ III степени эктопический водитель ритма расположен в АВС ниже места блокады. На ЭКГ выявляются следующие признаки: полное разобщение предсердного и желудочкового ритмов (атриовентрикулярная диссоциация), интервалы Р-Р и R-R постоянны, но R- R больше, чем Р-Р, число желудочковых сокращений колеблется от 40 до 60 в мин, QRS мало изменены (не расширены, узкие).
При дистальной (трифасцикулярной) форме АВБ III степени источник эктопического ритма желудочков расположен в одной из ветвей ножек пучка Гиса. ЭКГ-признаками дистальной АВБ III степени являются: полное разобщение предсердного и желудочкового ритмов (атриовентрикулярная диссоциация), интервалы Р-Р и R-R постоянны, но R-R больше, чем Р-Р, число желудочковых сокращений не превышает 40-45 в мин, желудочковые комплексы QRS уширены и деформированы.
Лечение больных с АВБ заключается в лечении основного заболевания имплантации ЭКС по показаниям, в зависимости от того будет ли блокада постоянной. В первую очередь должны быть корригированы обратимые причины блокады, например, электролитные нарушения. Некоторые заболевания имеют спонтанное разрешение, например, болезнь Лайма, блокада вследствие гипотермии или воспаления в области АВС после хирургических вмешательств. Иногда имплантация ЭКС оправдана вследствие возможности прогрессирования заболевания.
Рекомендации по постоянной электрокардиостимуляции при АВБ.
Класс I
АВБ III ст. и прогрессирующая блокада II ст. любого уровня, сочетающаяся с симптомами брадикардии и сердечной недостаточности (С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня, сочетающаяся с аритмиями, требующими медикаментозного лечения (С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня с документировавши периодами асистолии более 3,0 сек., либо любой выскальзывающий ритм менее 40 в мин.(С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня, у бессимптомных пациентов с ФП и с документированной хотя бы одной паузой 5 сек. и более (С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня у пациентов после радиочастотной абляции (РЧА) АВУ или п. Гиса (С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня с после операционной АВБ, если ее разрешение не прогнозируется (С).
АВБ III ст. и прогрессирующая блокада II ст. любого уровня у пациентов с нейромышечными заболеваниями (миотоническая мышечная дистрофия, синдром Кернс-Сэйра, дистрофия Лейдена (В).
АВБ ст. вне зависимости от типа с сопутствующей брадикардией (В).
Персистирующая АВБ III ст. с выскальзывающим ритмом более 40уд/мин в дневные часы у пациентов с кардиомегалией, дисфункцией ЛЖ (В).
АВБ II, либо III ст., возникающая при тесте с физической нагрузкой при условии отсутствия ИБС (С).
Класс IIа
Персистирующая АВБ III ст. при средней ЧСС в состоянии бодрствования более 40 в мин, без кардиомегалии и дисфункции ЛЖ (В и С)
Бессимптомная АВБ II ст. II тип, выявленная по ЭФИ (В).
Бессимптомная АВБ II ст. II тип, с узким QRS, если возникает АВБ Псг, с широким QRS, включая блокаду правой н. п. Гиса, показания переходят в I класс (В).
АВБ I и II ст с симптомами нарушения гемодинамики (В). Класс IIb
5. У пациентов с нейромышечными заболеваниями (миотоническая мышечная дистрофия, синдром Кернс-Сэйра, и т.д. с АВБ любой степени, включая блокаду I ст, с симптомами или без, т.к. может быть непредсказуемое прогрессирование (В).
6. При возникновении блокады в связи с применением препаратов и/илиих токсическим воздействием, когда разрешение блокады не ожидается даже в условиях его отмены (В).
7. АВБ I ст. с интервалом PQ> 0,30 сек. У пациентов с дисфункцией ЛЖ и симптомами застойной сердечной недостаточности у которых более короткий интервал приводит к гемодинамическому улучшению, предположительно за счет давления в левом предсердии (С) (отсутствует в рекомендациях Европейского общества кардиологов).
Класс III
Бессимптомная АВБ I ст. (В).
Бессимптомная АВБ II ст. I типа при неясно на каком уровне (проксимальном или дистальном) (С).
Ожидаемое разрешение АВБ или маловероятный ее рецидив (лекарственная токсичность, болезнь Лайма, повышение вагального тонуса) при отсутствии симптоматики (В).-
ТАХИКАРДИИ
Тахикардии могут быть приступообразными (пароксизмальными) и непароксизмальными - хроническими. Чаще в основе пароксизмальных тахикардий лежат механизмы re-entry и триггерные, а в основе хронических тахикардии - нарушения автоматизма. Пароксизмы тахикардии могут быть устойчивыми (>30 секунд) и неустойчивыми (<30 секунд).
По частоте приступы тахикардии могут быть разделены следующим образом:
редкие - менее 1 раза в месяц;
средней частоты - 1-3 раза в месяц;
частые - 1-2 раза в неделю;
сверхчастые - ежедневно;
непрерывно-рецидивирующие - несколько приступов в день;
постоянно-возвратные цепи тахикардии (разделены несколькими синусовыми комплексами).
Неритмичные тахикардии с широкими комплексами QRS:
полиморфная тахикардия («пируэт», двунаправленная ЖТ);
аритмичные тахикардии с блокадой ножек пучка Гиса.
Предсердные тахикардии
Очаги предсердной тахикардии (ПТ) локализуются в предсердиях и характеризуются ритмичностью распространения импульсов. Как правило, возникают с частотой 100-250 уд./в мин. СУ и АВУ не принимают участия в инициации и поддержании тахикардии. Во время пароксизма изоэлектрическая линия четко определяется между з. Р. Однако, если тахикардия имеет высокую частоту или нарушение внутрипредсердной проводимости ( з. Р становятся широкими), то это может имитировать ТП. Точный диагноз возможно установить только после проведения ЭФИ. Возможными механизмами ПТ являются аномальный автоматизм, триггерная активность и micro-re-entry. При аритмии, в основе которой лежит повышенный автоматизм отмечается постепенное нарастание частоты предсердного ритма (период «разогрева»), а перед окончанием пароксизма период «охлаждения». Автоматические ПТ носят, как правило, непрерывно-рецидивирующий характер, в то время как триггерные ПТ могут иметь как непрерывно-рецидивирующий, так и пароксизмальный характер. Неустойчивая ПТ редко проявляется клинической симптоматикой. Чаще всего встречается у лиц пожилого возраста со структурной патологией сердца. Политопная ПТ устанавливается, когда на ЭКГ регистрируются з.Р трех и более морфологий при разных интервалах сцепления. Так как ритм всегда неправильный, часто ставится диагноз - ФП, однако частота тахикардии невысокая. Чаще всего этот вид аритмии выявляется у пациентов с хроническими заболеваниями легких.
Атриовентрикулярные тахикардии
Атриовентрикулярные тахикардии составляют около 85% всех НЖТ (исключая фибрилляцию и трепетание предсердий). В основе этих аритмий лежит нарушение формирования импульса и нарушение проведения по типу повторного входа возбуждения (re-entry). Для возникновения этого механизма необходимо ряд условий: однонаправленный блок проведения, который может быть следствием повышения ЧСС или экстрасистолии, что изменяет рефрактерный период одного из участков петли re-entry, замедление проведения для поддержания кругового движения импульса. Атриовентрикулярные тахикардии делят на две большие группы: АВ узловые тахикардии и АВ тахикардии при синдроме Вольф-Паркинсон-Уайта (WPW).
В основе этих НРС лежит циркуляция волны возбуждения (reentry), либо по АВС, либо по АВС и ДПП при синдроме WPW. АВ узловая тахикардия выглядит на ЭКГ как ритмичная тахикардия с узкими комплексами QRS и отсутствием синусового зубца Р перед QRS.
Атриовентрикулярная
узловая тахикардия
Рисунок 6 Несинусовый зубец Р* располагается после комплекса QRS на расстоянии менее 100 мс.
Лечение больных с АВ тахикардиями
Выбор тактики лечения осуществляется исходя из тяжести состояния больного во время приступов и частоты приступов, а также особенностей электрофизиологии проводящей системы сердца и ДПП. Выбор способа лечения возможен после полноценного обследования больного, включающего ЭФИ. Пациент с подозрением на АВ тахикардию должен быть обязательно направлен к аритмологу.
Варианты хирургического лечения:
Трансвенозная деструкция АВС/или ДПП через эндокардиальный электрод с нанесением электрических разрядов мощностью 100-200 Дж.
Трансвенозная эндокардиальная деструкция АВС и/или ДПП посредством РЧА. Метод позволяет излечивать до 90% больных с АВ узловыми тахикардиями и АВ тахикардиями при синдроме WPW.
Криодеструкция ДПП, особенно левосторонних.
йперация с АИК на открытом сердце для деструкции ДПП.
Рекомендации по радиочастотной аблации ДПП.
Класс I
Пациенты с симптоматическим НЖТ, устойчивыми к ААП, а также при непереносимости препаратов пациентом или его нежеланием продолжать долгосрочную лекарственную терапию.
Пациенты с ФП с быстрым желудочковым ответом, связанным с антероградным проведением импульса по ДПП, если тахикардия устойчива к действию ААП, или при их непереносимости.
Класс II
Пациенты с НЖТ или ФП с высокой частотой сокращений желудочков, определяемой при проведении ЭФИ при изучении механизмов аритмии.
Пациенты с предвозбуждением желудочков, не имеющие симптомов, если их профессиональная деятельность и общественная безопасность будут нарушены в результате возникновения спонтанных тахиаритмий.
Пациенты с ФП и контролируемой частотой желудочковых ответов с проведением по ДПП.
Пациенты с семейным анамнезом внезапной сердечной смерти.
Класс III
Пациенты, у которых связанные с ДПП аритмии легко переносятся, и если пациент предпочитает медикаментозную терапию проведению аб лации.
ЖЕЛУДОЧКОВЫЕ ТАХИКАРДИИ
Желудочковые аритмии — это расстройства сердечного ритма, при которых источник эктопической импульсации расположен ниже бифуркации пучка Гиса. Именно ЖТ являются наиболее часто причиной ВС у больных с сердечнососудистыми заболеваниями. Так, по данным мониторирования ЭКГ во время смерти пациента, зарегистрировано, что в 62% имела место ФЖ, в 13% - ЖТ типа "пируэт", в 8% - нестабильная ЖТ, в 16,5% -брадиаритмия.
.
Синусовый
ритм с частотой 60 в мин. Спонтанное
восстановление синусового ритма

Рисунок 7. Мономорфная желудочковая тахикардия с частотой 170 в мин
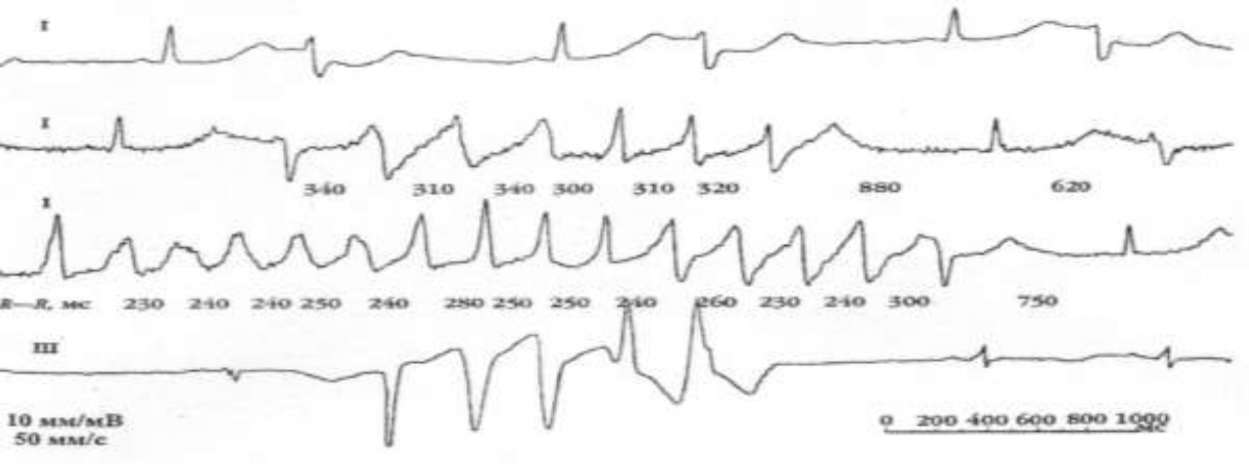
Рисунок 8. Двунаправленная веретенообразная типа «пируэт»
Классификация желудочковых тахикардии По форме:
Мономорфная (относительно ритмичная тахикардия с широкими QRS, напоминающими БНПГ;
Полиморфная/двунаправленная (относительно ритмичная тахикардия с широкими QRS и постоянно меняющейся электрической осью сердца) при нормальном интервале Q-T;
3) Двунаправленная веретенообразная - "пируэт" при синдроме удлиненного интервала Q-T (мало ритмичная тахикардия с широкими QRS, за короткий период их высота и полярность прогрессирующе изменяются, так что в течение 3-5-20 комплексов они направлены вверх, а затем вниз). По частоте:
от 51 до 100 — ускоренный идиовентрикулярный ритм;
от 100 до 250 — желудочковая тахикардия;
выше 250 — трепетание желудочков;
фибрилляция желудочков — аритмичная, хаотическая активация сердца. На ЭКГ дискретные комплексы QRS не идентифицируются.
По продолжительности:
устойчивые — более 30 секунд;
неустойчивые — менее 30 секунд.
По характеру течения: пароксизмальные и непароксизмальные.
Основной проблемой при наличии ЖТ является профилактика внезапной смерти. Тактика лечения больных с ЖТ зависит от степени злокачественности последних.
При оценке риска ВС учитывают следующие признаки: Класс I (доказанная высокая информативность)
Фракция выброса ЛЖ;
Вариабельность сердечного ритма;
Конечный систолический объем;
Семейный анамнез.
Класс 11А (умеренная информативность)
Желудочковая экстрасистолия;
Неустойчивая желудочковая тахикардия;
ЧСС.
Класс III (низкая информативность) дисперсия интервала QT.
БАБ и верапамил внесены только в III класс средств профилактики ВС при гипертрофической кардиомиопатии, так как, несмотря на то, что эти препараты способны снижать градиент давления в выносящем тракте ЛЖ, устранять симптоматику и улучшать клиническое состояние этих пациентов, имеющиеся данные не подтверждают, что эти средства могут играть важную роль в предотвращении ВС у данной категории больных. Таким образом, в качестве ААП, для профилактики ВС при органических заболеваниях миокарда, применяют АМИОДАРОН, СОТАЛОЛ и БАБ.
Купирование пароксизма мономорфной ЖТ производится согласно приведенному алгоритму (см. приложение). Вместо новокаинамида используют также АМИОДАРОН (при дисфункции ЛЖ - в обязательном порядке) 300 - 450мг в/в за 10-15 мин, затем длительная инфузия до общей дозы за сутки 1000 - 1200 мг. После чего переходят на прием препарата внутрь.
Амиодарон для профилактики ЖТ назначается по нескольким схемам, в зависимости от степени опасности аритмии:
2 недели - по 1200 мг/сут, 7 дней - 800 мг/сут, 400 мг/суг - поддерживающая доза;
1-й день - 30 мг/кг веса; 2-й день - 15 мг/кг веса, далее по 800-600 мг/сут до общей дозы 1г; затем поддерживающая доза - 400 мг/сут;
При в/в нагрузке амиодароном вводят в первые 24 часа 1г препарата по схеме: 150 мг за 10 минут, затем 360 мг за 6 часов (1 мг/мин), 540мг за 18 часов (0,5 мг/мин). Если через 24 часа необходимость во в/в терапии сохраняется, то инфузию продолжают со скоростью 0,5 мг/мин (720 мг/сут). Нагрузочный режим может быть не более эффективным, чем многие активные схемы нагрузки препаратом при приеме внутрь.
Оптимальное время для оценки эффективности амиодарона - это 10 недель от начала лечения. Хотя при назначении препарата в высоких дозах эффект проявляется раньше. Так, увеличение суточной дозы до 1000-1400 мг дает нужный эффект к 10 дню. При лечении амиодароном (особенно первые 1014 недель) необходимо систематически контролировать ЧСС, интервалы p-Q (не более 0,24 сек) и QT корр. (не более 0,5 сек). Обычная начальная доза COTAJIOJIA 80 мг 2 раза в день. При необходимости ее можно постепенно повысить до 240-320 мг/сут в 2-3 приема. Увеличение дозы проводить с интервалом в 2-3 дня. При подборе дозы из-за риска возникновения ЖТ "пируэт" необходимо контролировать интервал QТкорр (не более 0,5 сек). При этом риск ЖТ "пируэт" ниже 2%.
СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ РИТМА СЕРДЦА
Немедикаментозные методы лечения.
Дефибрилляция - кардиоверсия (наружная и внутрисердечная);
ЭКС (временная и постоянная; одно- (желудочковая или предсердная) и двухкамерная; частотно-адаптивная и нет; одно- и биполярная);
Имплантация кардиовертера-дефибриллятора (КВ-ДФ);
Радиочастотная аблация (интервенционное разрушение проводящих структур сердца: АВУ, ДПП, петли re-entry, очага тахикардии). При лечеииии ЖТ наследственного генеза проводят прямое разрушение очага ЖТ методом хирургической деструкции (крио-, электро-, лазеродеструкции). При ЖТ ишемического генеза выполняют: круговую вентрикулотомию, резекцию эндокарда, аневризмэктомию в сочетании с коронарным шунтированием.
Хирургия на открытом сердце. Применение для лечения НРС операций на открытом сердце, оправдано только при наличии другой патологии, требующей подобного вмешательства (аневризма левого желудочка, критический порок клапанов сердца и т.п.).
11. 1 Классификация антиаритмических средств
Классификация E.Vaughan-Williams (1969):
1 класс - средства, действующие на натриевые каналы.
1А - удлиняют реполяризацию (хинидин, прокаинамид, дизопирамид);
1В - укорачивают реполяризацию (лидокаин, тримекаин, мексилетин);
1С - практически не влияют на реполяризацию (пропафенон, флекаинид,
энкаинид, этмозин, этацизин, аллапинин).
класс - БАБ (пропранолол, атенолол, метопролол, эсмолол, надолол).
класс - средства, удлиняющие реполяризацию и действующие на калиевые каналы (амиодарон, соталол, ибутилид, дофетилид, бретилий).
4 класс - кальциевые блокаторы (верапамил, дилтиазем).
Препараты, не вошедшие в классификацию, но обладающие антиаритмическими свойствами.
- Холинолитики (атропин, препараты красавки) - используют для увеличения ЧСС при брадикардиях, особенно велико их значение в лечении вегетативных дисфункций синусового узла.
- Сердечные гликозиды (дигоксин, строфантин) - традиционные средства урежения сердечного ритма.
- Аденозин (АТФ) - препарат для купирования реципрокных тахиарит- мий.
- Электролиты (растворы калия, магния, пероральные препараты калия и магния) - препараты калия обладают урежающим действием. Действуя на патогенетические механизмы, электролиты способствуют нормализации ритма.
- Дигидропиридиновые БКК (нифедипин, нифедипин SR, амлодипин, фелодипин, лацидипин) - успешно применяются для лечения брадизависимых аритмий, поскольку приводят к умеренному увеличению ЧСС.
- ИАПФ (каптоприл, эналаприл, рамиприл, трандолаприл, квинаприл, лизиноприл) - доказан положительный эффект при желудочковых НРС. Поскольку НРС обусловлены нарушением электрофизиологических процессов, протекающих на клеточных мембранах, то при классификации ААП также исходят из вызываемых ими электрофизиологических эффектов.
Наиболее широкое распространение получила классификация Е. Vaughan-Williams (1969, 1970, 1984), согласно которой ААП сгруппированы согласно их основному электрофизиологическому эффекту. Класс I - локальные анестетики или мембраностабилизаторы, т.е. вещества, блокирующие быстрые Na каналы клеточной мембраны и тормозящие максимальную скорость начальной деполяризации (фаза 0 потенциала действия). Все ААП I класса обладают отрицательным инотропным эффектом и должны с большой осторожностью применяться при сердечной недостаточности, особенно это касается ААП IA подкласса (дизопирамид). ААП 1 класса разделены на 3 подкласса в зависимости от выраженности их влияния на скорость деполяризации и на эффективный рефрактерный период (ЭРП) ). Подкласс IA - хинидин, новокаииамйд, дизопирамид, аймалин. Препараты IA подкласса умеренно тормозят Na ток, (максимальная скорость фазы 0 потенциала действия) и в большей степени, чем другие ААП I класса, удлиняют продолжительность потенциала действия. Поэтому они замедляют проведение по миокарду предсердий (удлинение P-Q), миокарду желудочков (расширение QRS), а также удлиняют ЭРП (удлинение интервала Q-T). Применяются наиболее часто для купирования тахикардии. Так, новокаииамид является универсальным купирующим препаратом для НЖТ и ЖТ. Хинидин применялся для купирования ФП и ТП. Подкласс IB - лидокаин, тримекаин, токаинид, мексилетин, фенитоин. Эффективны преимущественно при ЖТ. Оказывают слабое действие на фазу 0 здоровых, тканей при медленном ритме. Эффект более выражен при быстром ритме сердечных сокращений. Не изменяют или укорачивают потенциал действия. В этой связи препараты мало влияют на QRS, интервал Q-T укорачивается. Наиболее известен лидокаин для купирования ЖТ.
Подкласс 1С - флекаинид, энкаинид, этацизин, аллапинии, пропафе- нон, боннекор. С наибольшей силой в сравнение с другими ААП I класса блокируют быстрые К - токи, замедляя фазу 0 при нормальном сердечном ритме в здоровых тканях, а значит, уменьшают скорость проведения по миокарду предсердий (удлинение интервала P-Q), миокарду желудочков (расширение QRS). ААП 1С подкласса почти не влияют на ЭРП (интервал Q-T - const). Обладают самым выраженным проаритмическим эффектом среди ААП I класса, поэтому не должны применяться у больных с высоким риском проаритмических эффектов.
Класс II. Блокаторы-адренорецепторов. Пропранолол, бисопролол, атено- лол, метопролол, бетаксолол. Антиаритмический эффект препаратов связан с их способностью блокировать в-адрецергические рецепторы, то есть защищать сердце от избыточных нервно-симпатических стимулов. Для меб- ранодепрессивного эффекта требуются большие дозировки этих ААП, чем для подавления аритмии. Основными "точками приложения" действия БАБ являются СУ и ABC. Они удлиняют фазу спонтанной диастолической деполяризации в клетках-пейсмекерах в СУ (удлинение интервала R-R), удлиняют эффективный рефрактерный период в ABC (удлинение интервала P-Q), немного укорачивают продолжительность реполяризации желудочков (уменьшение интервала Q-T). Применяются для профилактики СВТ и ЖТ, ФЖ. В большом числе исследований продемонстрировали способность предупреждать ВС. Применяются для нормализации ЧСС при МА.
Класс III. Вещества, удлиняющие 2 и 3 фазы реполяризации и, соответственно, продолжительность потенциала действия - амиодарон, бретилий, соталол, N-ацетилновокаинамид, клофилиум. Замедляют фазу спонтанной диастолической деполяризации в СУ и тем самым вызывают синусовую брадикардию. Препараты удлиняют ЭРП миокарда предсердий, желудочков, системы Гиса Пуркинье, дополнительных путей проведения и, в меньшей степени, АВС, поэтому имеет место феномен распознаваемого расширения QRS за счет преимущественного удлинения интервала H-V. ААП удлиняют интервал Q-T, вследствие замедления процессов реполяризации. Вызывает появление зубца U, который отражает феномен ранней постдеполяризации при удлинении фазы реполяризации Группа наиболее широко (наряду с бета-блокаторами) применяющихся ААП. Высоко эффективны как для профилактики, так и для купирования, как СВТ так и ЖТ.
Класс IV. Верапамил, дилтиазем. Наибольшее влияние оказывают на клетки с медленным, электрическим ответом (СУ, ABC), удлиняя фазу спонтанной диастолической деполяризации (уменьшение ЧСС), фазу быстрой деполяризации снижение скорости проведения по СУ и ABC (возникновение си- ноатриальных блокад и удлинение интервала P-Q). Наиболее эффективны при АВ реципрокных тахикардиях как для купирования, так и для профилактики пароксизмов.
Классификация Сицилианского гамбита (1994): Основная идея классификации - подбор препарата индивидуально больному, с учетом всех особенностей того или иного лекарства, ее применение упрощается с использованием компьютера. Состоит она из двух таблиц. По первой, определив механизм развития аритмии, находим уязвимые параметры и группы препаратов, которые могут на них повлиять. По второй таблице, выбирают конкретный препарат с учетом его клинических эффектов и действия на каналы, рецепторы, транспортные ферменты.
Проаритмические эффекты антиаритмических препаратов
Тактика лечения больных с НРС, основанная, прежде всего, на лечении основного и сопутствующих заболеваний, глубоко целесообразна в силу высокой частоты побочных эффектов ААП и, прежде всего, проаритмического влияния антиаритмиков. Любое действие ААП может вызвать как антиаритмический, так и аритмогенный эффект. Проаритмическое действие препаратов - это возникновение принципиально новых и, или резкое усугубление уже существующих НРС, возникающее чаще в ранние сроки (до 30 суток от начала приема ААП) и не обусловленное какой-либо другой причиной. О проаритмическом эффекте ААП стали с уверенностью говорить с 1980 года после серии клинических исследований. До этого времени были известны только "хинидиновые синкопе", как результат ЖТ типа "пируэт" у пациентов, принимающих хинидин. Наиболее известными исследованиями, привлекшими внимание кардиологов к этой проблеме, являются CAST I и CAST II. Работа была начата в 1987 году в 27 медицинских центрах и 100 клиниках Северной Америки и Европы. В исследование вошли больные с малосимптомными ЖА на фоне ПИКС. Изучали такие ААП 1С класса, как энкаинид, флекаинид, морицизин. Через 22 месяца исследование для энкаи нида и флекаинида было остановлено, так как среди пациентов, принимающих эти препараты, летальность была достоверно выше (в 3,6 раза), чем в группе плацебо. Причем летальность возросла, несмотря на выраженный антиаритмический эффект препаратов, то есть на фоне снижения числа ЖЭ возросла частота ФЖ и ВС. Затем аналогичные результаты были показаны для морицизина. Новый анализ 800 больных в 6 медицинских центрах показал возрастание летальности в 3 раза на фоне приема хинидина (2,6% против 0,8% в группе плацебо).
Таким образом, была опровергнута гипотеза о том, что подавление потенциально злокачественных ЖА аритмий любыми ААП снижает риск ВС. Вопрос о соотношении "польза-риск" ААП был поставлен ребром. Были проведены многочисленные исследования по большинству ААП, в процессе которых было показано, что неблагоприятные эффекты ААП встречаются примерно у 30% больных, из них 15% составляют проаритмические эффекты.
Неблагоприятные эффекты ААП можно разделить следующим образом:
системные;
сердечные;
проаритмические.
Системные эффекты. Например, гастроинтестинальные симптомы, связанные с приемом хинидина, токаинида, мексилетина, пропафенона, бретилия. Нарушения со стороны ЦНС свойственны больным, получающим лидокаин, токаинид, энкаинид, амиодарон, хинидин. Легочные токсические эффекты свойственны кордарону, фенитоину. Нарушения потенции могут возникнуть у больных, принимающих БАБ и дизопирамид. Системные эффекты обычно обратимы и не являются опасными для жизни. Исключение - пульмональный фиброз, спровоцированный амиодароном.
Сердечные эффекты. Почти все ААП обладают отрицательным инотропным эффектом и могут способствовать прогрессированию сердечной недостаточности у больных с нарушениями функционального состояния миокарда. Наиболее выражен отрицательный инотропный эффект у ААП 1С класса и у дизопирамида, эти препараты не должны применяться у больных с СН. Новокаинамид и хинидин обладают незначительным, но достоверным отрицательным инотропным эффектом. Амиодарон при быстром, в/в введении дает некоторый отрицательный инотропный эффект, при приеме per os не оказывает значимого влияния на миокард. БКК обладают выраженным отрицательным инотропным эффектом и не применяются при ХСН.
Проаритмические эффекты наиболее часто возникают рано, в первые 3 дня приема препаратов. Они документированы для всех ААП в большей или меньшей степени. Спровоцированные ААП НРС чаще протекают асим птомно, их появление можно обнаружить только при ЭКГ-МТ, нагрузочных тестах, ЭФИ. Нет достаточно надежных признаков, предсказывающих про- аритмический эффект.
Необходимо знать факторы риска проаритмического действия ААП:
Низкая ФВ. Так, при ФВ менее 40% частота побочных эффектов ААП возрастает в 7 раз, а риск проаритмического действия - в 5 раз. Возможными препаратами в этой ситуации считается кордарон, БАБ и соталол.
Следующим фактором риска является тяжесть основного заболевания и злокачественность аритмии. То есть, чем тяжелее протекает болезнь и чем злокачественнее НРС, тем больше риск побочных, в том числе - проаритмических эффектов ААП. Фактором риска является удлинение интервала QТ на 20% больше нормы (или на 75 мс), а также уширение QRS во время пробы с физической нагрузкой.
Нарушения метаболизма (гипоксия, алкалоз, гипокалиемия, гипомагниемия, ХПН), СД, XH3JI.
Комбинация ААП друг с другом и с сердечными гликозидами, а также постоянный прием сердечных гликозидов. Опасным в плане проаритмического действия является быстрое в/в введение высоких доз ААП.
Нарушение элиминации ААП и "критическое" повышение содержания препарата в плазме. В этой связи необходимо помнить, что за счет печеночного метаболизма элиминируется кордарон, лидокаин, верапамил, за счет почечного - ритмилен, за счет смешанного - хинидин и новокаинамид.
К группе риска относятся больные, у которых наряду с основным НРС, имеют место другие НРС, требующие противоположных методов лечения, например, СССУ. К группе риска относятся больные с высокой частотой сокращений желудочков (более 150 в мин) при ФП.
Способы профилактики проаритмических эффектов. Способами профилактики являются:
точная идентификация НРС;
оценка состояния проводящей системы сердца, что возможно только при электрофизиологическом ислледовании;
адекватное лечение основного и сопутствующих заболеваний;
соблюдение показаний и противопоказаний к назначению ААП;
устранение факторов риска проаритмического действия ААП.
Желательно не применять максимальные дозы препаратов, начинать лечение со средних доз и, при необходимости, их повышать. Очень осторожно комбинировать ААП, осуществлять тщательный контроль за состоянием больного, принимающего ААП, особенно в первые 3 суток, так как именно в это время чаще развиваются проаритмические эффекты. Тщательный контроль подразумевает длительное мониторирование ЭКГ и выполнение нагрузочных проб (например, тредмил-тест или велоэргометрия) на фоне приема антиаритмического препарата.
МЕРЦАТЕЛЬНАЯ АРИТМИЯ
Термин "мерцательная аритмия" предложил Г.Ф. Ланг: «...если при аритмии нельзя установить какой-либо правильности в чередовании пульсовых волн, то это почти всегда мерцательная аритмия. Мерцание предсердий, как оно наблюдается в эксперименте на животных, заключается в мелких неправильных сокращениях отдельных пучков мускулатуры предсердий, появляющихся взамен их нормальных сокращений. Эти мелкие движения мускулатуры заметны на обнаженном сердце только по переливающимся отблескам эпикарда - отсюда название мерцание. Электрокардиограмма (ЭКГ) при мерцании предсердий в эксперименте оказалась идентичной по своему характеру с ЭКГ при «постоянной аритмии» у больного человека.» (Г. Ф. Ланг. "Учебник внутренних болезней" Том I, часть 1, "Медгиз", Л., 1938 г.)
В настоящее время под этим термином объединяются две формы аритмии: фибрилляция предсердий (ФП) и трепетание предсердий II типа.
Фибрилляция предсердий (ФП) - это разновидность наджелудочко-вых тахиаритмий, характеризующаяся некоординированной электрической активностью предсердий с ухудшением их сократительной функции.
ФП диагностируется на основании следующих критериев:
«Абсолютно» нерегулярные интервалы RR (интервалы RR не повторяются по продолжительности). Иногда ФП называют arrhythmia absoluta;
Отсутствие на ЭКГ зР перед комплексом QRS. В некоторых отведениях, чаще всего V1, может определяться кажущаяся регулярной электрическая активность предсердий;
Длительность предсердного цикла (т.е. интервал между двумя возбуждениями предсердий), если определяется, составляет < 200 мс (> 300 в мин).
Изолиния замещена кривой, представляющей волны f, амплитуда волн f, и расстояние между ними, постоянно изменяются. При амплитуде волн f более 0,5 мм. и их частоте 350-450 в минуту говорят о крупноволновой ФП, при амплитуде волн f менее 0,5 мм и их частоте 600-700 в минуту о мелковолновой форме ФП.
Нормосистолическая ФП при ЧСС от 60 до 90, при ЧСС менее 60 - брадисистолическая, при ЧСС более 90 - тахисистолическая.
Трепетание предсердий (ТП) - это быстрая и регулярная активность предсердий, которая характеризуется отсутствием (по крайней мере, в одном отведении ЭКГ) изоэлектрической линии между предсердными комплексами. Трепетание предсердий I типа, координированная форма 2:1
Нормальные зубцы P на ЭКГ отсутствуют, вместо них регистрируются волны F. ТП 1 типа — частота F 240-340, имеет место постоянная амплитуда волн F и постоянная длина предсердного цикла, это ТП может быть купировано электрокардиостимуляцией с частотой не менее чем на 20% превышающей частоту. ТП II типа — частота F 340-440, характерна несколько непостоянная амплитуда F и изменяющаяся длина предсердного цикла, не купируется электрокардиостимуляцией, эффективна кардиоверсия.
Фибрилляция предсердий - самая распространенная аритмия сердца. Распространенность ФП в общей популяции составляет 1-2%. С возрастом (старше 80 лет) частота встречаемости увеличивается до 8%. За последние 20 лет частота госпитализаций по поводу ФП возросла на 66% в результате старения населения, увеличения распространенности хронических заболеваний сердца. В проспективных исследованиях заболеваемость ФП увеличивалась с менее 0,5% в год у людей в возрасте до 40 лет до более 5% - 15% в год в возрасте старше 80 лет. Проблему раннего распознавания ФП осложняют бессимптомные формы, которые встречаются примерно у 1/3 пациентов. В эпидемиологических исследованиях доля пациентов без заболеваний сердца в анамнезе среди больных ФП не превышает 12%. В некоторых исследованиях доля пациентов с изолированной ФП превышала 30%.

В Европе распространенность ФП за следующие 50 лет на фоне постарения населения увеличится в 2,5 раза. У мужчин распространенность ФП, скорректированная по возрасту, значительно выше, чем у женщин. Медиана возраста больных ФП составляет около 75 лет. Примерно 60% больных в возрасте старше 75 лет женщины. ФП ассоциируется с увеличением риска развития инсульта, хронической сердечной недостаточности (ХСН) и общей смертности.
Таблица №1
Таблица
1
Неблагоприятные исходы фибрилляции предсердий
Исход |
Изменение риска у больных с фибрилляцией предсердии |
Смерть |
Частота летальных исходов увеличивается в 2 раза |
Инсульт (включая геморрагический инсульт) |
Риск инсульта увеличивается в 5 раз, а каждый пятый инсульт развивается на фоне ФП. Течение более тяжелое у пациентов с фибрилляцией предсердий |
Госпитализация |
Более частые госпитализации и способствуют ухудшению качества жизни |
Качество жизни |
Изменения вариабельны от отсутствия до значительного ухудшения |
Функция левого желудочка |
Изменения вариабельны от отсутствия до развития острой сердечной недостаточности |
Из Рекомендаций Европейского общества кардиологов
по диагностике и лечению фибрилляции предсердий (2010г
ФП - это наджелудочковая тахикардия (НЖТ), которая характеризуется нескоординированной активацией предсердий и в последующем нарушением их механической функции. У больных ФП чаще всего обнаруживают фиброз и уменьшение мышечной массы предсердий. Однако фиброз может предшествовать аритмии и развиться в результате апоптоза (структурное ремоделирование предсердий на фоне органических заболеваний), который приводит к замещению миоцитов предсердий. Это приводит к электрической диссоциации мышечных пучков и неоднородности проведения, которые способствуют развитию и сохранению ФП. Электроанатомические изменения обуславливают появление множественных очагов циркуляции возбуждения, которые стабилизируют аритмию.
Дилатация предсердий активирует различные сигнальные пути, включая ренинангиотензиновую систему (РААС). Активация ангиотензина II происходит в ответ на растяжение, в ткани предсердий больных с перси- стирующей ФП отмечается повышенная экспрессия ангиотензин- превращающего фермента (АПФ). Подавление ангиотензина II может препятствовать развитию ФП за счет уменьшения фиброза. Накапливаются данные, подтверждающие важность РААС в патогенезе ФП и лечение антагонистами ангиотензина II снижает частоту ФП после катетерной абляции.
Механизмы развития фибрилляции предсердий.
Имеются данные, которые свидетельствуют о наличии очаговых триггеров ФП (повышенный автоматизм или множественные очаги циркуляции возбуждения re-entry), которые не исключают друг друга и могут сочетаться.
ФП может сочетаться с ТП или предсердной тахикардией. При ТП на ЭКГ определяются пилообразные регулярные зубцы F, которые лучше видны в отведениях II, III, aVF и V1. Частота предсердных зубцов составляет 240-320 в мин. В отведениях II, III, aVF зубцы F являются инвертированными, а вУ1 - положительными. ТП может перейти в ФП и наоборот. Очаговые предсердные тахикардии и узловые тахикардии по типу re-entry могут индуцировать развитие ФП. В этих случаях обычно определяются зубцы Р, морфология которых позволяет определить происхождение аритмии.
Факторы, предрасполагающие к развитию фибрилляции предсердий
Электрофизиологические нарушения: повышенный автоматизм, нарушения проводимости (re-entry).
Повышение давления в предсердиях: порок митрального или трикуспидального клапанов, поражение миокарда (первичное или вторичное; приводящее к нарушению систолической или диастолической функции), изменения полулунных клапанов, системная или легочная гипертония (тромбоэмболия легочной артерии), внутрисердечные опухоли или тромбы.
Ишемия предсердий: ишемическая болезнь сердца.
Воспалительные или инфильтративные заболевания предсердий: перикардит, амилоидоз, миокардит, возрастные фиброзные изменения.
Лекарства, алкоголь, кофеин.
Эндокринные нарушения: гипертиреоз, феохромоцитома, ожирение. Ожирение является важным фактором риска развития ФП. Увеличение риска связывают с дилатацией ЛП. По мере возрастания индекса массы тела наблюдается увеличение ЛП. Эти данные указывают на наличие физиологической связи между ожирением, ФП и инсультом, и позволяет предположить, что снижение массы тела приводит к уменьшению риска, связанного с ФП.
Изменения вегетативной нервной системы: снижение активности парасимпатической системы, повышение активности симпатической системы
Первичные опухоли или метастазы в стенку предсердий.
Операции на сердце, легких или пищеводе.
Врожденные пороки сердца.
Нейрогенные факторы: субарахноидальное кровоизлияние, негеморрагический инсульт.
Идиопатическая (изолированная) ФП. Примерно 30-45% случаев парксизмальной ФП и 20-25% случаев персистирующей ФП наблюдаются у молодых людей, без заболевания сердца. У части больных с изолированной или семейной ФП со временем появляются признаки заболевания сердца. Хотя ФП может развиться у пожилых людей без симптомов заболевания сердца, ее причиной считают повышение жесткости мышцы сердца. В тоже время заболевания сердца у пожилых людей могут быть не связаны с ФП.
Семейная ФП. Семейная ФП, наблюдающаяся у членов одной семьи, однако ее следует отличать от других генетических заболеваний, таких как семейные кардиомиопатии. Вероятность развития ФП повышена у детей больных с ФП. Молекулярные дефекты, лежащие в основе не установлены. Наличие связи ФП с определенными локусами хромосом в некоторых семьях указывает на роль генетических мутаций. ФП может встречаться при синдроме удлиненного интервала QT, гипертрофической кардиомиопатии, при мутации гена натрийуретического пептида, гена натриевых каналов сердца и других генетических аномалиях.
Классификация фибрилляции предсердий
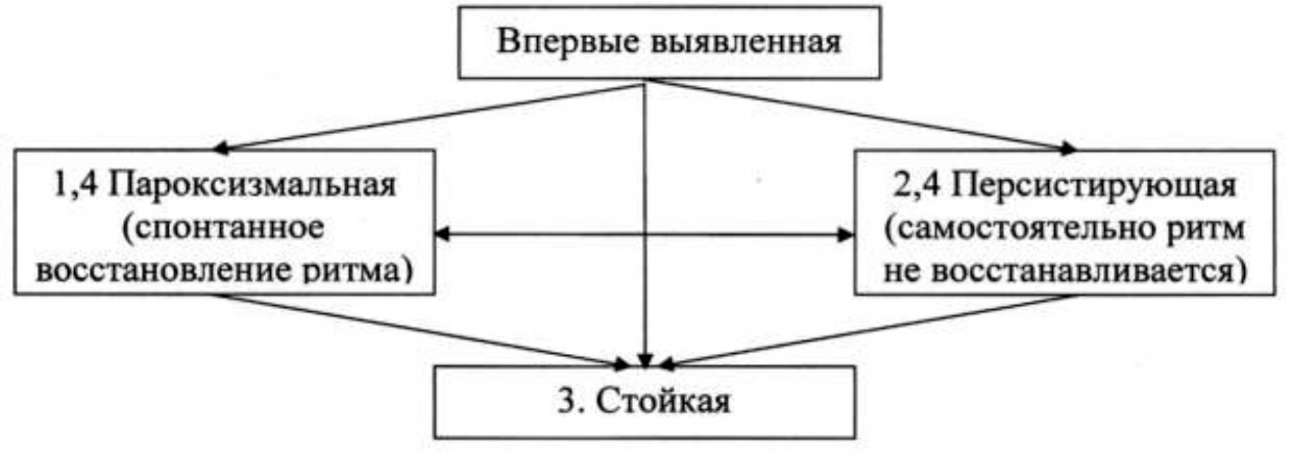
Клиницист должен распознать впервые выявленный приступ ФП, действительно ли он сопровождается симптомами, оканчивается ли самостоятельно. При этом необходимо учитывать, что определить реальную длительность пароксизма удается не всегда. Кроме того, ему могут предшествовать диагностированные пароксизмы ФП. Когда у больного было 2 или больше приступа, ФП считают рецидивирующей. Если аритмия заканчивается спонтанно, рецидив ФП называется пароксизмом, а форма - пароксизмальной; когда аритмия продолжается более 7 дней, ФП называется персистирующей.
Впервые выявленная ФП может быть пароксизмальной или персистирующей. Категория персистирующей ФП также включает случаи длительной ФП (например, больше чем 1 год), когда кардиоверсия не была показана или не была предпринята, обычно это приводит к хронической ФП. Эти варианты ФП не являются взаимоисключающими. У одного и того же пациента могут наблюдаться несколько эпизодов пароксизмальной ФП и отдельные эпизоды персистирующей или наоборот. Целесообразно определять тип ФП на основании более частых эпизодов аритмии. Риск осложнений ФП не отличается при коротких эпизодах аритмии и стойких ее формах
С учетом течения и длительности аритмии выделяют несколько типов ФП: впервые выявленная ФП, это любой первый эпизод независимо от длительности симптомов, пароксизмальная ФП, когда синусовый ритм восстанавливается самостоятельно, обычно в течение 48 ч. (более указанного срока вероятность спонтанной кардиоверсии низкая и необходимо решить вопрос о возможности антикоагуляции); персистирующая ФП, когда длительность эпизода превышает 7 дней, при этом для восстановления необходима медикаментозная или электрическая кардиоверсия; длительно персистирующая ФП, если персистирующая ФП продолжается > 1 года и выбрана стратегия контроля ритма; постоянную ФП диагностируют, когда считается возможным сохранение аритмии, и кардиоверсия не проводится (если предполагается восстановление ритма, то аритмию называют «длительно персистирующей»). Первым проявлением бессимптомой аритмии могут быть осложнения (ишемический инсульт или тахикардиомиопатия). Бессимптомные формы возможны при любой форме аритмии.
Варианты фибрилляции предсердий
Эпизоды аритмий, сохраняющиеся обычно < 7 дней (чаще < 24 ч);
Эпизоды обычно продолжаются более 7 дней;
Или длительно персистирующая, когда кардиоверсия оказалась неэффективной или не проводилась;
Пароксизмальная и персистирующая ФП может рецидивировать.
Приведенная классификация используется для обозначения эпизодов длительностью более 30с, не связанных с обратимыми причинами.
Вторичную ФП, развивающуюся при ОИМ, операциях на сердце, перикардите, миокардите, гипертиреозе или острых заболеваниях легких, рассматривают отдельно. В этих случаях ФП не является первичной проблемой и лечение основного заболевания обычно приводит к восстановлению синусового ритма. Однако если ФП возникает на фоне компенсированного гипотиреоза, то используют общую классификацию. Изолированной называют ФП, возникающую у пациентов в возрасте моложе 60 лет, у которых отсутствуют клинические или эхокардиографические признаки заболеваний сердцах. В таких случаях риск ТЭ осложнений и смерти низкий. Со временем риск ТЭ или смерти увеличивается, что может быть следствием старения или появления изменений сердца.К факторам, оказывающим влияние на гемодинамику при ФП, относятся: утрата систолы предсердий; нерегулярные сокращения желудочков; тахикардия и нарушение коронарного кровотока.
Внезапное нарушение координированной механической функции предсердий при ФП приводит к снижению ФВ на 5-15%. Отсутствие систолы предсердий может привести к значительному снижению сердечного выброса, особенно при нарушении заполнения желудочка в диастолу (при сниженной податливости желудочков при митральном стенозе, АГ, гипертрофической или рестриктивной кардиомиопатии), когда сокращение предсердий вносит значительный вклад в наполнение желудочков. Сократимость миокарда при ФП не является постоянной в связи с наличием зависимости между силой сокращения и длительностью сердечного цикла. У больных с персистирующей ФП средние объемы левого и правых предсердий со временем увеличиваются, а восстановление и сохранение синусового ритма приводит к их уменьшению.
Высокая частота желудочкового ритма сопровождается нарушением наполнения желудочков вследствие сокращения диастолы. Стойкое увеличение частоты желудочкового ритма при ФП более 120-130 в мин. может вызвать нарастание митральной регургитации и развитие дилатационной кардиомиопатии (кардиомиопатии, индуцированной тахикардией). Важно распознавать эту форму кардиомиопатии, при которой ХСН является не причиной, а следствием ФП, а контроль желудочкового ритма может привести к обратному развитию поражения миокарда. Тромбоэмболии, патофизиология и клиническое значение
Хотя ИИ и окклюзию артерий большого круга кровообращения у больных с ФП обычно связывают с ТЭ из левого предсердия, патогенез ТЭ сложен. Причиной инсульта у больных с ФП в 25% случаев могут быть поражение церебральных сосудов, другие источники эмболий или атероматозные изменения проксимального отдела аорты. Риск развития инсульта у больных с ФП составляет 3-8% в год и зависит от наличия других факторов риска. Примерно у половины пожилых больных с ФП имеется АГ (основной фактор риска цереброваскулярной болезни), а у 12% - стеноз каротидной артерии. Частота атеросклероза сонных артерий у больных с ФП и инсультом существенно не отличается от таковой у больных без ФП, а этот фактор риска, по-видимому, имеет не очень большое значение.
Образование тромба, которое является следствием стаза крови в ушке ЛП, читают основной причиной ТЭ у больных с ФП (> 90%). Внутрисердечные тромбы не всегда удается выявить с помощью трансторакальной ЭхоКГ, а ЧПЭхоКГ является более чувствительным и специфичным методом анализа функции ушка ЛП и диагностики тромбов. Результаты ЧПЭхоКГ в динамике во время кардиоверсии продемонстрировали снижение скорости кровотока в ушке ЛП в результате утраты систолы предсердия при ФП.
У больных с ФП, перенесших инсульт, тромбы обнаруживают чаще, чем у больных без инсульта. Хотя предполагается, что тромбообра зование происходит, если ФП сохраняется в течение, по крайней мере, 48 ч, тем не менее, при ЧПЭхоКГ тромбы обнаруживали и через более короткий срок. Повышение риска ТЭ после успешной кардиоверсии (электрической, фармакологической или спонтанной) может быть следствием оглушения миокарда ушка ЛП. Оно наиболее выражено непосредственно после кардиоверсии; улучшение транспортной функции предсердий обычно происходит в течение нескольких дней, хотя иногда для этого требуется 3-4 нед. в зависимости от длительности ФП. Известно, что более 80% ТЭ после кардиоверсии регистрируются в первые 3 дня и почти все - в течение 10дней. С помощью ЧПЭхоКГ подтверждено растворение тромбов у большинства больных. Динамический характер дисфункции ЛП после кардиоверсии послужил основанием для антикоагуляции, которую продолжают в течение нескольких недель до и после восстановления синусового ритма. Хотя оглушение миокарда может быть менее выраженным при определенных состояниях или при короткой продолжительности ФП, однако антикоагуляцию рекомендуется проводить во время кардиоверсии и в течение, по крайней мере, 4 нед. после нее у всех больных, у которых длительность ФП составляет более 48 ч или неиз-вестна, включая пациентов с изолированной ФП (если нет противопоказаний). Скорость кровотока в ушке ЛП при ТП обычно ниже, чем при синусовом ритме, но выше, чем при ФП. Однако неясно, позволяет ли это объяснить пониженную частоту тромбообразования и ТЭ при ТП. При этой аритмии, как и при ФП, после кардиоверсии наблюдается замедленное опорожнение ушка ЛП, что создает угрозу развития ТЭ и является основанием для антикоагуляции. Развитие ТЭ при ФП является следствием сложного взаимодействия различных факторов, включая стаз крови, эндотелиальную дисфункцию, системную и возможно локальную гиперкоагуляцию. Тесная ассоциация между АГ и инсультом у больных с ФП, возможно, опосредуется ТЭ из ушка ЛП, однако АГ повышает также риск эмболий из других источников. Важное значение имеет изучение вопроса о том, может ли лечение АГ привести к снижению риска развития ИИ у больных с ФП. Возрастное повышение риска инсульта у больных с ФП также является результатом различных факторов. Пожилой возраст - это ФР атеросклероза, а образование бляшек в дуге аорты может привести к инсульту независимо от ФП. Неблагоприятное значение возраста повышается при наличии других факторов риска, таких как АГ или женский пол. Риск инсульта особенно высокий при наличии ФП у женщин в возрасте старше 75 лет. Систолическая дисфункция ЛЖ позволяет предсказать развитие ИИ у больных с ФП, не получающих антитромботические средства, но не у больных группы среднего риска, принимающих аспирин.
ФП может проявляться сердцебиением, вызывает нарушения гемодинамики и тромбоэмболические осложнения или протекает бессимптомно. Результаты мониторирования ЭКГ свидетельствуют о том, что у одного и того же больного эпизоды ФП могут сопровождаться или не сопровождаться клиническими симптомами. Со временем сердцебиения могут исчезнуть, поэтому у больных с постоянной аритмией клинические проявления иногда отсутствуют. Это особенно характерно для пожилых людей. У некоторых пациентов симптомы возникают только при пароксизмальной ФП или появляются на время при устойчивой аритмии.
Симптомы ФП зависят от правильности и частоты желудочкового ритма, состояния сердца, длительности ФП и индивидуальных факторов. Первым проявлением ФП могут быть тромбоэмболия или нарастание СН, однако большинство больных жалуются на учащенное сердцебиение, боль в груди, одышку, утомляемость, головокружение или обморок. Полиурия может быть следствием секреции предсердного натрийуретического фактора, особенно при восстановлении синусового ритма. ФП, сопровождающаяся стойким увеличением частоты желудочкового ритма, может привести к развитию кардиомиопатии, индуцированной тахикардией, особенно у больных, которые не знают о существовании аритмии. Обморок - это нечастое осложнение, которое может развиться при восстановлении ритма у больных с дисфункцией синусового узла или на фоне частого желудочкового ритма у больных гипертрофической кардиомиопатией, стенозом аортального отверстия или синдромом преждевременного возбуждения.
Качество жизни у больных с ФП значительно ухудшается по сравнению с пациентами того же возраста. Устойчивый синусовый ритм сопровождается улучшением качества жизни и переносимости физической нагрузки, хотя этот эффект был подтвержден не во всех исследованиях. Большинство больных с пароксизмальной ФП отмечали, что аритмия оказывает влияние на образ жизни, хотя их ощущения не зависели от частоты или длительности клинически явных эпизодов аритмии.
Обследование пациентов с мерцательной аритмией
- Анамнез и физикальное обследование. Диагноз ФП должен быть подтвержден с помощью ЭКГ или амбулаторного ЭКГ-МТ. При наличии ФП необходимо определить, является ли она пароксизмальной или персистирующей, установить причину и выявить сопутствующие заболевания сердца, которые могут способствовать развитию аритмии. Обследование обычно проводят в амбулаторных условиях, за исключением случаев, когда НРС не документировано и необходимо наблюдение за пациентом. Физикальное обследование позволяет заподозрить ФП при наличии неритмичной пульсации. Диагноз ФП должен быть подтвержден на ЭКГ, по крайней мере, в одном отведении. У больных с имплантированными ЭКС или КВ-ДФ наличие диагностических функции памяти у прибора позволяет автоматически регистрировать аритмию.
- Инструментальные методы и лабораторные методы.
Рентгенографию грудной клетки проводят для исключения заболеваний легких и легочных сосудов. По крайней мере, однократно следует провести исследования функции щитовидной железы, почек и печени, анализ крови измерить сывороточные уровни электролитов. Всем больным необходимо проводить двухмерную допплеровскую ЭхоКГ для измерения размеров ЛП, толщины стенки ЛЖ и его функции, а также для исключения порока клапанов сердца, заболевания перикарда и ГКМП. Трансторакальная ЭхоКГ редко позволяет выявить тромбы в ЛП или ушке ЛП. Следующие изменения при ЧПЭхоКГ ассоциируются с развитием ТЭ у больных с неревматической ФП: тромб, эхоконтрастные тени, снижение скорости кровотока в ушке ЛП. Однако необходимы проспективные исследования с целью сравнения перечисленных изменений с клиническими и эхокардиографическими предикторами ТЭ. Наличие тромба в ЛП или ушке ЛП у больных с инсультом или системной эмболией подтверждает их кардиогенное происхождение.
- Дополнительные исследования.
Могут быть выполнены один или несколько тестов: проба с 6-минутной ходьбой, проба с физической нагрузкой, если вызывает сомнения адекватность контроля частоты желудочкового ритма; с целью воспроизведения ФП, индуцированной физической нагрузкой, для исключения ишемии перед назначением ААП. Суточное ЭКГ-МТ с целью оценки адекватности контроля частоты желудочкового ритма. ЭФИ для уточнения механизма тахикардии с широкими комплексами QRS, для идентификации другой аритмии, такой как ТП или пароксизмальной НЖТ. Более ранняя диагностика позволила бы своевременно назначить терапию и предотвратить не только последствия аритмии, но и прогрессирование с развитием рефрактерной аритмии.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ МЕРЦАТЕЛЬНОЙ АРИТМИИ
Американский колледж кардиологии (АСС) и Американская кардиологическая ассоциация (AHA) совместно занимаются разработкой методических рекомендаций в области сердечнососудистых заболеваний с 1980г. Большой честью для членов специального комитета является то, что в разработке этих рекомендаций с 2001г. участвует Европейское кардиологическое общество (ESC). Данный документ редактируется рецензентами и ежегодно пересматривается рабочей группой. Эксперты тщательно анализируют научную литературу, при обсуждении методов фармакотерапии используются результаты клинических исследований лекарственных средств, зарегистрированных в Северной Америке и/или Европе. В конце августа 2010г. на Конгрессе ESC, проходившего в Стокгольме были представлены новые рекомендации по ведению больных с ФП. В отличие от предыдущих Рекомендаций (2001г., 2006г.) эти рекомендации исключительно Европейские. В Европе и США для лечения пациентов разрешены различные препараты и по сравнению с Европой в США работает значительно больше врачей кардиологов и электрофизиологов, поэтому Европейские рекомендации ориентированы и на врачей общей практики и семейных врачей.
В целом тактика ведения больных с ФП не требует значительной адаптации для России, но есть некоторые особенности. В России отсутствует ряд лекарственных препаратов, которые приводятся в рекомендациях (1С - фле- каинид и III класс дофетилид, ибутилид). В Европейских рекомендациях не приводятся такие отечественные препараты как нибентан и этацизин. По мнению некоторых авторов, в России вместо ибутилида для внутривенной кардиоверсии при ФП, по-видимому, можно использовать нибентан, однако, его эффективность и безопасность не изучалась в крупных рандомизированных клинических испытаниях. Ввиду отсутствия в России полного спектра ААП, приводимых в рекомендациях, выбор препарата для кардиоверсии в России может ограничиваться амиодароном, нибентаном, прокаимидом и пропафеноном.
В лечении больных с ФП выделяют три цели:
контроль ЧСС;
профилактика тромбоэмболий;
контроль ритма.
Клинические исследования показали, что стратегия контроля синусового ритма не имеет преимуществ перед контролем частоты желудочкового ритма.
В первую очередь следует выбрать первичную стратегию лечения - контроль ЧСС или ритма. Если выбрана первая стратегия, то не предпринимаются меры, направленные на восстановление и/или удержание синусового ритма. Независимо от выбранной стратегии - контроль ЧСС или ритма - необходимо также использовать антитромботические средства для профилактики ТЭ.
Необходимо оценивать тяжесть симптомов, обусловленных ФП. Для этого можно использовать определение индекса симптомов EHRA.
Таблица 2
Индекс симптомов фибрилляции предсердий
Класс EHRA |
Проявления |
I |
Симптомов нет |
II |
Легкие симптомы; обычная жизнедеятельность не нарушена |
III |
Выраженные симптомы; изменена повседневная активность |
IV |
Инвалидизирующие симптомы; нормальная повседневная активность невозможна |
Из
Рекомендаций Европейского общества
кардиологов по диагностике и
лечению
фибрилляции предсердий (2010г.).
Однако лечение следует подбирать индивидуально с учетом выраженности и частоты симптомов, сопутствующих заболеваний и ответа на лечение. В зависимости от наличия симптомов контроль ЧСС может быть первичной стратегией лечения у пожилых больных с персистирующей ФП. У молодых людей, особенно с изолированной пароксизмальной ФП, может оказаться предпочтительной стратегия контроля ритма.
В лечении используют фармакологические и нефармакологические методы лечения. Лекарственные средства и аблация позволяют контролировать как ЧСС, так и ритм. В определенных ситуациях хирургическое вмешательство имеет преимущества.
Необходимость в антикоагуляции зависит от риска развития инсульта, а не сохранения синусового ритма. Если планируется контроль ритма, то лечение обычно начинают с лекарственных средств, а аблацию рассматривают как метод второй линии, особенно у больных с изолированной ФП. У некоторых больных, особенно молодых людей, у которых ФП сопровождается выраженными симптомами и необходимо удержание синусового ритма, радиочастотная аблация имеет преимущества перед многолетней антиаритмической терапией.
Операция аблации ЛП могут быть дополнением к аортокоронарному шунтированию или операциям на клапанах сердца, что позволяет предупредить рецидив ФП после хирургического вмешательства. Тромбы в 95% случаев образуются в ушке ЛП, поэтому эту структуру обычно исключают из циркуляции во время кардиохирургических вмешательств у больных группы риска развития послеоперационной ФП, хотя не доказано, что эта мера эффективна в профилактике инсульта.
Если планируется кардиоверсия, а длительность ФП не известна или превышает 48 ч, то больным, с отсутствием факторов риска, может быть проведена кратковременная антикоагуляция. Если контроль ЧСС не приводит к адекватному симптоматическому эффекту, то целью лечения является восстановление ритма. Ранняя кардиоверсия может оказаться необходимой, если ФП сопровождается артериальной гипотонией или декомпенсацией ХСН. И наоборот, уменьшение симптомов на фоне контроля ЧСС у пожилых пациентов может послужить основанием для отказа от попыток восстановления ритма. В некоторых случаях, когда причиной ФП являются обратимые состояния, например, тиреотоксикоз или операция на сердце, длительная терапия не потребуется.
В предыдущих рекомендациях для оценки факторов риска ТЭ предложен индекс CHADS2.Терапия антагонистами витамина К (АВК) показана CHADS2 > 2, при отсутствии противопоказаний. Риск инсульта считают низким при CHADS2 =0. Все факторы риска, оцениваются в 1 балл, а наличие перенесенного инсульта или ПНМК в 2 балла. Оценив сумму баллов у каждого пациента с ФП, врач легко может оценить у него риск развития инсульта в течение ближайшего года и принять решение о необходимости проведения антитромботической терапии.
Таблица 3
Индекс chads2
Фактор риска |
Баллы |
||
C |
Cardiac failure |
Сердечная недостаточность |
1 |
H |
Hypertension |
Артериальная гипертензия |
1 |
A |
Age |
Возраст > 75 лет |
1 |
D |
Diabetes |
Сахарный диабет |
1 |
S2 |
Stroke |
Инсульт/ТИА |
2 |
Из Рекомендаций ACC/AHA по диагностике и лечению фибрилляции предсердий (2006г.).
Индекс может применяться для быстрой начальной оценки риска инсульта, но он не включает многие факторы риска инсульта, которые следует учитывать. Опираясь на результаты исследований, где пероральные антикоагулянты имели преимущество перед аспирином, даже с индексом CHADS2 =1. У больных с индексом CHADS2 от 0 до 1 пользуется индексом CHA2DS2-VASC.
Таблица 4
Индекс cha2ds2-vaSc
Фактор риска |
Баллы |
||
C |
Cardiac failure |
Сердечная недостаточность |
1 |
H |
Hypertension |
Артериальная гипертензия |
1 |
A2 |
Age |
Возраст > 75 лет |
2 |
D |
Diabites |
Сахарный диабет |
1 |
S2 |
Stroke |
Инсульт/ТИА |
2 |
V |
Vascular disease |
Заболевания сосудов (ОИМ в анамнезе, атеросклероз периферических артерий) |
1 |
A |
Age |
Возраст 65-74 года |
1 |
S |
Sex category(female) |
Женский пол |
1 |
Из Рекомендаций Европейского общества кардиологов по диагностике и лечению фибрилляции предсердий (2010г.).
Бессимптомные рецидивы ФП у больных, получающих ААП, могут быть причиной ТЭ осложнений после прекращения антикоагуляции. В связи с этим у больных с высоким риском ИИ может быть необходима антикоагулянтная терапия независимо от выбранной стратегии лечения. Частота ИИ на фоне стратегии контроля ритма у больных, прекративших прием варфарина, осталась неопределенной, поэтому необходимы дополнительные исследования. Профилактическое применение аспирина менее эффективно в сравнении с АВК и может быть не более безопасным, особенно у пожилых больных.
НЕПРЯМЫЕ АНТИКОАГУЛЯНТЫ
Согласно принципам доказательной медицины препаратом выбора для профилактики инсульта при ФП являются антагонисты витамина К. Мета-анализ контролируемых исследований показал, что эта группа препаратов снижает риск развития инсультов на 64% и эффект был сопоставим как при первичной, так и вторичной профилактике. В 1941 г. группа американского биохимика K.Linka выделила из сладкого клевера, подвергшегося силосованию, токсическое вещество, вызвавшее в 20- е годы в Северной Америке и Канаде гибель большого поголовья скота от геморрагического диатеза. Первоначально дикумарол применялся в качес-тве крысиного яда под названием WARFARIN, а в 1947г. был впервые использован для лечения инфаркта миокарда. Применение непрямых антикоагулянтов (НАК) нарушает синтез полноценных витамин-К зависимых факторов свертывания (II, VII, IX, X) и антикоагулянтных протеинов С и S. В зависимости от химической структуры молекулы НАК различают производные монокумарина, дикумарина, цик- локумарины и индандионы.
Наиболее широко в мире применяются МОНОКУМАРИНЫ (Вафарин и Синкумар), что обусловлено их оптимальной продолжительностью действия (прием 1 раз в сутки) и хорошей переносимостью. Фенилин находит весьма ограниченное применение в связи с его высокой токсичностью. С 1981 года ВОЗ провела стандартизацию определения протромбинового теста. Эффективность АВК контролируется по Международному Нормализованному Отношению (MHO), которое представляет собой стандартный показатель, не зависящий от вида коммерческого тромбопластина, который использует та или иная лаборатория, тогда как величина такого показателя как протромбиновый индекс (ПТИ) определяется видом используемого тромбопластина. Это делает невозможным как сравнение результатов различных лабораторий, использующих различные тромбопластины, так и применение общих стандартов лечения непрямыми антикоагулянтами. МНО, ПВ-протромбиновое время. МИЧ - международный индекс чувствительности, которым маркируются все коммерческие тромбопластины. МИЧ показывает, насколько чувствительность данного тромбопластина отличается от таковой Референтного Стандарта Тромбопластина. Различают 3 уровня гипокоагуляции:
низкий (MHO 1,6-2,0);
средний (MHO 2,0-3,0);
высокий (2,5-3,0).
АВК не оказывают прямого воздействия на уже образовавшийся тромб, они предотвращают возникновение тромбов и увеличение их размеров, предотвращают возникновение ТЭ.
Клинически значимые изменения в свертывании крови после приема первой дозы НАК определяются не ранее, чем через 8-12 часов, максимальный эффект проявляется спустя 72-96 часов, а продолжительность действия однократно принятой дозы может составлять от 2 до 5 дней. Использование общепринятых ранее ударных "насыщающих" доз НАК не рекомендуется по причине реальной угрозы тромбообразования (вследствие более быстрого снижения уровня антикоагулянтного протеина С в сравнении с фактором II). В настоящее время для профилактики инсульта у больных с ФП изучаются новые пероральные препараты: прямые ингибиторы тромбина, так называемые «гатраны» (дабигатрана этексилат, AZD0873), и ингибиторы фактора Xa, так называемые «ксабаны» (ривароксабан, апиксабан, эндоксабан, бетриксабан, YM150). К декабрю 2010 года стали известны результаты трех исследований с новыми антикоагулянтами: RELY показало, что при неклапанной ФП с факторами риска тромбоэмболических осложнений дабигатрана этексилат в дозе 110мг 2р/день не уступает варфарину по эффективности в профилактике инсульта и СТЭ и реже вызывает крупные кровотечения. Дабигатран в дозе 150мг 2 р/сут оказался эффективнее варфарина при сопоставимой частоте крупных кровотечений. При этом применение обеих доз дабигатрана было сопряжено с более редким возникновением внутричерепных кровотечений. 20 сентября 2010 года Американская администрация по пищевым продуктам и лекарствам одобрила применение дабигатрана у больных ФП для профилактики ИИ, препарат был внесен в рекомендации Американской Коллегии кардиологов и Американской ассоциации сердца по лечению больных ФП. По предварительным данным ривароксабан в дозе 20 мг в сут у больных с неклапанной ФП и факторами риска ТЭ осложнений в исследовании ROCKET-AF оказался, по меньшей мере, сопоставим с варфарином по влиянию на риск инсульта и системных эмболий, а также по частоте крупных кровотечений. Исследование AVERROES, проводимое у больных с неклапанной ФП и факторами риска ТЭ осложнений в сочетании с противопоказаниями к АВК или нежеланием принимать данную группу препаратов, было прекращено досрочно из-за абсолютных преимуществ апиксабана в дозе 5 мг 2 р/сут по сравнению с ацетилсалициловой кислотой в дозе 81 -324 мг/сут в профилактике ИИ и СЭ. Результаты исследований с новыми пероральными антикоагулянтами еще будут обсуждаться, но они являются серьезной заявкой на использование их с целью профилактики ИИ.
Правила назначения антитромботической терапии
Терапию АВК рекомендуется начинать с поддерживающих доз (для Варфарина 2.5-5 мг). Более низкие дозы показаны больным старше 60 лет, уроженцам Азии (особенно китайцам), пациентам с нарушением функции почек, печени, с артериальной гипертонией.
Перед назначением препарата необходимо оценить противопоказания, факторы, влияющие на эффект препарата (лекарственные препараты, продукты питания), и предполагаемую продолжительность лечения.
Перед приемом препарата необходимо оценить общий анализ крови с тромбоцитами, протромбиновое время, активированное парциальное тромбопластиновое время, общий анализ мочи, определить уровень билирубина, креатинина, активность трансаминаз, гамма ГТП. Эти исследования необходимы для выявления противопоказаний или факторов риска кровотечений (тромбоцитопения, анемия, почечная и печеночная недостаточность).
Препарат принимается 1 раз в день в фиксированное время после еды (для Варфарина - прием в 17-19 часов).
Контроль MHO проводится через 8-10 часов, то есть в 9-11 часов.
На протяжении 1 -й недели MHO определяют ежедневно, затем 1 раз в неделю, после достижения стабильного желаемого уровня MHO определяют 1 раз в 4 недели.
В основе антитромботической терапии у больных с ФП лежит оценка риска ишемического инсульта (ИИ) и системных эмболий (СЭ). Данные о частоте ТЭ у пациентов, вошедших в группы контроля исследований, посвященных изучению эффективности антитромботической терапии у больных ФП, послужили основой для выявления у них ФР ишемического инсульта.
На основе ФР создана удобная шкала, позволяющая врачу оценить риск ИИ у каждого пациента с ФП. Шкала получила название CHADS2 (см. гл. 5). Для большинства больных с ФП препаратами выбора для профилактики инсульта являются АВК. Антитромботическая терапия для профилактики инсульта рекомендована всем больным с ФП за исключением лиц, имеющих абсолютные противопоказания.
Таблица
5
Профилактика тромбоэмболических
осложнений у больных с фибрилляцией
предсердий
Категория
риска
Баллы
CHA2DS2-VASC
Терапия
1
«основной» фактор риска или > 2
клинически значимых неосновных
факторов риска
>
2
Оральные
антикоагулянты
1
клинически значимый неосновной
фактор риска
1
Оральные
антикоагулянты (предпочтительно) или
аспирин 75-325 мг в сут
Нет
факторов риска
0
Аспирин
75-325 мг в сут или отсутствие
антитромботической терапии
(предпочтительно)
Из
Рекомендаций Европейского общества
кардиологов по диагностике и лечению
фибрилляции предсердий (2010г.).
Выбор антитромботического препарата для профилактики ИИ у больных с ФП осуществляется на основе оценки риска инсульта и геморрагических осложнений. У больных с ФП, имеющих высокий риск инсульта, определяющийся наличием хотя бы 1 ФР высокой значимости рекомендована неопределённо долгая терапия АВК со значениями MHO в диапазоне 2,0 - 3,0. Аспирин в суточной дозе 75-325 мг рекомендован больным с ФП и не имеющим ФР ишемического инсульта, но менее эффективна у больных старше 75 лет. При наличии механических протезов клапанов сердца и ФП целевое значение MHO зависит от вида протеза, его позиции и наличия, дополнительных ФР тромбоэмболиче- ских осложнений, но не может быть меньше 2,5. У больных с ТП анти- тромботическая терапия с целью профилактики ИИ проводится аналогично. При выборе препарата учитываются риск кровотечений, возможность достижения устойчивой и безопасной антикоагуляции. Однако, по некоторым данным АВК эффективнее аспирина. Выбор антитромботического препарата у больных с пароксизмальной и персистирующей формами ФП осуществляется аналогично больным, имеющим постоянную форму. Потребность в антитромботической терапии должна регулярно пересматриваться, особенно, в связи с возникающими у больного новыми показаниями и противопоказаниями. У больных пожилого возраста с риском геморрагических осложнений и наличием показаний к АВК с целью первичной профилактики инсульта и системных ТЭ, целевые значения MHO, по мнению экспертов, могут быть снижены до 2,0 (диапазон 1,6-2,5).
В исследовании ACTIVE лечение варфарином превосходило комбинацию клопидогрела и аспирина по способности уменьшить риск развития инсульта. При этом частота крупных кровотечений в обеих группах была сопоставима. Но комбинация двух антиагрегантов (клопидогрела и аспирина) оказалась эффективнее монотерапии ацетилсалициловой кислотой.
Таблица 6
Клинические характеристики шкалы оценки риска кровотечений has-bled
Буква
Клиническая
характеристика
Баллы
H
^pertension
(Артериальная
гипертензия; систолическое АД > 160
мм рт ст)
1
A
Abnormal
renal
and
liver
function
(нарушение
функции почек - хронический диализ,
трансплантация почки, креатинин >
200 ммоль/л; или печени - цирроз, билирубин
> 2 р выше нормы, Алт, Аст > чем в 3
раза) по 1 баллу
1
или 2
S
Stroke
(Инсульт)
1
B
Bleeding
(Кровотечение;
в анамнезе или предрасположенность
-геморрагический диатез, анемия)
1
L
Labile
INRs
(Лабильное
МНО; нестабильное в целевом диапазоне
< 60% времени)
1
E
Elderle
(Пожилой
возраст)
1
D
Drugs
or
alcohol
(лекарства;
сопутствующий прием нестероидных
противовоспалительных или
антитромбоцитар- ных препаратов;
злоупотребление алкоголем) по 1 баллу
1
или 2
Максимум
9
,баллов
Из
Рекомендаций Европейского общества
кардиологов по диагностике и лечению
фибрилляции предсердий (2010г.).
Антикоагулянтная терапия в особых ситуациях
У больных ФП, получающих АВК перед операциями, следует на время прервать лечение. Плановые операции проводят при МНО<1,5 или в пределах нормального диапазона. У каждого больного следует сопоставить риск кровотечения во время хирургического вмешательства с риском инсульта, который может возникнуть при отмене АВК. Если больной получает варфарин, период полувыведения которого 36-42 часа, то его следует отменить примерно за 5 сут до операции, чтобы обеспечить снижение МНО. Хирургические процедуры с риском кровотечения выполняются на фоне субтерапевтической антикоагуляции продолжительностью до 48 часов, без перехода на гепарин, если риск ТЭ в этот период низкий. Затем в день операции при условии адекватного гемостаза лечение АВК следует возобновить в «обычной» для больного поддерживающей дозе без использования нагрузочной дозы. Отмена АВК перед операцией у пациентов с механическими протезами клапанов сердца или у пациентов ФП и высоким риском ТЭ осложнений может иметь негативные последствия. В подобных случаях период временного перерыва использования АВК необходимо перевести больного на низкомолекулярный или нефракционированный гепарин в дозах, используемых при лечении венозного тромбоза («терапия моста»).
У больных с ФП, получающих АВК и имеющих проявления заболеваний, связанных с атеросклерозом коронарных или периферических артерий дополнительно назначают антитромбоцитарные препараты, чаще аспирин. Эта комбинация не снижает риска инсульта или других сосудистых событий, включая ОИМ, но существенно увеличивает частоту кровотечения. В современных руководствах после стентирования коронарных артерий и острых коронарных синдромов (ОКС) рекомендуется применять комбинацию аспирина с клопидогрелом (в течение 4 недель после установки голометаллического стента и 6-12 месяцев после имплантации стента, выделяющего антипролиферативные лекарства - стенты «с покрытием»). Если таким больным с ФП не назначить АВК, то это приведет к увеличению основных сердечно-сосудистых событий и смертности. При этом частота кровотечений у данной категории больных с ОКС, получающих и неполучающих АВК достоверно не различается. Больным со стабильным течением сосудистых заболеваний без ОКС и чрескожных вмешательств показана монотерапия АВК, одновременно аспирин назначать не нужно. Опубликованные данные свидетельствуют, что АВК также эффективны как и аспирин. В рекомендациях Европейского кардиологического общества по тромбозу у больных с ФП рекомендовано избегать имплантации покрытых стентов, проводить тройную антитромботическую терапию (АВК + аспирин + кло- пидогрел) в течение короткого срока после стентирования, а затем продолжать лечение АВК в сочетании с одним антитромбоцитарным препаратом (клопидогрелом или аспирином). Стенты, выделяющие лекарственные вещества, следует применять только в случаях, где их преимущество очевидно перед голометаллическими стентами. Тройную терапию применяю минимум 4 недели после имплантации голометаллического стента, >3 мес. после стента, выделяющего сиролимус, эверолимус, такролимус и >6 мес. после установки стента, выделяющего паклитаксел. В последующем до 12 мес. АВК в сочетании с клопидогрелом 75 мг/сут или аспирином 75-100мг/сут с ингибитором протонного насоса в зависимости от риска кровотечений и ТЭ осложнений. Если у пациента имеется средний и высокий риск ТЭ и получающих АВК, не следует прерывать антикоагулянтную терапию, сохраняя ее в терапевтическом диапазоне МНО 2,0-3,0. С целью уменьшения риска кровотечений использовать радиальный доступ. У пациентов с ОИМ без стойкого подъема сегмента ST на ЭКГ рекомендована двойная терапия аспирина и клопидогрела, а больным с ФП, имеющим средний и высокий риск инсульта следует назначить еще и АВК. Эксперты рекомендуют тройную терапию на 3-6 мес, затем 12 мес. АВК+аспирин 75-100мг/сут или монотерапия АВК с целевым МНО 2,5-3,5.
Антикоагуляция в острую фазу ишемического инсульта может привести к развитию внутричерепного кровотечения или геморрагической трансформации инфаркта мозга. У пациентов с ФП и острым ишемическим инсультом необходимо обеспечить адекватный контроль артериальной гипертонии и провести компьютерную или магнитно-резонансную томографию головного мозга для исключения внутричерепного кровоизлияния. При отсутствии кровоизлияния антикоагуляцию начиают через 2 недели. У пациентов с ТИА и ФП антикоагулянтную терапию следует назначать как можно раньше при условии исключения кровоизлияния.
Рекомендуемые стратегии лечения
Рисунок 10. Тактика ведения пациентов с фибрилляцией предсердий
На первом этапе пациентам с ФП следует всегда назначать антитромботические препараты и средства, урежающие сердечный ритм. Если цель лечения - восстановление и удержание синусового ритма, то продолжать урежающую терапию, за исключением постоянного сохранения синусового ритма. Если ФП сохраняется длительное время, то восстановление синусового ритма может оказаться затруднительным. При наличии ФП не всегда легко выяснить, когда она появилась, особенно если симптомы аритмии отсутствуют. Если эпизоды ФП проходят самостоятельно, то применение антиаритмических препаратов для их профилактики обычно не требуется за исключением тех случаев, когда ФП сопровождается выраженными симптомами, такими как гипотония, ишемия миокарда или ХСН. Результаты исследования AFFIRM показали, что при наличии ФР инсульта антикоагулянтная терапия приносит пользу даже в случае восстановления синусового ритма. Таким образом, развитие ФП у больных с ФР тромбоэмболических осложнений является основанием для неотложного назначения длительной антикоагулянтной терапии, если у пациентов отсутствуют обратимые причины аритмии, такие как гипертиреоз. Если ФП персистирует, то можно смириться с ее переходом в постоянную форму. В таких случаях необходимы антитромботическая терапия и контроль частоты желудочкового ритма. Хотя может показаться целесообразной (по крайней мере, однократно) попытка восстановить синусовый ритм. Исследование AFFIRM продемонстрировало отсутствие разницы выживаемости или качества жизни при сравнении стратегий контроля ритма и ЧСС. В других исследованиях, в которых изучался этот вопрос, были получены сходные данные. Следовательно, решение о попытке восстановления синусового ритма следует принимать с учетом тяжести симптомов аритмии и потенциального риска антиаритмической терапии. Если решено восстановить и удерживать синусовый ритм, то перед кардиоверсией следует назначить антикоагулянты и добиться контроля ЧСС. Хотя длительная антиаритмическая терапия может не потребоваться для профилактики рецидивов ФП после кардиоверсии, непродолжительное применение антиаритмических средств может быть полезным. У больных с ФП, сохраняющейся более 3 месяцев после кардио версии часто развиваются ранние рецидивы аритмии. В таких случаях может быть начата антиаритмическая терапия с адекватной антикоагуляцией до кардиоверсии с целью снижения вероятности рецидива.
Таблица
7
Рекомендации
Класс
Уровень
У
пожилых больных с маловыраженными
симптомами
I
A
лечение
следует начинать с контроля ЧСС
(EHRA=1)
На
фоне вмешательств для удержания
синусового рит
I
A
ма
следует продолжать прием средств,
урежающих ЧСС, чтобы обеспечить
адекватный контроль частоты
желудочкового
ритма при рецидивах ФП
Контроль
ритма рекомендуется, если симптомы
ФП
I
B
(EHRA>2)
сохраняются,
несмотря на адекватый кон
троль
ЧСС
Если
ФП сопровождается сердечной
недостаточностью,
IIa
B
рекомендуется
контроль ритма для купирования сим
птомов
У
молодых пациентов, у которых не
исключена воз
IIa
C
можность
катетерной аблации, рекомендуется
начинать
лечение
с контроля ритма
Контроль
ритма рекомендуется больным с
вторичной ФП, субстрат которой был
устранен (ишемия, гипоти-
IIa
C
реоз
и др.)
Рекомендации по контролю чсс и ритма при фибрилляции предсердий
Контроль частоты ритма - обоснованная стратегия ведения пожилых больных в отсутствие тяжелых симптомов ФП (индекс EHRA=1). Контроль ритма купирует симптомы, но не является основанием для прекращения лечения основного заболевания сердца и отказа от антитромботической терапии. Менее строгий контроль ЧСС <110 в мин обоснован у пациентов в отсутствие выраженных симптомов, связанных с высокой ЧСС.
Достоинства контроля частоты желудочкового ритма:
возможность улучшения симптоматики;
безопасность и хорошая переносимость препаратов (БАБ, СГ).
Недостатки контроля частоты желудочкового ритма:
неполное устранение симптомов;
необходимость постоянной антикоагулянтной терапии;
развитие дисфункции ЛЖ при неадекватном контроле ЧСС;
тахи-бради форма МА.
Начальная стратегия лечения может отличаться от отдаленной цели ведения пациента. Существуют исследования, оценивающие выживаемость больных после восстановления синусового ритма, вынужденных принимать ААП, и пациентов с постоянной формой МА, которым адекватно контролируют ЧСС и осуществляют профилактику ТЭ варфарином. Согласно данным этих исследований, отсутствуют достоверные различия в выживаемости этих категорий больных. В связи с этим рекомендуется более взвешенно подходить к проблеме восстановления синусового ритма при персистирующей МА.
Нерегулярный ритм и высокая ЧСС у больных с ФП могут вызвать сердцебиения, одышку, утомляемость. Адекватный контроль частоты желудочкового ритма позволяет уменьшить симптомы и улучшить гемодинамику за счет увеличения времени наполнения желудочков и профилактики тахиаритмической кардиомиопатии. Оптимальный уровень контроля частоты желудочкового ритма не установлен. В исследовании RACE II жесткий контроль частоты желудочкового ритма не имел преимуществ перед менее строгим контролем ЧСС. Критерием менее строгого контроля была ЧСС в покое <110 в минуту, а более жесткого контроля ЧСС в покое <80 в минуту.
8 Таблица 8 Средства для контроля частоты сердечных сокращений
Препарат |
Внутривенно |
Пероральная доза |
Бета-блокаторы |
||
Метопролол XL |
2,5-5 мг |
100-200мг 1р/день |
Бисопролол |
- |
2,5-10 мг 1р/день |
Атенолол |
- |
25-100 мг 1р/день |
Эсмолол |
10 мг |
- |
Пропранолол |
1 мг |
10-40 мг 3 раза в день |
Карведилол |
- |
3-25 мг 2 раза в день |
Недигидропиридиновые антагонисты кальция |
||
Верапамил |
5 мг |
40 мг 2 раза в день/360 мг 1р/день |
Дилтиазем |
- |
60 мг 3 раза в день360 мг 1р/день |
Сердечные гликозиды |
||
Дигоксин |
0,5-1 мг |
0,125 - 0,5 мг 1 р/день |
Другие |
||
Амиодарон |
5 мг/кг в течение часа, поддерживающая 50 мг/ч |
100-200 мг 1 р/день |
Дронедарон (только у пациентов с непостоянной формой) |
|
400 мг 2 р/день |
Из Рекомендаций Европейского общества кардиологов по диагностике и лечению фибрилляции предсердий (2010г.).
Для урежения желудочкового ритма применяют БАБ, недигидро- пиридиновые антагонисты кальция и сердечные гликозиды. Применение БАБ оправдано при повышенном тонусе адренергической системы и ишемии миокарда. Эффективность и безопасность установлены в сравнительных исследованиях с плацебо и дигоксином. Верапамил и дилтиазем оказывают отрицательное инотропное действие, их не следует назначать больным с систолической дисфункцией ЛЖ. Дигоксин контролирует ЧСС в покое, но не при физической нагрузке. Комбинация БАБ и дигоксина может быть эффективна у больных с сердечной недостаточностью. Дронедарон эффективен при длительном лечении и существенно снижает ЧСС в покое и при физической нагрузке, он успешно снижает ЧСС при рецидивах ФП, но пока не зарегистрирован для лечения постоянной ФП. При неэффективности можно применять амиодарон, который можно применять длительно при неэффективности других лекарственных средств, хотя может вызвать дисфункцию щитоидной железы и брадикардию. ААП I класса не применимы для контроля ЧСС.

Рисунок
11.
Оптимальный
контроль частоты сердечных сокращений
Выбор средств, урежающих ритм зависит от возраста, заболевания сердца и цели терапии. На начальном этапе следует снизить ЧСС в покое 110 в мин., при сохранении симптомов увеличить дозы средств, урежающих ритм или применить комбинированную терапию. При сохранении симптомов обеспечить более жесткий контроль ЧСС и провести суточное мониторирование ЭКГ, чтобы оценить наличие пауз и брадикардии.
Фармакологическая кардиоверсия
Во многих случаях синусовый ритм восстанавливается спонтанно в течение первых несколько часов. В клинических исследованиях 38% больных восстанавливают ритм через 12 часов после введения плацебо при ФП, длящейся менее 7 дней. При МА, длящейся более 7 дней, плацебо восстанавливает ритм только в 3-4%.
При наличии нарушений гемодинамики, сохранении симптомов, несмотря на контроль ЧСС проводится кардиоверсия. Фармакологическую кардиоверсию проще выполнить, чем электрическую, однако она менее эффективна, кроме того, имеется опасность токсических побочных эффектов ААП. Большинство больных, которым проводится медикаментозная кардиоверсия, нуждаются в непрерывном наблюдении и монито рировании во время введения препарата и после его завершения (обычно в течение периода полувыведения), чтобы обеспечить своевременно выявление проаритмического действия. Существенно повышают риск аритмогенного действия ГЛЖ, ИБС, ПИКС, ХСН (особенно при сниженной фракции выброса). Прокаинамид, пропафенон, флекаинид (не зарегистрирован в России), ибутилид (не зарегистрирован в России) не должны применяться как средства фармакологической кардиоверсии у больных с органическими заболеваниями сердца. Этацизин, аллапинин также должны быть исключены, как средства для профилактики рецидивов после восстановления ритма. Медикаментозная кардиоверсия как способ самопомощи по принципу «таблетка в кармане» возможна у отдельных амбулаторных больных, если безопасность подобного способа была установлена ранее в условиях стационара.
Фармакологическая кардиоверсия наиболее эффективна, если выполняется впервые 7 дней. Эффективность использования большинства препаратов доказана у больных с ФП не более 48 часов. Исключение составляет Нибентан, способный восстанавливать синусовый ритм у больных с персистирующей ФП продолжительностью более 1 года и может применяться у больных с органическим заболеванием сердца и ФВ>40%. Безопасность купирования недавно возникшей ФП на фоне приема антиаритмических препаратов не изучена и, по мнению экспертов, в этом случае должна применяться стратегия контроля ритма.
Повышенный риск ТЭ после кардиоверсии хорошо известен, в связи с этим обязательной считают антикоагуляцию перед электрической или медикаментозной кардиоверсией ФП > 48 часов. На основании исследований рекомендованы антагонисты витамина К (АВК) (МНО 2,03,0) за 3 недели до кардиоверсии. Обязательная антикоагуляция может быть сокращена, если при ЧПЭХО-КС не будет выявлен тромб в ЛП или ушке ЛП. Это может стать альтернативой при неотложной кардиоверсии. При наличии тромба следует проводить лечение АВК (МНО 2,0-3,0) и повторить ЧПЭХО-КС, при его растворении может быть проведена кардиоверсия. Если тромб сохраняется, можно отказаться в пользу контроля частоты ритма.
Терапию АВК следует продолжать в течение 4 недель после восстановления ритма, при наличии факторов риска инсультов или рецидива ФП лечение АВК проводят пожизненно даже при сохранении синусового ритма. Если ФП < 48 часов, то кардиоверсию можно выполнить в неотложном порядке под прикрытием гепарина в/в в дозе 12-18 ЕД/кг/ час после болюса 4000 ЕД в/в под контролем АЧТВ (которое должно быть удлинено в 1,5-2,5 раза от исходного). При наличии факторов риска АВК назначают после кардиоверсии, а лечение гепарином продолжают до достижения МНО 2,0-3,0. При отсутствии факторов риска назначать АВК не следует.
Эксперты АКК/ААС/ЕКО рекомендуют при МА, длящейся менее 7 дней, применять следующие препараты (по мере убывания эффективности):
Пропафенон внутрь или в/в (1А класс рекомендаций);
Амиодарон внутрь или в/в (11а, А класс рекомендаций);
Хинидин внутрь (11а, В класс рекомендаций).
ААП, эффективность которых не доказана или недостаточно изучена:
Прокаинамид в/в (IIb, С класс рекомендаций);
Дигоксин внутрь или в/в (III А класс рекомендаций);
Соталол внутрь или в/в (IIIA класс рекомендаций).
При МА, длящейся более 7 дней, эксперты ААС/АКК/ЕКО рекомендуют (по мере убывания эффективности):
Амиодарон внутрь или в/в (II а, А класс);
Пропафенон внутрь или в/в (II b, В класс);
Хинидин внутрь (II b, В класс).
ААП, эффективность которых не доказана или недостаточно изучена:
Прокаинамид в/в (IIb, С класс рекомендаций);
Соталол внутрь или в/в (III А класс рекомендаций);
Дигоксин внутрь или в/в (III С класс рекомендаций). Пропафенон. При приеме внутрь однократно, восстановление ритма в 40-80% случаев. Более эффективен при ФП и несколько менее при ТП. Эффект наступает между 2 и 6 часами после приема внутрь, при в/в введении быстрее (в/форма не зарегистрирована России). Тяжелые побочные эффекты встречаются нечасто, однако, может вызвать брадикардию в момент восстановления синусового ритма. Пероральное применение пропафенона применимо у амбулаторных больных с нечастыми рецидивами от 1 раза в мес. до 1 раза в год, сопровождающимися выраженными симптомами.
Амиодарон восстанавливает синусовый ритм более чем через 12 часов почти у 80% больных. Препарат может назначаться в/в, внутрь и двумя путями одновременно. Препарат действует медленнее, чем другие препараты. Одинаково эффективен при ФП и ТП. Вне стационара - прием внутрь 600-800 мг/сут до общей дозы 10г за несколько дней, затем по 200-400 мг/сут. В стационаре возможен прием per os 30 мг/кг однократно (постепенный прием таблеток), восстановление ритма через 8 часов после приема последней таблетки у 87% больных. Или (в стационаре) - 1,2-1,8 г в день в несколько приемов внутрь до общей дозы 10 г за несколько дней, затем по 200-400 мг/сут. При в/в введении амиодарон вводят в дозе 5-7 мг/кг за 30-60 мин, затем по 1,2-1,8 г в день в виде непрерывной инфузии в/в или в несколько приемов внутрь по 1,2-1,8г/сут до общей дозы 10 г за несколько дней, затем внутрь по 200-400 мг/сут.
Прокаинамид (новокаинамид) — используется для восстановления ритма у больных с эпизодом ФП длительностью не более 24 часов. В Европейских рекомендациях впервые в 2010году исключен из числа ААП, рекомендованных для восстановления ритма. Но, благодаря невысокой стоимости, до сих пор распространен в России. Крупных многоцентровых исследований с новокаинамидом не проводилось, эффективность 40-50% в перые 8-12 часов. Прокаинамид, по-видимому, менее эффективен чем другие ААП и его эффективность при персисти- рующем варианте МА изучена недостаточно. Гипотония - главный побочный эффект. В связи с этим препарат вводят очень медленно внутривенно 20-30 мг/мин до общей дозы 1000 мг. Если ЧСС при ФП более 120 в мин, то предварительно вводят препараты, уменьшающие ЧСС (обзидан 0,1 мг/кг со скоростью 1 мг/мин или дигоксин).
Нибентан - первый отечественный ААП III класса. Эффективность его применения для восстановления синусового ритма изучалась в небольших немногочисленных исследованиях без сравнения с плацебо. Однако в этих исследованиях участвовали пациенты с персистирующей ФП более года, у которых медикаментозная кардиоверсия другими ААП не давала эффекта и только ЭКВ нормализовала сердечный ритм (т.е в тех случаях, когда вероятность плацебо-эффекта была равна нулю). По данным одной из работ, эффективность нибентана была 77%. Отсутствуют данные о применении у больных с органическими поражением сердца и при сердечной недостаточности (в одной работе использовались менее высокие дозы). Риск аритмогенного действия, в виде тахикардии типа «torsade de point» носит дозозависимый характер, что подчеркивает соблюдение дробного введения, начиная с минимальной дозы и наблюдение в течение 24 часов после введения.
Электрическая кардиоверсия
Наиболее успешна электрической кардиоверсии (ЭКВ) при продолжительности эпизода МА менее 1 года, молодом возрасте пациента, при ТП. При длительности ФП более 48 часов обязательно антикоагуляционная подготовка (как при медикаментозной кардиоверсии) в течение 3-х недель перед восстановлением ритма, а также рекомендовано проведение ЧПЭХО-КГ для исключение внутрипредсердного тромбоза.
Факторами риска неудачной ЭКВ являются дилатация ЛП, органическое заболевание сердца и кардиомегалия. Эксперты ACC/AHA/ESC при проведении ЭКВ рекомендуют переднезаднее расположение электродов, что более эффективно (87% против 76%) и требует разряда меньшей мощности. ЭКВ выполняется под общим наркозом, для которого лучше использовать препараты для кратковременного наркоза или седативные средства. Электрический разряд синхронизируют с зубцом "R" на ЭКГ. Начальный разряд для лечения ТП составляет 50 Дж. При ФП требуется более мощный начальный разряд - 200 Дж. Мощность последующих разрядов повышают на 100 Дж до тех пор, пока не достигнут максималь-ной мощности в 400 Дж. Чтобы свести к минимуму повреждение миокарда, интервал между последовательными разрядами должен быть не менее 1 мин.
ЭКВ у пациентов с электрокардиостимуляторами: электрод должен находиться на расстоянии 8 см от батарейки водителя ритма, рекомендовано накладывать электроды в передне-боковом положении, предпочтительнее использование двухфазного дефибриллятора, т.к. для купирования ФП в данной ситуации требуется разряд с меньшей энергией. Можно ожидать увеличение порога стимуляции, такие пациенты должны находиться под наблюдением после кардиоверсии.
Начиная медикаментозную терапию до ЭКВ, можно повысить вероятность немедленного успеха и подавить ранние рецидивы ФП. Предварительная фармакотерапия наиболее обоснована у больных с неудачной первоначальной попыткой ЭКВ, а также у тех, кому первоначальную ЭКВ проводили в связи с персистирующим ФП.
Предварительную медикаментозную терапию можно начинать вне стационара (амиодарон, соталол, БАБ) и в стационаре (прокаинамид, пропафенон). Опасности предварительной медикаментозной терапии включают возможность парадоксального повышения порога дефибрилляции (флекаинид) и ускорение желудочкового ритма в начале терапии ААП IA или 1С подклассов. В случае восстановления ритма после ЭКВ больные, получающие ААП, которые удлиняют интервал Q-T (амиодарон, соталол), должны оставаться под наблюдением в стационаре не менее 1 -2 суток, чтобы можно было оценить эффекты замедления ритма сердца и своевременно вмешаться, если разовьется ЖТ типа "пируэт". Пропафенон, назначаемый за 2 дня до ЭКВ, подавляет немедленные рецидивы МА (в течение первых 10 мин). Пропафенон в комбинации с верапамилом (3 дня до и 3 дня после ЭКВ) предупреждает возникновение немедленных и подострых рецидивов. Амиодарон и соталол, снижают риск немедленных и ранних рецидивов. Для профилактики поздних рецидивов наиболее действенным средством является амиодарон (69% больных сохраняют синусовый ритм в течение года применения амиодарона). Аллапинин и этацизин исследовались в немногочисленных небольших, открытых исследованиях. Пациенты, у которых эпизоды ФП протекают с выраженной клинической симптоматикой, но редко (1-2 раза в год), предпочитают электрическую кардиоверсию постоянному приему ААП или лечению, направленному на урежение ЧСС в условиях сохраняющейся аритмии.
Противопоказания для восстановления синусового ритма
Абсолютные противопоказания
Наличие неорганизованного внутрисердечного тромба;
Дефибрилляция противопоказана пациентам с интоксикацией сердечными гликозидами (IIIC);
Относительные противопоказания
Пороки сердца, подлежащие хирургической коррекции;
Малый (менее 6 месяцев) срок с момента проведения хирургической коррекции пороков сердца;
Активность ревматического процесса II-III степени (неустраненная);
Тиреотоксикоз (неустраненный);
Наличие внутрисердечного тромба у больного с ТЭ в анамнезе;
Возраст > 65 лет у больных с пороками сердца и >75 лет у больных ИБС;
Недостаточность кровообращения III ст;
Кардиомегалия. Значительное расширение ЛП у больных митральным пороком сердца, ДКМП, аневризмой ЛЖ и другими заболеваниями, осложнившимися недостаточностью кровообращения;
Давность эпизода МА более 3 лет, за исключением МА на фоне тиреотоксикоза, когда давность аритмии не уменьшает эффективности ААТ.
Частые (1 раз в месяц и чаще) приступы МА перед ее настоящим эпизодом, требовавшие введения ААП или ЭИТ. В этой ситуации восстановление синусового ритма не решает вопрос дальнейшей тактики лечения больного.
Изолированная хроническая идиопатическая ФП у лиц, не имеющих расширения ЛП или признаков заболевание сердца. Волны f при этом едва различимы, сохранить синусовый ритм крайне трудно.
Предшествующий появлению данного эпизода МА, СССУ (с выраженными клиническими проявлениями).
Брадикардитическая ФП с редкими желудочковыми ответами, в особенности у пожилых больных, не принимавших дигиталиса, верапамила, бета-адреноблокаторов. У многих из них после восстановления синусового ритма появляется выраженная СБ как проявление СССУ.
Осложнения при электрической кардиоверсии
Тромбоэмболии (ТЭ) наблюдаются у 1-7% больных, которые до ЭКВ не получали профилактической антитромботической терапии и МА, продолжающейся более 48 часов. Риск ТЭ сохраняется в течение 1 месяца после кардиоверсии.
Опасные НРС (ЖТ, ФЖ) могут провоцироваться у больных с гипокалиемией или дигиталисной интоксикацией. Для безопасной и эффективной ЭКВ требуется нормальный уровень калия. При клинических и ЭКГ признаках передозировки гликозидов необходимо отложить ЭКВ до исчезновения признаков дигиталисной интоксикации не менее чем на 24 часа. При отсутствии признаков передозировки гликозидов нет необходимости отменять дигоксин перед плановой кардиоверсией. Если у больного до ЭКВ зарегистрирован медленный желудочковый ритм (в отсутствии лекарственных препаратов) необходимо профилактическое введение трансвенозного или чрескожного электрода для временной ЭКС.
3. Возможно возникновение преходящей элевации сегмента ST, а также острой левожелудочковой недостаточности, гипотонии.
Рецидивы после ЭКВ возникают в 3 фазы:
Немедленный рецидив, развивающийся в течение первых несколько минут после дефибрилляции;
Ранний рецидив, возникающий в первые 5 дней после кардиоверсии;
Поздний рецидив, развивающийся более чем через 5 дней. Факторы, предрасполагающиеся к рецидиву включают: возраст, длительность пароксизма, число предыдущих рецидивов, увеличение размера ЛП, наличие ИБС, заболеваний легких и др. Пациенты с редкими приступами (1-2 раза в год), сопровождающимися выраженными симптомами, предпочитают повторную кардиоверсию длительной ААТ.
Профилактика рецидивов мерцательной аритмии
Таким образом, пароксизмальная или персистирующая МА является хроническим заболеванием, и у большинства больных рано или поздно возникает рецидив. По этой причине большинство больных нуждаются в профилактическом назначении ААП для поддержания синусового ритма. Однако, пока не известно, предотвращает ли поддерживающая терапия ТЭ и смерть. Поскольку клинические факторы, которые предрасполагают больного к рецидивам МА (пожилой возраст, ХСН, АГ, дилатация ЛП и дисфункция ЛЖ), являются также факторами риска для ТЭ, устранение МА может не снижать риск ТЭ. Удержание синусового ритма с помощью ААП может снижать частоту развития ХСН, однако в одном исследовании показано, что повторные кардиоверсии при персистируюшем течении МА не предотвращают осложнений. В связи с этим считают, что ААП для поддержания синусового ритма показаны больным, у которых симптомы связаны с паро- ксизмальным течением МА или рецидивом после ЭКВ и которые могут переносить ААП.
Достоинства контроля синусового ритма:
улучшение или полное устранение симптоматики;
улучшение гемодинамики;
снижение риска тромбоэмболических осложнений;
возможность отмены непрямых антикоагулянтов.
Недостатки контроля синусового ритма:
сердечные и внесердечные побочные эффекты ААП;проаритмические эффекты ААП
- высокая частота рецидивов;
нет преимуществ в выживаемости в сравнении с контролем ЧСС
ОБЩИЙ ПОДХОД К АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ
Выбор подходящего ААП должен основываться в первую очередь на его безопасности при заболевании сердца, а также на числе и течении прежних эпизодов МА. 25 % больных удерживают синусовый ритм при применении плацебо. I класс препаратов эффективен у 50-60% больных. Амиодарон — у 85%. При подборе антиаритмической терапии новый ААП назначается не ранее, чем через 5 периодов полувыведения (1/2 Т) предыдущего ААП.
Органическое
заболевание сердца отсутствует или
минимально выражено
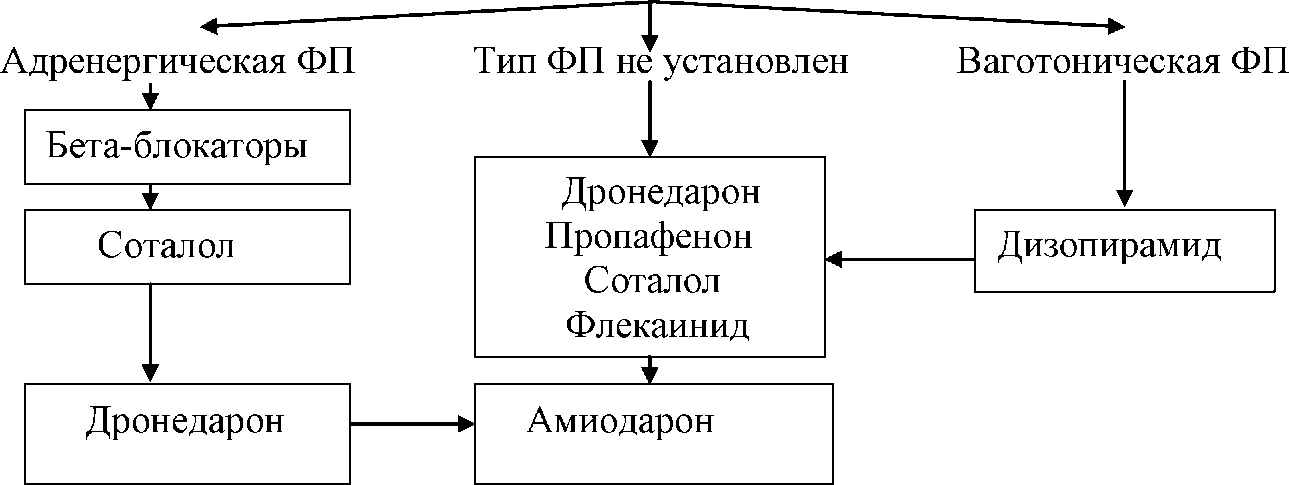
Рисунок 12 Выбор антиаритмического препарата у больных без серьезных органических заболеваний сердца
Алгоритм лечения больных с рецидивирующей МА:
При впервые возникшей МА после восстановления ритма не надо назначать ААП и антикоагулянты, возможны только бета- адреноблокаторы (метопролол, бисопролол, бетаксолол).
При рецидивирующих эпизодах МА (не леченных ранее ААП) при бессимптомных приступах или при редких симптомных приступах (не чаще 1 раза в 3 месяца) также назначают только бета- адреноблокаторы, антикоагулянты не назначают.
При частых приступах (чаще 1 раза в 3 месяца) назначают для профилактики приступов ААП, а для профилактики ТЭ - антикоагулянты.
При рецидивирующих эпизодах МА на фоне лечения ААП при бессимптомных приступах - подбор ААП, антикоагулянты для постоянного приема, возможно хирургическое лечение.
При симптомных редких приступах (не чаще 1 раза в месяц) - подбор ААП, антикоагулянты для постоянного приема, желательно- хирургическое лечение.
При симптомных частых приступах (чаще 1 раза в месяц), прежде всего, необходимо решить вопрос о хирургическом лечении; на втором плане — подбор ААП, антикоагулянты для постоянного приема.
Выбор препаратов для профилактики МА:
нечастые и хорошо переносимые пароксизмы: наблюдение
с симптомами, требующими лечения:
- поражение сердца отсутствует или минимальное — ПРОПАФЕНОН, ФЛЕКАИНИД, БАБ (СОТАЛОЛ, МЕТОПРОЛОЛ), при неэффективности - АМИОДАРОН, при неэффективности—комбинация ААП, аблация, альтернативные препараты, ЭКС и т. д.
- значимое заболевание сердца - БЕТА-АДРЕНОБЛОКАТОРЫ, при неэффективности—АМИОДАРОН,
при неэффективности комбинация АМИОДАРОН+ББ, аблация, альтернативные препараты, ЭКС и т. д.
Амиодарон является одним из наиболее эффективных ААП для профилактики пароксизмов МА, насыщение АМИОДАРОНОМ:
этап - 14-20 дней по 200 мг 3 раза в день (600 мг/сут),
этап - 15-30 дней по 200 мг 2 раза в день (400 мг в сутки),
— поддерживающая доза — 200 мг/сут для постоянного приема. Возможно проводить насыщение кордароном быстрее: 1000 мг/сут
7 дней, далее - поддерживающая доза. При достижении насыщения амиодароном интервал Q-T удлиняется на 10-15% от исходного, что является предиктором антиаритмического эффекта препарата. Комбинированная ААТ
Амиодарон +ББ - потенцирование эффектов почти в 2 раза.
Амиодарон+Пропафенон (III+IC)
ББ+Пропафенон (1I+IC)
Амиодарон+Пропафенон+ББ
При комбинированной терапии ААП применяют в 1/2 терапевтической дозы. БАБ уменьшают безопасность препаратов IС класса.
Таблица 9
Средства для контроля часты сердечных сокращений
Препарат |
Внутривенно |
Поддерживающая пероральная доза |
Метопролол XL |
2,5-5мг |
100-200мг 1 раз в день |
Бисопролол |
- |
2,5-10мг 1 раз в день |
Атенолол |
- |
25-100мг 1 раз в день |
Карведилол |
- |
25мг 1 раз в день |
Пропранолол |
1мг |
10-40мг 3 раз в день |
Верапамил |
5мг |
40мг два раза в день/360мг 1 раз в день |
Дилтиазем |
- |
60мг три раза в день/360 мг 1 раз в день |
Дигоксин |
0,5-1мг |
0,125-0,5мг 1 раз в день |
Амиодарон |
5мг/кг в течение часа, поддерживающая 50мг/ч |
100-200мг 1 раз в день |
Постоянная мерцательная аритмия. Контроль за сердечным ритмом
Если синусовый ритм не восстанавливают, то необходим адекватный контроль ЧСС: ЧСС в покое 60-80 в мин, при физической нагрузке 90-110 в мин.
БЕТА-АДРЕНОБЛОКАТОРЫ контролируют ЧСС как в покое, так и при нагрузке. Их применение наиболее оправдано при повышенном тонусе адренергической системы и ишемии миокарда на фоне ФП. Эффективность и безопасность применения БАБ установлена в нескольких сравнительных исследованиях.
При неэффективности БАБ (при ФВ>40%) возможен переход на недигидропиридиновые антагонисты кальция (ВЕРАПАМИЛ или ДИЛ- ТИАЗЕМ). Эти препараты оказывают отрицательное инотропное действие, поэтому они не показаны пациентам с систолической сердечной недостаточностью. При неэффективности возможен переход на АМИОДАРОН, применение которого хорошо переносится пациентами с нарушением гемодинамики. Этот препарат, который сначала применялся у пациентов для контроля ритма, может применяться для контроля частоты сердечных сокращений при трансформации ФП в постоянную форму.
При неэффективности - аблация ABC и имплантация ЭКС.
Сердечные гликозиды (ДИГОКСИН), урежающие сердечный ритм за счет повышения тонуса парасимпатической системы, эффективно контролируют частоту сердечных сокращений в покое, но в меньшей степени уменьшают ее во время нагрузки. Комбинация их с БАБ может быть эффективна у пациентов с сердечной недостаточностью. Длительная терапия ДРОНЕДАРОНОМ значительно снижает ЧСС в покое и при физической нагрузке, но у препарата в настоящее время не зарегистрировано показаний для лечения постоянной формы ФП. Рекомендации АКК/ААС/ЕКО по профилактической фармакотерапии для поддержания синусового ритма.
Класс I (безусловные рекомендации)
При выборе ААП для поддержания синусового ритма у больных с плохо переносимыми симптомами во время МА следует учитывать, главным образом, их безопасность (В).
Необходимо лечить заболевания, предрасполагающие к развитию МА, или устранимые ее причины до начала ААТ (С)
Класс IIа (больше "за", чем "против")
Назначать ААП для поддержания синусового ритма с целью профилактики развития аритмогенной кардиомиопатии, вызываемой МА (С)
Нечастые и хорошо переносимые рецидивы МА в некоторых случаях могут расцениваться как успешный исход ААТ (С)
У некоторых больных допустимо начинать ААТ вне стационара (С)
Класс II В (больше "против", чем "за")
Назначать антиаритмическую терапию для поддержания синусового ритма у бессимптомных больных с целью профилактики ремоде- лирования предсердий (С)
Назначать ААП для поддержания синусового ритма с целью профилактики ТЭ или ХСН у некоторых больных (С)
Назначать ААП для поддержания синусового ритма в случаях, когда монотерапия с помощью ААП неэффективна (С)
Класс III (вмешательство неэффективно или противопоказано)
Использование специфического ААП для поддержания синусового ритма больных с несомненными ФР развития проаритмических (аритмогенных) побочных эффектов для этого препарата (А)
Использование ААП для поддержания синусового ритма у больных с выраженной дисфункцией СУ узла или АВС при отсутствии функционирующего электрокардиостимулятора (С).
