
- •Введение
- •Рекомендуемая литература
- •Тема 1. Кинематика поступательного и вращательного движения §1.1. Кинематика поступательного движения
- •§1.2. Кинематика вращения
- •§1.3. Центр масс
- •Тема 2. Динамика поступательного движения. Элементы специальной теории §2.1. Законы Ньютона
- •§2.2. Силы взаимодействия
- •§2.3. Элементы специальной теории относительности
- •Тема 3. Динамика вращательного движения
- •Тема 4. Работа и энергия. Законы сохранения в механике §4.1. Работа, мощность
- •§4.2. Энергия
- •§4.3. Импульс
- •Тема 5. Распределение Максвелла и Больцмана
- •Тема 6. Средняя энергия молекул
- •Тема 7. Первое начало термодинамики. Работа при изопроцессах
- •Тема 8. Второе начало термодинамики. Энтропия
- •Тема 9. Электростатическое поле в вакууме
- •Тема 10. Законы постоянного тока
- •Закон Ома для неоднородного участка цепи:
- •Тема 11. Магнитостатика. Явление электромагнитной индукции
- •Тема 12. Электрические и магнитные свойства вещества
- •Тема 13. Уравнения Максвелла
- •Тема 14. Свободные и вынужденные колебания. Сложение гармонических колебаний §14.1. Свободные гармонические колебания и их характеристики
- •§14.2. Гармонические осцилляторы
- •§14.3. Сложение свободных гармонических колебаний
- •§14.4. Вынужденные колебания, резонанс
- •Тема 15. Волны. Уравнение волны
- •2.Взаимосвязь длины волны, периода и частоты: , .
- •Тема 16. Электромагнитные волны
- •Тема 17. Интерференция и дифракция света
- •Тема 18. Поляризация и дисперсия света
- •Тема 19. Тепловое излучение. Фотоэффект. Эффект Комптона. Световое давление
- •Тема 20. Спектр атома водорода. Правило отбора
- •Тема 21. Дуализм свойств микрочастиц. Соотношение неопределенностей Гейзенберга
- •Тема 22.Уравнение Шредингера
- •Тема 23. Ядро. Элементарные частицы. Фундаментальные взаимодействия
- •Тема 24. Ядерные реакции. Законы сохранения в ядерных реакциях
§4.3. Импульс
Кроме
энергии состояние движущегося тела
характеризует импульс
или количество движения тела :  .
.
В
соответствии со вторым законом Ньютона
сила, действующая на тело равна скорости
изменения импульса тела под действием
этой силы  , отсюда
следует
, отсюда
следует  =
-приращение импульса, иногда произведение
(
=
-приращение импульса, иногда произведение
( )
называют импульсом силы.
)
называют импульсом силы.
Закон
сохранения импульса
– в инерциальной системе отсчета полный
импульс замкнутой физической системы
остается в процессе движения постоянным  .
.
Пример 4.10. Импульс материальной точки изменяется по закону
 .
Модуль
силы (в Н), действующей на точку в момент
времени t
= 4 c,
равен …
.
Модуль
силы (в Н), действующей на точку в момент
времени t
= 4 c,
равен …
Решение:
согласно второму закону Ньютона скорость
изменения импульса материальной точки
равна действующей на нее силе:
.
Тогда зависимость силы от времени имеет
вид
 .
.
Модуль
силы
 .
.
Пример 4.11. Шар массой m1=200г, движущийся со скоростью р=неупругий, скорость шаров (в м/с) после удара равна:
 0,5
0,6
2
1,67
0,5
0,6
2
1,67
Решение:
закон сохранения импульса для этого
случая 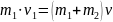 .
.
 .
.
Пример 4.12. Шар имел до удара импульс р0, после удара р1 (рис. а). Чему равно изменение импульса шара? (одна клетка 1кгм/с)
Р ешение:
изменение импульса шара
ешение:
изменение импульса шара .
Найдем геометрическую разность векторов
(рис.b).
Изменение импульса р
– гипотенуза прямоугольного треугольника,
рассчитаем его длину по теореме Пифагора:
.
Найдем геометрическую разность векторов
(рис.b).
Изменение импульса р
– гипотенуза прямоугольного треугольника,
рассчитаем его длину по теореме Пифагора:
 .
.
П ример
4.13. Первый шар имел до удара импульс р0,
о него ударился шар с импульсом р и
остановился (рис. а). Чему равен импульс
первого шара после удара? (одна клетка
1 кгм/с)
ример
4.13. Первый шар имел до удара импульс р0,
о него ударился шар с импульсом р и
остановился (рис. а). Чему равен импульс
первого шара после удара? (одна клетка
1 кгм/с)
Решение:
по закону сохранения импульса
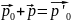 построим
сумму векторов р и р0(рис.
b),
рассчитаем его длину по теореме
Пифагора:
построим
сумму векторов р и р0(рис.
b),
рассчитаем его длину по теореме
Пифагора: .
.
Тема 5. Распределение Максвелла и Больцмана
В случае анализа свойств макроскопических систем (МС), например, идеального газа, бесполезно интересоваться физическими свойствами отдельных частиц в данный момент времени, но важно знать, какова вероятность присутствия в системе частиц с тем или иным значением физической величины. Законы распределения – это закономерности устанавливающие связь между физическими величинами в МС с вероятностью их присутствия в системе при определенных условиях.
Если система состоит из идентичных, различных частиц, которые могут обладать любым значением спина, то ее физическая статистика определяется распределением Больцмана:
 ,
,
 -
вероятность того, что частицы системы
обладают энергией Ei
при температуре Т; В – коэффициент,
определяемый физической величиной r.
Например, идеальный газ подчиняется
распределению Больцмана.
-
вероятность того, что частицы системы
обладают энергией Ei
при температуре Т; В – коэффициент,
определяемый физической величиной r.
Например, идеальный газ подчиняется
распределению Больцмана.
Из распределения Больцмана следует распределение Максвелла – распределение молекул идеального газа по скоростям:
 ,
,
г де
m0
– масса молекулы. Кривая распределения
имеет максимум соответствующий наиболее
вероятной скорости молекул газа при
данной температуре:
де
m0
– масса молекулы. Кривая распределения
имеет максимум соответствующий наиболее
вероятной скорости молекул газа при
данной температуре:
 .
.
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла). Свойства распределения Максвелла:
 -
доля молекул, скорости которых заключены
в интервале скоростей отдо+
в расчете на единицу этого интервала;
-
доля молекул, скорости которых заключены
в интервале скоростей отдо+
в расчете на единицу этого интервала;
площадь под кривой всегда равна единице;
если не меняя температуры взять другой газ с меньшей молярной массой и таким же числом молекул, то площадь под кривой не изменятся, величина максимума уменьшится, максимум сместится вправо в сторону больших скоростей;
если не меняя температуры взять другой газ с большей молярной массой и таким же числом молекул, то площадь под кривой не изменятся, величина максимума увеличится, максимум сместится влево в сторону меньших скоростей;
если увеличить температуру- максимум сместится вправо в сторону больших скоростей, величина максимума уменьшится;
если уменьшить температуру- максимум сместится влево в сторону меньших скоростей, величина максимума увеличится.
Пример 5.1. На рисунке (см. выше приведенный рисунок) представлен график распределения молекул идеального газа по скоростям (распределение Максвелла), где f(v) – доля молекул, скорости которых заключены в интервал отv до v+dv в расчете на единицу этого интервала. Если, не меняя температуры и числа молекул, взять другой газ с меньшей молярной массой, то
максимум сместится вправо в сторону больших скоростей
максимум сместится влево в сторону меньших скоростей
площадь под кривой уменьшится
Решение: смотри 2 и 4 свойство функции распределения.
П ример
5.2.В
трех одинаковых сосудах при равных
условиях находится одинаковое количество
водорода (μ=0,002 кг/моль), гелия (μ=0,004
кг/моль), азота(μ=0,014 кг/моль). Какая
кривая соответствует распределению
молекул водорода?
ример
5.2.В
трех одинаковых сосудах при равных
условиях находится одинаковое количество
водорода (μ=0,002 кг/моль), гелия (μ=0,004
кг/моль), азота(μ=0,014 кг/моль). Какая
кривая соответствует распределению
молекул водорода?
Решение:
кривая распределения имеет максимум
при скоростипрямо пропорциональный
температуре и обратно пропорциональный
массе молекул:
 .
Масса молекул водорода минимальна из
всех приведенных, значит, ей соответствует
кривая (3) с наибольшим значением vm.
.
Масса молекул водорода минимальна из
всех приведенных, значит, ей соответствует
кривая (3) с наибольшим значением vm.
Распределение скоростей молекул гелия будет описывать кривая 2, азота – 1.
Пример 5.3. Используем тот же рисунок, газ находится при разных температурах, какая кривая соответствует минимальной температуре?
Решение:
кривая распределения имеет максимум
при скоростипрямо пропорциональный
температуре, следовательно минимальная
температура – минимальная скорость,
это кривая (1). Соотношение между
температурами:
 .
Кроме того, на рисунке верно изображено
увеличение величины максимума при его
смещении в сторону меньших скоростей
при понижении температуры.
.
Кроме того, на рисунке верно изображено
увеличение величины максимума при его
смещении в сторону меньших скоростей
при понижении температуры.
