
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Термодинамика растворения
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
- •Ферменты. (Лекция №4)
- •Ферменты – это белковые катализаторы.
- •Участок фермента, непосредственно взаимодействующий с субстратами называется активным центром фермента.
- •Свойства активного центра
- •Основные свойства ферментов.
- •Зависимость скорости ферментативной реакции от концентрации субстрата
- •Способы регуляции активности ферментов.
- •Конкурентное ингибирование.
Зависимость скорости ферментативной реакции от концентрации субстрата
Зависимость скорости ферментативной реакции от концентрации субстрата описывается уравнением Михаэлиса – Ментон.
Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
k1 k2
![]()
k -1
ЕS –субстратно-ферментный комплекс, это неустойчивое короткоживущее промежуточное соединение Применяем метод стационарных концентраций – скорость образования и распада промежуточных соединений равны
k1 [E] [S] = k2 [ES] +k3[ES]
перенесем в одну сторону:
k1 [E] [S] – k2 [ES] –k3[ES] = 0
[E] = [Е]о – [ES]
[Е]о-начальная концентрация фермента.
k1 [E]о [S] – k1 [ES] [S] – k2 [ES] –k3[ES] = 0
[ES] = k1 [E]о[S]/(k1[S] + k2 +k3)
V= k3[ES] = k1k3[E]о[S]/(k1[S] + k2+k3)
Разделим на k1 и подставим
(k2+k3)/ k1 = КМ
Vмах=Eо[S]
Получим
V= Vмах [S]/([S] + КМ)
Проанализируем.
При низких концентрациях субстрата [S]<<КМ, пренебрегаем в знаменателе значением [S]. Получаем V=Vмах[S]/(КМ), Скорость растет линейно с ростом концентрации субстрата.
При высоких концентрациях субстрата если [S] >> КМ , то пренебрегаем в знаменателе КМ и получим V= Vмах [S]/[S], V= Vмах.
Таким образом,- при низких концентрациях субстрата скорость возрастает линейно, по мере насыщения фермента рост активности замедляется, а когда все молекулы фермента насыщаются субстратом, активность становится постоянной и равна vmax.
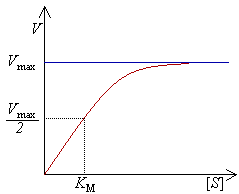
Если [S]= КМ, то V= Vмах [S]/([S] +[S]), V= Vмах/2, таким образом, КМ численно равна такой концентрации субстрата, при которой скорость равна половине максимальной.
Константа Михаэлиса – численно равна концентрации субстрата, при которой скорость равна половине максимальной. Константа Михаэлиса отражает сродство фермента к субстрату. Чем меньше константа Михаэлиса, тем больше сродство фермента к субстрату.
Скорость, с которой вещества реагируют друг с другом, зависит и от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов изменяет скорость реакции.
Для того, чтобы избежать влияния диффузии на скорость процесса в клетке повышены концентрации субстратов.
Способы регуляции активности ферментов.
Конкурентное (изостерическое) ингибирование .
Аллостерическое ингибирование.
Фосфорилирование – дефосфорилирование.
Частичный протеолиз.
Регуляция синтеза ферментов.
Конкурентное ингибирование.
Вещество связывается с активным центром фермента и конкурирует с субстратом за активный центр.
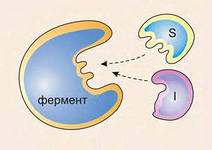
S – cубстрат I – конкурентный ингибитор (замедлитель).
Конкурентный ингибитор может вступать в реакцию, катализируемую этим ферментом или просто связываться с активным центром. В обоих случаях скорость реакции, в которой участвует субстрат, снижается. Часто конкурентный ингибитор по структуре похож на субстрат и фермент его путает с субстратом. Сродство фермента к ингибитору может быть больше или меньше, чем к субстрату. От этого и от концентрации ингибитора зависит степень ингибирования процесса. Примером конкурентного ингибирования может быть конкуренция метилового и этилового спирта за алкогольдегидрогеназу.
