
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Термодинамика растворения
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
- •Ферменты. (Лекция №4)
- •Ферменты – это белковые катализаторы.
- •Участок фермента, непосредственно взаимодействующий с субстратами называется активным центром фермента.
- •Свойства активного центра
- •Основные свойства ферментов.
- •Зависимость скорости ферментативной реакции от концентрации субстрата
- •Способы регуляции активности ферментов.
- •Конкурентное ингибирование.
Плавление
Теплота плавления — это количество теплоты, которое необходимо сообщить веществу при постоянном давлении и постоянной температуре, равной температуре плавления, чтобы полностью перевести его из твердого кристаллического состояния в жидкое. Теплота плавления равна тому количеству теплоты, которое выделяется при кристаллизации вещества из жидкого состояния. При плавлении вся подводимая к веществу теплота идет на увеличение потенциальной энергии его молекул. Кинетическая энергия не меняется, поскольку плавление идет при постоянной температуре.
Для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того, чтобы расплавить 1 кг свинца — 25 кДж.
Кристаллизация из расплава
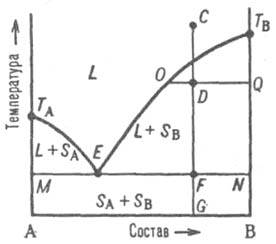 На диаграмме
состояния
изображена зависимость температуры
начала выделения из жидкой фазы твердого
компонента (начала равновесной
кристаллизации) от состава Линия
отделяющая жидкость от зоны начала
кристаллизации называется ликвидус.
Линия M-N
- линия солидуса, отделяющая твердую
фазу А+В. Ниже нее расположено фазовое
поле SA
+ SB
твердого состояния системы.
На диаграмме
состояния
изображена зависимость температуры
начала выделения из жидкой фазы твердого
компонента (начала равновесной
кристаллизации) от состава Линия
отделяющая жидкость от зоны начала
кристаллизации называется ликвидус.
Линия M-N
- линия солидуса, отделяющая твердую
фазу А+В. Ниже нее расположено фазовое
поле SA
+ SB
твердого состояния системы.
![]() При
охлаждении жидкой фазы, например, из
начального состояния С,
фигуративная точка системы в целом
движется вниз вдоль прямой CG.
В точке ее пересечения с линией ликвидуса
начинается кристаллизация компонента
В, система становится двухфазной.
При
охлаждении жидкой фазы, например, из
начального состояния С,
фигуративная точка системы в целом
движется вниз вдоль прямой CG.
В точке ее пересечения с линией ликвидуса
начинается кристаллизация компонента
В, система становится двухфазной.
В точке F пересечения прямой CG с линией солидуса начинается кристаллизация компонента А. В обсуждаемом случае система после затвердевания состоит из относительно крупных кристаллов В и мелкодисперсной смеси совместно возникших при эвтектической кристаллизации кристаллов А и В; такую смесь называют эвтектикой. Состав этой эвтектической смеси соответствует точке Е (эвтектической точке).
Перекристаллизация из раствора
Перекристаллиза́ция — метод очистки вещества, основанный на различии растворимости вещества в растворителе при различных температурах. Обычно интервал температур - от комнатной до температуры кипения растворителя. Перекристаллизация подразумевает плохую растворимость вещества в растворителе при низких температурах, и хорошую — при высоких. При нагревании колбы вещество растворяется. После стадии адсорбции примесей (если это необходимо) активированным углём, охлаждении образуется перенасыщенный раствор, из которого растворённое вещество выпадает в виде осадка. Иногда используют охлаждение раствора льдом или жидким азотом. Ниже приведены приборы для перекристаллизации.
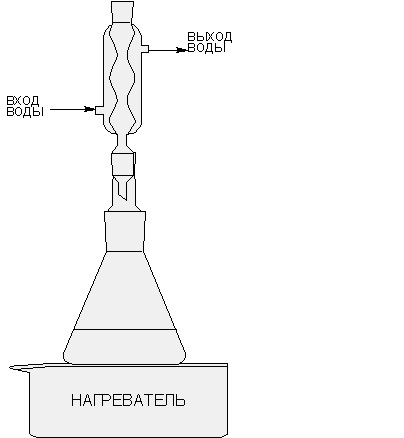
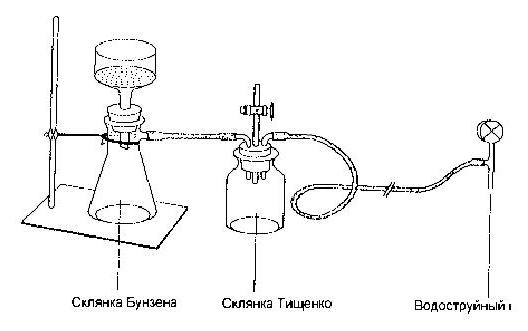
Во многих случаях перекристаллизацию приходится повторять несколько раз. Это зависит от так называемого коэффициента распределения, показывающего распределение примеси между кристаллами и раствором.
Достоинство метода: высокая степень очистки. Недостаток метода: сильные потери вещества в ходе перекристаллизации: всегда часть растворённого вещества в осадок не выпадет, потери при перекристаллизации нередко составляют 40—50 %. Можно использовать два растворителя.
Можно использовать смесь двух растворителей. В одном вещество легко растворимо уже при комнатной температуре, во втором плохо растворимо даже при кипении. Оба растворителя должны неограниченно смешиваться друг с другом. В результате мы подбираем состав смеси таким образом, что вещество может быть легко перекристаллизовано.
