
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Термодинамика растворения
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
- •Ферменты. (Лекция №4)
- •Ферменты – это белковые катализаторы.
- •Участок фермента, непосредственно взаимодействующий с субстратами называется активным центром фермента.
- •Свойства активного центра
- •Основные свойства ферментов.
- •Зависимость скорости ферментативной реакции от концентрации субстрата
- •Способы регуляции активности ферментов.
- •Конкурентное ингибирование.
Уравнение Клайперона – Клаузиса
Энергия расширения пара при постоянном давлении равна Vdp. Тогда выражение для dG для жидкости и пара выглядит так:
dGж=Vжdp – SжdT для жидкости
dGп=Vпdp – SпdT для пара.
В состоянии равновесия dGж= dGп,; тогда
Vпdp – SпdT= Vжdp – SжdT, перегруппируем:
Vпdp – Vжdp = SпdT –SжdT;
ΔVdp =ΔSdT отсюда dp/dT = ΔS/ΔV;
Так как ΔН=ТΔS, то dp/dT = ΔН/ТΔV
Величины берем, отнесенными к 1молю.
Перевернув уравнение получим dT /dp = ТΔV/ΔН
Эти уравнения применимы ко всем фазовам переходам двухфазных систем. Величина показывает на сколько меняется температура при изменении давления на единицу. Знак dp/dT определяется знаком ΔV. ΔV в ходе процесса кипения всегда положительно поэтому Ткип растет с ростом давления. Для большинства веществ при плавлении Vж> Vтв и ΔV>0. Отсюда температура плавления также растет с ростом давления. Однако для воды, чугуна и висмута ΔVплавл <0 и температура с ростом давления падает. Это видно на фазовой диаграмме воды.
Для процессов кипения и возгонки (с участием пара) можно выразить объем газа из уравнения Менделеева – Клайперона. Считая, что ΔV = Vгаза.
Тогда если ΔV= RT/p, то dp/dT = ΔН p/RТ2
Разделим переменные dp/р = ΔН dT /RТ2
Проинтегрируем уравнение в пределах первого и второго состояния ∫dр/р = ΔН/R∫dT /Т2 получим ∫d lnр = ΔН/R∫d(–1/T); Отсюда
ln р2/р1= ΔН/R(1/Т1–1/Т2).
Уравнение Трутона
Уравнение Трутона позволяет приблизительно оценить( с точностью 10-30%) теплоту кипения из температуры кипения. Приблизительно по правилу Трутона ΔS = 88 Дж/моль град. Так как ΔН =ТΔS, то ΔНкип=88Ткип
При снижении давления температура кипения в области низких давлений быстро снижается. Что позволяет осуществлять перегонку жидкостей при низких давлениях и низких температурах кипения. Теплота затрачиваемая на парообразование равна количеству теплоты, выделяющемуся при конденсации пара в жидкость.
Зависимость температуры кипения воды от давления
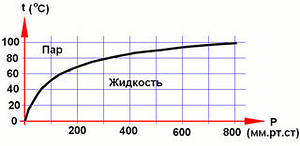
Теплота парообразования равна количеству теплоты, выделяющемуся при конденсации пара в жидкость. Превращение жидкости в пар при постоянной температуре не ведет к увеличению кинетической энергии молекул, но сопровождается увеличением их потенциальной энергии, т. к. расстояние между молекулами существенно увеличивается.
Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры, называется удельной теплотой парообразования. Удельная теплота парообразования и конденсации. Опытами установлено, что для полного обращения в пар 1 кг воды (при температуре кипения) необходимо затратить 2,3 МДж энергии. Для обращения в пар других жидкостей требуется иное количество теплоты. Например, для спирта оно составляет 0,9 МДж.
Кипение
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре. В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования — кипение — возможен лишь при совершенно определенной (при данном давлении) температуре — температуре кипения.
По мере увеличения температуры стенки и дно сосуда покрываются мелкими пузырьками. Они образуются в результате расширения мельчайших пузырьков воздуха, которые существуют в углублениях и микротрещинах не полностью смачиваемых стенок сосуда. Пары жидкости, которые находятся внутри пузырьков, являются насыщенными. С ростом температуры давление насыщенных паров возрастает, и пузырьки увеличиваются в размерах. С увеличением объема пузырьков растет и действующая на них выталкивающая (архимедова) сила. Кипение начинается после того, как давление насыщенного пара внутри пузырьков сравнивается с давлением в окружающей жидкости, (которое складывается из внешнего давления и гидростатического давления столба жидкости). Во время кипения температура жидкости и пара над ней не меняется. Она сохраняется неизменной до тех пор, пока вся жидкость не выкипит. Это происходит потому, что вся подводимая к жидкости энергия уходит на превращение ее в пар.
Кипение двухкомпонентной системы (смешивающиеся жидкости). При постоянном давлении температура кипения смеси зависит от состава. Нижняя кривая - это кривая кипения, а верхняя кривая конденсации. Состав пара отличается от состава жидкости. Согласно 1-ому закону Коновалова: Пар в двухкомпонентной системе обогащен легкокипящим компонентом.
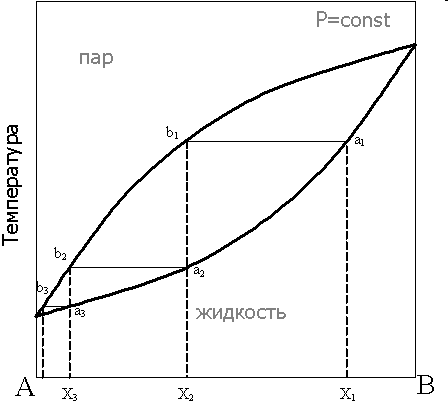
При нагревании исходной смеси состава Х1 кипение начнётся в точке а1. При этом состав первых порций пара соответствует точке b1. При конденсации этого пара образуется смесь состава Х2.
Отметим, что при кипении смеси состава Х1 состав оставшейся жидкости будет обогащаться компонентом В, соответственно температура кипящей жидкости будет повышаться до тех пор, пока в жидкости не останется только компонент В.
Компонент А мы получим в виде конденсата, содержащего компонент В. Степень очистки А можно повысить в ходе повторной перегонки. При повторной перегонке жидкости состава Х2, нагрев этой смеси приведёт к получению конденсата состава Х3 и так далее. Конденсат можно собирать фракционно. Каждая следующая фракция будет содержать больше высококипящего компонента. Степень очистки компонента А можно повысить, используя дефлегматор.
Особенности проведения перегонки. Перегонкой разделяют жидкости с отличающимися температурами кипения.
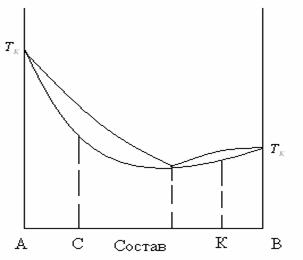
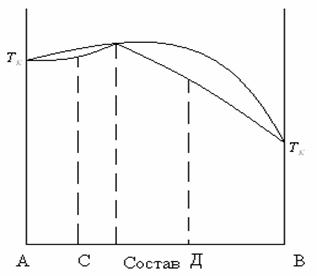
Кривая зависимости температуры кипения от мольной доли веществ. Может иметь максимум или минимум. Такая система называется азеотропной. Такая смесь кипит при постоянной температуре равной температуре максимума или минимума и имеет состав пара равный составу жидкости.
Второй закон Коновалова: Точки максимума или минимума на кривой температур кипения отвечают растворам, состав которых одинаков с составом их насыщенного пара.
Аппарат для перегонки
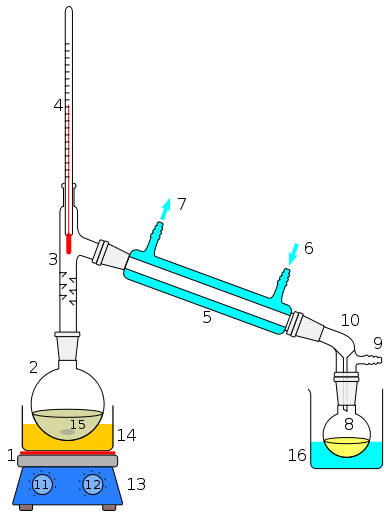
1 Плитка, 2 Круглодонная колба, 3 Насадка Вюрца, 4 Термометр 5 Холодильник Либиха, 6 Подвод воды, 7 Отвод воды, 8 Приёмная колба, 9 Отвод газа (в том числе с понижением давления), 10 Аллонж, 14 Водяная (масляная, песочная баня), 15 Мешалка или гранулы.
Для разделения жидкостей с высокой температурой кипения используют перегонку под вакуумом. Для этого к системе подключают водоструйный или масляный насос. Ниже приведена графическая
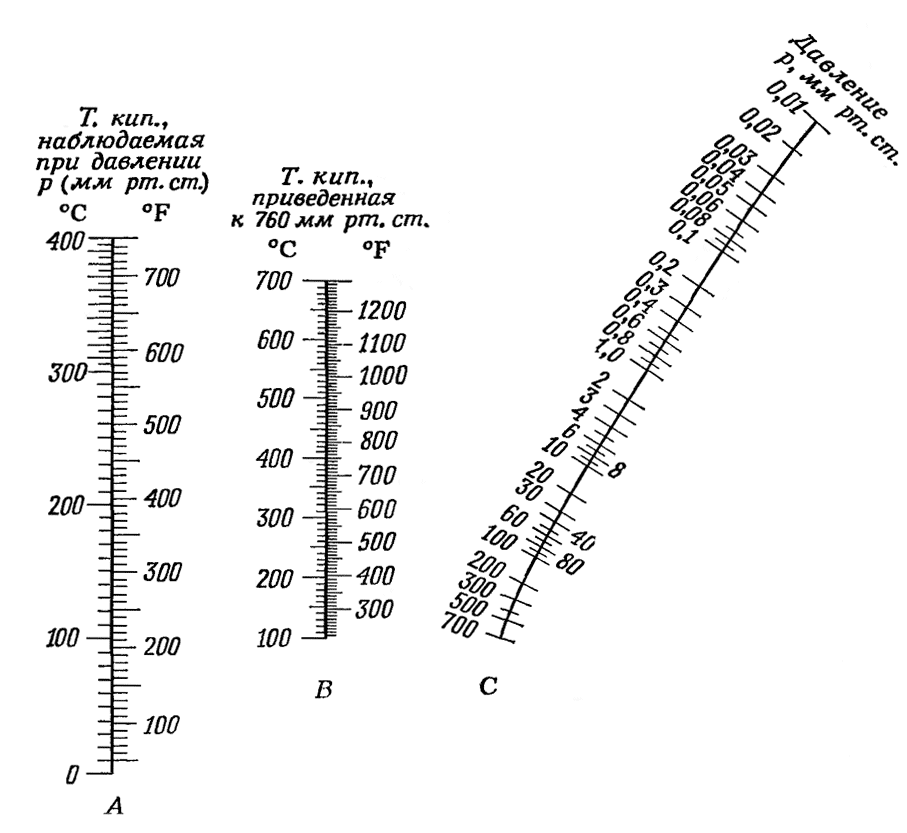 зависимость
позволяющая рассчитать температуру
кипения жидкости при разных давлениях.
зависимость
позволяющая рассчитать температуру
кипения жидкости при разных давлениях.
Можно заставить жидкость перейти в твердое состояние, забрав у нее тепло. Для этого достаточно поместить ее в более холодную среду. При потере тепла молекулы жидкости замедляют свое движение и, в конце концов, уже не могут перемещаться, а просто колеблются вокруг фиксированных точек. С наступлением этой фазы жидкость отвердевает, т. е. превращается в твердое вещество. Например, вода замерзает при температуре 0°С.
