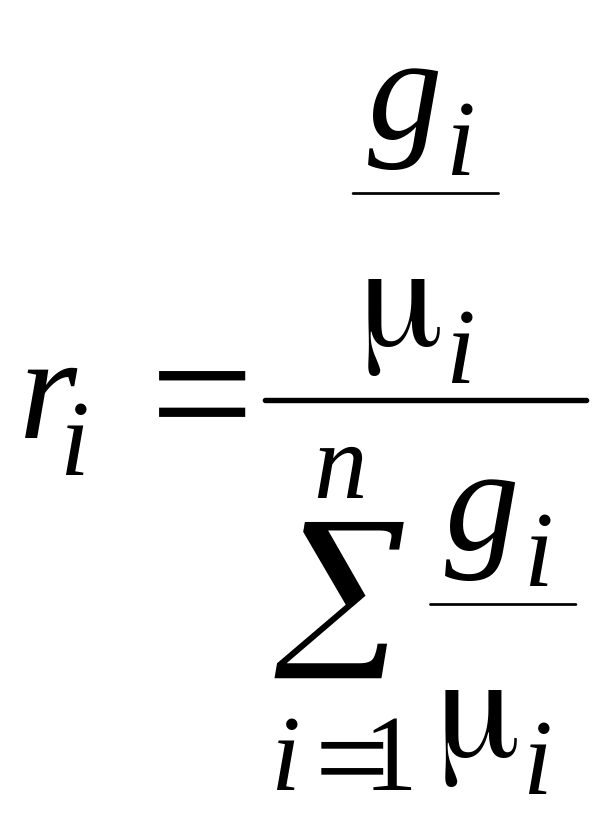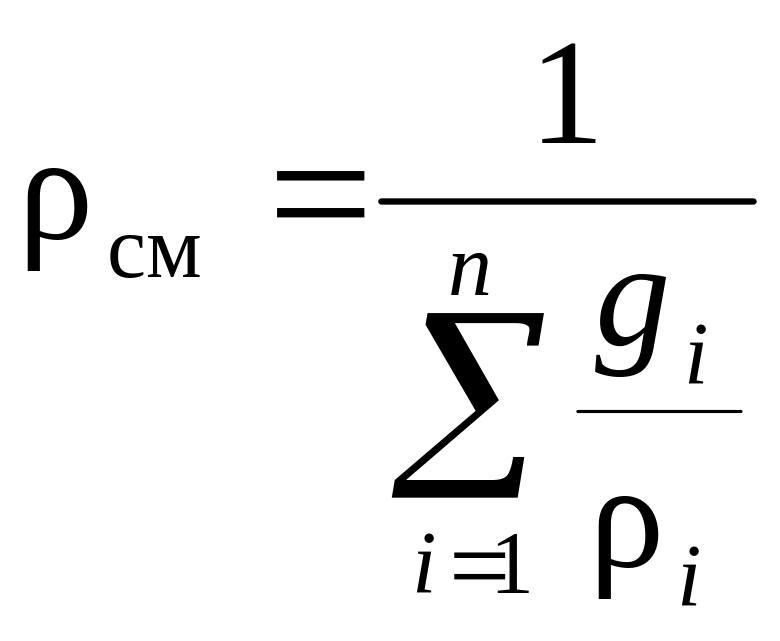- •15 Января 2013 г.
- •Кафедра теплотехники и теплосиловых установок сПбГлту
- •Введение
- •Расчет характеристик и процессов для газовой смеси
- •1. Задание на курсовую работу
- •1.1. Расчет характеристик газовой смеси
- •1.2. Расчет теплоемкостей газовой смеси по заданному химическому составу смеси
- •1.3. Расчет термодинамического цикла
- •Исходные данные к курсовой работе
- •Исходные данные к курсовой работе
- •Параметры состояния рабочего тела в характерных точках цикла
- •Результаты расчетов характеристик процессов цикла
- •2. Указания по выполнению курсовой работы
- •2.1. Расчет характеристик газовой смеси
- •Соотношение для расчета смесей идеальных газов
- •2.2. Расчет теплоемкостей газовой смеси по заданному химическому составу смеси
- •2.3. Расчет термодинамического цикла
- •Формулы для расчета термодинамических процессов
- •Зависимость термического кпд от степени сжатия ε
- •Молярные массы, плотности и газовые постоянные различных газов
- •Образец оформления титульного листа
- •Образец оформления задания на курсовую работу
- •А. Указания по оформлению курсовой работы
- •Б. Правила оформление расчетов
- •1 94021, Санкт-Петербург, Институтский пер., 5.
Исходные данные к курсовой работе
Параметр |
Последняя цифра шифра |
|||||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
ε |
16 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
16 |
18 |
λ |
1,5 |
1,6 |
1,5 |
1,7 |
1,4 |
1,5 |
1,6 |
1,7 |
1,7 |
1,5 |
ρ |
1,6 |
1,4 |
1,3 |
1,4 |
1,5 |
1,5 |
1,4 |
1,3 |
1,5 |
1,3 |
Таблица 3
Параметры состояния рабочего тела в характерных точках цикла
Номер точки |
р, Па (кПа) |
υ, м3/кг |
Т, К |
1 |
р1 |
υ1 |
Т1 |
2 |
р2 |
υ2 |
Т2 |
3 |
р3 |
υ3 |
Т3 |
4 |
р4 |
υ4 |
Т4 |
5 |
р5 |
υ5 |
Т5 |
Таблица 4
Результаты расчетов характеристик процессов цикла
№ п/п |
Процессы |
Δu, кДж/кг |
Δi, кДж/кг |
Δs, кДж/(кг · К) |
l, кДж/кг |
q, кДж/кг |
1 |
1 – 2 |
|
|
|
|
|
2 |
2 – 3 |
|
|
|
|
|
3 |
3 – 4 |
|
|
|
|
|
4 |
4 – 5 |
|
|
|
|
|
5 |
5 – 1 |
|
|
|
|
|
6 |
Итого за цикл |
|
|
|
|
|
2. Указания по выполнению курсовой работы
2.1. Расчет характеристик газовой смеси
В начале курсовой работы определяются массовые или объемные доли заданной газовой смеси, используя формулы табл. 5.
Таблица 5
Соотношение для расчета смесей идеальных газов
Расчет смеси |
Способ задания смеси |
|
массовыми долями (gi) |
объемными долями (ri) |
|
Определение долей |
где Мi – масса данного (i-го) компонента, кг; Мсм – масса всей смеси, кг. При этом: М1 + М2 + … + Мi = Мсм;
|
где Vi – приведенный объем данного (i-го) компонента, м3; Vсм – объем всей смеси, м3. При этом:
|
Формула перехода |
|
|
Парциальное давление компонентов |
|
pi = r i · pсм |
Удельный объем смеси |
|
|
Плотность смеси |
|
|
Средняя молярная масса смеси |
|
|
Окончание табл. 5
Расчет смеси |
Способ задания смеси |
|
массовыми долями (gi) |
объемными долями (ri) |
|
Газовая постоянная смеси |
|
|
Теплоемкость смеси |
|
|
Примечание:
В табл. 5 приняты следующие обозначения:
gi
и ri
– массовые и объемные доли соответственно;
μi
– молярная масса компонента, кг/моль;
μсм
– молярная масса смеси, кг/моль; рi
и рсм
– давление компонента и смеси
соответственно, Па; Ri
и Rсм
– газовая постоянная компонента и смеси
соответственно, Дж/(кг · К); ρi
и ρсм
– плотность компонента и смеси
соответственно, кг/м3;
сi,
![]() и μсi
– массовая [кДж/(кг · К)], объемная
[кДж/(нм3
· К)] и мольная [Дж/(моль · К)] теплоемкости
компонента; ссм,
и μсi
– массовая [кДж/(кг · К)], объемная
[кДж/(нм3
· К)] и мольная [Дж/(моль · К)] теплоемкости
компонента; ссм,
![]() и μссм
– массовая, кДж/(кг · К), объемная, кДж/(нм3
· К) и мольная, Дж/(моль · К), теплоемкости
смеси соответственно.
и μссм
– массовая, кДж/(кг · К), объемная, кДж/(нм3
· К) и мольная, Дж/(моль · К), теплоемкости
смеси соответственно.
2.1.1. Рассчитать массовые доли компонентов, пользуясь формулами табл. 5.
2.1.2. Используя значения молярных масс компонентов, рассчитываются их газовые постоянные по формуле
![]() ,
Дж/(кг
· К), (1)
,
Дж/(кг
· К), (1)
где μi – молярная масса, кг/моль (прил. 1).
2.1.3. Газовую постоянную, среднюю молярную массу смеси, парциальные давления компонентов определяем через массовые или объемные доли по формулам табл. 5.
2.1.4. Смеси идеальных газов обладают свойствами идеального газа, т. е. они подчиняются всем газовым законам [6]. Масса смеси выражается из уравнения Клапейрона для Мсм, кг, смеси газа:
рсм Vсм = Mсм Rсм Tсм, (2)
где рсм и Тсм – абсолютное давление, Па, и температура, К, смеси при нормальных условиях; Vсм – объем смеси, м3 (табл. 1); Мсм – масса смеси, кг; Rсм – газовая постоянная смеси, Дж/(кг · К).
2.1.5. Через рассчитанные ранее массовые или объемные доли находим массы компонентов и их приведенные объемы при заданном объеме смеси Vсм.
2.1.6. Рассчитать число молей в смеси (мольные доли компонентов численно равны объемным долям, т.е. ki = ri) из формулы
Мсм = Nсм · μсм, кг. (3)
Примечание: По определению объемной доли i-го компонента газовой смеси можно записать:
 ,
(4)
,
(4)
где
ni
–
число молей i-го
компонента в смеси, моль;
![]() – объем одного моля i-го
компонента при условии, что он находится
при температуре смеси Тсм
и давлении рсм.
– объем одного моля i-го
компонента при условии, что он находится
при температуре смеси Тсм
и давлении рсм.
Равенство
![]() определяется законом Амага.
определяется законом Амага.
Из
закона Авогадро известно, что при
одинаковых температуре и давлении 1
моль любого компонента смеси занимает
один и тот же объем V′.
То есть в (4)
можно записать
![]() ,
из чего следует:
,
из чего следует:
 ,
(5)
,
(5)
где nсм – число молей всей смеси, моль; ki – мольная доля i-го компонента смеси.
Таким образом, благодаря (5) установлено, что объемные доли компонентов смеси идеальных газов всегда численно равны их мольным долям.
2.1.7. Плотность компонентов при нормальных условиях определяем по выражению:
![]() кг/нм3,
(6)
кг/нм3,
(6)
где Мi, Vi – массы, кг, и парциальные объемы, нм3, соответствующих компонентов газовой смеси.
Значения плотности компонентов ρi, вычисленные по соотношению (6), проверяются по формуле [4]:
![]() ,
кг/нм3.
(7)
,
кг/нм3.
(7)
2.1.8. Через известные массовые или объемные доли находим плотность смеси при нормальных условиях по выражениям табл. 5:
![]() ,
кг/нм3. (8)
,
кг/нм3. (8)
Значение плотности смеси ρсм, вычисленное по соотношению (8), проверяется по формулам табл. 5 по заданному химическому составу смеси:
, кг/нм3 (9)
или
, кг/нм3 (10)