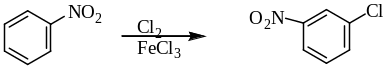- •6. Арены т
- •Оглавление
- •6. Арены
- •Циклопентадиенил анион катион тропилия
- •6.1. Электрофильное ароматическое замещение
- •6.1.1. Хлорирование и бромирование
- •6.1.2. Нитрование
- •6.1.3. Сульфирование
- •6.1.4. Алкилирование
- •6.1.5. Ацилирование
- •Пропионилхлорид пропиофенон
- •Применение реакции Фриделя-Крафтса имеет следующие ограничения:
- •6.2. Алкилбензолы
- •6.2.1. Реакции электрофильного замещения толуола
- •6.3. Окисление аренов
- •Нафталин фталевый ангидрид фталевая кислота
- •6.4. Стирол
- •6.5. Фуллерены и нанотрубки
6.1.4. Алкилирование
Важный метод синтеза алкилбензолов состоит в действии на ароматические соединения алкилгалогенидов при каталитическом участии галогенидов металлов, обычно хлорида алюминия. Этот способ называют алкилированием по Фриделю-Крафтсу.

Винил- и арилгалогениды в условиях реакции Фриделя-Крафтса инертны. Алкилированием бензола трет-бутилхлоридом получают трет-бутилбензол

трет-бутилхлорид трет-бутилбензол
Любой компонент смеси, способный образовывать карбокатион, может алкилировать бензол. Наиболее часто источниками карбокатионов служат алкены и спирты, генерирующие катионы при взаимодействии с сильными кислотами. Алкилированием бензола этиленом получают этилбензол:
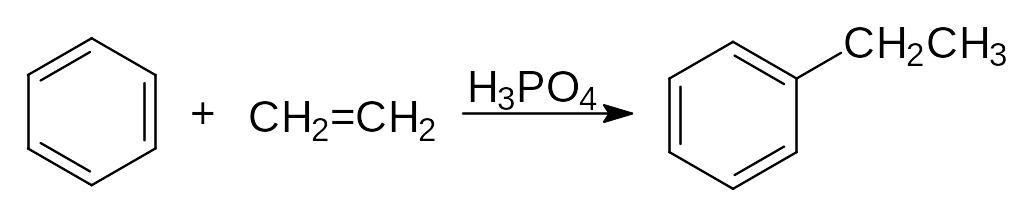
Алкилированием бензола пропиленом получают кумол:

6.1.5. Ацилирование
В этой реакции, сходной с алкилированием по Фриделю-Крафтсу, ацилгалогенид реагирует с бензолом в присутствии избытка безводного хлорида алюминия. В качестве растворителей при ацилировании обычно используют нитробензол или сероуглерод.

ацилхлорид ацилбензол
Ацилхлориды получают из карбоновых кислот действием на них SOCl2 или PCl5:


Упр.1. Напишите реакции алкилирования и ацилирования бензола по Фриделю-Крафтсу следующими реагентами:
(а)
![]() (б)
(б)![]() (в)
(в)
Ответ
Ацилированием бензола пропионилхлоридом получают пропиофенон:

Пропионилхлорид пропиофенон
Для получения моноалкиларенов не опасаясь перегруппировок, прибегают к ацилированию с последующим восстановлением карбонильной группы в метиленовую. Одним из методов такого восстановления является реакция Клеменсена. По Клеменсену кетон нагревают в соляной кислоте, содержащей амальгамированный цинк:
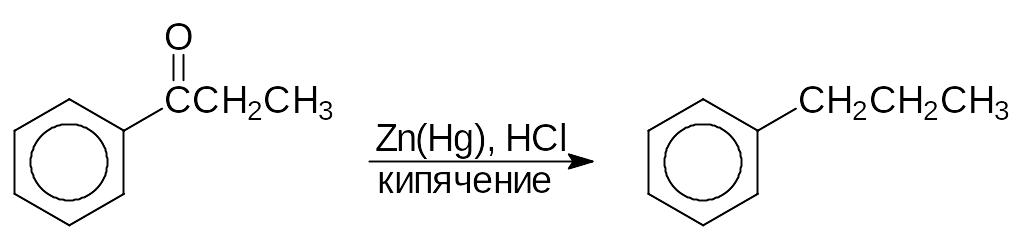
пропиофенон пропилбромид
Применение реакции Фриделя-Крафтса имеет следующие ограничения:
1. Реакции алкилирования сопровождаются перегруппировками.
2. Реакции алкилирования сопровождаются образованием полиалкиларенов.
3. В реакцию Фриделя-Крафтса (алкилирования и ацилирования) не вступают соединения, содержащие электроноакцепторные группы.
4. В реакцию Фриделя-Крафтса не вступают арил- и винилгалогениды.
6.1.6. Ди- и полизамещение (правила ориентации)
Существенной особенностью реакций электрофильного замещения является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направления реакций замещения в бензольном ядре, называются правилами ориентации.
Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью промежуточно образующихся аренониевых ионов – -комплексов (динамический фактор).
Статический фактор отражает распределение электроннной плотности в молекуле субстрата. Например в толуоле, где электронодонорная группа СН3 повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара-положениях, т.е. активирует эти положения больше, чем мета-положения. В нитробензоле электроноакцепторная нитрогруппа понижает электронную плотность кольца, причем орто- и пара-положения дезактивируются больше, чем мета-положения.
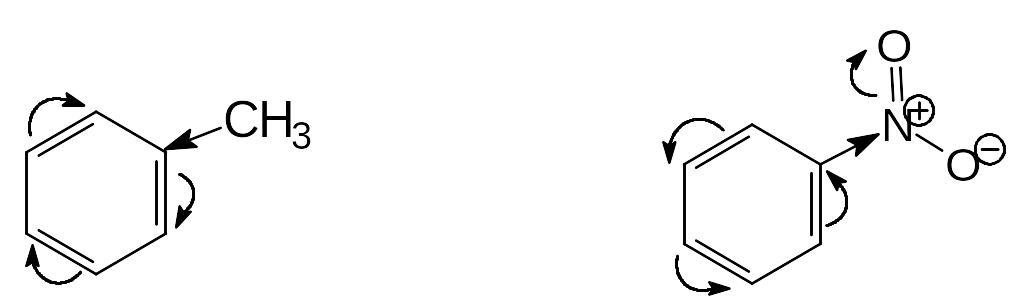
Динамический фактор, т.е. стабилизирующее или дестабилизирующее влияние заместителя на образующиеся в ходе реакции аренониевые ионы, имеет важнейшее значение. Дезактивирующие заместители дестабилизируют -комплекс и увеличивают энергию активации стадии, приводящей к его образованию. Группы, активирующие бензольное кольцо, стабилизируют -комплекс, снижают его энергию и энергию активации образования -комплекса.
Таблица 1. Влияние заместителей на реакции SEAr
орто, пара-Ориентанты |
мета-Ориентанты |
Сильно активирующие O , NH2, NHR, NR2, OH
Умеренно активирующие NHCOCH3, NHCOR, OCH3, OR
Слабо активирующие -CH3 и другие алкилы, C6H5
Слабо дезактивирующие F, Cl, Br, I |
Сильно дезактивирующие NO2, +NR3, CF2, CCl3
Умеренно дезактивирующие CN, SO3H, COOH, COOR, CHO, COR
|
Заместители, подающие электроны на бензольное кольцо и ориентирующие заместитель в орто- и пара-положения называют заместителями I рода. Заместители, оттягивающие электроны с бензольного кольца и ориентирующие заместитель в мета-положение называют заместителями II рода.
В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца. Возможны случаи и несогласованной ориентации, когда ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя. При несогласованной ориентации заместители конкурируют между собой, что приводит к образованию смеси продуктов. Но и в этом случае можно предсказать основное направление реакции, руководствуясь следующими обобщениями.
Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной группой. Если в бензольном кольце имеются активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой.
Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета-положении относительно друг друга. Атаку электрофила затрудняют стерические препятствия, что ососбенно важно, когда с кольцом связаны объемные заместители.
Направление реакции и соотношение изомеров в электрофильном ароматическом замещении зависит также от активности электрофильного реагента Е+ и от пространственных факторов. Чем выше активность электрофильного реагента Е+, тем меньше его избирательность.
Состав продуктов реакции при несогласованной ориентации заместителей подчиняется определенным правилам:
- все орто, пара-ориентанты доминируют над мета-ориентантами,
- все активирующие орто, пара-ориентанты доминируют над галогенами,
- сильно и умеренно активирующие орто, пара-ориентанты доминируют над более слабыми орто, пара-ориентантами.
Нитробензол путем длительного нагревания с использованием концентрированных кислот способен нитроваться до динитробензола, в основном мета.
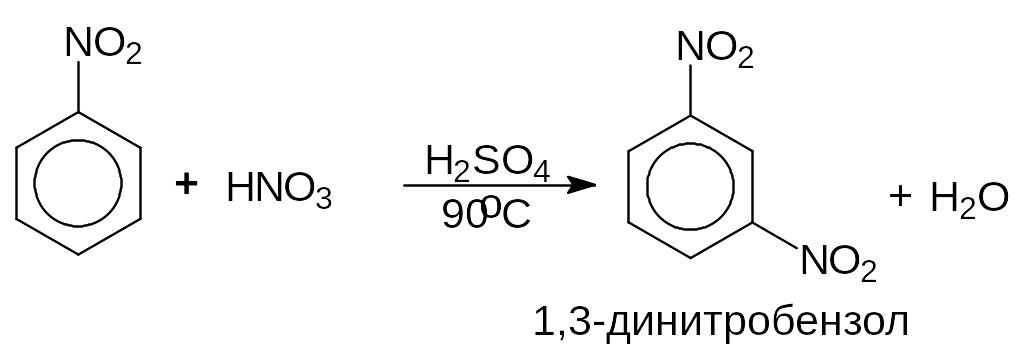
Полинитросоединения сами по себе используются в качестве взрывчатых веществ. Гидрированием м-динитробензола получают м-фенилендиамин.

м-динитробензол м-фенилендиамин
Реакционная способность хлорбензола в нитровании ниже, чем реакционная способность бензола. Нитрование хлорбензола приводит к образованию орто- и пара-хлорбензолов. Галогены являются орто, пара-ориентантами, но при этом дезактивируют электрофильное замещение, так как у них –J > +M.

орто-хлорбензол пара-хлорбензол
Хлорирование нитробензола дает мета-хлорнитробензол