
- •6. Арены т
- •Оглавление
- •6. Арены
- •Циклопентадиенил анион катион тропилия
- •6.1. Электрофильное ароматическое замещение
- •6.1.1. Хлорирование и бромирование
- •6.1.2. Нитрование
- •6.1.3. Сульфирование
- •6.1.4. Алкилирование
- •6.1.5. Ацилирование
- •Пропионилхлорид пропиофенон
- •Применение реакции Фриделя-Крафтса имеет следующие ограничения:
- •6.2. Алкилбензолы
- •6.2.1. Реакции электрофильного замещения толуола
- •6.3. Окисление аренов
- •Нафталин фталевый ангидрид фталевая кислота
- •6.4. Стирол
- •6.5. Фуллерены и нанотрубки
6. Арены т
(пособие для самостоятельной работы студентов)
10
27
Оглавление
А. Ароматичность 2
Б. Аннулены. Правило Хюккеля 2
В. Стабильность бензола 2
Г. Строение бензола 3
Д. Конденсированные ароматические углеводороды 4
Е. Ароматичские ионы 4
6.1. Электрофильное ароматическое замещение 5
6.1.1. Хлорирование и бромирование 5
А. Механизм электрофильного ароматического замещения. Хлорирование бензола 5
6.1.2. Нитрование 6
6.1.3. Сульфирование 6
6.1.4. Алкилирование 7
6.1.5. Ацилирование 8
6.1.6. Ди- и полизамещение (правила ориентации) 9
6.2. Алкилбензолы 11
А. Кумольный метод получения фенола и ацетона 12
6.2.1. Реакции электрофильного замещения алкилбензолов 12
А. Нитрование 12
Б. Сульфирование 14
В. Галогенирование 15
6.3.Окисление аренов 15
6.4. Стирол 16
А. Анионная полимеризация стирола 16
6.5.. Фуллерены и нанотрубки 16
6. Арены
История ароматических соединений началась в 1825 году, когда английский ученый Фарадей выделил бензол из осветительного газа. В 1834 году немецкий химик Митчерлих получил бензол нагреванием бензойной кислоты с оксидом кальция и установил, что он имеет формулу С6Н6. В 1865 г Кекуле предложил формулу бензола. В конце 19 века в органической химии распространилась теория строения органических соединений (Бутлеров - Кекуле и Купер). В результате все соединения были разделены на алифатические и ароматические углеводороды.
А. Ароматичность
Термин «ароматический» возник потому, что многие соединения бензальдегид, бензиловый спирт, эфиры бензойной кислоты, содержащие бензольные кольца, были выделены из различного рода ладанов, ароматических масел и бальзамов. Ароматические соединения отличаются по свойствам от других ненасыщенных соединений:
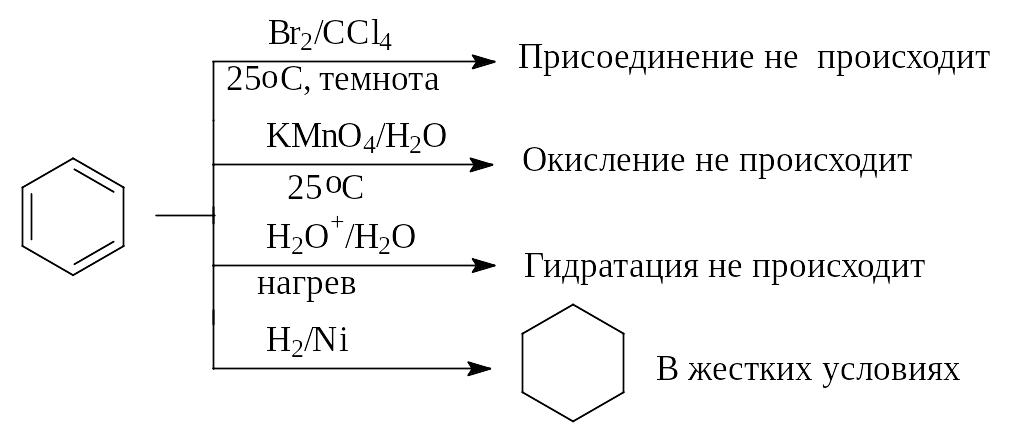
Критериями ароматичности являются:
- высокая термодинамическая стабильность;
- ненасыщенный характер их молекул почти не проявляется;
- они трудно вступают в реакцию присоединения;
- соединение считается тем ароматиченее, чем менее реакционноспособны его двойные связи, и чем выше его термодинамическая стабильность;
- ароматические соединения отличаются от алифатических соединений по их поведению по отношению к электрофильным реагентам: электрофильные реагенты при взаимодействии с ароматическими соединениями не присоединяются по их кратным связям, а замещают атомы водорода, связанные с ароматическими циклами;
- легкость образования аренов в различных реакциях;
- устойчивость к действию окислителей.
Б. Аннулены. Правило Хюккеля
В случае циклических соединений сопряжение может быть циклическим кольцевым. Группа соединений с одинаковой эмпирической формулой (СН)n и циклической структурой называют аннуленами. Их номенклатура ясна из приводимых примеров.

[4]-аннулен [8]-аннулен [14]-аннулен
Некоторые из аннуленов обладают повышенной термодинамической стабильностью.
Хюккель вывел правило, по которому: ароматичностью обладают карбоциклы имеющие плоское строение и содержащие в замкнутой системе сопряжения (4n + 2) -электронов. Из правила Хюккеля следует, что [2], [6] и [10]-аннулены должны быть ароматическими. Понятие ароматичности возникло раньше правила Хюккеля. Правило Хюккеля является лишь квантовомеханическим критерием ароматичности.
В. Стабильность бензола
Гидрирование бензола в присутствии платинового или никелевого катализатора приводит к образованию циклогексана:
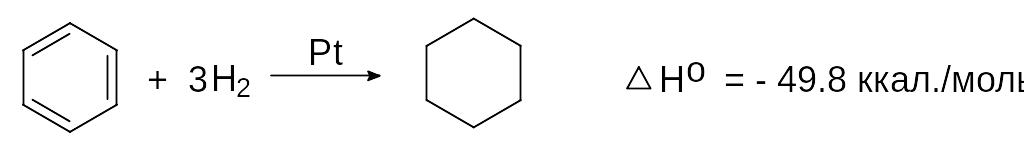
бензол циклогексан
При этом продуктов неполного гидрирования (циклогексена и 1,3-циклогексадиена) не образуется. При гидрировании циклогексена выделяется 28,6 ккал/моль.
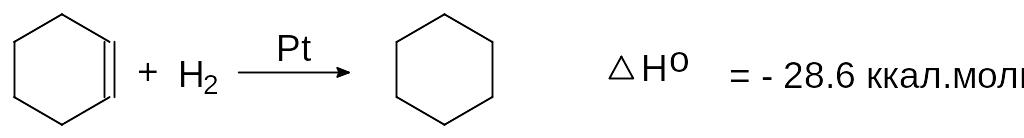
цикоогексен циклогексан
При гидрировании 3 молей циклогексена, таким образом, выделяется 28,6 х 3 = 85,8 ккал/моль. Если из этой суммы вычесть энергию, выделяющуюся при гидрировании одного моля бензола, содержащего то же количество кратных связей, что и три моля циклогексена (85,8 - 49,8 = 36 ккал. моль), получим энергию стабилизации или энергию резонанса в бензоле. Энергия стабилизации представляет собой разницу между вычисленной энергией, которая могла бы выделиться при гидрировании гипотетического 1,3,5-циклогексатриена в случае отсутствия в нем делокализации электронов и экспериментально найденной энергией, выделяющейся при гидрировании реального бензола.
Г. Строение бензола
Данные современных физико-химических методов указывают на то, что все СС и СН связи в бензоле эквивалентны. Согласно этим данным, бензол представляет собой правильный гексагон с длиной СС связи 1,397 Å и валентным углом 120о. Образование -связей СС можно представить как результат продольного перекрывания sp2-гибридных орбиталей углерода, при этом шесть негибридных p-орбиталей шести атомов углерода образуют замкнутую -электронную систему за счет бокового перекрывания. Образующийся при этом секстет -электронов обусловливает особые свойства и стабильность бензола.


Согласно теории МО, шесть атомных p-орбиталей атомов углерода комбинируются с образованием шести молекулярных -орбиталей, из которых три являются связывающими, а три – разрыхляющими.
Д. Конденсированные ароматические углеводороды
Правило Хюккеля выведено и, строго говоря, применимо для моноциклических систем. Однако некоторые полициклические соединения могут рассматриваться как электронные аналоги аннуленов, в которых общая для двух циклов СС связь жестко закрепляет конфигурацию всей молекулы, что благоприятствует делокализации -электронов. Изображение строения нафталина, антрацена и фенантрена с помощью формул с кругом в центре шестиугольника может привести к недоразумению.



нафталин антрацен фенантрен
Е. Ароматические ионы
Правило Хюккеля применимо не только для циклических, полностью сопряженных полиенов, но и для плоских циклических ионов, содержащих, как и полиены, (4n + 2)-электронов. Оно правильно предсказывает ароматический характер катиона циклопропенилия, двухзарядного катиона циклобутадиенилия (n = 0), аниона циклопентадиена и катиона циклогептатриена (n = 1), дианиона циклооктатетраена и т.д.

