
- •2.4. Тепловміст палива і продуктів згоряння
- •2.4.1. Хімічна енергія і теплота утворення речовини
- •2.4.2. Система відліку повних ентальпій
- •2.4.3. Розрахунок повного тепловмісту окислювача, пального і палива
- •2.4.4. Повний тепловміст продуктів згорання палива
- •2.4.5. Зв'язок між повним тепловмістом і величиною
ЛЕКЦІЯ 7
2.4. Тепловміст палива і продуктів згоряння
Повний запас енергії речовин, які можуть вступати в хімічну реакцію, визначається повним тепловмістом (сумою фізичного тепловмісту і хімічної енергії).
Фізичний тепловміст це кількість тепла, яка витрачається на нагрівання даної (хімічно незмінної) речовини від абсолютного нуля до тієї температури Т, за якої її використовують у двигуні. У загальному випадку фізичний тепловміст масової одиниці газоподібної речовини (наприклад, продукту згоряння), що має температуру Т, з урахуванням залежності теплоємності від температури, як відомо, складає
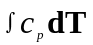
Оскільки під час термодинамічних розрахунків важливо не абсолютне значення тепловмісту, а його зміна, то температура початку відліку фізичного тепловмісту може вибиратися довільною. Якщо її позначити Т0, то умовна величина фізичного тепловмісту складе

Для рідких компонентів палива, які практично нестисливі, теплоємністі за постійного тиску і об'єму рівні між собою і можуть вважатися незалежними від температури, їх позначають буквою с. Тоді для масової одиниці рідких компонентів палива величина фізичного тепловмісту, дорівнюватиме
І = с(Т-Т0)
Очевидно, що:
1. Чисельна величина фізичного тепловмісту даної речовини залежить від обраної початкової температури Т0.
2. Зі збільшенням температури Т, за якої речовина надходить до камери двигуна або знаходиться в ній, фізичний тепловміст збільшується.
3. Фізичний тепловміст речовини може бути від’ємним, якщо його температура нижче обраної початкової температури Т0 .
Якщо під час нагрівання або охолодження даного компонента від початкової температури Т0 до температури Т відбувається його фазове перетворення (наприклад, конденсація або випаровування компонента), то теплота фазового перетворення повинна входити до величини фізичного тепловмісту компонента з відповідним знаком. Так, наприклад, якщо гас, початковий стан якого приймається рідким, надходить до камери після випаровування, то до фізичного тепломісту повинна бути додана теплота його випаровування, так. як у цьому випадку тепло підводиться до речовини із зовні і збільшує у ній запас фізичного тепловмісту.
2.4.1. Хімічна енергія і теплота утворення речовини
Повний тепловміст компонентів палив і продуктів згоряння у значній мірі залежить від наявного у них запасу хімічної енергії. Тому розглянемо більш детально природу і способи визначення запасів хімічної енергії.
Хімічні реакції протікають між атомами елементів так, що атом і елементарні частинки, що входять до нього, не змінюються. Проте у процесі хімічної реакції атоми елементів вступають у взаємодію або, навпаки, розривають зв’язки, що були між ними раніше. При цьому відбувається перерозподіл електронів, що входять в атоми, а у зв'язку з цим і зміна запасу енергії в атомах або, як кажуть, зміна їх енергетичного рівня.
Хімічна енергія, що виділяється або поглинається під час реакції, і складає різницю енергетичних рівнів вихідних і кінцевих речовин реакції. Одна і та ж речовина, яка створюється у результаті хімічної реакції, може бути утворена з різних вихідних речовин, наприклад, вода може утворитися з водню і кисню, що знаходяться в молекулярному або атомарному стані. Внаслідок цього і хімічна енергія, що виділяється або витрачається під час утворення даної речовини, буде мати різну величину. Для того щоб уникнути невизначеності з величиною хімічної енергії компонентів палив і їх продуктів згоряння, вихідні речовини, необхідні для їх утворення, завжди беруть у певному, так званому стандартному стані. Під стандартним станом елемента розуміють такий стан, у якому цей елемент найбільш поширений у природі.
За стандартний стан елементів, які входять до складу палив РРД приймають такі, вуглець у формі твердого графіту, кисень, водень і азот у вигляді молекулярних газів О2, Н2 і N2.
Розглянемо деякі приклади. Під час утворення окису азоту NO зі стандартних азоту і кисню, тобто з газоподібних N2 і О2 за рівнянням N2 + O2 = 2NO необхідно затратити деяку енергію. Таким чином, окис азоту має деякий запас енергії у порівнянні з енергією простої механічної суміші стандартних елементів N2 і О2. Ця енергія і є хімічною енергєю.
Схема енергетичних рівнів речовин, що беруть участь в цій реакції, зображена на рис. 2.3.
Окис азоту NO

Хімічна енергія окису азоту (позитивна)
Механічна суміш
Механічна суміш
Хімічна енергія води (негативна)
Вода Н2О
Умовний нуль відліку хімічних енергій, що приймається у розрахунках повного тепловмісту
Довільний нуль відліку хімічних енергій
H2 i O2
N2 i O2
Q2
Q1
Рис. 2.3. Енергетичні рівні стандартних елементів, їх з’єднань і хімічна енергія речовин:
Q1 – хімічна енергія механічної суміші N2 і О2 у разі довільно обраного нуля відліку хімічної енергії; Q2 – хімічна енергія окису азоту у разі довільно обраного нуля відліку хімічної енергії
Якщо прийняти умовно, що стандартні елементи та їх механічні суміші не мають запасу хімічної енергії, то енергія, витрачена на утворення окису азоту, тобто його хімічна енергія, буде позитивною. При цьому неважко бачити, що величина запасу хімічної енергії не залежать від вибору нуля відліку хімічних енергій. Так, наприклад, якщо взяти за нуль відліку хімічних енергій довільний енергетичний рівень (див. рис. 2.3), то хімічна енергія вихідних і кінцевих речовин (механічної суміші N2 і О2 і окису азоту NО) буде рівною Q1 і Q2 відповідно. Хімічна енергія NО, яка рівна різниці Q1 - Q2, не буде залежати від того, як визначено енергетичний рівень, прийнятий за нуль відліку хімічних енергій. Хімічна енергія речовини може бути і негативною. Так, наприклад, під час утворення води за рівнянням
2H2+O2=2H2O
відбувається виділення енергії. У даному випадку (якщо врахувати прийняті значення хімічної енергії стандартних елементів) вода має менший запас енергії, ніж механічна суміш Н2 і О2, тобто її хімічна енергія негативна. Ця енергія виділилася під час утворення води.
У зазначених вище прикладах поглинання або виділенні енергії відбувається тому, що у разі перебудови молекул і атомів вихідних стандартних елементів для отримання молекули даної речовини (NО або Н2О) у них збільшується або зменшується запас енергії.
Ця зміна запасу енергії залежить тільки від будови електронних оболонок атомів вихідних і кінцевих молекул, тому вона не залежить ні від тиску, ні від температури, за яких відбувається утворення нової молекули.
Хімічна енергія, що виділяється або витрачається під час протікання реакціі утворення речовини, може бути визначена двома способами.
Перший спосіб полягає в тому, що на підставі вивчення спектрів частинок (атомів і молекул) обчислюють енергетичні рівні атомів елементів, які вони мають до і після реакції. За їх різницею знаходять величину хімічної енергії, що відповідає даному перетворенню речовини.
Другий спосіб заснований на експериментальному визначенні теплових ефектів реакцій, тобто кількостей тепла, витрачених або виділених під час протікання тієї чи іншої реакції. Величина цього теплового ефекту, віднесена до утвореної речовини, називається теплотою утворення. Найчастіше даний метод використовують під час визначення теплового ефекту реакцій горіння. У цьому випадку в спеціальному посуді, ізольованому від навколишнього середовища (в калориметрі), здійснюють необхідну реакцію, в процесі якої хімічна енергія перетворюється в теплову. Ця енергія витрачається на нагрівання продуктів горіння. Після закінчення реакції, її продукти охолоджуються до тієї температури, яку мали вихідні речовини до початку реакції, причому вимірюється кількість тепла, яка відводиться від продуктів реакції. Визначену таким чином кількість тепла і називають теплотою утворення речовини, на відміну від хімічної енергії, що визначається за першим способом. Тепловий ефект реакції горіння іноді називають також теплотою горіння.
Теплота утворення і хімічна енергія не рівні між собою, але пов’язані певною відповідністю. Різниця між ними полячгає в тому, що під час зміни речовини у процесі реакції відбувається зміна запасу фізичного тепла у ній, яка складає
 ,
,
де спр – теплоємність продуктів реакції (утворених речовин); свих – теплоемність вихідних речовин.
Якщо вважати, що теплоємності не залежать від температури, то

Відмінність теплоємності продуктів реакції від теплоємності вихідних речовин пояснюється тим, що утворені речовини мають будову і властивості, відмінні від будови і властивостей вихідних речовин. Крім того, теплоємність газоподібних речовин залежить від того, за яких умов (за постійного тиску чи постійного об’єму) здійснюється реакція. Таким чином, ∆Q залежить від типу реакції, умов її протікання і температури Т, яка має на величину ∆Q найбільший вплив.
Теплота
утворення компонентів палив та
їх продуктів
згоряння, яку
використовують
під
час
розрахунків
РРД,
відносять
зазвичай
до таких
умов: постійному тиску, рівному 0,0981
МПа
і до кімнатних температур (288…298
К).
У цьому випадку теплота утворення
дорівнює зміні повного тепловмісту
речовин, що беруть участь у реакції, і
позначається ∆НТ.
Нижній індекс «Т»
позначає
температуру, за
якої
отримана теплота утворення. Якщо теплоту
утворення речовини відносять
до того випадку, коли вихідні і кінцеві
речовини знаходяться у
стандартному стані за
температури
Т,
то до позначення додається верхній
індекс «0»,
а саму
теплоту
утворення
 називають
стандартною. Знайдемо зв'язок між
теплотою утворення і
хімічною енергією. Припустимо, що в
калориметрі на утворення речовини за
температури
Т
витрачено,
тобто підведено до системи речовин, або
виділилося, тобто
втрачено
самою системою речовин, кількість тепла
∆НТ.
Воно витрачене
на зміну хімічної енергії Iхім
речовини і на зміну запасу тепла ∆Q,
яке для прийнятих умов дорівнюватиме
називають
стандартною. Знайдемо зв'язок між
теплотою утворення і
хімічною енергією. Припустимо, що в
калориметрі на утворення речовини за
температури
Т
витрачено,
тобто підведено до системи речовин, або
виділилося, тобто
втрачено
самою системою речовин, кількість тепла
∆НТ.
Воно витрачене
на зміну хімічної енергії Iхім
речовини і на зміну запасу тепла ∆Q,
яке для прийнятих умов дорівнюватиме
 .
.
Отже,

або
 (2.13)
(2.13)
Якщо Т=0, то незалежно від величини різниці маємо ∆Q =0, а отже, Iхім = ∆Н0. Іншими словами, хімічна енергія речовини дорівнює її теплоті утворення за абсолютного нуля. Знак теплоти утворення і хімічної енергії визначають за таким правилом. Якщо система, що вступила в реакцію, втратила тепло і отже, нa відповідну величину у ній зменшився запас енергіі, то теплота утворення, а також хімічна енергія від’ємні. Таким чином, теплота утворення і хімічна енергія продуктів згоряння завжди від’ємні. Теплота утворення, а отже, і хімічна енергія таких речовин, як ОН, N0 або атомарні гази, позитивна, так як для утворення їх зі стандартних газів в молекулярнії формі необхідно витратити тепло.
Слід зазначити, що в деякій літературі, особливо в хімічній, знак теплоти утворення визначають з протилежних міркувань. Якщо на утворення даного продукту тепло витрачається, то теплота утворення його вважається відємною і, навпаки, якщо тепло виділяється, то теплота утворення вважається додатньою. Тому під час використання довідкових даних щодо теплоти утворення необхідно звертати увагу на те, в якому сенсі вживається її знак.
Величина теплоти утворення зазвичай наводиться в кДж/г-моль.
ЛЕКЦІЯ 8
