
285 Токсоплазмоз
Токсоплазмоз — паразитарная патология из группы прото-зойных зоонозов, вызываемая внутриклеточным паразитом Toxoplasma gondii, для которого характерна способность проникать практически во все ткани организма, следствием чего является полиорганность поражений и полиморфизм клинических проявлений.
Лат. — toxoplasmosis.
Англ. — toxoplasmosis.
Краткие исторические сведения. Первые сообщения о токсо-плазмозе были получены лишь в 1908 г., когда почти одновременно A.Splendore в Бразилии у кроликов и С. Nicolle и L. Manceaux в Северной Африке у грызунов гонди выделили этот паразит (они и дали ему название «Toxoplasma gondii»). Патогенность токсоплазм для человека была доказана несколько позже— в 1914 г. (A.Castellani, 1914).
В последующие годы постепенно накапливалась информация о характере поражений, вызываемых токсоплазмами в организме человека. В 1923 г. J. Janku впервые обнаружил токсоплазм у 11-месячного ребенка с врожденной патологией глаз, а в 1939 г. поступило сообщение о случае энцефаломиелита, при котором токсоплазмы были выделены из мозговой ткани (A. Wolf, D. Cowen, B.H. Paige).
Однако лишь в 1970 г. удалось изучить сложный жизненный цикл токсоплазм, протекающий со сменой хозяев.
Актуальность. Токсоплазмоз встречается повсеместно. Проведенные в различных странах исследования показали, что большинство взрослого населения инфицировано токсоплазмами, а в отдельных регионах зараженность почти поголовная.
Контролировать эту патологию сложно, так как распространение ее в природе происходит без участия человека — более чем у 300 видов млекопитающих и 60 видов птиц обнаружены токсоплазмы в организме.
Легкость заражения, хроническое течение делают токсоплазмоз весьма актуальным для человека. Протекать данная патология может как с тяжелыми полиорганными поражениями, так и латентно, но предсказать особенности дальнейшего развития процесса невозможно — это своего рода «мина замедленного действия». Особенно опасен токсоплазмоз для лиц с иммунодефицитом любого генеза, в организме которых в результате неконтролируемого размножения токсоплазм может развиться генерализованное поражение органов, что даже может стать причиной смерти.
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
286
Токсоплазмоз является серьезной проблемой для беременных, так как внутриутробное заражение может привести к гибели плода, дефектам его развития, рождению больного ребенка.
Этиология. Токсоплазмы относятся к классу споровиков (Spo-гохоа), отряду Coccidia. В организме человека они встречаются в виде трех основных форм:
трофозоиты—паразиты, свободно одиночно располагающиеся в тканях зараженного организма;
псевдоцисты — клетки зараженного организма, содержащие огромное количество быстро делящихся токсоплазм — maxu-зоитов;
цисты — группа медленно делящихся или покоящихся токсоплазм — брадизоитов, окруженных собственной общей оболочкой.
Трофозоиты имеют полулунную форму, размеры 2—4x4—7 мкм при внутриклеточном расположении; при расположении вне клетки они бывают несколько крупнее — длиной до 10 мкм.
Токсоплазма имеет довольно сложную внутреннюю структуру (рис. 17).
Располагающийся на переднем конце коноид, напоминающий присоску, способствует проникновению токсоплазмы в клетку. Помогает этому процессу и секрет, который вырабатывают органеллы, находящиеся у основания коноида. Одним из компонентов выделяемого секрета является гиалуронидаза. В клетку токсоплазмы проникают, совершая вращательные движения.
Внутри токсоплазмы имеются плотные гранулы, их содержимое освобождается в особые мелкие вакуоли, которые затем располагаются на поверхности паразита. Считают, что они функционируют как экскреторно- секреторные антигены (J.E. Smith, 1995).
Токсоплазмы весьма чувствительны к действию высоких температур (погибают через 10 мин при температуре 55 °С ), высушиванию, УФО. Быстро гибнут в 50 % растворе спирта, 1 % растворе фенола. Хорошо переносят низкие температуры: при температуре 4—5°С в молоке остаются жизнеспособными несколько суток, в донорской крови — до 30 сут, а при замораживании до — 70°С в физиологическом растворе с сывороткой и глицерином — в течение нескольких месяцев.
Отдельные штаммы токсоплазм различаются по степени вирулентности, хотя и сохраняют антигенную однородность. Менее вирулентные штаммы отличаются большей устойчивостью во внешней среде, при попадании в организм человека или животного они вызывают чаще субклинический процесс. Степень чувствительности животных к токсоплазмам неодинакова (например, заражение крыс
ТОКСОПЛАЗМОЗ
287
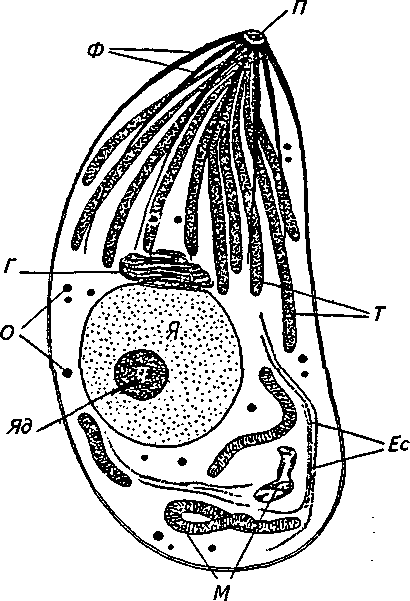
Рис. 17
Схема строения токсоплазмы — электронная микроскопия (из книги Л.К. Коровицкого с соавт. «Токсоплазмоз», 1966):
Я— ядро клетки; Яд — ядрышко; П— круглый полюс (наружная часть коноида); Ф— фибриллы (скелетная основа организма); Г— аппарат Гольджи (органоид, принимающий участие в секреторной функции клетки, синтезе гликопротеидов и полисахаридов, внутриклеточном переваривании); М— митохондрии (органоиды, содержащие ферменты системы переноса электронов и окислительного фосфорилирования, участвующие в генерации и аккумуляции энергии); Т— токсонемы (парные структуры секреторного типа); О— осмо-фильные включения; Ее — эндо-плазматические сеточки(органоид из системы канальцев, вакуолей и цистерн, обеспечивающий транспорт веществ в цитоплазме)
штаммами, высоковирулентными для мышей, может вызвать у них лишь незначительное повышение температуры).
Жизненный цикл токсоплазм сложен, он включает такие основные этапы развития:
шизогония (бесполый цикл, проходит в организме животных и птиц);
эндодиогония (внутриклеточное размножение в процессе шизогонии);
гаметогония (половой цикл, проходит только в организме представителей семейства кошачьих);
— спорогония (созревание, образование инвазивных форм). Токсоплазмы проникают в желудок, а затем кишечник человека
в виде ооцисты (зрелая форма, содержащая спорозоиты). В тонкой кишке под действием пищеварительных ферментов оболочка ооцист растворяется и освободившиеся спорозоиты проникают в эпителиальные клетки, где начинают быстро размножаться путем продольного деления. Уже через несколько часов протоплазма зараженной клетки заполняется огромным количеством (до 1000 и более) токсо-
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
288
плазм — тахизоитов, таким образом образуется псевдоциста. При разрушении (разрыве) клеточной оболочки псевдоцисты тахизоиты попадают в окружающую среду и внедряются в соседние клетки, совершая там очередной цикл развития. С током крови (чаще в фагоцитах, где происходит незавершенный фагоцитоз) они заносятся в другие органы, в клетках которых также происходит их активное размножение по той же схеме. Токсоплазмы могут поражать практически все клетки, кроме безъядерных эритроцитов.
По мере формирования иммунного ответа число циркулирующих свободных токсоплазм уменьшается, а затем они полностью исчезают из крови. Но это не означает освобождения организма от паразитов — они переходят к другой форме существования. В пораженной клетке резко замедляется процесс размножения токсоплазм (такие медленно делящиеся токсоплазмы называются брадизоитами). Бра-дизоиты образуют свою, более плотную оболочку, которая надежно защищает их от всех неблагоприятных воздействий, в том числе от медикаментозного, — формируется циста, имеющая сначала двух-контурную оболочку (она состоит из оболочки клетки, в которой находятся паразиты, и собственной). Постепенно оболочка клетки разрушается, и цисты, имеющие теперь лишь собственную оболочку, свободно лежат в ткани. Размеры цист бывают весьма значительными — до 200 мкм, каждая из них может содержать несколько тысяч паразитов. Циста в неактивном состоянии сохраняется годами, но при определенных условиях, приводящих к снижению реактивности организма, циста может разрушаться, а выходящие из нее трофозоиты, внедряясь в новые клетки, превращаются в тахизоиты. В результате их активного размножения во вновь инфицированных клетках наступает обострение процесса.
Цисты могут подвергаться обызвествлению, в таких случаях они уже не способны будут в дальнейшем вызывать рецидив болезни.
В одном и том же зараженном организме можно при определенных условиях одновременно обнаружить свободные трофозоиты, цисты, псевдоцисты.
Схематически бесполый цикл развития токсоплазм в организме человека и животных и обусловленные этим некоторые особенности патогенеза токсоплазмоза представлены на рис. 18.
Представители семейства кошачьих занимают особое место в цикле развития токсоплазм и распространения этих паразитов в природе, поскольку в их организме происходит как половой, так и бесполый цикл развития токсоплазм.
Бесполый цикл развития происходит аналогично таковому у других животных.
При половом цикле развития (гематогонии) в отдельных инфицированных клетках из внедрившихся в них паразитов формируются
ТОКСОПЛАЗМОЗ
289
Заражение
(в организм проникают
зрелые ооцисты, каждая из которых
содержит 4 спорозоита)
Т
Разрушение оболочки ооцист
V
Освобождение паразитов (спорозоитов)
I й
Внедрение паразитов в ближайшие ■<-клетки, размножение **
I
Формирование псевдоцисты с тахизоитами
Разрушение псевдоцисты
Постепенное уменьшение,
а затем
и полное
исчезновение
внеклеточных
паразитов
1,
J
Часть паразитов, внедряясь в клетку, формирует цисты, содержащие брадизоиты
Освобождение паразитов (тахизоитов)
t
Ларазиты разносятся по всему организму, оседая в различных органах
\
Клинические проявления болезни (или субклиническое течение активного процесса)
Стихание активности процесса
Действие провоцирующих факторов
Рис. 18
Схема шизогонии:
Разрушение цисты
Выход в окружающие ткани паразитов
19 — 2-3077
рецидив
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
290
мужские и женские половые клетки (гамонты). Мужские гамонты многократно делятся, образуя в конечном результате множество микрогамет. Из женской половой клетки формируется, созревая, лишь одна макрогамета. В результате слияния микро- и макрогаметы образуется незрелая ооциста, с фекалиями попадающая во внешнюю среду. Кошки начинают выделять ооцисты с фекалями во внешнюю среду уже на 3—4-й день после заражения, иногда несколько позже (на 15—20-й день). В почве, куда попадает ооциста, она созревает, при этом в ней образуются 2 спороцисты, каждая из которых содержит 2 спорозоита. Длительность созревания ооцист в почве зависит от внешних условий (температура, влажность), но обычно этот процесс длится не более 2—4 дней. Созревание прекращается при температуре ниже 4 °С и выше 37 °С.
Дальнейшее развитие паразита может пойти по типу шизогонии (если ооциста попадает в организм человека или животного) или гаметогонии и шизогонии одновременно, если заражается кошка (цикл развития в организме кошек представлен на рис. 19).
Ооцисты имеют овальную форму, диаметр 10—12 мкм, отличаются повышенной устойчивостью к действию различных неблагоприятных факторов. При комнатной температуре во влажной среде сохраняются год и более, меньше — в сухой среде (несколько месяцев). Больше, чем другие формы токсоплазм, устойчивы к действию дезинфицирующих растворов. Плохо переносят высушивание, замораживание (ниже — 20 °С) и нагревание (более 67 °С).
Размножение токсоплазм происходит только внутриклеточно — в цитоплазме зараженной клетки, поэтому для выделения токсоплазм обычно заражают либо культуры клеток, либо эмбрионы, либо лабораторных животных.
Хорошо окрашиваются различными красителями (эозин, метиле-новый синий). Но наиболее часто используют окраску по Романовскому—Гимзе. При этом протоплазма паразита окрашивается в голубой цвет, а ядро — в рубиново-красный.
Эпидемиология. Основной хозяин токсоплазм — представители семейства кошачьих. В наших условиях наибольшую роль в эпид-процессе играют кошки (домашние и бродячие). Заражение кошек может произойти при поедании инфицированного сырого мяса, содержащего цисты больных токсоплазмозом мышей и крыс, а также при поедании загрязненных выделениями кошек продуктов, содержащих ооцисты. Заразившиеся кошки могут в течение 1—3 нед выделять во внешнюю среду с фекалиями ооцисты, инфицируя объекты окружающей среды.
Проконтролировать процесс новых заражений кошек и, следовательно, очередного периода выделения ооцист практически не-
ТОКСОПЛАЗМОЗ
291
Заражение
Ооцисты, цисты
Разрушение оболочек клеток, содержащих паразиты
i
Инфицирование клеток ^эпителия тонкой кишки >
Бесполый цикл (шизогония, см. рис. 18)
Половой цикл (гаметогония)
Из внедрившихся паразитов формируются
Мужские гамонты |
|
Женские гамонты |
||||
1 |
' |
|
>' |
|||
Ми кро гаметы |
|
' |
|
Макрогаметы |
||
|
' |
1 |
|
|||
|
Сливаются |
|
||||
|
\ |
' |
|
|||
|
Ооцисты |
|
||||
|
|
1 |
1 |
|
|
|
Попадают во
внешнюю среду
с фекалиями
i
Созревают.
Каждая ооциста
содержит 4 спо-
розоита
Рис.19
Схема гаметогонии
19*
Такие ооцисты становятся инвазивными
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
2Q2
возможно, особенно если домашняя кошка ведет свободный образ жизни.
Заболевание у кошек может протекать как в бессимптомной форме (чаще), так и с тяжелым поражением нервной системы, лихорадкой.
Чувствительны к заражению, кроме человека, многие теплокровные животные (в том числе собаки, свиньи, лошади, крупный рогатый скот, овцы, козы), а также домашние и дикие птицы. Как и в организме человека, у них обнаруживают пролиферативные формы (трофо-зоиты), псевдоцисты и цисты. Контакт с больными животными (кроме кошек) опасности не представляет ни для человека, ни для других животных. Но мясо больных животных, недостаточно обработанное, при употреблении его в пищу может вызвать заболевание.
Человек заражается главным образом алиментарным путем. При этом возможны два варианта заражения:
при употреблении в пищу продуктов, на которых могут находиться зрелые ооцисты. Чаще всего это овощи, ягоды, растущие на почве, загрязненной фекалиями кошек. Ооцисты могут находиться в питьевой воде (описаны даже групповые вспышки заболевания, связанные именно с таким фактором передачи), на кошачьей шерсти, поэтому общение с таким животным без последующего тщательного мытья рук также может привести к заражению. Переносить на пищу ооцисты могут тараканы, мухи;
при употреблении в пищу плохо термически обработанных мяса и субпродуктов от зараженных домашних и диких животных, в органах и тканях которых имеются цисты и псевдоцисты. Есть отдельные сообщения о возможности заражения при употреблении в пищу сырого молока от животных с острой стадией болезни, но пока убедительных доказательств этому нет. Обнаруживали токсоплазмы в яйцах. Травоядные животные заражаются, поедая траву, на которой находятся ооцисты. В организм плотоядных животных, как и в организм человека, токсоплазмы попадают не только в виде ооцист, но и в виде цист, псевдоцист.
Таким образом, в природе постоянно происходит «обмен» различными формами токсоплазм между основным хозяином (представители семейства кошачьих) и промежуточным (теплокровные животные и птицы) — рис. 20.
Внутриутробное инфицирование плода (вертикальная передача) — второй возможный путь передачи инфекции. Следствием такого заражения может быть гибель плода, формирование различных дефектов развития и т.д. Но сейчас получены данные, что через неповрежденную плаценту токсоплазмы практически не проникают, К тому же наиболее опасен острый токсоплазмоз, возникающий у
ТОКСОПЛАЗМОЗ
293
Представители семейства кошачьих
Шизогония
Гаметогония
Поедание
зараженного
мяса
Образование цист в <*-различных органах
Внутриутробное -заражение
Выделение С загрязнен- ооцист с ной пищей
фекалиями
Шизогония
Теплокровные
животные и птицы
Рис. 20
Основные пути циркуляции токсоплазм в природе
беременных при первичном заражении. Повторные инфицирования и рецидивы значительно менее опасны у иммунокомпетентных женщин, поскольку и мать, и плод защищены имеющимися антителами, да и паразитемия у них не бывает такой интенсивной, как при первичном инфицировании.
Возможно заражение реципиента при переливании ему крови донора с нераспознанной, скрыто протекающей паразитемией, поскольку в цитратной крови, хранившейся при температуре 4 °С , токсоплазмы могут сохраняться до 1,5 мес.
Не меньшую опасность представляет пересадка органов и тканей (печень, сердце, костный мозг) от серопозитивных доноров сероне-гативным реципиентам. В ткани таких органов токсоплазмы могут находиться в цистах и псевдоцистах.
Описаны случаи лабораторного заражения сотрудников, работающих с культурами токсоплазм. В этих случаях не исключалась возможность заражения при прямом контакте с инфицированным материалом. Таким же путем могут заразиться люди, разделывающие туши зараженных животных (мясники, охотники).
Существует по этой же причине повышенный риск заражения некоторых категорий медицинских работников. Так, имеются данные, что зараженность медицинского персонала акушерских отделений примерно в 1,5—2 раза выше, чем даже хирургических, так как в
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
294
околоплодных водах инфицированных женщин содержится особенно большое количество токсоплазм.
Восприимчивость к токсоплазмозу всеобщая, различий, связанных с полом, генетическими особенностями, не выявлено.
Есть данные о том, что дети легче заражаются токсоплазмозом. Но, по-видимому, связано это с тем, что у детей больше возможностей для инфицирования (игра с животными, несоблюдение правил гигиены и т.д.) К тому же у них чаще, чем у взрослых, бывают манифестные формы.
Классификация. Единой общепринятой классификации токсоплазмоза нет. Пожалуй, единственное, на чем сходятся все, занимающиеся проблемой токсоплазмоза, что по способу заражения можно выделять такие формы токсоплазмоза:
приобретенный;
врожденный.
Врожденный и приобретенный токсоплазмоз по длительности заболевания может протекать как острый и хронический
Что же касается классификаций отдельных клинических форм, то их существует великое множество, нередко очень громоздких.
Очень удачной, на наш взгляд, терминологией пользовались R.E. McCabe и J.S. Remington (1985). Они выделяли:
— токсоплазмоз — как болезнь. В этом случае должны обязатель но быть какие-либо клинические признаки помимо выявляе мых специфических серологических реакций.
Болезнь может протекать:
остро;
хронически — в этом случае выделяют стадии: рецидива и ремиссии (латенции);
токсоплазмозную инфекцию (toxplasma gondii infection). О такой форме можно говорить, если появление специфических антител (сероконверсия) не сопровождается никакими клиническими проявлениями (это та форма, которая в некоторых классификациях рассматривается как первично-латентная). Но, вероятно, при протозойных заболеваниях будет логичнее термин не «инфекция», а «инвазия».
Токсоплазмозная инфекция может быть острой (при этом имеются четкие проявления первичной сероконверсии) и хронической. При хронической токсоплазмозной инфекции процесс может обостряться, но он обычно протекает субклинически, ничем не манифес-тируясь.
Таким образом, токсоплазмоз и токсоплазмозная инфекция имеют одинаковые этапы развития, но основные различия в том, что токсоплазмозная инфекция не имеет никаких клинических проявлений, появление их — показатель перехода в токсоплазмоз (по ана-
ТОКСОПЛАЗМОЗ
295
логии с ВИЧ-инфекцией и СПИДом, цитомегаловируснои болезнью и цитомегаловируснои латенцией и т.д.).
Мы приводим эту классификацию для того, чтобы ориентировать врача, который будет знакомиться с зарубежной литературой.
Пока же в нашей стране остается наиболее признанной классификация А.П.Казанцева (1985), в которой фигурирует единое название — токсоплазмоз. Но при обследовании больного практическому врачу вряд ли удается так тонко, как предусматривает эта классификация, детализировать все особенности течения токсоплазмоза, тем более, что такие попытки при дефиците диагностических возможностей нередко вносят путаницу в структуру диагноза. Поэтому представляем упрощенный вариант классификации.
С учетом длительности заболевания и выраженности клинических проявлений можно выделить такие формы токсоплазмоза:
острый (первичное заражение сопровождается развитием клинической симптоматики);
первично-латентный (первичное заражение проявляется только сероконверсией, клинические проявления отсутствуют);
—вторично-латентный (период ремиссии, следующий за острым токсоплазмозом);
первично-хронический (полисимптомная клиническая картина и наличие специфических антител выявляются у больных, у которых отсутствовали проявления острого токсоплазмоза, т.е. ему предшествовало первично-латентное течение); однако о достоверности такого диагноза приходится обычно говорить с большой осторожностью: клинические проявления острого токсоплазмоза могли быть оценены как проявление другого заболевания;
вторично-хронический (его возникновению предшествовал острый токсоплазмоз, документально подтвержденный; таким образом, это уже рецидив болезни);
Первично-хронический и вторично-хронический могут протекать с рецидивами и ремиссиями (латенцией).
Приведенную выше классификацию можно представить в виде схемы (рис. 21), которая облегчит понимание логической связи между отдельными формами.
В настоящее время как особый вариант течения болезни описывают токсоплазмоз у больных СПИДом и с иммунодефицитом другого генеза.
По тяжести течение токсоплазмоза бывает:
легкое;
средней тяжести;
тяжелое.
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
296
Врожденный Приобретенный
токсоплазмоз токсоплазмоз
Первично-латентный — --*-Острый »-Вторично-латентный
>'
"
Первично- -^ ^Вторично-
хронический \ / хронический
I 1
Обострения ч ^Ремиссии
Рис. 21
Клинические формы токсоплазмоза
В МКБ-10(1995) в основу классификации положен органный принцип. Так, выделяют:
токсоплазмозную окулопатию (токсоплазмозный хориорети-нит);
токсоплазмозный гепатит;
токсоплазмозный менингоэнцефалит;
легочный токсоплазмоз;
токсоплазмоз с поражением других органов (токсоплазмозный миокардит, миозит).
На наш взгляд, главным недостатком этой классификации, как и многих других статистических классификаций, является отсутствие информации о давности и активности процесса, а это — один из важнейших факторов, определяющих эффективность лечения и возможность вынашивания и рождения ребенка.
Поэтому при выявлении у больной (больного) токсоплазмоза диагноз лучше детализовать, дополнив статистические сведения информацией о давности и остроте процесса, что обеспечит преемственность в ведении таких пациентов.
Примерная формулировка диагноза. 1 .Острый токсоплазмоз, менингоэнцефалит (Т. gondii в ликворе), тяжелое течение.
2. Вторично-латентный хронический токсоплазмоз (IgM — отр., IgG — 1:200—1:200). Атрофия зрительного нерва правого глаза.
3. Первично-латентная токсоплазмозная инфекция (IgG — 1:200). Диагноз обязательно должен быть убедительно аргументирован
соответствующими лабораторными исследованиями.
Патогенез. Основной путь заражения— пероральный. Токсо-плазмы в тонкий кишечник поступают с загрязненной пищей, содержащей ооцисты.
ТОКСОПЛАЗМОЗ
297
При растворении оболочек ооцист пищеварительными ферментами освобождающиеся паразиты внедряются в клетки эпителия кишки, где происходит их активное размножение с образованием псевдоцист. При разрушении псевдоцист находившиеся в них тахи-зоиты внедряются в новые соседние клетки, распространяясь, таким образом, как круги по воде, затем — в мезентериальные лимфоузлы (следствие этого — отек и увеличение их), проникают в кровяное русло, лимфатические сосуды и разносятся по всему организму. Способствуют распространению (генерализации) инфекции свойства тахизоитов инвазировать все клетки, кроме эритроцитов, в том числе макрофаги, в которых происходит незавершенный фагоцитоз. Избирательную тропность токсоплазмы проявляют к нейронам головного мозга, миоцитам исчерченных мышц, сердечной мышце, структурам глаза, клеткам ретикуло-эндотелиальных органов. Таким образом, происходит активное размножение токсоплазм в различных органах.
Макрофаги оказываются неспособными ограничить и локализовать процесс — они сами становятся объектом агрессии. В результате в зоне внедрения и размножения токсоплазм формируются некротические очаги с лимфогистиоцитарной и плазмоклеточной инфильтрацией на периферии их (впоследствии такие некротические участки могут обызвествляться); довольно крупные очаги можно обнаружить при УЗИ и рентгенографии, но они неспецифичны (в отличие от обызвествленных цист). Могут возникать нарушение кровообращения в зоне поражения, отек тканей, а при значительной распространенности процесса — нарушение функции органа.
У иммунокомпетентных лиц первичное инфицирование может остаться клинически бессимптомным, что объясняется быстротой формирования защитных реакций.
Процесс размножения токсоплазм приостанавливается, а затем и полностью прекращается с появлением специфических антител (конец 1-й — начало 2-й недели). К этому же периоду появляются а-ин-терферон, ИЛ-2 и другие факторы, губительно действующие на токсоплазм. В результате из крови исчезают тахизоиты, а затем разрушаются и псевдоцисты вместе с содержащимися в них паразитами. Лизис инфицированных токсоплазмами клеток обеспечивают главным образом лимфоциты CD8 и CD4. Повышается и активность макрофагов, которые приобретают способность уничтожать проникшие в них тахизоиты. Уцелеют лишь те клетки, в которых паразиты успели сформировать собственную оболочку. В дальнейшем оболочка самой клетки разрушается, а сформировавшаяся циста оказывается надежно защищенной своей оболочкой.
Острый процесс стихает. Наступает стадия ремиссии (латенции). Сформировавшийся в острой фазе нестерильный иммунитет держит
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
298
под контролем дальнейший процесс. Он не защищает от возможного повторного инфицирования, но проникшие в организм токсоплазмы быстро уничтожаются, способствуя поддержанию напряженности иммунитета на достаточно высоком уровне.
Одновременно происходит сенсибилизация организма продуктами жизнедеятельности и гибели токсоплазм, что проявляется реакцией гиперчувствительности замедленного типа; она в последующем будет служить надежной пожизненной меткой инфицирования токсоплазмами (не болезни!).
Предсказать дальнейшее развитие событий невозможно. Токсоплазмы в «дремлющем» состоянии (брадизоиты) могут сохраняться неопределенно долго в цистах, иногда — пожизненно. Постепенно цисты обызвествляются, находящиеся в них брадизоиты погибают.
Но действие различных неблагоприятных факторов (интеркур-рентные заболевания, радиация, беременность, нарушение питания, нерациональная химиотерапия, в том числе попытки лечения латентной формы токсоплазмоза, и т.д.) может сопровождаться угнетением функции Т- и В -лимфоцитов, активности макрофагов. Следствием этого бывает рецидив болезни — при этом выходящие из разрушающихся цист брадизоиты, внедряясь в новые клетки, приобретают свойства тахизоитов и начинают активно в них размножаться. Если процесс сопровождается клиническими проявлениями, то они характеризуются полиморфизмом симптомов, но прежде всего проявляются реакцией со стороны глаз, нервной системы, сердца, что обусловлено особой тропностью токсоплазм к этим тканям, большим количеством находящихся в них псевдоцист. К тому же сказывается предшествующая сенсибилизация.
Стихание процесса на фоне очередной активизации защитных реакций тоже не приводит к полному освобождению организма от паразитов, а лишь к очередной латенции.
С каждым новым рецидивом (если таковые возникают) увеличивается реальная возможность формирования грубых остаточных явлений в виде хориоретинита, атрофии зрительных нервов, диэнце-фального синдрома и др.
Свои особенности имеет развитие болезни у лиц с иммунодефицитом. Отсутствие иммунной защиты в результате резкого угнетения функции Т- и В-лимфоцитов приводит к неконтролируемому процессу размножения токсоплазм в организме, развитию генерализованного поражения органов. Процесс быстро прогрессирует и даже может стать причиной смерти больного.
Врожденный токсоплазмоз. Вероятность инфицирования плода определяется прежде всего периодом болезни у матери (острый, латентный, рецидив). При остром токсоплазмозе особой роли не играет выраженность клинических проявлений у матери, так как глав-
ТОКСОПЛАЗМОЗ
299
ное — отсутствие антител в ее крови и выраженная на этом фоне па-разитемия. Имеет значение и состояние плаценты: неповрежденная плацента — мощный защитный барьер против токсоплазм.
Риск рождения ребенка с врожденным токсоплазмозом от инфицированной иммунокомпетентной матери относительно невелик: при выявленной зараженности 20—30 % женщин заболеваемость детей составила б—7 на тысячу новорожденных (К.Н.Токаревич, 1979). Особенности клинических проявлений врожденного токсоплазмоза определяются периодом заражения плода.
Клиника. Приобретенный токсоплазмоз. Первичное инфицирование в подавляющем большинстве случаев (считают, что более чем в 95 %) протекает субклинически, проявляясь только сероконверсией (в таких случаях ставится диагноз первично-латентный токсоплазмоз). Но примерно у 10—20 % первично инфицированных при тщательном изучении анамнеза и внимательном осмотре можно выявить некоторые клинические признаки, которые в большинстве своем не являются строго специфичными, а поэтому нередко вводят врача в заблуждение, маскируя токсоплазмоз.
Наиболее частое проявление острого приобретенного токсоплазмоза — локализованный шейный лимфаденит. При этом у больного постепенно, обычно без выраженной интоксикации, на фоне нормальной температуры тела или субфебрилитета начинают увеличиваться шейные лимфатические узлы. Через несколько недель они могут достигать 2—2,5 см в диаметре. В большинстве случаев такие лимфатические узлы эластичны, не спаяны между собой, при пальпации практически безболезненны. В последующем они начинают уменьшаться в размерах; процесс этот (до полной нормализации) весьма длительный, может протекать несколько месяцев. Но возможно атипичное течение токсоплазмозного лимфаденита, когда лимфатические узлы становятся плотными, болезненными, могут спаиваться между собой и даже нагнаиваться.
Так как больших неудобств и боли увеличенные лимфатические узлы обычно не вызывают, больные чаще всего к врачу не обращаются.
Описаны случаи и более тяжелого течения острого токсоплазмоза— с высокой лихорадкой, интоксикацией, профузными потами, макуло-папулезной сыпью, болями в животе (на фоне увеличения мезентериальных лимфатических узлов), выраженным миозитом, увеличением печени и селезенки. В процесс могут вовлекаться нервная система (энцефалит, менингоэнцефалит), сердце (миокардит, перикардит). Таким образом, процесс развивается по типу диссеми-нированной болезни. Вероятность поражения отдельных органов, очередность появления разных симптомов — процесс индивидуальный и непредсказуемый.
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
300
Но такое течение у иммунокомпетентных лиц бывает очень редко. Поэтому больных с подобной клиникой следует тщательно обследовать для выяснения другой возможной отягощающей причины, прежде всего необходимо исключить скрытый иммунодефицит любого генеза.
В глазные клиники могут обращаться больные с признаками хори-оретинита (обычно односторонннего) — единственным проявлением острого приобретенного токсоплазмоза.
Иногда единственным проявлением острого токсоплазмоза может быть упорная высокая лихорадка. В этом случае только паразитоло-гические и серологические исследования помогут уточнить этиологию заболевания, проходящего иногда под диагнозом «длительная лихорадка неясного генеза».
Вторично-латентный токсоплазмоз, возникающий после острой фазы, не сопровождается признаками, характерными для активной фазы болезни. Некоторые резидуальные явления (увеличение лимфатических узлов при их медленном рассасывании и склерозировании, диэнцефальные нарушения и др.), выявляющиеся у больных, не дают оснований говорить об остроте процесса и назначать лечение.
Первично-хронический токсоплазмоз начинается обычно постепенно — с общего недомогания, слабости, снижения работоспособности, потливости, иногда— небольшого субфебрилитета, снижения аппетита, неопределенной боли в животе, сердцебиений, боли в области сердца, в мышцах и суставах.
Жалобы бывают столь обильны и красочны, что некоторые больные производят впечатление неврастеников или даже агровантов.
Однако при осмотре уже на ранних стадиях болезни можно выявить и объективные признаки болезни — генерализованную лим-фаденопатию, тахикардию, приглушенность сердечных тонов, нестабильность АД, болезненность мышц при пальпации. У женщин может возникать нарушение менструального цикла. Возможны дис-пептические явления, вздутие живота. Увеличиваются печень, селезенка. Очень частым, нередко ведущим симптомом бывает хориоре-тинит. Возможны приступы головных болей, а при прогрессирова-нии заболевания — возникновение эпилептиформных приступов, снижение интеллекта.
Таким образом, огромный полиморфизм клинических проявлений может привести больного к специалисту любого профиля. Но все же при первично-хроническом токсоплазмозе клиника может быть хотя и яркой, но с явным преобладанием признаков поражения какого-либо одного органа или системы.
Значительно более выражены полиорганность нарушений при вторично-хроническом токсоплазмозе.
Хронические формы протекают циклически, с рецидивами и
ТОКСОПЛАЗМОЗ
301
ремиссиями. Длительность ремиссий определяется характером повреждений органов, эффективностью проводимой в острый период терапии, состоянием реактивности организма, наличием и характером сопутствующей патологии. На течение процесса оказывает влияние и вирулентность штамма токсоплазм, вызвавших заболевание.
В период ремиссий состояние больных улучшается, многие патологические проявления стихают или даже полностью исчезают (в случае, если еще не сформировались стойкие морфологические дефекты в органах).
Очередной рецидив (обострение) болезни, спровоцированный любыми факторами, может протекать легко, с менее выраженной симптоматикой. Однако возможно не только возвращение всех ранее наблюдавшихся проявлений болезни, но и появление новых. К тому же постепенно формируются более отчетливые резидуальные явления, что делает клинику еще более «пестрой».
Токсоплазмоз у ВИЧ-инфицированных и у лиц с иммунодефицитом иного генеза протекает тяжело.
Первичное инфицирование токсоплазмами при ВИЧ-инфекции характеризуется генерализацией процесса с мультиорганными поражениями. Процесс может развиваться стремительно, с быстро прогрессирующим поражением нервной системы, сердца, гемоди-намическими нарушениями, дыхательной недостаточностью (для иммунокомпетентных больных поражение легких, дыхательная недостаточность не характерны). При развитии раннего токсоплазмоз-ного энцефалита в течение ближайших месяцев наступает смерть. Он может начинаться подостро — с неврологических нарушений (в большинстве случаев) или остро, внезапно, по типу острого нарушения мозгового кровообращения — с нарушения речи, гемипаре-зов. У больных рано появляются спутанность сознания, нервно-психические и двигательные нарушения, менингеальные знаки, а при прогрессировании процесса — эпилептиформные приступы, поражение черепных нервов. Если процесс затягивается, у некоторых больных появляются тремор, паркинсонизм, возможны деменция, тяжелые нервно-психические расстройства.
У ВИЧ-инфицированных гораздо чаще, чем у иммунокомпетентных больных, возникают поражения спинного мозга, проявляющиеся нарушением чувствительности, иногда — расстройством функции тазовых органов, двигательными расстройствами.
Поражение пищеварительного тракта проявляется периодической или постоянной болью в животе, вздутием кишечника, признаками секреторной недостаточности желудка, кишечника, поджелудочной железы. У некоторых больных развивается острый гепатит, снижается секреция антидиуретического гормона, что приводит к развитию несахарного диабета (diabetes insipidus).
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
302
Сердечная недостаточность проявляется тахикардией, падением АД. Эти явления могут прогрессировать настолько быстро, что у лечащего врача создается впечатление об инфекционно-токсическом шоке.
Поражение легких характеризуется одышкой, кашлем, может появляться жидкость в плевральной полости.
У ВИЧ-инфицированных возможно и развитие хориоретинита, но встречается он реже, чем у иммунокомпетентных больных. Основные проявления поражения глаз — боль в глазах, снижение остроты зрения. Поражение бывает одно- или двусторонним.
Чем больше выражена полиорганность поражений, чем быстрее прогрессирует энцефалит, тем быстрее наступает финал.
Токсоплазмоз может тяжело протекать и у лиц, которым проводилась иммуносупрессивная терапия при пересадке органов и тканей. У них также возможна генерализация процесса с полиорганными поражениями. Токсоплазмоз может стать причиной отторжения трансплантата.
Врожденный токсоплазмоз. Особенности течения определяются прежде всего сроками заражения плода.
Если заражение произошло в I триместре беременности, то велика угроза гибели плода, самопроизвольного аборта.
Если же плод все же выживает или инфицируется позже (II триместр), прежде всего поражается его нервная система— велика вероятность рождения ребенка с микроцефалией, гидроцефалией, эпилепсией, страбизмом и другими расстройствами, которые становятся заметными сразу же при рождении. Возможны и другие, самые разнообразные дефекты развития внутренних органов, конечностей и т.д. Инфицированный ребенок при рождении может и не иметь никаких клинических проявлений болезни — они стихают к моменту родов. Лишь при рентгенографии черепа иногда обнаруживают кальцификаты, расположенные в веществе мозга. В более поздние сроки нередко выявляется отставание такого ребенка в умственном и физическом развитии, у него нередко возникают эпилептические припадки, прогрессируют тяжелые поражения глаз, вплоть до атрофии зрительного нерва.
Заражение в более поздние сроки (III триместр) приводит к развитию генерализованного процесса и рождению ребенка с острыми проявлениями токсоплазмоза — лихорадкой, распространенной сыпью различного характера (пятнистая, розеолезная и даже петехи-альная на фоне тромбоцитопении), генерализованной лимфаденопа-тией, гепатоспленомегалией с желтухой и без нее. У ребенка с первых дней жизни могут возникнуть стойкая диарея, специфическая токсоплазмозная пневмония, анемия. Часто бывает хориоретинит, иногда обнаруживают атрофию зрительного нерва. Беспокойство
ТОКСОПЛАЗМОЗ
303
паи резкая заторможенность могут быть проявлениями энцефалита. Возможны судороги, парезы и параличи. Без лечения большинство таких детей погибают в первые недели или даже дни жизни.
Инфицированный в различные сроки беременности ребенок может родиться без признаков токсоплазмоза, практически здоровым (первично-латентная форма). Однако в дальнейшем, через несколько лет, у него токсоплазмоз может проявиться в первично-хронической форме, течение которой возможно самое различное — от поздно (в 5—8 лет) проявившегося хориоретинита или прогрессирующего слабоумия до генерализованных форм с полиорганными поражениями (они проявляются в более ранние сроки).
Но возможны и такие случаи, когда внутриутробное инфицирование ребенка распознается лишь по наличию внутричерепных каль-цификатов и положительных серологических реакций с токсоплаз-мозными диагностикумами.
Осложнения. Полиорганность поражений определяет и возможное появление множественных осложнений.
Наиболее тяжелые осложнения формируются при длительном течении токсоплазмоза с частыми рецидивами (клинически выраженными или даже субклиническими). У таких больных нередко формируются выраженный стойкий астеновегетативный синдром, миокардиодистрофия, выявляются прогрессирующее снижение интеллекта (вплоть до слабоумия), стойкие психоневрологические расстройства, эпилептиформные приступы. Токсоплазмоз может привести к слепоте за счет атрофии зрительного нерва.
У женщин токсоплазмоз может стать причиной нарушения менструального цикла, невынашивания беременности.
Исходы. Острый приобретенный токсоплазмоз у иммунокомпе-тентных лиц протекает как самолимитирующаяся инфекция, болезнь в подавляющем большинстве случаев даже без лечения переходит в стадию латенции. Но непредсказуемость дальнейшего течения процесса не позволяет, несмотря на это, делать оптимистические прогнозы. Постепенно формирующиеся в результате рецидивов, даже протекающих субклинически, резидуальные явления могут стать причиной инвалидизации.
Токсоплазмоз входит в число СПИД-индикаторных заболеваний (см. том 2) и может быть одной из непосредственных причин смерти.
У детей с врожденным токсоплазмозом, родившихся даже без выраженной физической патологии, велик риск прогрессирования заболевания в дальнейшем со снижением остроты зрения (особенностью врожденного токсоплазмоза является двусторонний процесс), интеллекта.
Методы диагностики. Общеклинические методы исследования. Общий анализ крови. В период латенции изменений нет. При ост-
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
304
ром токсоплазмозе и в периоды обострений количество лейкоцитов остается нормальным или бывает несколько сниженным (лейкопения), увеличено число лимфоцитов и моноцитов, могут появляться единичные мононуклеары (но не более 1—3%). СОЭ нормальная или несколько увеличена.
Анализ мочи без особенностей.
Спинномозговая жидкость при развитии токсоплазмозного энцефалита прозрачная, иногда ксантохромная, вытекает под повышенным давлением. Определяется незначительный лимфо- и моноци-тарный цитоз (до 100—120 клеток в 1 мл), слегка повышено содержание белка. У новорожденных с врожденным токсоплазмозом содержание белка может быть весьма значительным.
Биохимические методы исследования. Выбор их для обследования больных определяется периодом болезни и особенностями течения (желтуха, миокардит и т.д.). Но главное, что закономерно для всех форм токсоплазмоза, — отрицательные острофазовые реакции, это помогает в дифференциальной диагностике с гнойно-септическими процессами.
Иммунологические тесты помогают уточнить остроту процесса: при остром токсоплазмозе и рецидивах изменяется соотношение CD4/CD8 (оно становится меньше 1). Но этот тест неспецифичный, он выявляется при всех заболеваниях, протекающих с иммунодефицитом.
Дополнительные методы обследования. Выбор их определяется характером поражений. Информативны радиологические методы (радиография, компьютерная томография, ультрасонография), позволяющие обнаружить косвенные признаки токсоплазмоза — каль-цификаты в мягких тканях и веществе мозга, которые могут быть одиночными и множественными, мелкими и достаточно крупными, видными невооруженным глазом. При врожденном токсоплазмозе у некоторых новорожденных определяют одно- или двустороннее расширение желудочков мозга.
Гистологические исследования могут оказать существенную помощь не только в верификации диагноза, но и при уточнении степени активности процесса. Исследовать можно мышечную ткань, лимфатические узлы, при необходимости — биоптаты мозга, пунктаты костного мозга. При свежем токсоплазмозе выявляют очаги некроза с лимфоцитарной и плазмоклеточной инфильтрацией по периферии очагов.
При наличии хориоретинита целесообразно обследование у окулиста. Хориоретинит чаще встречается при врожденном токсоплазмозе, чем при приобретенном. При поражении зрительного (желтого) пятна развивается потеря центрального зрения. Визуально острое поражение определяется в виде напоминающих вату желтова-
ТОКСОПЛАЗМОЗ
305
то-белых пятен, окруженных зоной гиперемии. Старые поражения (единичные или множественные) имеют вид четко очерченных ат-рофических сероватых бляшек и темных пятен пигмента. В стекловидном теле определяется воспалительный экссудат, затрудняющий исследование глазного дна. Воспаление диска зрительного нерва (папиллит) может приводить к его последующей атрофии.
Специфическая диагностика. Паразитоскопия. При остром токсо-плазмозе тахизоиты могут быть обнаружены в биологических жидкостях — крови, асцитической, плевральной, а при наличии токсо-плазмозного энцефалита — в спинномозговой жидкости. Исследуют полученный после центрифугирования осадок, окрашенный по методу Романовского—Гимзы, при этом среди форменных элементов крови бывают хорошо видны крупные полулунной формы токсо-плазмы (рис. 22).
Паразитоскопическому методу исследования подлежит и биоп-сийный материал. Облегчает обнаружение паразитов в биоптатах метод пероксидазно-антипероксидазной иммуногистохимической окраски и прямая и непрямая РФА.
Значительно более надежный метод — выделение культуры ток-соплазм. Исследуемый материал (биологические жидкости, биопта-ты и пунктаты тканей) вводят в тканевые культуры (7—8-дневные

Рис. 22
Toxoplasma gondii. Мазок крови (по А.И. Коротяеву и С.А. Бабичеву, 1998)
20 ~ 2-3077
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ 306
куриные эмбрионы). При наличии токсоплазм в тканевых культурах появляются белесоватые бляшки; зараженные клетки и отдельные тахизоиты обнаруживаются при специальном окрашивании (на 3— 6-й день).
Надежнее выделение токсоплазм путем заражения животных. При внутрибрюшинном введении их новорожденным мышам (5—7 дней) через 6—10 сут наступает их смерть. В асцитической жидкости погибших животных обнаруживают в большом количестве токсо-плазмы. Целесообразно проводить исследования параллельно на нескольких животных, так как не все они погибают, некоторые могут выжить за счет образования у них защитных антител (рекомендуется проверить, имеются ли эти антитела).
Для выявления специфической сенсибилизации к токсоплазмозу ставится внутрикожная проба с токсоплазмином (проба становится положительной через 4—6 нед после заражения и считается положительной, если на месте введения 0,1 мл токсоплазмина появляется гиперемия и инфильтрат не менее 10 мм в диаметре). Специфическая сенсибилизация сохраняется пожизненно, пожизненно положительной будет и проба. Однако снижают ее ценность возможность ложно положительных реакций при других заболеваниях (туберкулез, сифилис и др.) и ложноотрицательных — при иммунодефици-тах.
Наиболее широкое распространение получили серологические методы исследования.
В настоящее время существует множество различных серологических методов, позволяющих верифицировать диагноз. Но при этом вступает в действие правило: чем больше методов предлагается для диагностики заболевания, тем менее надежен каждый из них.
Существующие методы можно разделить на несколько групп в зависимости от того, какие маркеры они определяют.
В крови инфицированных уже к концу 1-й недели после заражения можно обнаружить противотоксоплазменные антитела класса IgM. Количество этих антител достигает своего пика через 3—4 нед, затем начинает снижаться, а через несколько месяцев они исчезают. Таким образом, это белки острой фазы. Но иногда появление антител класса IgM запаздывает (а у больных с иммунодефицитом они могут вообще не выявляться), иногда же такие антитела в достаточно высоких концентрациях могут персистировать год и более. Таким образом, безоговорочно ориентироваться на IgM при постановке диагноза не следует. Наиболее часто их выявляют с помощью РНИФ и ELISA. Снижает диагностическую ценность методов то, что их результаты могут быть ложноположительными при наличии в крови больного ревматоидного фактора и противонуклеарных антител. IgM могут отсутствовать при наличии изолированного токсоплаз-
ТОКСОПЛАЗМОЗ
307
мозного хориоретинита, a IgG при этом определяются обычно в невысоких титрах — 1:8 — 1:16. Для суждения об остроте процесса только уровень анти-IgM существенной роли не играет, к тому же отсутствует корреляция между выраженностью этого процесса и уровнем антител. Ценным показателем острого токсоплазмоза является сероконверсия — появление IgM у прежде серонегативного пациента или нарастание титров антител этого класса при исследовании в динамике (с интервалом в 3 нед) не менее чем в 2 раза.
Антитела класса IgG появляются несколько позднее (через 1 — 2 нед), через 6—8 нед концентрация их достигает максимума, а затем постепенно снижается. В последующие годы они выявляются пожизненно, иногда в высоких титрах, и таким образом могут свидетельствовать лишь о том, что обследуемый был инфицирован токсо-плазмами, но судить о давности и остроте процесса не позволяют.
Кроме РНИФ, ELISA хорошо зарекомендовали себя реакция Сэ-бина—Фельдмана (высокоспецифичная и высокочувствительная реакция, однако широкое ее применение ограничено прежде всего техническими сложностями), РА. Но при постановке и этих реакций возможны ложноположительные и ложноотрицательные (редко) результаты. Считается, что отсутствие IgG ставит под сомнение наличие токсоплазмоза у больного. У больных с ВИЧ-инфекцией титры антител могут быть очень низкими.
В последние годы в качестве дополнительных методов, используемых для подтверждения диагноза, применяют методики, позволяющие определять специфические антитела классов IgA и IgE.
Определение антител класса IgA против токсоплазм методом ELISA особенно информативно при обследовании новорожденных для исключения врожденного токсоплазмоза (метод более чувствительный, чем определение IgM в пуповинной крови).
IgE выявляются более кратковременно, чем IgM, поэтому они надежнее для определения остроты процесса у взрослых, детей старшего возраста с врожденным токсоплазмозом и токсоплазмозным хориоретинитом.
Таким образом, к оценке лабораторных показателей, полученных при обследовании больных на токсоплазмоз, нужно подходить очень осторожно, так как диагноз определит характер лечебной тактики. При оценке полученных результатов следует учитывать такие факторы:
паразитологические находки даже в период наиболее выраженной паразитемии составляют не более 10—50 %;
при проведении паразитологических и серологических исследований очень важно четкое соблюдение всех технических правил. Существует множество факторов, которые могут влиять на результаты; обязательно следует учитывать степень ве-
20*
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
308
роятности получения ложноположительных и ложноотрица-тельных результатов в каждом случае;
— отсутствует четкая корреляция между уровнем специфических антител и выраженностью клинических симптомов;
—прежде чем окончательно сформулировать диагноз, необходимо повторить исследования с интервалом 3 нед. При этом следует использовать ту же тест-систему и ту же методику, что и первоначально, поскольку тесты отличаются по степени чувствительности к определенным антигенам. Даже условия, в которых производят исследования, могут оказывать существенное влияние на результат. Лучше параллельно ставить исследования с сыворотками, взятыми с интервалом 3 нед. Если возникают хоть малейшие сомнения в достоверности результатов, исследование необходимо повторить;
целесообразно не ограничиваться одной методикой, а использовать несколько, что позволит избежать ошибок (в некоторых странах существуют специальные рекомендации по созданию стандартных «панелей», куда входят 4—5 тестов);
должны быть унифицированные методики обследования пациентов, их оценка; спорные случаи должны решаться в рефе-ренс-лаборатории.
ПЦР — один из самых современных методов, позволяющий обнаруживать ДНК токсоплазм в крови, спинномозговой, асцитичес-кой жидкости, биоптатах. Она обладает 100% специфичностью, а вот сведения о ее чувствительности различаются весьма существенно (11—77%). В значительной мере это определяется клинической формой токсоплазмоза, материалом, который берется для исследования.
Таким образом, в настоящее время бесспорным доказательством диагноза «острый токсоплазмоз» могут считаться :
обнаружение паразитов (тахизоитов) в биологических жидкостях и тканях;
выявление ДНК токсоплазм.
Серологические, гистологические, иммунологические, радиологические методы в определенных вариантах и сочетаниях могут подтверждать диагноз (при грамотной осторожной их интерпретации), но не все и не при всех условиях могут давать информацию об остроте процесса.
Существуют некоторые различия при оценке полученных при обследовании больных данных у таких категорий больных:
иммунокомпетентные;
больные с иммунодефицитом (прежде всего ВИЧ-инфицированные);
с врожденным токсоплазмозом;
ТОКСОПЛАЗМОЗ
309
— беременные.
Часто выделяют еще одну категорию — больные с токсоплазмоз-ным хориоретинитом. Изолированный хориоретинит встречается крайне редко, обычно он сочетается с другими проявлениями токсо-плазмоза. Но все же такие формы описываются и, как правило, этиология их остается неуточненной, поскольку специфические антитела класса IgM обычно не обнаруживаются, a IgG могут определяться в очень низких концентрациях. При постановке диагноза для верификации остроты процесса у таких больных наибольшее значение приобретает выявление вирусной ДНК методом ПЦР в жидкости передней камеры глаза.
Токсоплазмоз можно выявить у плода еще в пренатальный период при исследовании амниотической жидкости (обнаруживается ДНК токсоплазм). Метод обладает очень высокой чувствительностью. Но при этом необходимо очень тщательно изучать целесообразность осуществления такой небезопасной процедуры — она имеет свои оптимальные сроки проведения, как и особенности оценки серологических реакций в различные сроки (все это должно быть изложено подробно в соответствующих инструкциях женских консультаций и гинекологических стационаров).
Очень ответственный этап — подтверждение или исключение токсоплазмоза у беременных, определение степени активности процесса, поскольку от этого зависит вероятность инфицирования плода и тактика дальнейшего ведения беременности.
Очень важно, чтобы женщина обратилась в женскую консультацию как можно раньше — это позволит грамотно провести ее обследование. Особого внимания и наблюдения заслуживают сероне-гативные женщины: сероконверсия у них в любые сроки беременности чревата большой вероятностью заражения плода. Имеет значение и нарастание титров антител классов IgM и IgG более чем в 2 раза. В тех случаях, когда первое исследование проведено поздно, высокие титры антител, образовавшихся к этому времени, уже могут иметь тенденцию к стабилизации или даже снижению, а это не позволит определить сроки заражения беременной и степень риска для плода.
Безусловно, мы привели здесь лишь самые общие принципы, касающиеся как верификации самого диагноза «токсоплазмоз», так и определения периода болезни, что очень важно для выбора врачебной тактики по отношению к пациенту.
Обоснование диагноза. Об остром токсоплазмозе можно думать при наличии таких признаков:
постепенное начало (преимущественно);
нередко — лихорадка (чаще субфебрильная);
лимфаденопатия (преимущественно бывают увеличены шей-
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ 310
ные лимфатические узлы), хотя возможна и генерализованная лимфаденопатия;
полиморфизм жалоб (часто);
явления хориоретинита (одно из наиболее частых, но не абсолютно обязательных проявлений);
отсутствие эффекта от применения антибактериальных средств;
— нормоцитоз или лейкопения с лимфо- и моноцитозом.
Указание на общение с кошкой — важный, но вовсе не обязательный элемент при обосновании диагноза. Таким образом, в большинстве случаев отсутствуют клинические специфические проявления у больного, которые позволили бы говорить о токсоплазмозе с высокой степенью вероятности. Тем большее значение приобретают внимательное отношение к жалобам больного, стремление выяснить их причины.
Диагноз подтверждают выявление тахизоитов или ДНК токсо-плазм в исследуемом материале, сероконверсия.
Еще труднее без специфических исследований бывает обосновать диагноз «хронический токсоплазмозе, поскольку полиорган-ность поражений при отсутствии лихорадочной реакции или при незначительной ее выраженности, очень постепенное начало могут привести больного к врачу любой специальности. Поэтому следует учитывать и такие особенности болезни:
— генерализованная лимфаденопатия;
прогрессирующее снижение зрения, характерные изменения в структуре глаз (при хориоретините);
увеличение печени и селезенки (часто);
наличие кальцификатов во внутримозговых и мягких тканях;
полиорганность поражений, выявляемых на фоне полиморфных жалоб;
отсутствие выраженных гематологических изменений, несмотря на длительность течения;
уменьшение соотношения CD4/CD8 лимфоцитов.
Следует помнить и о возможности изолированного поражения органа (токсоплазмозный миокардит, хориоретинит), что, безусловно, затрудняет этиологическую расшифровку такой патологии. Серологические реакции в данных случаях бывают малоинформативны. Они помогают иногда подтвердить наличие инфекции, но не указывают на степень ее активности.
Для врожденного токсоплазмоза с ранними сроками инфицирования характерна триада:
гидроцефалия;
хориоретинит;
внутримозговые кальцификаты.
ТОКСОПЛАЗМОЗ
311
Достоверным подтверждением внутриутробного заражения является наличие противотоксоплазмозных IgM у плода, так как материнские IgM через плаценту не проходят. Но при очень ранних сроках заражения у новорожденного могут отсутствовать IgM, их наличие — чаще свидетельство заражения в более поздние сроки.
Еще раз стоит обратить внимание на необходимость очень деликатного отношения к интерпретации клинических и особенно лабораторных показателей, полученных при обследовании больных в различные периоды болезни.
Дифференциальный диагноз. Практически невозможно представить все варианты течения токсоплазмоза, а следовательно, объем дифференциально-диагностических мероприятий, которые необходимо провести врачу, — он будет строго индивидуальным и, к сожалению, нередко весьма громоздким.
Острый токсоплазмоз может давать клинику очень многих инфекционных заболеваний — инфекционного мононуклеоза, тифа (брюшного и сыпного), энцефалитов различного генеза, вирусного гепатита, сепсиса и др. Но все-таки наиболее постоянным признаком острого токсоплазмоза бывает лимфа денопатия, что позволит несколько сузить рамки дифференциально-диагностических исследований.
В первую очередь необходимо будет исключить инфекционный мононуклеоз, цитомегалию, туберкулез, туляремию, фелиноз, а также такие заболевания, как острый лейкоз, саркоидоз, лимфогранулематоз. Во всех случаях при проведении дифференциального диагноза учитываются также характер органных поражений, эффективность специфической терапии и лабораторные показатели; для уточнения диагноза может понадобиться биопсия увеличенного лимфатического узла.
В тех случаях, когда ведущим в клинике является поражение нервной системы, дифференциальный диагноз проводят с менингоэнце-фалитами другой этиологии — вирусными, бактериальными (в первую очередь туберкулезным), органическими поражениями ЦНС (опухоль, кровоизлияния). При этом особое внимание обращают на наличие или отсутствие полиорганных поражений, столь характерных для токсоплазмоза, признаков хориоретинита, особенности изменений в ликворе.
Хориоретиниты токсоплазмозной природы приходится дифференцировать от поражений глаз цитомегаловирусной, герпетической, сифилитической природы, а также от поражений, вызванных гнойной инфекцией. В диагностике могут помочь достаточно характерные изменения в структуре глаза; иногда возникает необходимость в паразитоскопическом исследовании жидкости передней камеры глаза. Однако следует помнить, что серологические реакции
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ
312
могут оказаться малоинформативными при изолированном токсо-плазмозном хориоретините.
Сходные по характеру поражения плода могут возникать при ток-соплазмозе, цитомегалии, краснухе, герпетической инфекции, сифилисе, листериозе. Сложность дифференциации заключается и в том, что возбудители TORCH-синдрома при краснухе, цитомегалии, герпетической инфекции, как и токсоплазмоза, могут обусловить развитие хориоретинита, а краснуха и цитомегалия — сопровождаться к тому же появлением кальцификатов в веществе мозга.
Еще сложнее бывает дифференциальный диагноз при наличии патологии у лиц с иммунодефицитом, так как у них возможно одновременное инфицирование двумя и даже более возбудителями, вызывающими сходную клиническую симптоматику (например, ток-соплазмами и цитомегаловирусами или обострение герпетической инфекции на фоне токсоплазмоза и т.д.). В этих случаях необходимо уточнить степень активности процесса, вызываемого каждым из возбудителей.
Лечение. Больной токсоплазмозом может быть госпитализирован в любое отделение, так как при обычном общении опасности для окружающих он не представляет. Тем не менее, осторожность следует соблюдать медицинским работникам, прежде всего персоналу акушерских и гинекологических стационаров при проведении манипуляций женщинам с острым токсоплазмозом.
Лечению подлежат больные с острым токсоплазмозом и хроническим в стадии обострения, т.е. те, у кого имеются тахизоиты в органах и крови. Псевдоцисты и цисты резистентны к медикаментам.
Этиотропная терапия. Лечение больных лучше проводить в стационаре, поскольку противопаразитарные средства, применяемые для лечения токсоплазмоза, обладают широким спектром токсического действия. Поэтому необходимо контролировать не менее 2—3 раз в неделю гематологические показатели, делать анализы мочи, учитывая нефротоксичность многих препаратов, а также способность сульфаниламидов вызывать кристаллурию. Возможны общетоксические (тошнота, рвота) и аллергические реакции. Врач, приступающий к лечению больного токсоплазмозом, должен еще раз, не надеясь на память, самым тщательным образом ознакомиться с прилагаемыми к препаратам инструкциями и схемами лечения, изучить анамнез своего пациента, провести детальное обследование (обязательно исследовать функцию печени и почек), чтобы выбрать оптимальную схему лечения, позволяющую свести риск возникновения осложнений к минимуму.
Универсальной общепризнанной схемы лечения токсоплазмоза нет. Выбор препаратов, их комбинации, дозы определяются многи-
ТОКСОПЛАЗМОЗ
313
ми условиями — наличием и степенью иммунодефицита, возрастом пациента, характером сопутствующей патологии и т.д. Но объединяет все схемы следующее:
основой их является пйриметамин (син.—хлоридин, тинду-рин, дараприм);
необходима комбинация 2—3 препаратов (одним из них обязательно должен быть пйриметамин); она будет гораздо эффективнее, чем монотерапия, но вероятность возникновения токсических реакций при этом увеличивается.
Пйриметамин тормозит размножение токсоплазм, губительно действует на тахизоиты, хорошо всасывается в пищеварительном тракте и медленно выводится из организма (период полувыведения составляет 4—5 дней). Концентрация в ликворе составляет 10—25 % от концентрации в сыворотке крови, что должно учитываться при лечении больных токсоплазмозным менингоэнцефалитом. Да и в крови концентрация препарата может значительно варьировать при одинаковой дозе, полученной разными больными.
Наиболее часто пйриметамин назначают в комбинации с сульфаниламидными препаратами (сульфадимезин, сульфадиазин), действующими синергично с пириметамином, увеличивающими проницаемость для него гематоэнцефалического барьера.
Схемы, применяемые в разных клиниках, отличаются длительностью, тактикой подбора препаратов — используются цикловые методы лечения, схемы со сменой препаратов (кроме пириметамина).
Нам кажется достаточно простой и удачной схема лечения, которую приводят J.G. Montoya, J.S. Remington (2000).
Комбинация пириметамина с сульфадиазином:
1-й день — ударная доза (пйриметамин—100—200 мг/сут в 2 приема, сульфадиазин — 75 мг / кг в сутки, эту дозу, делят на 4 приема; максимальная суточная доза — до 4—6 г);
в последующие дни доза пириметамина: при всех формах ток-соплазмоза для иммунокомпетентных — 25—50 мг/сут, для больных СПИДом — 50—75 мг/сут; доза сульфадиазина одинакова для всех — по 500 мг 4 раза в сутки. При назначении сульфаниламидов необходимо следить, чтобы больной пил достаточно жидкости с целью профилактики кристаллурии.
Длительность курса лечения (непрерывного) — 2—4 нед, при СПИДе — 4—6 нед.
Учитывая длительность периода полувыведения пириметамина (4—5 сут), есть предложения по назначению этого препарата с более длительными интервалами (2—4 дня).
Часто назначают комбинацию из 3 препаратов, добавляя одно из следующих средств — азитромицин, кларитромицин, тетрациклин, спирамицин и др. Механизм их действия, усиливающего антипара-
ЗАБОЛЕВАНИЯ С МНОЖЕСТВЕННЫМ МЕХАНИЗМОМ ПЕРЕДАЧИ 314
зитарное влияние двух основных, недостаточно изучен, но эффект отчетливый, хотя и возрастает вероятность возникновения токсических реакций. В отдельных случаях их используют как альтернативу сульфадиазину.
Лечение беременных женщин осуществляют дифференцированно, учитывая поставленную цель, а именно:
назначение медикаментов инфицированной матери с целью предотвращения передачи инфекции плоду;
назначение препаратов в условиях достоверной инфицированное™ плода.
В первом случае наиболее эффективным оказался спирамицин (3 г в сутки). Он не проходит через плаценту, поэтому безопасен для плода, но более чем на 60 % снижает риск передачи ему инфекции.
Во втором случае можно назначать комбинацию пириметамина (25 мг/сут) и сульфадиазина (4 г/сут). Такая терапия может быть альтернативной, если в силу каких-либо причин прервать беременность нельзя. Но следует учитывать, что пириметамин нельзя назначать первые 12—14 нед беременности, так как препарат обладает тератогенным действием; поэтому в таких случаях приходится ограничиваться одним сульфадиазином.
Патогенетическая терапия. Из патогенетических средств наиболее важное значение имеет фолиевая кислота, способная частично нейтрализовать неблагоприятное действие пириметамина на костный мозг, ее назначают вместе с пириметамином внутрь после еды 2—3 раза в день.
Неоднозначно отношение к глюкокортикоидам. Безусловно, они уменьшают выраженность аллергических реакций, но они же, являясь иммунодепрессантами, могут способствовать более активной репликации токсоплазм. Существует прямо противоположная позиция — назначать при токсоплазмозе одновременно с антипаразитарными средствами у-интерферон — медиатор формирования резистентности организма против токсоплазм. Особенно эффективно его действие при сочетании с антибактериальными препаратами (азит-рамицин, клиндамицин и др.). Сочетанное же назначение преднизо-лона и у-интерферона нецелесообразно, учитывая их антагонистическое действие.
Спорной является и целесообразность включения в схему лечения вакцинотерапии (токсоплазмином) при хроническом токсоплазмозе, УФО-облучения.
Необходимость применения других препаратов определяется особенностями течения болезни. Дополнительная нагрузка — витамины (кроме фолиевой кислоты), антиоксиданты и другие препараты — может оказаться обременительной для больных.
ТОКСОПЛАЗМОЗ
315
Профилактика. Общая профилактика заключается в создании необходимых условий содержания домашних кошек, соблюдении правил личной гигиены при общении с ними. Обязательно тщательно промывать овощи, употребляемые в пищу сырыми, не выпускать кошек туда, где растут ягоды и овощи, которые могут быть загрязнены их выделениями. Не пробовать сырой мясной фарш; мясо при приготовлении доводить до полной готовности. Необходимо хозяйкам иметь отдельные доски для разделки сырого мяса и готовых блюд. Особую осторожность при разделке сырого мяса следует соблюдать охотникам, работникам мясокомбинатов. Помнить о возможности профессионального заражения сотрудников медучреждений, работающих с больными токсоплазмозом.
Необходимо избегать пересадки органов и тканей от серопози-тивных доноров серонегативным реципиентам. В тех случаях, если это все же произошло, рекомендуется профилактическое лечение реципиентов — после трансплантации в течение б нед они должны получать пириметамин.
Профилактика врожденного токсоплазмоза — это прежде всего предотвращение возможности инфицирования женщины перед зачатием или во время беременности. Вопрос о прерывании беременности может ставиться при доказанной инфицированности женщин в эти сроки.
Специфическая профилактика не разработана.
Критические состояния в клинике инфекционных
болезней
■Lb рактическому врачу приходится нередко встречаться с ситуациями, когда от его оперативности, умения своевременно сориентироваться в возникших критических обстоятельствах зависит жизнь больного. Часто в первые минуты врач может рассчитывать главным образом на интуицию, свой профессиональный опыт и опираться на стандартные схемы лечения, традиционно применяющиеся в таких ситуациях. В дальнейшем, когда самые неотложные меры осуществлены, врач имеет возможность скорректировать лечебную тактику, использовав дополнительные диагностические методы, позволяющие оценить характер и тяжесть возникших нарушений, уточнить патологические механизмы, участвующие в их развитии.
У больных с инфекционной патологией спектр внезапно возникающих и быстро прогрессирующих критических состояний чрезвычайно велик: шок (гиповолемический, анафилактический, ИТШ), острая недостаточность почечная (преренальная и ренальная), печеночная, сердечная, ДВС-синдром и др. Возможна комбинация синдромов таких критических состояний, что значительно затрудняет их распознавание и коррекцию (острая почечная недостаточность и ДВС-синдром при лептоспирозе; преренальная, а позднее и ренальная недостаточность на фоне дегидратационного шока при холере; острая сердечная и дыхательная недостаточность при дифтерии; острая почечная недостаточность и мозговая кома при тропической малярии; острая надпочечниковая недостаточность на фоне ИТШ и ДВС-синдрома при менингококцемии; ДВС-синдром и острая печеночная недостаточность при фульминантных формах ВГ и т.д.). Критические состояния могут быть спровоцированы нерациональной или даже ошибочной терапией (отек легких и мозга на фоне излишне интенсивной инфузионной терапии, особенно проводимой
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 317
без учета функционального состояния почек; развитие ИТШ у больных сепсисом на фоне введения бактерицидно действующих препаратов; почечная недостаточность при лечении тяжелой тропической малярии хинином; желудочные кровотечения с последующим развитием геморрагического шока на фоне приема салицилатов, кор-тикостероидов; анафилактический шок при несоблюдении правил введения препаратов, обладающих аллергогенными свойствами, и т. д.). Противопоказаны адреналин для стабилизации давления при гиповолемическом шоке, полиглюкин — при отеке легких (усиление отека), желчегонные средства — при ВГ в разгар болезни (усиление желтухи) и т.д.
В данном разделе приводится информация о наиболее часто возникающих у больных с инфекционной патологией нарушениях, которые можно отнести к числу критических, требующих неотложной квалифицированной врачебной помощи, об основных патогенетических механизмах, участвующих в их развитии. Это, как мы полагаем, позволит врачу легче сориентироваться в возникшей ситуации, быстрее и увереннее действовать при выборе лечебной тактики в конкретном случае с учетом патогенеза основного заболевания, на фоне которого возникли грубые нарушения, требующие немедленной коррекции, и не усугублять при этом тяжести течения основного заболевания. Терапия возникших нарушений, особенно при их комбинации, и основного заболевания не должна быть взаимоотя-гощающей.
К встрече с весьма нежелательными, но вероятными осложнениями течения болезни или лечения должен быть готов любой врач, так как времени на размышления, обращение к справочной литературе нередко не остается. Надеемся, что наши рекомендации и советы, проверенные на практике, будут полезны коллегам.
Хотелось бы обратить внимание на особенности интерпретации клинических и лабораторных показателей при оценке тяжести возникших нарушений, эффективности проведенных мероприятий. И если в отношении трактовки клинических проявлений особых противоречий в литературе нет, то могут возникать определенные сложности при изучении результатов лабораторных исследований. Дело в том, что не всегда их можно сравнивать с привычными стандартами, с приведенными в учебниках и руководствах нормами. Полученные результаты могут зависеть от особенностей используемой лабораторной техники, реактивов, методик, условий, в которых проводились исследования, и т.д. Чтобы избежать возможных ошибок при сопоставлении результатов, полученных при обследовании больного в динамике, целесообразно соблюдать ряд правил:
— все исследования необходимо проводить в одной и той же лаборатории в течение всего периода наблюдения за больным;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
318
в процессе наблюдения пользоваться одними и теми же лабораторной техникой, методикой, реактивами;
необходимо ознакомиться с нормами лабораторных показателей для используемых аппаратуры и методик исследования (например, существуют различия в показателях активности АлАТ при использовании кинетического и колориметрического методов, а также при исследовании неразведенных и разведенных сывороток).
В разделах, посвященных описанию отдельных критических состояний, приведены лабораторные показатели, которые позволяют наиболее полно оценить каждое из них, нормальные величины представлены в основном в системе СИ. Но характеризуют динамику этих показателей не абсолютные величины, а направленность изменений с учетом глубины и тяжести возникших нарушений:
Т — умеренное увеличение;
ft — значительное увеличение; ТТТ— резкое увеличение;
•I — умеренное снижение (уменьшение);
•li — значительное снижение; 4Д4,— резкое снижение.
Такая ориентация на направленность и степень изменений возникших нарушений, представленные в соответствующих разделах в таблицах, могут оказать врачу существенную помощь при оценке глубины и тяжести развившейся патологии. Если же выявляются несоответствия (отсутствует представленная в таблице корреляция м"ежду изменениями отдельных показателей), следует подумать о причине этого и прежде всего — о возможности дополнительных патогенетических механизмов, оказывающих влияние на течение патологического процесса.
шок
319
Шок
(общие понятия)
Понятие «шок» в медицинской литературе впервые появилось в работе F. Le Dran в 1743 г. для обозначения «состояния организма после проникновения в него снаряда (травматического повреждения)». J. Lyatta в 1795 г. употребил термин «шок» (от англ. shock — ударять) в клинической практике в том смысле, в котором он используется в настоящее время.
Однако до сих пор не существует общепринятого определения состояния, называемого шоком, что отражает недостаточность изучения всех аспектов этой проблемы на современном этапе развития медицины. R. Raven в 1952 г. писал: «Сложность явлений при состоянии шока нельзя ограничивать и вынуждать подчиняться одному лишь определению, и возможно, что никакой набор не в состоянии определить шок». A.L. Deloyers (1964) высказался так: «Шок легче распознать, чем описать, и легче описать, чем дать ему определение».
Шок является скорее собирательным понятием, которым пользуются клиницисты, когда характеризуют особые состояния жизненно важных функций организма, возникшие вследствие экстремального воздействия на него и проявляющиеся комплексом патологических процессов в виде синдрома полиорганной недостаточности. Удачным патогенетическим определением шока можно считать следующее «Шок — это состояние, при котором повсеместное длительное уменьшение тканевой перфузии приводит к генерализованному нарушению функции клеток» (Е. Braunwald, 1988). Для клинициста более приемлемо определение шока как «остро развивающегося, угрожающего жизни патологического процесса, обусловленного действием на организм сильного патологического раздражителя и характеризующегося тяжелыми нарушениями деятельности ЦНС, кровообращения, дыхания и обмена веществ» (с изм., БМЭ, 1984).
Неопределенность существует и в вопросе классификации видов шока. Большинство созданных до настоящего времени систематик грешат громоздкостью, неубедительностью предложенного критерия разделения, малоприменимы в клинической практике. Наиболее подходящей для клинических целей является классификация шоков Е. Braunwald, G.Williams (1987), согласно которой выделяют:
Гиповолемический шок.
Кардиогенный шок, причины:
инфаркт миокарда;
нарушения ритма (пароксизмальная тахикардия, фибрилляция, тяжелая брадикардия);
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
320
тяжелая застойная сердечная недостаточность с низким сердечным выбросом;
механические кардиальные факторы:
острая митральная или аортальная недостаточность;
разрыв межжелудочковой перегородки.
3. Шок из-за препятствий кровотоку, причины:
эмболия легочной артерии;
напряженный пневмоторакс;
тампонада сердца;
расслаивающая аневризма аорты;
внутрисердечные причины (шаровидный тромб клапана, мик-сома предсердия).
4. Нейропатический шок, причины:
медикаментозные нарушения (анестезия, терапия ганглиобло-каторами и другими гипотензивными средствами, интоксикация барбитуратами и др.);
повреждения спинного мозга;
ортостатическая гипотензия (первичная вегетативная недостаточность, периферические нарушения).
Инфекционно-токсический шок (спровоцированный грамотри-цательной септицемией или вызванный другими возбудителями).
Анафилактический шок.
Шок вследствие эндокринной недостаточности (аддисонова болезнь, микседема).
Шок в результате острой аноксии.
В основу этой классификации положено разделение шоков на группы с однотипным первичным пусковым фактором. В случае гиповолемического шока — это катастрофическое уменьшение ОЦК, вызванное различными причинами. При кардиогенном шоке пусковым фактором является тяжелое повреждение сердца, нарушение его работы. Шок из-за препятствий кровотоку связан с механическим препятствием движению крови в сосудистой системе, Нейропатический шок возникает в результате первичного генерализованного воздействия на нервную регуляцию сосудистого русла. В основе инфекционно-токсического шока лежит запредельное влияние на организм попавших в кровь токсинов и других факторов агрессии бактерий. Повсеместное разрушение лаброцитов (тучных клеток) и выход в кровь большого количества биологически активных медиаторов является причиной анафилактического шока Серьезное нарушение работы эндокринных органов может тоже привести к развитию своеобразного шока. И наконец, в генезе анок-сического шока основная роль принадлежит причинам, приводящим к первичному фатальному нарушению газообмена.
В последние десятилетия широко дискутировались вопросы как
шок
321
терминологии, так и клинико-лабораторных критериев стадий шока. Так, довольно распространенная классификация стадий шока Е. Mares и I. Suteu (1956) различает следующие этапы его развития:
1-я стадия — компенсированного шока (кортикального возбуждения);
2-я стадия — декомпенсированного, но обратимого шока (кортикального торможения);
3-я стадия — декомпенсированного, необратимого шока (терминального шока).
Однако стадийные термины «компенсированный» и «декомпен-сированный» на современном этапе понимания сущности шока стали не только неточными, но и даже опасными заблуждениями, так как слишком тесно связаны с количественными значениями АД и пульса, диагностическое значение которых минимально. Ведь нередко эти клинические показатели, используемые в качестве критерия стадий шока, могут быть искажены вследствие выраженной лихорадки, вегетативных нарушений, свойственных многим болезням, особенно инфекционным. Тенденция к необратимости процесса появляется уже в начальный период шока, поэтому само понятие «компенсированный шок» обманчиво и опасно.
Этап необратимости обозначает тот момент в процессе развития шока, когда активация регулирующих систем не может улучшить состояние, а организм в целом является потенциально некурабель-ным, хотя как биологическая система еще существует. Вместе с тем, в клинике трудно установить момент перехода к необратимости, так как это состояние определяется на клеточном, субклиническом уровне. Поэтому клинически определяемая необратимость часто бывает ложной, потому что игнорируется факт наличия первичного поражения или заболевания, которое обусловило развитие шока. Об основном диагнозе и необходимости эффективного лечения пускового фактора, т.е. явившегося причиной развития шока и поддерживающего его прогрессирование и необратимость, часто забывают. Они отодвигаются на второй план, а в лечении отдается предпочтение воздействию на некий комплексный неспецифический синдром. Именно поэтому, вероятно, стоит отказаться от терминов «компенсированный шок» и «декомпенсированный шок», так как они акцентируют внимание на шоке лишь как на общей патофизиологической реакции. И хотя стадийный диагноз «необратимый шок» и может быть истинным, его целесообразно использовать в клинической практике исключительно лишь для возможного повышения интенсивности лечения, т.к. ошибка в определении терминальной стадии может стоить жизни больному. Гипотензия как симптом вообще имеет второстепенное значение. Состояние шока, кажущееся «компенсированным», согласно критериям АД, уже может сопро-
21 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
322
вождаться выраженной микроциркуляторнои недостаточностью и вследствие этого — фатальной гипоксией клеток.
Необходимо различать также понятия «орган при шоке» и «шоковый орган». В первом случае речь идет о функциональных нарушениях, связанных с некоторой гиповолемией, достаточно легко устранимой инфузионной терапией. При «шоковом органе» вначале гипотензия, а в дальнейшем всевозможные токсические продукты и формирующаяся по различным причинам выраженная гипоксия совокупно приводят к органическому поражению данного органа с дегенеративно-дистрофическими изменениями в нем, что ухудшает прогноз при шоке.
Разный удельный вес занимает шок в инфекционной патологии. Наибольшее значение в практике врача-инфекциониста имеют ин-фекционно-токсический, дегидратационный и анафилактический шоки, которые будут рассмотрены далее.
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
323
Инфекционно-токсический шок
Инфекционно-токсический шок (ИТШ) — это неотложное состояние, возникающее под влиянием живого возбудителя и его биологически активных веществ, которое выражается комплексом патологических сдвигов в деятельности всех физиологических систем вследствие чрезмерных или неадекватных компенсаторных реакций и нарушением жизненно важных функций организма — системного кровообращения, дыхания, ЦНС, свертывания крови, эндокринной системы, в основе которых находятся тяжелые нарушения микроциркуляции, метаболизма и гипоксия тканей. Синоним: септический шок.
Лат.— shock infectiotoxicum.
Англ. — septic shock.
Краткие исторические сведения. Довольно долго шок обозначал лишь те изменения, которые происходят в организме при огнестрельных ранениях и травмах. В 1879 г. G. Mapother опубликовал работу, в которой впервые коснулся патофизиологических нарушений при шоке (в том числе и при лихорадочных болезнях), связав их с вазоконстрикцией. В 1896 г. J. Lister заявил, что применение анестетиков устраняет не только боль, но и шок. В 1901 г. Н. Park четко описал фазы шока и предложил препараты для лечения, в том числе солевые растворы. До 1950 г. в литературе рассматривались только травматический, операционный, анафилактический и дегидратаци-онный шок. В фундаментальных работах G. Selye и D. Wiggers (1950) были сформулированы основные патофизиологические и классификационные понятия шока, впервые выделен шок «вследствие септицемии». В 1955 г. L. Spink с сотрудниками проводит исследования бактериального шока, данные которых быстро стали общепризнанными в мире.
Активные исследования по изучению механизмов развития шока, которые проводятся в ведущих клиниках разных стран, обусловлены тем, что пациенты с ИТШ составляют от 15 до 33% от общего числа больных, находящихся на лечении в отделениях реанимационного профиля. Несмотря на гигантские шаги, которые сделала интенсивная терапия в своем развитии и совершенствовании за последние 50—60 лет, лечение ИТШ остается глобальной проблемой. И если в 1909 г. летальность при шоке составляла 41 %, то в 1985 г. — 40 %, т.е. в течение XX в. не произошло существенного прогресса в решении этой важной проблемы.
21*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
324
Этиология. ИТШ может осложнять течение различных болезней, вызванных живым возбудителем. Довольно часто он встречается при заболеваниях, относящихся к ведению инфекциониста, — при генерализованной форме менингококковой инфекции, сальмонел-лезах, шигеллезе, вызванном палочкой Григорьева—Шиги, чуме, сибирской язве, болезни легионеров, гипертоксической форме дифтерии и др. Шок при сепсисе выделяют как особое понятие — «септический шок». Он нередко встречается в практической деятельности акушеров и гинекологов (шок при осложнениях беременности, родов, абортов), хирургов (при различных гнойных заболеваниях), урологов (при обструктивных заболеваниях мочевыводящих путей). Необходимо отметить, что практически при любом заболевании, сопровождающемся бактериемией, возможно развитие ИТШ.
Механизм поражающего действия у каждого вида возбудителей достаточно индивидуален и определяется имеющимися факторами патогенкости, которые являются биологически активными компонентами возбудителя, воздействующими на организм человека. Поэтому если течение чумы в 40—70 % случаев осложняется ИТШ, что связано с наличием у этого возбудителя более чем 20 мощных факторов агрессии, то при сальмонеллезах этот вид шока встречается лишь в 3—6 % случаев, так как у сальмонелл значительно меньше агрессивных факторов и их шокогенные свойства слабее.
ИТШ является следствием развития в организме человека инфекционного процесса в виде болезни. Возбудители и их токсины, биологически активные вещества взаимодействуют с клетками и ферментами иммунной системы. Это взаимодействие протекает по определенным принципам и осуществляется на молекулярном и мо-лекулярно-клеточном уровнях. Вместе с тем, активность иммунной системы, выраженность реакции взаимодействия определяются прежде всего генотипом индивидуума, некоторыми другими факторами. Таким образом, при условии однотипности возбудителя, выраженность взаимодействия обусловливается во многом активностью иммунной системы. При прочих равных условиях течение болезней в молодом возрасте чаще осложняется развитием ИТШ, нежели у пожилых лиц, у которых реактивность иммунной системы слабее, Взаимодействие между внешними и внутренними факторами происходит в основном в микроциркуляторном русле, изменения которого в дальнейшем и предуготовляют развитие ИТШ.
Классификация. Группы шока представлены в разделе «Шок». Вне зависимости от этиологического фактора ИТШ принято делить на определенные стадии (фазы, этапы) развития. Наиболее удачной считается современная классификация ИТШ по R.M. Hardaway (1963):
Стадия 1. Обратимый шок, имеющий 3 фазы развития:
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙШОК 325
Ранний обратимый шок.
Поздний обратимый шок.
Устойчивый обратимый шок. Стадия 2. Необратимый шок.
Фаза 1.1. характеризуется нормальным АД, спазмом в микроцир-куляторном русле (бледная кожа и слизистые оболочки, олигурия) и клеточной гипоксией в тканях.
Фаза 1.2. отличается снижением АД, дилатацией микроциркуля -торного русла и депонированием в нем крови, нарастанием гипоксии клеток, началом ферментативного метаболизма в клетках тканей наиболее чувствительных и уязвимых органов.
Фаза 1.3. — устойчивый обратимый шок с «безразличным» АД, развитием ДВС-синдрома не менее 2-й стадии. Вследствие выраженной гипоксии клетки становятся поставщиками недоокисленных метаболитов, распространяющихся по всему организму, грубо изменяющих КОС. Появляются признаки нарушения функции отдельных органов — полиорганная недостаточность.
В стадии 2 (необратимый шок) АД часто весьма снижено, развивается глубокий ДВС-синдром с грубыми расстройствами микроциркуляции и свертывания крови, выраженный внутриклеточный ацидоз приводит к дезорганизации и гибели клеток. Все вместе обусловливает появление тяжелой необратимой системной полиорганной недостаточности. Расширение зон некроза и плазматическая генерализация предваряют наступающую гибель всего организма.
Патогенез. Развитие ИТШ обусловлено проникновением в кровь большого количества чужеродных бактерий и их токсинов. Самым важным классом бактериальных антигенов являются липополисаха-риды (ЛПС) грамнегативных бактерий, которые составляют основу так называемого эндотоксина — основного пускового фактора развития ИТШ. Эндотоксины мало диффундируют в окружающую среду — большая часть их высвобождается только после гибели бактериальной клетки. Они являются соматическими антигенами и проявляют необычайно мощную биологическую активность, вследствие чего и получили название эндотоксинов. Токсический эффект ЛПС определяется эндогенными медиаторами, которые активно продуцируют клетки лимфоретикулярной системы, вступившие в контакт с ЛПС. Массивная стимуляция клеток этой системы приводит к освобождению большого количества провоспалительных медиаторов, которые имеют ведущее значение в развитии лихорадки, артериальной гипотензии, повреждения тканей при этом виде шока.
ЛПС расположен на поверхности мембраны грамнегативных бактерий. Внешняя О-сторона состоит из серии олигосахаридов, которые определяют серологическую специфичность и большую вариабельность. Токсичность ЛПС, вероятнее всего, обусловлива-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
326
ет лигшд А, структура которого практически однотипна у всех грам-негативных бактерий. ЛПС сначала связывается с сывороточным белком и образует ЛПС-связанный белок. Этот комплекс в свою очередь связывается с поверхностным клеточным рецептором CDU макрофагов и сегментоядерных лейкоцитов, активирует эти клетки, стимулирует продукцию цитокинов и других медиаторов системного воспалительного ответа и шока (комплемента, вазоактивных медиаторов, метаболитов арахидоновой кислоты, кининов, фактора активации тромбоцитов, гистамина, эндотелинов, эндорфинов, факторов коагуляции, активных кислородных радикалов). Кроме того, эндотоксин оказывает прямое цитотоксическое, а также миокардио-депрессивное действие.
Большинство грампозитивных бактерий не содержи! а мембранах эндотоксин. У них чаще имеется липосахаридная капсула, клеточная стенка содержит фосфолипиды, пептидогликаны, теихоевые кислоты. Такие бактерии могут содержать специфические антигены (стафилококковый протеин А, стрептококковый протеин М). Эти, а также некоторые другие компоненты микробной клетки способны стимулировать продукцию цитокинов, активировать альтернативные пути комплемента, изменяют активность макрофагов и лимфоцитов, связываются с гуморальными факторами. Существует много разновидностей грампозитивных бактерий и соответственно особенностей компонентов клеточной мембраны. Комплекс ответных реакций на инвазию грампозитивной микрофлоры значительно более сложный по сравнению с эндотоксиновой. Идентифицировано большое количество токсинов, которые, воздействуя на моноциты, вызывают выброс цитокинов, активируют метаболизм арахидоновой кислоты с образованием лейкотриенов и простагландинов, каскад системы комплемента, тромбоциты, факторы коагуляции, увеличивают проницаемость клеточных мембран. Так называемый токсин 1 вызывает синдром септического шока действуя подобно эндотоксину, а также инициирует воспалительную реакцию.
В ответ на стимуляцию сегмектоядерныо лейкоциты, моноциты, макрофаги секретируют большое количество веществ группы про-воспалительных факторов (цитокины, у-интерферон, комплемент, вазоактивные медиаторы, метаболиты арахидоновой кислоты, ки-нины, фактор активации тромбоцитов, гистамин, эндотелины, эн-дорфины, факторы коагуляции, активные кислородные радикалы). Одновременно ЛПС и факторы агрессии грампозитивных бактерий стимулируют выделение и группырегуляторных белков противовоспалительного эффекта.
Дисбаланс между уровнем продукции веществ, производных этих двух групп, в сторону значительного преобладания провоспалитель-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
327
ных факторов приводит к развитию синдрома системного воспалительного ответа — патогенетической основы ИТШ.
Стимуляция комплемента обусловливает продукцию анафилоток-синов СЗа и С5а, которые вызывают вазодилатацию, повышение сосудистой проницаемости, стимулируют агрегацию тромбоцитов, агрегацию и активацию нейтрофилов.
Дальнейшее высвобождение дериватов арахидоновой кислоты, активных кислородных радикалов, лизосомальных ферментов вызывает локальные вазоактивные эффекты на уровне микроциркуляции, оказывает цитотоксический эффект на клетки эндотелия сосудов и как следствие — повышение проницаемости капилляров.
Образование свободных радикалов и других метаболитов перекисного окисления липидов составляет неотъемлемую часть системного воспалительного ответа. Свободные радикалы и метаболиты образуются в процессе синтеза простагландинов и леикотриенов из арахидоновой кислоты.
Одновременно происходит разрушение микробов активированными макрофагами, нейтрофилами, фагоцитами вследствие мие-лопероксидазных реакций, которые, в свою очередь, усиливают адгезию нейтрофилов в зоне повреждения с сосудистым эндотелием. Вследствие активации нейтрофилы продуцируют токсичные кислородные метаболиты и лизосомальные ферменты, способные повреждать ткани, клеточные мембраны, органеллы путем перекисного окисления липидов, денатурировать ферменты, структурные белки, ядра и т.д.
Мощная стимуляция провоспалительными цитокинами нейтрофилов активирует процесс их взаимодействия с эндотелием сосудов.
Перед миграцией нейтрофилов в ткани происходит их адгезия с сосудистым эндотелием и стимуляция его клеток, которые бесконтрольно начинают продуцировать ряд медиаторов, наиболее важными среди которых являются фактор агрегации тромбоцитов и чрезвычайно мощный вазодилататор NO. Вызываемое им расширение сосудов не чувствительно к действию вазопрессоров. Базальная продукция его является важным фактором регуляции сосудистого тонуса и передачи сигналов между нейронами.
В ответ на развитие синдрома системного воспалительного ответа (ССВО), дилатационных процессов в микроциркуляторном русле происходит снижение общего периферического сосудистого сопротивления (ОПСС) и значительное уменьшение объема перфузии. Под влиянием медиаторов ССВО возникает спазм пре- и посткапилляров, открываются короткие артериовенозные шунты, посредством которых кровь устремляется мимо капиллярной сети из артериального русла прямо в венозное. Уменьшаются преднагрузка и соответственно — постнагрузка, угнетается сократительная способность
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
328
миокарда. Это улавливается специфическими рецепторами, активация последних и является пусковым фактором нейроэндокриннойреакции, в результате которой увеличивается секреция АДГ, гормона роста, адреналина и норадреналина. Повышение продукции АКТГ, ишемическая активация ренин-ангиотензинной системы стимулируют освобождение надпочечниками кортизола и альдостерона. Высвобождение катехоламинов с развитием тахикардии и увеличением СВ, воздействие АДГ, кортизола и альдостерона, приводящее к задержке Na+ и воды, обеспечивают некоторую оптимизацию гемодинамики — временно несколько увеличивается пред- и постнагрузка, минутный объем сердца (МОС), ОПСС. Это расценивается как гипердинамическая реакция циркуляции.
Через мембраны капилляров к сосудистую систему поступает ин-терстициальная жидкость. Ее приток происходит лить в первую стадию шока и осуществляется двухфазно. Вначале в сосудистое русло мигрирует жидкость с низким содержанием белка, а после развития начальной гиповолемии поступает интерстициальный транссудат уже с достаточной концентрацией белка.
Ухудшение микроциркуляции вызывает развитие гипоксии тканей. Активируется в связи с дефицитом кислорода анаэробный метаболизм. Хотя подобный тип метаболизма невыгоден для организма, он позволяет кратковременно улучшить условия гемодинамики и оптимизировать обмен углеводов в миокарде и мозге. Однако именно нарушения микроциркуляции и связанная ней прогрессирующая гипоксия тканей органов и будут в дальнейшем основными факторами, способствующими прогрессированию шока.
Нейроэндокринная стимуляция лимбической системы вызывает беспокойство и возбуждение больного, иногда у него возникает страх смерти. Последнее особенно характерно для ИТШ при стафилококковом сепсисе. Конечным эффектом нейроэндокринных воздействий являются повышение ОПСС, перераспределение системного кровотока, усиление работы миокарда, задержка воды и солей почками, повышение уровня глюкозы в крови, переход интерстици-альной жидкости из тканей в сосуды.
Если на этом этапе развития патологического процесса принять меры к устранению причины развития ИТШ (этиотропная терапия), восстановить ОЦК и микроциркуляцию, то дальнейшее развитие его прекращается. Этот этап соответствует фазе 1.1. ИТШ— раннему обратимому шоку.
Но тогда, когда бактериальная стимуляция превалирует над восстановительными процессами, а лечебные мероприятия недостаточны, то развитие шока продолжается.
Увеличивающиеся гшюволемия, гипоксия и ацидоз усиливают ка-техоламиновую стимуляцию микроциркуляции, что приводит к еще
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙШОК
329
большей вазоконстрикции на периферии. И эта быстро протекающая адаптационная реакция усугубляет начавшиеся реологические расстройства — сладж-синдром, ДВС-синдром (см. главу «ДВС-син-дром при инфекционных болезнях»). Вследствие развивающихся локальных гипоксических нарушений обмена веществ существенно усиливается ацидоз, накапливаются тканевые метаболиты, которые вызывают расширение прекапилляров, в то время как посткапилляры остаются спазмированными. Происходит своеобразное «закачивание» крови в микроциркуляторное русло с повышенной проницаемостью стенок и выпотеванием плазмы крови в интерстициаль-ное пространство, что приводит к дополнительным потерям ОЦК. Капиллярное русло расширяется и депонирует до 10 % ОЦК.
Вазоконстрикция никогда не охватывает все периферические сосуды равномерно. В одних органах она более выражена, в других — вообще может отсутствовать, что зависит от наличия а-адре-норецепторов. Наиболее выражена вазоконстрикция в печени, поджелудочной железе, кишечнике, почках, коже, мышечной системе, наименее — в сердце, мозге. Более того, последние два органа при шоке получают крови значительно больше, чем в норме. Такое изменение кровообращения обозначают термином «централизация кровообращения». В процессе симпатоадреналовой реакции повышается тонус не только периферических сосудов, но и крупных — происходит равномерное распределение крови венозного русла на фоне уменьшения ОЦК. Эта фаза патогенеза примерно соответствует фазе 1.2. — позднему обратимому шоку.
Легкие являются наиболее уязвимым органом при шоке. Они определяют состояние оксигенации крови и, следовательно, возможность выживания больного. Через них проходит весь объем циркулирующей крови. Легкие являются естественным фильтром для циркулирующих при шоке в плазме крови клеточных агрегантов, липидов, токсического детрита и синтетических субстанций. Все они, осаждаясь в легочных капиллярах, частично или полностью их закупоривают, вызывают воспалительную инфильтрацию, которая сопровождается повышением проницаемости. Это состояние становится почвой для развития интерстициального отека легких, который существенно ухудшает перфузию кислорода и диоксида углерода, усиливая, таким образом, гипоксию. Такие вазоактивные вещества, как гистамин, серотонин и кинины, инактивируются в легких, при этом повреждаются стенки капилляров, возникают микро-эмболии. Активированная фракция комплемента С5а стимулирует агрегацию нейтрофилов, следствием которой в дальнейшем становится развитие легочно-артериальной гипертензии и отека легких. Развивающийся ДВС-синдром также существенно ухудшает функцию легких, вызывая возникновение внутрилегочного шунтирова-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
330
ния, которое обусловливает тяжелую гипоксию — до 30 % крови, составляющей минутный объем сердца, направляется через артерио-венозный шунт. При ИТШ отмечается повышение уровня диоксида углерода. Если нормальное значение Ра С02 равное 40 мм рт.ст., увеличивается только на 2 мм рт. ст., ритм и глубина дыхания удваиваются для выделения избытка диоксида углерода.
Работа сердца имеет решающее значение для прогноза ИТШ. Благодаря тому, что вследствие централизации кровообращения в мозг и сердце поступает максимальное количество крови, в течение определенного времеш; сохраняются минимально необходимый сердечный выброс и минутный обт.ем. Однако метаболический фон, на котором миокард в условиях шока испытывает высокую нагрузку, неблагоприятный, а при отсутствии эффективного лечения он постепенно ухудшается: уменьшается ОЦК, снижается Ра02 и повышается РС02, нарастают токсическое воздействие, ацидоз. Снижается преднагрузка, повышается иостнагрузка, минимально необходимый ОЦК удается сохранить за счет тахикардии. Обычно в этой фазе снижается АД, по оно все же выше необходимого уровня почечной фильтрации.
С уменьшением ОЦК и спазмированием почечных сосудов развивается своеобразная почечная ишемия— уменьшается фильтрационное давление, развивается олигурия, нарушается концентрационная функция. В спазмировании предклубочковых сосудов участвуют ренин-ангиотензинная система и, возможно, простагландины. В ткани почек развиваются дистрофические нарушения. Существует определенная зависимость — чем выраженнее ацидоз, тем меньше почечный кровоток. На этом этапе развития шока почки еще активно участвуют в механизмах компенсации метаболического ацидоза. Они выделяют протоны (Н+), удерживая гидрокарбонат.
Печень имеет высокий уровень метаболической активности и играет важнейшую роль в процессе очищения организма. В нормальных условиях печеночным кровоток составляет 25—30 % сердечного выброса, а значит, находится в большой зависимости от системного кровотока. При уменьшении ОЦК открываются прямые внутрипе-ченочкые шунты через печеночные синусоиды.
Вследствие уменьшение поступления кислорода в печени нарушается обмен веществ — истощаются запасы гликогена, снижается синтез альбумина, факторов свертывающей и противосвертываю-щей систем крови, угнетаются синтез мочевины и дезактивация токсических метаболитов, снижается уровень энергетических фосфатов (АТФ, АДФ, КФ) и т. д.
Поджелудочная железа также страдает при развитии шока, поскольку имеет высокую метаболическую активность. Увеличивается
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
331
продукция инсулина и глюкагона, выделяется ряд факторов, имеющих миокардиодепрессивное действие.
Существенные изменения возникают и со стороны пищеварительного тракта. Развивается эрозивный гастрит, который сам по себе может вызвать дополнительную кровопотерю. Слизистая оболочка кишечника обычно меньше подвержена повреждающему действию резко сниженного кровотока при шоке, однако при его выраженности возможен дополнительный прорыв кишечного барьера (так называемая транслокация) и инвазия бактериальной микрофлоры и ее токсинов. Следствием этого может стать внезапное развитие еще и гематогенного сепсиса.
В первой фазе шока отмечается распространенное возбуждение ЦНС и связанные с ним усиление функционирования сердечно-сосудистой системы, одышка, интенсификация обмена веществ и деятельности эндокринных желез (гипофиз, надпочечники). Эти изменения в основном являются приспособительными. В дальнейшем наступает так называемая торпидная фаза — торможение различных отделов ЦНС, в частности, вследствие торможения сосудодвигательного центра угнетается рефлекторная регуляция сосудистой системы.
Гипогликемия и гиперинсулинемия в начальный период шока — нормальная реакция, обусловливающая поддержание анаболической направленности метаболизма. Однако она не может противостоять в условиях гипоксии катаболическим реакциям, вызванным гиперпродукцией катехоламинов, кортизола и глюкагона. В результате развивается гипергликемия, которая в таком состоянии имеет положительное значение, так как поддерживает возможность покрытия высокого метаболизма в миокарде и мозге. Таким образом, перестройка метаболизма углеводов при шоке происходит в ущерб периферическим тканям, но в пользу церебрального и частично ми-окардиального метаболизма.
При шоке повышается уровень триглицеридов и жирных кислот в крови. Эта приспособительная реакция направлена на поддержание достаточного энергетического потенциала организма для покрытия резко возросших его потребностей. Однако действенными являются лишь некоторые пути их превращения и то в течение короткого времени.
Немедленно после развития шока усиливается катаболизмбелков с повышением синтеза мочевины и увеличением количества ароматических аминокислот, которые являются «сырьем» для синтеза нейромедиаторов (в том числе и ложных) — адреналина, норадрена-лина, серотонина, дофамина и некоторых других.
Резкое повышение уровня обмена веществ требует и существенного увеличения количества кислорода, который необходим для по-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
332
лучения макроэргов. Поэтому важнейшим для полноценного функционирования клеток является достаточное снабжение кислородом.
Продолжающееся снижение ОЦК приводит к открытию все новых артериовенозных шунтов и к дальнейшему уменьшению периферического кровотока, что вызывает нарастание гипоксии тканей и клеток. Аэробный, наиболее эффективный путь образования АТФ и других фосфатергических соединений в условиях дефицита кислорода частично или полностью переключается на анаэробный. Эффективность последнего значительно меньше, более того, в процессе образования АТФ образуются кислые продукты, которые существенно изменяют реакцию внутриклеточной среды. А ведь многие биохимические процессы внутри клеток происходят при определенных значениях рН. Клинически этот этап примерно соответствует фазе 1.3.— устойчивому обратимому шоку.
Временная гипоксия клеток — вполне физиологическое явление в организме. Сама по себе гипоксия является толчком для усиления кровоснабжения активно функционирующей зоны. Однако если такого усиления кровообращения не происходит, то гипоксия приобретает патологический, повреждающий характер. Чувствительность различных клеток к гипоксии разная, она зависит от функциональной активности и некоторых других причин. Различна и восприимчивость к повреждающему действию гипоксии отдельных органов. Наиболее страдает от этого ЦНС (астроциты переносят гипоксию без серьезных последствий не более 15с), наименее — кожа, мышцы (последние имеют некоторый запас кислорода в виде соединения с миоглобином). Печень может нормально функционировать в условиях гипоксии более 1 ч. В целом устойчивость к гипоксии зависит от уровня снабжения органа кислородом и содержания гликогена.
При гипоксии повышается проницаемость клеточной мембраны для глюкозы и запускаются механизмы обусловленных катехола-минами процессов анаэробного гликолиза, обеспечивающих минимальные потребности клетки в фосфатергических соединениях. Но в условиях шока компенсация гипоксии невозможна, поэтому постепенно прекращаются высокоэнергетические реакции в связи с дефицитом АТФ, нарушается функционирование внутриклеточного K+-Na+-насоса. Вследствие этого возникает внутриклеточный отек, поражающий лизосомы и митохондрии, что способствует механическому повреждению лизосомальных мембран и высвобождению ферментов. Недостаточная протективная функция мембран в конечном счете приводит к гибели клетки. В этом процессе большое значение имеет также нарушение обмена внутриклеточного кальция, Кроме непосредственного действия гипоксии влияет также первичное изменение внутриклеточного метаболизма аминокислот, жирных кислот, углеводов, но этот механизм до конца не изучен.
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
333
Нарушение водно-электролитных взаимоотношений также изменяет характер ответа клетки на воздействие различных биологически активных веществ — катехоламинов, кортизола, инсулина и т.д.
Следует указать и на то, что все нарушения, возникающие при шоке на уровне клетки, являются вторичными по отношению к расстройствам микроциркуляции и находятся в прямой зависимости от них.
В тканях, а затем и в крови нарастает уровень кислых метаболитов и особенно молочной кислоты (лактата), что приводит к системному ацидозу. Умеренное повышение ее концентрации вызывает спазм гладких мышц, ухудшая, таким образом, доставку кислорода к клеткам и усиливая гипоксию. Высокие концентрации лактата блокируют влияние катехоламинов на а- и Р-адренорецепторы микроциркуляции, вызывая явления пареза. Глубокий ацидоз существенно меняет все сосудистые реакции организма, ухудшает кровообращение и может привести к необратимым изменениям. Таким образом, стадия устойчивого обратимого шока переходит в стадию необратимого шока.
Если ишемическая гипоксия в микроциркуляторном русле является обратимой, то следующий этап (застойная гипоксия—аноксия) — необратим, так как имеются уже грубые клеточные морфологические поражения. Прогрессирующий ацидоз, являющийся показателем клеточного метаболического истощения, достигает критической точки — прекращения ферментативных процессов, в результате исчезает архитектоника клеток, происходит их полная дезорганизация, что и обусловливает появление очагов некроза, которые в дальнейшем сливаются и становятся генерализованными.
Печень. При глубоком шоке кровоток по воротной системе может снижаться до 40—50 % от необходимого, что приводит к нарушению фильтрационной и детоксикационной функции печени. Клетки РЭС не в состоянии изымать из кровотока естественный плазменный детрит, бактерии, биологически активные вещества, которые в дальнейшем попадают в легкие и сердце, усугубляя их повреждение. Возможно, именно этот момент является главной причиной перехода шока в необратимую фазу. Существует определенная зависимость между кровотоком в печени и уровнем ацидоза — чем выра-женнее ацидоз, тем меньше печеночный кровоток. В печени развиваются дистрофические изменения.
Легкие. За счет исключительно высокого шунтирования кровообращения (до 51%) значительно уменьшается количество функционирующих капилляров, сокращается дыхательная поверхность, нарушается диффузия газов, что приводит к гипоксемии и гипер-карбоксемии. Нарушается образование сурфактанта, возникают диссеминированные ателектазы, формируются генерализованный
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
334
интерстициальныи отек и кровоизлияния в альвеолы, в результате чего легкие становятся влажными и жесткими. Внешнее дыхание при этом малоэффективно, одышка резко усиливается.
Достаточно часто при ИТШ развивается респираторный дистресс-синдром взрослых, который значительно ухудшает газообмен в легких, быстро приводит больного к критическому состоянию.
Почки. Сохраняющийся и (или) увеличивающийся дефицит почечного кровотока приводит к развитию «шоковой» почки с явлениями олигурии или анурии. Ишемия вызывает прогрессирующий некроз канальцев вследствие гломерулярной, а затем и тубулярной недостаточности с образованием цилиндров в дистальных канальцах. В крови увеличивается уровень мочевины и креатинина. При определенном низком уровне АД в почечной артерии прекращает действовать механизм компенсации ацидоза, что благоприятствует его прогрессированшо. Следует помнить, что даже после нормализации АД (выведения из состояния шока) еще достаточно длительное время сохраняется спазм почечных сосудов и выражены проявления ОПН.
Изменения со стороны сосудистой системы и микроциркуляции. Под постоянным влиянием ацидоза, различных биологически активных веществ быстро прогрессирует ДВС-синдром с аккумуляцией большого количества плазмы крови и ее форменных элементов в микроциркуляторном русле. В результате развиваются микротромбозы и тотальная тканевая гипоксия, причиной которой становится невозможность утилизировать доставленный кислород, а также непосредственное токсическое поражение метаболически активных клеток. Оба феномена прогностически неблагоприятны. При этом клетки эндотелия неконтролированно продуцируют мощный вазо-дилататор NO, причем вызываемая им вазодилатация не чувствительна к действию катехоламинов (см. рис. 23).
Изменения со стороны миокарда. Несмотря на максимально возможный объем кровоснабжения, сердце продолжает функционировать в тяжелых условиях. Постоянно возрастающие гипоксемия, ацидоз, токсическое воздействие различных метаболитов, миокар-диодепрессивное действие эндотоксина, секреторных фракций поджелудочной железы создают крайне неблагоприятные условия функционирования миокарда. В нем также развивается токсически и гипоксически обусловленная дистрофия. На фоне падения периферического сопротивления в очередной раз уменьшается венозный возврат, в связи с чем уменьшается и сердечный выброс, так как в данных условиях компенсаторные возможности для его увеличения отсутствуют. Падает кровоснабжение миокарда и мозга.
Изменения со стороныЦНС. Уменьшение ниже минимально необходимого уровня сердечного выброса и минутного объема сердца не-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
335
медленно сказывается на ЦНС. При Ра С02, равном 60—80 мм рт. ст., вентиляция доходит до 60 л/мин. С этих значений давления диоксид углерода начинает действовать наркотически на нейроны коры головного мозга. Постепенно угнетаются сердечный и дыхательный рефлексы, развивается торможение сосудодвигательного центра. При снижении АД до 40—50 мм рт. ст. исчезают условные рефлексы.
Общие закономерности развития ИТШ представлены на рис. 23. Клиника. Фаза 1.1. ИТШ достаточно кратковременна и клинически не всегда обнаруживается. Под действием эндотоксина и факторов ССВО развивается гипердинамическое состояние и периферическая вазодилатация. Обычно эта стадия проявляется выраженным речевым и двигательным возбуждением, беспокойством. Может появиться умеренно выраженная жажда. Сосудистый тонус сохранен, чаще всего отмечается генерализованный артериолоспазм, в связи с чем кожа и видимые слизистые оболочки бледные. Кожа на ощупь теплая, иногда слегка влажная, изредка — розовая. Пульс учащен, напряжен, причем частота пульса несколько превышает необходимую при повышении температуры тела. Наполнение шейных вен удовлетворительное. Зрачки сужены, дыхание достаточно глубокое, ритмичное, несколько учащенное на фоне лихорадки. Чаще всего при этой фазе шока АД не снижается или даже чуть повышается. Тоны сердца становятся громкими. Дефицит ОЦК компенсируется поступлением крови из депо, тахикардией, за счет чего и возрастает сердечный выброс. Но систолическая и диастолическая функции желудочков часто угнетены, несмотря на высокий сердечный выброс. Диурез снижается, но часовой дебит мочи еще не менее 40 мл/ч. ЦВД — в пределах нормы или снижено незначительно. В крови — незначительный метаболический ацидоз, гиперкоагуляция, гипергликемия.
В большинстве случаев у врача складывается впечатление полного благополучия, и состояние больного не вызывает опасений. Это находит свое отображение и в диагностических рассуждениях — фаза шока 1.1. практически никогда не фиксируется в диагнозе.
Фаза 1.2. шока. Дальнейшие увеличение гиповолемии, замедление капиллярного кровотока, развитие ДВС-синдрома, торможение симпатической нервной системы, метаболические расстройства, парез прекапиллярных сфинктеров приводят к переходу шока в следующую фазу. Она характеризуется постепенным уменьшением сердечного выброса и минутного объема сердца, развитием спазма периферических сосудов и функционированием артериовенозных шунтов. Относительно адекватный кровоток сохраняется лишь в сердце и мозге. Отмечаются постепенное снижение АД и увеличение тахикардии. Критическим становится снижение систолическо-
336-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Взаимодействие бактерий и/или их фрагментов с макрофагами и нейтрофилами, гиперреактивность
Поступление
медиаторов воспаления
в кровь
Вазодилатация
Гиповолемия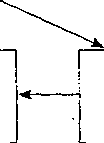
Ишемия органов и тканей
ДВС-синдром
Анемия
Централизация кровообращения
Гипоперфузия
и гипоксия органов
и тканей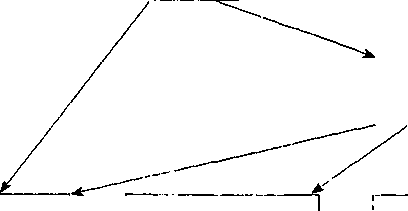 Острая
Острая
дыхательная
недостаточность
Острая
почечная
н е д остаточ ность
I Дистрофические изменения •! органов и тканей
Полиорганная н е достаточ ность
Смерть
Рис. 23
Общие закономерности развития ИТШ
,/
~^
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
337
го АД — ниже 60 мм рт. ст., при котором почти прекращается почечная фильтрация и существенно нарастает гипоксия почек. С этого момента начинается отсчет времени, длительность которого определяет в дальнейшем возможность выведения из шока. Тоны сердца становятся глухими или несколько ослабленными. Пульс — частым и слабым, шейные вены постепенно спадаются. Измерение АД в этой фазе шока становится затруднительным, ЦВД существенно снижается. Психомоторное возбуждение постепенно меняется на угнетение сознания. Усиливается бледность кожи — она приобретает мраморный оттенок, становится холодной и влажной, с выраженным периферическим цианозом — отмечается синюшность кончика носа, губ, ушей, концевых фаланг пальцев, лицо становится серо-ци-анотичным.
Резкое снижение давления кислорода — ниже 50 мм рт. ст. в артериях обусловливает возникновение состояния гипоксии-гиперкап-нии. Развивается явная, постепенно усиливающаяся одышка, дыхание в легких становится жестким. Легочная вентиляция может превышать 20 л/мин.
Однако такая вентиляционная компенсация уже недостаточна для устранения ацидоза тканей. Уменьшается диурез, он становится ниже 20 мл/ч. Вследствие прогрессирования ДВС-синдрома может появиться различная, прежде всего геморрагическая сыпь. Снижается температура тела до субфебрильной или нормальной, но общее состояние больного не улучшается.
Фаза 1.3. шока. Состояние больного продолжает прогрессивно ухудшаться. Нарастает тахикардия, АД уже может не определяться, пульс обычно настолько мягкий и частый, что его подсчет практически невозможен. Тоны сердца глухие, резко ослаблены. Частота дыханий превышает 30 в 1 мин, дыхание поверхностное и неэффективное. В терминальной стадии шока, когда рН снижается до 7,25 и ниже, может появиться дыхание по типу Куссмауля. Возникают признаки начинающегося отека легких — жесткое дыхание, единичные влажные хрипы в нижних отделах легких. Постепенно влажных хрипов становится все больше, они распространяются на остальные участки легких. Цианоз нарастает, распространяется по всему телу, часто становится тотальным. Температура тела падает до субнормальной. Углубляются симптомы гипоксии мозга, развивается сопорозное состояние, постепенно переходящее в кому.
В фазе 1.3. еще возможно вывести больного из шока, но затем следует 2-я, необратимая стадия ИТШ, из которой вывести больного уже невозможно, так как дистрофические изменения в паренхиматозных органах становятся необратимыми. Клинически их различить крайне сложно.
Концепция необратимости шока. Широко распространено мне-
22 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
338
ние, что клиническая диагностика шока чрезвычайно проста и доступна практически каждому врачу. Это действительно гак, если идет речь о поздних стадиях шока или о наличии шока вообще. В ситуации, когда необходимо определить тактику лечения, усгановить причину развития ИТШ, оценить синдромы, которые его выражают, диагностика становится значительно сложнее. Полноценность такой диагностики определяется уровнем подготовленности врача, собственным клиническим опытом, а также качеством объективной информации, которую можно получить при клиническом, лабораторном и инструментальном обследовании больного. В современных условиях именно это часто становится решающим фактором. Большое значение приобрели так называемые инвазивные методы диагностики, так как другие менее точны. Даже банальное измерение АД во многих случаях может давать значительную ошибку в сравнении с истинным, а при наличии нестабильной гемодинамики — практически у всех. При артериальной гипотензии истинные значения систолического давления могут быть занижены в среднем на 20—35 мм рт. ст., а у больных с сердечной недостаточностью —даже на 40—60 мм рт. ст. Подобное связано с тем, что тоны Короткова возникают за счет самого кровотока, при снижении же АД они теряют звучность и первые слабые звуки могут быть не зафиксированы. Поэтому у больных с низким АД «манжеточный» метод определения желательно не применять.
Согласно современным медицинским воззрениям, нецелесообразно прекращать лечебные мероприятия, даже если необратимость шока у больного достаточно очевидна. Ведь понятие «необратимости» шока во многом также зависит от уровня диагностических и лечебных возможностей, а также наших знаний об этом состоянии. Для этого необходимо поставить диагноз смерти мозга.
Вместе с тем, в клинической практике чаще встречаются состояния, при которых скрытые причины могут симулировать необратимость шока. Наиболее частые причины подобных ситуаций следующие:
недостаточный объем вводимой жидкости;
гипоксия в связи с недостаточной ИВЛ;
токсичность лекарственных препаратов и усиление их действия в случае гюлипрагмазии;
неадекватная коррекция сдвигов КОС;
недиагностированный ДВС-синдром:
необоснованное лечение белковыми препаратами (альбумин, плазма) в условиях ьлражения капиллярных мембран легких, усиления интерстициального отека легких и гипоксии.
Постреанимационные повреждения. Период, следующий за восстановлением системного АД, может сопровождаться сохраняю-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
339
щейся ишемией и прогрессирующим повреждением органов. При ИТШ могут развиваться 3 основных синдрома постреанимационно-го повреждения — невосстановленный органный кровоток, репер-фузионное повреждение, кислородная задолженность.
Невосстановленный органный кровоток характеризуется устойчивым низким обеспечением кровью внутренних органов, в частности пищеварительного тракта, что может привести к нарушению барьерной функции слизистой оболочки кишечника и попаданию кишечной микрофлоры в системный кровоток. Часто развивается ишемия мозга, которая вызывается вазоконстрикцией его сосудов и сохраняется в течение нескольких часов. В отдаленные сроки невосстановление кровотока клинически проявляется как синдром полиорганной недостаточности, который нередко приводит к летальному исходу.
Реперфузионное повреждение возникает при восстановлении кровоснабжения органов. Но во время ишемии накапливаются токсические вещества, которые после возобновления кровотока разносятся по всему организму, попадая даже в отдаленные органы. Это активные формы свободного кислорода, продукты перекисного окисления липидов. Они способны резко повысить проницаемость мембран не только на клеточном, но и тканевом уровне. Установлено, что повышение оксигенации тканей мозга после ишемии (вследствие реанимационных мероприятий) приводит к увеличению содержания перекисных соединений. Попытки антиоксидантной терапии реперфузионного повреждения дали весьма противоречивые результаты, что свидетельствует о возможном значении и некоторых других веществ (оксид азота).
Кислородная задолженность — дефицит кислорода, возникающий во время ишемии тканей. Он должен быть компенсирован в постишемический период. Больные, неспособные на такую компенсаторную реакцию, имеют высокий риск повреждения жизненно важных органов, что приводит к фатальному исходу. Поэтому даже после стабилизации гемодинамики необходимо проводить лечебные мероприятия, направленные на существенный рост содержания кислорода в крови.
Методы диагностики. Общеклинические методы имеют для диагностики самого шока и его стадий второстепенное значение. Общий анализ крови отражает бактериальный характер повреждения — отмечаются лейкоцитоз, нейтрофилез, увеличение СОЭ. В случаях глубокого шока возможна даже и лейкопения. Достаточно остро при ИТШ стоит проблема вязкости крови, так как усиливаются агре-гационная способность не только тромбоцитов, но и эритроцитов. С другой стороны, со снижением гематокрита уменьшается и кис-лородтранспортное свойство крови. Поэтому принято расценивать
22*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
340
наиболее благоприятным уровень гематокрита около 0,33—0,35 (с возможными колебаниями от 0,30 до 0,40). В общем анализе мочи возможна цилиндрурия, эритроцитурия.
Диагностика и оценка метаболических расстройств с помощью биохимических методов исследований. Наиболее распространена диагностика метаболических расстройств по изменению КОС и обмена глюкозы. Глубина, характер и форма расстройств КОС зависят от стадии развития шока. В начальной стадии может отмечаться респираторный алкалоз, который достаточно быстро сменяется метаболическим ацидозом различной глубины, причем преимущественно за счет лактата. В крови нарастают явления и респираторного алкалоза.
Имеется достаточно выраженная корреляция между уровнем лактата и эндотоксина, а также обратная зависимость между уровнем глюкозы и эндотоксина. Предлагают даже использовать как прогностический критерий и терапевтический ориентир соотношение глюкоза/лактат. Да и само определение концентрации лактата может служить важным прогностическим фактором. Так, повышение его концентрации от 2,1 до 3 ммоль/л снижает вероятность выживания с 90 до 10 %, а концентрация, превышающая 7—8 ммоль/л всегда является критической. Высокий уровень лактата может сосуществовать с метаболическим алкалозом (при введении оснований) или дыхательным алкалозом (при гипервентиляции).
Необходимость коррекции ацидоза определяется уровнем тканевой перфузии. Уровень рН ниже 7,25 опасен, так как вызывает депрессию миокарда и снижает его сократительную чувствительность к катехоламинам. При шоке коррекцию ацидоза гидрокарбонатом натрия следует проводить очень осторожно, так как в условиях алкалоза ухудшается кислородтранспортное свойство крови из-за смещения кривой диссоциации гемоглобина влево и способствует накоплению натрия в организме на фоне сниженной перфузии почек. Вследствие этого возможно развитие истинного гиперосмолярного синдрома.
Содержание глюкозы в крови, особенно в начальном этапе, может быть повышенным (из-за гииеркатехоламинемии), нормальным и даже сниженным.
Коагуляционный статус. Закономерно развивается ДВС-синд-ром, диагностика которого подробно описана в соответствующем разделе.
Оценка водно-электролитного состояния и функции почек. Выраженность нарушения водно-электролитного состояния, как правило, соотносится с тяжестью состояния больного и глубиной шока. Необходимо определять концентрацию электролитов в крови и моче не менее 2 раз в сутки, почасовой и суточный диурез, суточную экс-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
341
крецию электролитов, осмолярность плазмы и мочи, уровень креа-тинина и мочевины, а также их клиренс. В 1.2.—1.3. фазе шока снижается уровень калия, повышается — натрия. В артериальной крови уменьшается концентрация диоксида углерода, гидрокарбонатов плазмы, так как почечная компенсация невозможна.
Оценка сердечного выброса. Это наиболее важная и одновременно наиболее сложная проблема диагностики шока. Получение объективной информации возможно лишь при применении инвазив-ных методов. Наиболее информативным считается термодилюци-онный метод с применением плавающего катетера Свена—Ганса. Кроме получения информации о сердечном выбросе, эта методика позволяет определять так называемое давление заклинивания легочной артерии (ДЗЛА), то есть, по существу, уровень давления в левом предсердии, что характеризует преднагрузку. Этот метод также позволяет быстро определить тип гемодинамического ответа у больного — гипердинамический или гиподинамический, что крайне важно для прогноза течения шока. Чаще гипердинамический ответ соответствует фазам 1.1.—1.2. ИТШ, гиподинамический — фазе 1.З.-—2-й стадии ИТШ, хотя могут быть и исключения.
В табл. 11 приведены критерии размежевания этих двух типов гемодинамики при ИТШ (по Г.А. Рябову, 1988, с изм.).
Таблица 11. Клинические и биохимические показатели при различных типах гемодинамики
Показатель |
Норма |
Гипер- |
Гипо- |
|
|
динамический |
динамический |
Пульс |
60—80 в 1 мин |
ттт |
t |
АД |
120/70 мм рт. ст. |
N |
44 |
ЦВД |
6—12 см вод. ст. |
Nit |
4 |
Систолический |
2,5—3,5 л/(минхм2) |
тт |
4 |
индекс (СИ) |
|
|
|
ДЗЛК |
10—12 мм рт. ст. |
4, N |
4, N |
ОПСС |
1200—2500 динхс/(см3хм2) |
4-4-4- |
44 |
чд |
12—18 в 1 мин |
tttt |
ft |
Диурез |
1500 мл/сут |
п |
4 |
Ра02 |
90—100 мм рт. ст. |
4 |
4 |
РаС02 |
36—46,6 мм рт. ст. |
4Т |
tt |
Доставка 02 |
520—720л/(минхм2) |
44 |
4 |
рН |
7,35—7,45 |
4, N |
4 |
Лактат арте- |
2—4 м моль/л |
4, N |
Т4 |
риальный |
|
|
|
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
342
Продолжение табл. 11
Показатель |
Норма |
Гипердинамический |
Гипо-динамический |
Реакция на |
|
т |
тт |
нагрузку жид- |
|
|
|
костью (250— |
|
|
|
500 мл солево- |
|
|
|
го раствора) |
|
|
|
Кожа |
Теплая, сухая |
Теплая, |
Холодная, |
|
|
сухая |
влажная |
К+ |
3,5—5,5 ммольЛ |
1 |
! I |
Глюкоза/ |
2—3 раза |
1—11 |
'^/'w' ~-—" ^г ^Г V* |
лактат |
|
|
|
Гемодинамический профиль определяют следующие показатели:
Систолический индекс (СИ) — отношение величины сердечного выброса (СВ), определенного методом термодилюции, к площади поверхности тела (ППТ): СИ = СВ / ППТ л/(минхм2);
доставку кислорода (Д02) определяют умножением полученного значения СИ на содержание кислорода в артериальной крови (SaOJ: Д02=СИх 3а02мл/(минхм2);
потребление кислорода (VO ) — количество его, поглощаемое тканями из капилляров в течение 1 мин. Показатель получают умножением полученного ранее значения СИ на артериовенозный градиент по кислороду (Sa02—Sv02):V02 = CHx(SaO,,—SvO.,) мл/(минхм2).
Оценка транспорта кислорода и уровня гипоксии. Это одна из важнейших проблем диагностики шока. Гипердинамическое состояние сердечно-сосудистой системы на начальном этапе ИТШ обусловливает как повышение доставки кислорода, так и увеличение его потребления. Однако расход кислорода снижается, так как уменьшается экстракция его на периферии (артериовенозные шунты). В норме артериальная кровь, превращаясь в венозную, отдает в ткани 23—27 % содержащегося в ней кислорода. В фазе 1.1. шока тканям временно удается извлекать до 60 % кислорода и даже больше. Увеличение элиминации кислорода в тканях может свидетельствовать как о повышении его потребления, так и об уменьшении его доставки. Высокое поглощение кислорода тканями в сочетании с низким кислородным потоком свидетельствует о возможности неблагоприятного исхода. Усиление потребления кислорода в сочетании с повышенным кислородным потоком является признаком, благоприятным для исхода шока. Однако при шоке существенно нарушается
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
343
периферический кровоток и возникает шунтирование. Поэтому даже при высоких показателях кислородного снабжения наблюдается гипоксия с высоким кислородным долгом.
Гипоксия при шоке может быть вызвана 4 основными причинами:
гипоксемия в результате поражения легких;
циркуляторная гипоксия вследствие существенного снижения сердечного выброса;
анемия, (ДВС-синдром);
высокое потребление кислорода, которое не покрывается избыточной его доставкой, даже если оно близкое к норме (гипердинамическая фаза ИТШ).
Финальная форма гипоксии чаще всего возникает вследствие неспособности тканей потреблять доставленный кислород (блокада микроциркуляторного русла и токсическое поражение метаболически активных клеток). Чем меньше артериовенозная разница по кислороду, тем хуже прогноз. Однако при клинической оценке сниженного периферического потребления кислорода тканями следует учитывать не только величину Pv02, которая в этой ситуации может быть нормальной или даже повышенной, но и длительность развития шокового состояния, показатели легочной оксигенации, сердечного выброса и некоторые другие. Поэтому резкое падение потребления кислорода, которое ранее было чрезвычайно высоким, может быть не благоприятным признаком, а свидетельством продолжающегося ухудшения, скорого летального исхода.
Серьезной является проблема вязкости крови, т.к. усиливается агрегация и эритроцитов. С проведением дилюции и снижением гематокрита снижается и кислородтранспортное свойство крови. Поэтому наиболее благоприятным считается уровень Ht около 0,33—0,35 (с колебаниями от 0,30 до 0,40).
Вместе с тем, в последние годы для оценки адекватности доставки кислорода в клетку применяют измерение рН внутри слизистой оболочки желудка при помощи желудочной тонометрии. Считают, что этот показатель является более надежным индикатором оксигенации и лучшим прогностическим признаком исхода, чем гемодина-мические показатели и расчетные данные утилизации кислорода.
Критерии диагноза. Чрезвычайно важно определить не только развитие шока как такового, но и его стадию, ибо лишь в этом случае возможно назначение адекватного лечения. Критерии ИТШ:
наличие лихорадки и токсикоза в дебюте заболевания;
тахикардия превышает уровень лихорадки, в дальнейшем наступает нормализация температуры тела;
снижение АД;
появление акроцианоза, одышки, олигурии;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
344
изменение сердечного выброса, минутного объема сердца, АЗЛК, ОПСС;
развитие ДВС-синдрома;
лейкоцитоз или лейкопения и палочкоядерный сдвиг более 10 %;
снижение объема кислорода, высокий уровень лактата, выраженный метаболический ацидоз.
Дифференциальный диагноз. ИТШ необходимо отличать от дегид-ратационного, геморрагического, анафилактического, кардиоген-ного видов шока, от тяжелых форм брюшного и сыпного тифов.
При дегидратационном шоке, как и при ИТШ, наблюдается прогрессирующее нарушение гемодинамики.
Дегидратационный шок имеет следующие отличия:
начальными ведущими проявлениями выступают рвота и диарея;
потеря воды и солей носит прогрессирующий и доминирующий характер;
уменьшение скорости расправления кожной складки, сухость слизистых оболочек, снижение фонации;
нехарактерна лихорадка;
быстро развиваются судороги мышц, имеющие восходящий характер;
сознание практически не теряется;
нет проявлений токсикоза (головной боли, ломоты в теле, ми-алгий);
отмечается прогрессирующее увеличение количества эритроцитов, гемоглобина, гематокрита, относительной плотности плазмы;
рано появляются аритмии, нарушения ритма на ЭКГ;
не характерен нейтрофилез.
Геморрагический шок при внутреннем кровотечении, как и ИТШ, сопровождается снижением АД, тахикардией. Но он имеет следующие особенности;
как правило, особенно в начальный период, отсутствуют лихорадка и токсикоз;
часто появляется влажность ладоней;
нарастает бледность кожи;
часто есть связь с закрытой травмой брюшной полости;
отмечается прогрессирующее уменьшение количества эритроцитов, гемоглобина, гематокрита.
При анафилактическом шоке, как и при молниеносной форме ИТШ, наблюдается бурное нарушение гемодинамики. Но этот вид шока характеризуется;
— катастрофическим нарушением АД и пульса сразу же после введения лекарственного вещества или же укуса насекомыми;
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
345
отсутствием лихорадки и токсикоза в начальный период;
жалобами больного на выраженное затруднение дыхания и связанную с этим одышку;
более быстрым прогрессированием процесса, чем при развитии ИТШ;
отсутствием выраженного лейкоцитоза и нейтрофилеза.
При кардногенном шоке также, как и при ИТШ, отмечаются снижение АД, учащение пульса. Но при этом:
часто возникает в пожилом возрасте, при инфаркте миокарда, на фоне длительно существовавшей ИБС;
физическое перенапряжение, наличие психоэмоциональных перегрузок в ближнем анамнезе;
ведущие —болевой синдром, ощущение перебоев, дискомфорта в области сердца;
быстрое появление выраженного цианоза;
отсутствие лихорадки и токсикоза;
отсутствие выраженного лейкоцитоза и нейтрофилеза;
на ЭКГ появление признаков ишемии миокарда, разнообразных нарушений ритма.
При брюшном тифе возможно тяжелое течение с выраженным угнетением сознания и гипотензиеи, что может симулировать позднюю стадию ИТШ. В отличие от него при тяжелом течении брюшного тифа:
нет предшествующей фазы психомоторного возбуждения;
повышение температуры имеет тенденцию к длительному развитию лихорадочной кривой постоянного типа;
характерна брадикардия, в том числе и абсолютная;
максимальное развитие лихорадки, угнетения сознания и гипо-тензии наблюдается поздно, на 2—3-й неделе болезни;
выражена бледность кожи;
отсутствует тахипноэ;
в крови наблюдаются лейкопения и лимфоцитоз.
Нужно отметить, что в редких случаях при брюшном тифе может развиться истинный ИТШ и геморрагический шок, но в разные фазы заболевания.
Гипотензия при сыпном тифе, психомоторное возбуждение, наличие ДВС-синдрома сближают его с ИТШ. Но гипотензия при этом связана с воспалительным процессом в кровеносных сосудах, а не с повреждающим действием токсинов, как в случае ИТШ. При сыпном тифе:
больной имеет завшивленность или был в контакте с подобными лицами;
не выражено тахипноэ;
частота пульса не коррелирует со степенью снижения АД;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
346
психомоторное возбуждение явно преобладает над процессами угнетения ЦНС, сопровождается выраженным галлюцинозом;
сыпь носит розеолезно-петехиальный характер, по типу звездного неба;
нарушения отделения мочи чаще обусловлены характерной парадоксальной ишурией;
в крови нет нейтрофилеза.
Лечение. Это чрезвычайно сложная проблема даже для специализированных стационаров. Объем помощи зависит от стадии, на которой больной поступает в стационар. Кроме того, глобальное значение имеют сроки оказания врачебной помощи. Не потому ли в странах, где первую медицинскую помощь оказывают так называемые парамедики (при шоке качество и сроки оказываемой квалифицированной врачебной помощи имеют основное значение), эффективность препаратов и вообще лечение шока оцениваются только на фазе 1.З., когда действенность даже высококвалифицированных мероприятий оказывается достаточно условной.
Обязательное лечение основного заболевания. При этом следует учитывать так называемый эндотоксиновый потенциал бактерицидных антибиотиков, которые нельзя назначать при ИТШ, ибо они, увеличивая образование эндотоксина, могут существенно утяжелять течение шока. Поэтому возможно применение бактериоста-тических препаратов, а также с осторожностью — бактерицидных с наименее низким эндотоксинообразующим потенциалом. К последним относятся имипенем, фторхинолоны, амикацин. Лечение основного заболевания прерывать нельзя!
Непосредственное лечение шока. Терапия любой стадии включает в себя лечение, которое проводилось на предыдущих стадиях шока.
Принципиальные моменты в лечении ИТШ:
на поздних стадиях шок протекает со сниженным сердечным выбросом и нарушенной общей периферической тканевой перфузией или с нормальным (повышенным) сердечным выбросом и нарушенным распределением периферического кровотока;
рекомендуется достижение сверхнормальных показателей Д02 и V02, учитывая значительное ускорение метаболических процессов. Поддерживать высокий уровень V02 позволит усиление сердечного выброса (насколько это возможно), величина СИ должна на 50 % превышать нормальные значения. Важным критерием является уровень лактата, которым определяется должное количество кислорода. Его необходимо поддерживать в сыворотке крови ниже 2 ммоль/л;
гемодинамический статус при шоке постоянно меняется, поэтому терапию необходимо постоянно контролировать и переоценивать;
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
347
— систолическое АД следует удерживать на уровне 80—85 % от «рабочего».
Стабилизацией гемодинамики лечение шока не заканчивается. Вследствие возможности развития постреанимационных повреждений необходимо продолжать лечение, направленное на повышение оксигенации тканей.
Фаза 1.1. шока. Основным патогенетическим механизмом является патологическое перераспределение жидкости в организме и развитие дефицита ОЦК. Поэтому основой лечения шока в первой фазе является восстановление ОЦК с применением кристаллоидов — сочетания 5 % раствора глюкозы, изотонического раствора натрия хлорида, глюкозо-инсулино-калиевого (ГИК) раствора. Внутривенная инфузия ГИК смеси улучшает гемодинамику у пациентов с сердечным индексом ниже 4 л/(минхм2), механизм ее действия на клеточном уровне не ясен.
Вместе с тем, нет единой точки зрения на характер инфузион-ной среды. Одни отдают предпочтение кристаллоидам, другие — коллоидам, причем по кислородтранспортным свойствам они примерно равны. Каждый из указанных способов восполнения имеет свои достоинства и недостатки. Так, чрезвычайно велика опасность инфузии коллоидных растворов при выраженном синдроме капиллярного просачивания, который часто наблюдается при ИТШ. Формирующийся при этом отек легких является главным компонентом синдрома дыхательной недостаточности, наиболее трудно поддающимся лечению.
Однако на поздних стадиях развития шока синдром капиллярного просачивания выражен всегда и практически все виды инфузион-ных сред становятся опасными. Поэтому имеет смысл применения комбинации вышеуказанных кристаллоидных препаратов в сочетании с 20—25 % раствором сывороточного альбумина, плазмой, растворами желатины, декстранов (реополиглюкин, полиглюкин), пер-фтораном в соотношении 3:1, 2:1.
При наличии гипотензии олигурия не служит противопоказанием для продолжения введения жидкости. С целью предупреждения развития отека легких, когда ЦВД достигает примерно 10— 11 см вод. ст., а давление в легочной артерии—■ 16—18 см вод. ст., следует вводить салуретики с целью усиления диуреза. При ЦВД на уровне 12—14 см вод. ст. продолжение введения жидкости может вызвать быстрое развитие отека легких.
Определенными критериями длительности инфузионной терапии могут служить стабилизация систолического АД на уровне 90—100 мм рт. ст. (при «рабочем» 120—130 мм рт. ст.), ЦВД— 8— 10 см вод. ст., достижение скорости мочеотделения свыше 20 мл/ч.
Основным салуретиком, применяемым в неотложной терапии,
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
348
является фуросемид. Непосредственно диуретический эффект фу-росемида проявляется через 20 мин после введения и длится около 2 ч, причем он может быть причиной стойкого снижения скорости клубочковой фильтрации, вплоть до 10 мл/мин. Начинать введение фуросемида необходимо с дозы 40 мг, при отсутствии эффекта в течение 1 ч препарат вводят повторно.
Но этот препарат обладает специфическим действием на кровообращение, отличным от общеизвестного диуретического. Он может вызывать нежелательные эффекты при лечении шока. Внутривенное введение фуросемида (1мг/кг) приводит к быстрому нарастанию периферического сопротивления и снижению сердечного выброса. Эффект возникает через 5 мин после введения препарата и продолжается около 30 мин. Вазоконстрикция может быть вызвана активацией ренин-ангиотензинной системы. Раньше диуретического эффекта изменяется давление наполнения желудочков сердца, как в сторону повышения, так и в сторону снижения. Предсказать направление изменения невозможно.
Следует помнить, что нестероидные противовоспалительные средства способны блокировать действие фуросемида и некоторых других диуретиков, а также о возможности перекрестной аллергии между фуросемидом и сульфаниламидами.
Важным элементом лечебных мероприятий является поддержание дыхательной функции. В связи с этим с самого начала важно обеспечить свободное дыхание и поступление кислорода через носовой катетер, маску или трахеостому, чтобы предупредить развитие ацидоза и гипоксии.
Восстановление микроциркуляции и ликвидация гипоксии тканей являются важнейшим элементом лечения шока. По сути, оттого, насколько быстро удастся это сделать, во многом зависят результаты лечения шока. Уже на данном этапе показано лечение ДВС-син-дрома или его профилактика (см. соответствующий раздел) с обязательным применением ингибиторов протеаз в дозе 500—1500 МЕ/кг в сутки.
Коррекция КОС осуществляется 3 % раствором натрия гидрокарбоната. В большинстве случаев его вводят для того, чтобы довести рН крови до 7,3 для оптимизации диссоциации оксигемоглобина.
Фаза 1.2. шока. Одними из основных препаратов на этой стадии являются глюкокортикостероиды (ГКС). Как предполагают, они блокируют высвобождение арахидоновой кислоты из клеточных мембран, повышают сердечный выброс, вызывают периферическую ва-зодилатацию, усиливают фагоцитоз, положительно влияют на систему макрофагов (ретикулоэндотелиальную), перенос кислорода гемоглобином, снижают активность лизосомальных ферментов, оказывают дезагрегационное действие на тромбоциты, усиливают клиренс
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК 34д
эндотоксинов. ГКС угнетают комплементобусловленную активацию сегментоядерных клеток. Если учесть, что активация неитрофилов является одним из центральных патогенетических моментов, определяющих развитие синдрома капиллярного просачивания в легких и, следовательно, острой дыхательной недостаточности, то становится понятной их роль в лечении шока. Именно они значительно снижают выраженность острой дыхательной недостаточности.
Следует подчеркнуть, что эффективность ГКС сохраняется до фазы 1.3. шока. Кроме того, необходимо учитывать, что массивная ГКС-терапия благоприятствует развитию инфекционного фактора, может способствовать возникновению желудочно-кишечных кровотечений, снижает толерантность организма больного в критическом состоянии к нагрузке глюкозой. Все это ограничивает длительность их применения.
Опыт свидетельствует в пользу раннего назначения больших доз ГКС в течение относительно короткого периода времени — 24—48 ч. Наиболее эффективным является преднизолон, суточная доза которого может достигать 30 мг/кг в сутки, возможно применение дек-саметазона в дозе до 3 мг/кг в сутки. Препараты должны вводиться внутривенно капельно и струйно. Несмотря на более быструю элиминацию при внутривенном введении, чем при внутримышечном, первое предпочтительнее вследствие нарушения всасывания из мышечного депо при шоке. После выведения из шока препарат обычно быстро отменяют.
Показано применение дофамина. Он является предшественником норадреналина, прямо стимулирует дофаминовые рецепторы и опосредованно активирует а- и р-адренорецепторы, причем эффект стимуляции зависит от дозы. Дофамин вызывает расширение почечных, мозговых и мезентериальных сосудов и, вместе с тем, воздействуя на дофаминовые рецепторы гладких мышц, обусловливает спазм легочных вен, что приводит к повышению давления в легочных капиллярах. Однако в последнее время появились сообщения
недостаточной эффективности малых доз дофамина (5 мкг/кг в
мин) с целью профилактики почечной недостаточности. Введение больших доз вызывает вазоконстрикцию за счет стимуляции периферических а-адренорецепторов. Поэтому при сохранении сердечного выброса дофамин применяется в малых дозах — 1—2 мкг/кг в 1 мин, при снижении его — в средних дозах (3—10 мкг/кг в 1 мин), что приводит также к увеличению сердечного выброса. Следует помнить, что дофамин несовместим с гидрокарбонатом натрия и другими щелочными растворами. Механизм действия дофамина в средних дозах делает его ценным противошоковым препаратом.
При сниженном сердечном выбросе и высоком уровне периферического сопротивления показано применение добутамина. Это
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 350
синтетический катехоламин, введенный в клиническую практику в 1978 г. Он уменьшает периферическое сопротивление, что улучшает условия функционирования сердца и приводит к снижению пред- и постнагрузки на него, причем ЧСС, как правило, остается неизменной, но у пациентов с явлениями гиповолемии наблюдается тахикардия. Добутамин также существенно увеличивает сердечный выброс, но это увеличение дозозависимо. По сравнению с дофамином добутамин обладает более выраженной кардиотонической активностью и реже вызывает желудочковые аритмии. Обычная доза составляет 5—15 мкг/кг в 1 мин при внутривенном медленном капельном введении. Добутамин несовместим с растворами щелочной реакции. Даже кратковременные инфузии добутамина хмогут обеспечить продолжительное улучшение сердечной деятельности (до 4 нед), но механизм этого явления пока не ясен.
Фаза 1.3. шока является критической. Терапия прессорными аминами, которая проводится на этой стадии развития шока, является терапией отчаяния. По сути, они дают время (иногда недостаточное) для ликвидации тех нарушений микроциркуляции и гипоксии органов и тканей, которые развиваются при шоке. Поэтому обязательно проведение лечебных мероприятий предыдущих этапов развития шока.
С лечебной целью может применяться гиперосмотический (7,5 %) раствор натрия хлорида. Механизм его положительного действия заключается в снижении выраженности интерстициального отека миокарда, уменьшении субэндокардиальной ишемии и, следовательно, повышении сократительной способности миокарда.
Сосудосуживающие препараты используют для устранения вазо-дилатации и повышения АД. Однако при шоке фазы 1.3. вазоконс-трикция может быть опасной по следующим причинам:
вазопрессорные средства могут вызвать лактацидемию из-за очень сильного спазма артериол на периферии;
чрезмерный спазм на периферии приведет к усугублению микроциркуляции, гипоксии тканей и метаболизма, что может оказаться фатальным;
катехоламины стимулируют метаболизм и тем самым сводят к минимуму свой благоприятный эффект, обусловливающий увеличение сердечного выброса;
адреналин способен повышать содержание лактата в крови вследствие гликогенолитического действия.
Дофамин применяют в дозе 10—20 мкг/(кгхмин) и более внутривенно капельно. В такой дозе он будет повышать АД без чрезмерной вазоконстрикции, усиливая одновременно почечный кровоток, уменьшая риск почечных осложнений. Однако у некоторых больных может развиться нечувствительность к препарату. Как побоч-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
351
ное действие достаточно часто формируется тахиаритмия, а в очень больших дозах дофамин может вызвать выраженную вазоконстрик-цию. Возможно уменьшение его эффективности после нескольких дней введения вследствие истощения запасов норадреналина, высвобождаемого препаратом из гранул пресинаптических мембран.
Добутамин вводят в дозе 15—20 мкг/(кгхмин) внутривенно ка-пельно. В сочетании с инфузией жидкости добутамин увеличивает реальное потребление кислорода больше, чем дофамин, не говоря уже о больных, нечувствительных к последнему. Как правило, добутамин вызывает в этой ситуации повышение АД. Развитие гипотен-зии во время инфузии добутамина может быть следствием нераспознанной гиповолемии.
При лечении шока может применяться также и норадреналин в случае неэффективности лечения дофамином. Однако риск развития выраженной вазоконстрикции после введения норадреналина существенно ограничивает его применение. Некоторые специалисты считают, что норадреналин значительно эффективнее способствует улучшению гемодинамики и потребления кислорода в органах брюшной полости и почках, чем дофамин.
Норадреналин является стимулятором а-адренорецепторов, но при введении малых доз (менее 2 мкг/мин) может оказывать кардио-стимулирующее действие посредством активизации Pj-адреноре-цепторов. В более высоких дозах стимулирующее действие на (3,-ад-ренорецепторы в значительной степени нивелируют рефлекторные механизмы. Норадреналин вызывает вазоконстрикцию всех сосудов, включая почечные, однако добавление к нему малых доз дофамина— 1 мг/(кгхмин) способствует сохранению почечного кровотока, хотя последнее сейчас оспаривается.
Инфузию норадреналина начинают со скоростью 5 мкг/мин, увеличивая ее до достижения необходимого эффекта. Следует помнить, что эффективные дозы весьма различны, особенно при тяжелом шоке. Средняя терапевтическая доза находится в пределах 0,5— 1 мкг/мин, или 30—70 мкг/мин. Следует помнить о несовместимости норадреналина с изотоническим раствором натрия хлорида или раствором «Лактасоль» (рингер-лактат).
При длительной инфузии препарата может развиться гангрена конечностей, при его попадании в ткани, даже при достаточной фиксации иглы в вене, происходят некроз и изъязвление больших участков тканей. Возможно появление почечной недостаточности, а также иных проявлений периферической вазоконстрикции.
В случае неэффективности сосудосуживающих препаратов показано применение налоксона. Эндогенные опиоиды причастны к нарушениям гемодинамики при шоке. Эффект налоксона, специфического антагониста опиатов и опиоидных пептидов, при ИТШ изу-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
352
чался в эксперименте и клинических условиях, но результаты были достаточно противоречивы. Повышение АД отмечалось при введении малых доз препарата, тогда как большие дозы заметно не влияли на него. Не удалось выявить клинические факторы, которые бы предсказывали благоприятный эффект налоксона. Препарат является достаточно безопасным в применении, среди побочных действий выявлены лишь повышение болевой чувствительности и увеличение содержания катехоламинов в крови в послеоперационный период.
Начальная доза налоксона при внутривенном струйном введении 2 мг (5 ампул). Эффект наступает в течение 3—5 мин. Дозу можно удваивать каждые 15 мин до достижения 10 мг. Получив эффект при подобном введении, можно продолжить нагнетать препарат путем капельной инфузии (при этом ежечасная доза составляет 2h струйной).
ИВЛ показана во многих случаях фазы 1.3. шока, но основным показанием является неэффективное внешнее дыхание. Ее необходимо начинать при Ра02 ниже 60 мм рт. ст. при дыхании атмосферным воздухом или ниже 80 мм рт. ст.— при дыхании кислородом, а РаС02 при этом выше 56 мм рт. ст.
Применение сердечных гликозидов с целью увеличения СИ малоэффективно, так как они требуют увеличения количества кислорода, доставляемого в миокард, что практически невозможно.
В период восстановленного системного АД (в результате комплексной медикаментозной терапии на предыдущем этапе) необходимо контролировать степень ишемии органов и тканей и компенсировать имевшуюся тканевую ишемию, т.к. высокий V02 еще не гарантирует компенсацию предыдущей ишемии и соответствие уровню метаболизма. Поэтому развитие ишемии тканей может продолжаться. В этой ситуации важным показателем удовлетворения метаболических потребностей является уровень лактата (молочная кислота образуется в тканях при неудовлетворительном снабжении кислородом и поступает в кровь). Как правило, в артериальной крови при физическом покое уровень лактата в норме ниже 2 ммоль/л, а в условиях стресса — не превышает 4 ммоль/л. Печень преобразует молочную кислоту очень активно и даже ее тяжелое заболевание само по себе не приводит к накоплению лактата в крови.
Подходы к лечению этой фазы шока представлены на рис. 24.
Если V02 меньше 110 мл/(минхм2), то увеличения сердечного выброса достигают введением кристаллоидов. Инфузионная терапия проводится до тех пор, пока ДЗЛК не возрастет до уровня > 18 мм рт. ст., при котором высока опасность развития отека легких. Она всегда предпочтительнее для восстановления периферического кровообращения, чем лекарственные средства, влияющие на гемо-
ИНФЕКЦИОННО-ТОКСИЧЕСКИЙ ШОК
353
ДЗЛА/СВ/ОПСС
Низкое •*-
Инфузионная
терапия,
добутамин
-*- НОРМА <-
т —V0,
2
т
НОРМАЛЬНОЕ
АД
Высокое
Наблюдение
Содержание лактата в сыворотке крови
~*~ < 4 ммоль/л
> 4 ммоль/л
Инфузионная терапия, добутамин
Рис.24
Подходы к лечению шока после стабилизации гемодинамики (по PL Marino, 1996)
динамику. Если же инфузионное лечение не может быть продолжено, то для повышения сердечного выброса назначают добутамин.
Если V02 снижается, то тактику дальнейшего лечения определяет уровень лактата в артериальной крови: при концентрации его выше 4 ммоль/л увеличения сердечного выброса достигают инфузионной терапией или введением добутамина.
Подобный подход позволяет уменьшить риск повреждения органов в восстановительный период.
Профилактика. Поскольку в настоящее время не определены убедительные критерии, позволяющие в каждом конкретном случае спрогнозировать возможность развития ИТШ, то основное значение принадлежит профилактике конкретных болезней, часто осложняющихся этим видом шока. Общие меры по предупреждению тех инфекционных заболеваний, которые нередко сопровождаются формированием в своем течении ИТШ, изложены в соответствующих разделах руководства. Раннее начало этиотропного лечения, адекватное и интенсивное наблюдение больных, у которых имеется подозрение на возможность развертывания ИТШ, своевременная диагностика его на ранней стадии позволяют вовремя вмешаться в течение данного осложнения и добиться благоприятного исхода.
23 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
354
Дегидратационный шок
Дегидратационный шок — патологическое состояние, развивающееся в результате катастрофического уменьшения объема циркулирующей жидкости из-за нарастающей потери организмом воды и электролитов (дегидратации и деминерализации) в результате рвоты и диареи, что характеризуется выраженными изменениями водно-электролитного баланса, кислотно-основного состояния, сердечной деятельности, сосудистого и мышечного тонуса, функции почек, развитием гипоксии.
Лат. — shock dehydratationum.
Анг. — dehydration shock.
Дегидратационный шок является разновидностью гиповолемического шока и развивается в результате внешних потерь жидкости.
Гиповолемический шок — это патологическое состояние, развивающееся при катастрофическом уменьшении объема циркулирующей крови (ОЦК) в организме.
Потеря ОЦК может происходить в результате разных причин. Это отражено в классификации Е. Braunwald и G. Williams (1987), согласно которой различают гиповолемический шок:
в результате внешних потерь жидкости:
кровотечение (геморрагический шок);
дегидратация (потери в результате рвоты и диареи);
потери через почки (сахарный и несахарный диабет, избыточный прием мочегонных препаратов);
потери через кожу (ожоговая болезнь, раневая болезнь, гипертермия, избыточное потоотделение);
в результате секвестрации жидкости внутри организма:
переломы (травматический шок);
асцит (перитонит, панкреатит, цирроз печени);
кишечная непроходимость;
распространенные отеки;
гемоторакс;
гемоперитонеум.
Как видно из приведенной классификации, некоторые варианты гиповолемического шока сопровождаются потерей не только воды и электролитов, но и форменных элементов крови (кровотечения, гемоторакс, гемоперитониум). Не все варианты гиповолемического шока имеют равное значение в практике инфекциониста. С некоторыми из них он даже может ни- разу в своей деятельности и не
ДЕГИДРАТАЦИОННЫИ ШОК
355
встретиться (например, с травматическим шоком). С другой стороны, гиповолемия развивается при довольно большом количестве инфекционных заболеваний. Но развивающийся в подобной ситуации дефицит ОЦК редко приводит к шоковым нарушениям гемодинамики и довольно легко купируется, в том числе и банальным приемом жидкости.
Гиповолемический шок вследствие кровопотери может осложнять течение брюшного тифа и паратифов, некоторых геморрагических лихорадок (Ласса, Марбург, Эбола, желтой). Но лечебные мероприятия в этой ситуации давно определены, восполнение ОЦК осуществляется компонентами крови, что подробно изложено в разделах, посвященных этим заболеваниям.
Однако в инфекционной патологии наиболее часто встречается и максимальное значение имеет вариант гиповолемического шока — дегидратационный шок, который может развиться при многих инфекционных заболеваниях. Этому шоку посвящен данный раздел.
Гиповолемический шок из-за почечных потерь может осложнить период полиурии ОПН в случаях тяжелого лептоспироза, ГЛПС и некоторых других инфекционных заболеваний. Принципы развития этого состояния, его лечения изложены в главах, посвященных этим заболеваниям, а также ОПН (см.) при инфекционных болезнях.
При тяжелом течении малярии, когда гиповолемия развивается в результате как высокой лихорадки, так и профузного потоотделения может понадобиться ее медикаментозная коррекция. Но лишь в редких случаях это осложнение требует реанимационно-интенсивной терапии, так как все-таки не доходит до состояния истинного шока, который может возникнуть только при церебральной форме малярии. Принципы и особенности лечения шока в подобной ситуации изложены в главе «Малярия».
Довольно редко при инфекционных болезнях встречается гиповолемический шок вследствие секвестрации жидкости. Он может развиться на стадии декомпенсированного цирроза печени как финала течения хронических вирусных гепатитов, когда появляется асцит. Патогенез этого явления, принципы терапии сформулированы в разделе «Вирусные гепатиты». При тяжелом течении кожной формы сибирской язвы может наблюдаться гиповолемический шок в результате распространенного отека. В главе «Сибирская язва» подробно рассмотрены такие состояния.
Гиповолемия может иметь значение в развитии поздних стадий и других видов шока, к примеру инфекционно-токсического, анафилактического (см. соответствующие разделы). Как важный и нередко ведущий компонент при некоторых заболеваниях она иногда может участвовать в формировании смешанного шока, как, напри-
23»
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
356
мер, при одновременном развитии инфекционно-токсического и де-гидратационного шока в отдельных случаях сальмонеллезов.
Краткие исторические сведения. Проблема дегидратаций стояла перед человечеством давно. Еще Гиппократ в V в. до н. э. в своих трудах приводил примеры клинических состояний, сопровождавшихся обезвоживанием. Появление холерных пандемий в XIX в. привело к новому витку клинического интереса к дегидратациям. Т. Lyatta в 1832 г. впервые применил солевой раствор для лечения больного холерой. С. Rokitansky в своих работах в 40-е годы XIX в. большое значение придавал «обескровливанию» в результате сгущения крови, определяя пусковой механизм этого как «изнурительный экс-судативный процесс в результате поноса и рвоты». F. Pachini в 50-е годы того же века сообщал о первостепенном значении нарушения водного обмена при ряде патологических состояний, в том числе и инфекций.
Классические исследования расстройств водно-солевого обмена были предприняты в 80-е годы XIX в. в Лондоне S. Ringer. В результате проведенных изысканий был создан раствор для коррекции дегидратаций, ставший надолго основным при лечении данных состояний. Дальнейшее развитие этого направления в XX в. произошло благодаря работам D. Gemble, который провел фундаментальные экспериментальные исследования нарушений обмена жидкости у детей при различных патологических состояних. Работы в середине XX в. были продолжены D. Derrow, предложившим схему лечения дегидратаций. Особое значение для терапии дегидратационного шока имели фундаментальные работы R, Phillips в 40—60-е годы XX в. Он показал, что испражнения при кишечных инфекциях, особенно при холере, носят изотоничный плазме крови характер. R. Phillips впервые определил спектр теряемых электролитов и предложил восполнять их потери парентеральным введением сбалансированных полиионных растворов.
Актуальность. Ежегодно в мире около 2 млрд людей болеют острыми кишечными инфекциями. По статистическим подсчетам, более 60 % этих инфекций сопровождается ощутимыми нарушениями водно-солевого обмена, а около 15 % — развитием шоковых реакций на их основе. Особенно это относится к холере, эшерихиозам, саль-монеллезам, ротавирусным поражениям у детей, при которых дегид-ратационный шок является ведущей причиной смерти.
Диарейный синдром и рвота — характерные проявления кишечных инфекций, поэтому наиболее часто приходится иметь дело с дегидратационным шоком как осложнением течения заболеваний из этой группы инфекций. Однако частота развития подобного осложнения разная. Так, при холере, энтеротоксигенных эшерихио-зах дегидратационный шок встречается в 30—40 % случаев. Реже
ДЕГИДРАТАЦИОННЫИ ШОК
357
этот вид шока осложняет течение сальмонеллезов, шигеллеза Зонне, пищевых токсикоинфекций, вызванных условно-патогенными возбудителями, в отдельных вспышках достигая 3—7 %. Казуистичен дегидратационный шок при кампилобактериозе, кишечном иерси-ниозе, псевдотуберкулезе, шигеллезах, вызванных другими видами шигелл, вирусных поражениях кишечника.
Большое значение в реализации потенции развития дегидратаци-онного шока имеют особенности самого больного. Так, низкие возможности адаптационных механизмов регуляции у новорожденных приводят к тому, что ротавирусы способны вызвать у них в большинстве случаев дегидратационный шок, тогда как у взрослых подобное осложнение — казуистика. Инволюционное снижение компенсаторных процессов приводит к тому, что у лиц пожилого и старческого возраста скорее и в большем проценте случаев развивается дегидратационный шок, чем у молодых. Несовершенство регуляции водно-солевого обмена у детей младшего возраста способствует также быстрому и частому развитию этого вида шока. Более чувствительны к потерям жидкости тучные люди, так как их организм содержит меньше жидкости. При прочих равных условиях дегидратационный шок быстрее развивается у женщин, так как у них снижено содержание воды в организме в сравнении с мужчинами.
Классификация. Иногда выделяют компенсированный дегидратационный шок (при отсутствии изменений гемодинамики в покое), субкомпенсированный (при снижении систолического АД до уровня фильтрационного для данного организма) и декомпенсированный (при снижении систолического АД ниже уровня фильтрационного). Однако данная классификация не удовлетворяет клиницистов тем, что в основу ее положены нарушения гемодинамики, которые могут изменяться не только из-за дегидратации и деминерализации, но и при воздействии других факторов (влияние токсинов на сосудистую иннервацию, поражения сердечной мышцы и др.).
В клинической практике для характеристики степеней обезвоживания при кишечных инфекциях удобны классификации В.И.Покровского и ВОЗ (1974, 1992) — см. «Холера». Считают, что II—IV степени дегидратации по В.И. Покровскому и выраженное, тяжелое обезвоживание согласно оценке ВОЗ соответствуют развитию дегидратационного шока.
Патогенез. Прежде чем перейти к изложению непосредственно патогенеза дегидратационного шока, считаем необходимым напомнить о некоторых показателях, обеспечивающих нормальное функционирование человеческого организма [кислотно-основное состояние — КОС, водно-электролитный обмен), раскрыть понятие «диа-рейный синдром», охарактеризовать варианты дегидратации.
Важнейшим условием нормальной жизнедеятельности организма
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
358
является поддержание на должном уровне КОС. Кислотно-основное состояние (равновесие)— это процесс, который сопровождается непрерывным образованием и выделением кислот. Равновесие биологических систем макроорганизма непосредственно связано с сохранением нормального рН крови и тканей и достигается активными физико-химическими процессами, направленными на сохранение этой константы. Изменения КОС связаны с малейшими сдвигами в в одно-электролитном обмене. Любое повреждение органа или системы, нарушающее транспорт водорода, приводит к изменению рН. Поддержание нормальной концентрации ионов водорода (Н + ) имеет решающее значение для работы ферментативных систем клетки. При нормальной рН концентрация Н+ составляет около 40 нмоль/л. Уменьшение рН ниже 6,8 и увеличение выше 7,7 соответствуют пределам его нелетальных изменений в организме, при этом концентрация Н+ изменяется от 20 до 160 нмоль/л. Поддержание постоянства КОС достигается содружественной работой буферных систем, легких, почек.
Буферные системы — это биологические жидкости организма, которые поддерживают рН на нормальном уровне. Любая буферная система состоит из смеси слабой кислоты и ее соли, образованной сильным основанием (щелочью). Попадание в систему сильной кислоты приводит к реакции буферных систем, в результате чего образуется слабая кислота. При попадании в систему сильного основания образуется слабое основание. Такие процессы регуляции приводят к тому, что рН или не изменяется, или же происходят его минимальные сдвиги. Среди буферных систем организма основное значение принадлежит гидрокарбонатной (53 % буферной способности). Кроме нее имеются гемоглобиновая (35%), протеиновая (7 %) и фосфатная (5 %) системы.
Реакции в буферных системах приводят к образованию диоксида углерода (углекислого газа, СО,,), избыточное количество которого выводят легкие. В сутки образуется до 2х106/л диоксида углерода и почти такое же количество выделяется наружу при дыхании. В результате этого процессы образования диоксида углерода и его выведения легкими находятся в стабильном равновесии.
Роль почек в процессе регуляции КОС велика, но изучена еще недостаточно. Известно, что почки участвуют в восстановлении гидрокарбонатного буфера. При снижении его концентрации в крови проксимальные канальцы реабсорбируют буфер. Происходит также незначительная экскреция Н+ с мочой. Более значительное выведение водорода происходит в связанной форме в виде кислот, образовавшихся при работе фосфатного буфера. Однако действие этого механизма непродолжительное. Образование в почечных канальцах аммиака также способствует выведению из организма Н + : аммиак в
ДЕГИДРАТАЦИОННЫЙ ШОК
359
моче соединяется с Н+ и выводит их наружу, не давая возможности реабсорбироваться. К сожалению, почки лишь постепенно увеличивают концентрацию выводимых кислот в моче, что является причиной медленной компенсации.
Если рН крови сдвигается в кислую сторону, то говорят об ацидозе, если в щелочную, то об алкалозе. Данные об изменениях рН артериальной крови приведены в табл. 12.
Таблица 12. Общая характеристика изменений рН артериальной крови у человека
Показатели рН крови |
6,8—7,28 |
7,29—7,34 |
7,35—7,45 |
7,46—7,56 |
7,56—7,7 |
Трактовка |
Декомпен- |
Субком- |
Норма |
Декомпен- |
Субком- |
полученного |
сирован- |
пенсиро- |
|
сирован- |
пенсиро- |
показателя |
ныи |
ванныи |
|
ныи |
ванныи |
|
ацидоз |
|
алкалоз |
||
Примечание. Значения рН ниже 6,8 и выше 7,7 несовместимы с жизнью.
По механизму возникновения различают ацидоз и алкалоз метаболический и респираторный (дыхательный). В основе метаболических изменений КОС лежат изменения количества оснований во внеклеточной жидкости. При респираторных нарушениях основное значение имеет степень содержания диоксида углерода в организме. Характеристика этих нарушений приведена в табл. 13.
Чаще всего в результате возникновения какого-либо нарушения КОС постепенно появляются и другие виды его расстройства, поэтому врач в основном имеет дело со смешанными нарушениями (например, дыхательный и метаболический ацидоз). Смешанный характер нарушений вызывает значительные затруднения в диагностическом процессе и требует от врача более внимательного отношения к подобному состоянию.
Водный баланс. Человеческий организм в основном состоит из воды. У новорожденных общее количество ее составляет около 80 % массы тела. Уменьшается объем воды в пожилом возрасте. Женский организм содержит жидкости меньше, чем мужской, — в среднем у здорового мужчины вода составляет около 60 %, а у здоровой женщины — до 50 % массы тела. У людей с избыточной массой тела содержится иногда до 42 % воды, а у лиц с пониженным питанием — до 75 %. В жировой ткани приблизительно 30 % воды, тогда как в обезжиренной массе — 72—73 %. Этим объясняется тот факт, что тучные
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
360
Таблица 13. Характеристика метаболических и респираторных изменений КОС
Состояние |
Основное характеризующее свойство |
Наиболее частые причины |
Метаболический ацидоз Метаболический алкалоз Респираторный ацидоз Респираторный алкалоз |
Дефицит оснований во внеклеточной жидкости Избыток оснований во внеклеточной жидкости Избыточное накопление диоксида углерода в организме. Чаще всего из-за нарушения функции внешнего дыхания Выделение из организма диоксида углерода выше уровня его продукции |
Гиповолемия Почечная недостаточность разного генеза Интенсивная потеря соляной кислоты из желудка в результате выраженной рвоты Гипокалиемия Лечение большими дозами кор-тикостероидов и диуретиков Избыточное введение гидрокарбоната в организм Отек легкого Тяжелые пневмонии Поздние стадии шока («шоковое» легкое) Истерия Некоторые заболевания ЦНС Гипертермия Тромбоэмболия легочной артерии ОПЭ |
люди тяжелее переносят потери воды, нежели те, у которых масса тела нормальная или сниженная.
Примерно 2/з водной среды организма сосредоточено в клетках, что составляет внутриклеточное пространство; ]/з приходится на внеклеточное пространство, которое в свою очередь разделяется на внутрисосудистый, интерстициальный и трансцеллюлярный (межклеточный) секторы. Внутрисосудистый сектор — это плазма крови, имеющая постоянный катионно-анионный состав и содержащая белки, удерживающие жидкость в сосудистом русле. На него приходится количество воды, равное приблизительно 4—5 % массы тела. Интерстициальный сектор — это среда, в которой расположены и активно функционируют клетки. Количество этой жидкости составляет около 15 % массы тела. Трансцеллюлярный сектор — это жид-
ДЕГИДРАТАЦИОННЫИ ШОК
361
кость, которая располагается в полостях организма, в том числе и в пищеварительном тракте, она составляет 1—2 % массы тела.
Водный баланс в организме поддерживается адекватным поступлением воды в соответствии с ее потерями и регулируется различными механизмами, среди которых основное значение имеет runoma-ламо-гапофизарно-надпочечниковый и ренальныи.
Система гипоталамус—гипофиз—надпочечники реагирует на изменения осмолярности плазмы крови, включая механизм образования антидиуретического гормона и альдостерона, что уменьшает или усиливает диурез в зависимости от степени увеличения или уменьшения осмолярности плазмы. Большое значение имеет ренальныи механизм регуляции, связанный с непосредственным образованием мочи в почках.
Процессы регуляции водного баланса очень сложны, многообразны, тесно взаимосвязаны с функционированием других органов и систем и быстро изменяются в зависимости от меняющегося действия факторов внешней среды. Не все компоненты этого равновесия до конца изучены.
Суточная потребность организма в воде зависит от множества факторов: массы тела, возраста, пола, температуры окружающей среды, психоэмоционального состояния человека и др., поэтому колеблется довольно в широких пределах, чаще всего составляя 1—3 л в сутки. Количество выпиваемой воды приблизительно соответствует диурезу, а количество воды, образуемой эндогенно в результате переваривания пищи, примерно равно потерям вследствие дыхания и потоотделения. Нормальным показателем неощутимых потерь воды у взрослого человека с массой тела 70 кг является 1 л в сутки.
Для понимания механизмов развития дегидратационного шока важное значение имеет представление о кишечной составляющей регуляции водного обмена. Каждые сутки в пищеварительный тракт поступает приблизительно 9 л жидкости. Из этого количества около 2 л приходится на долю выпитой жидкости. Остальное количество составляют секрет слюнных, желудочных, поджелудочной, панкреатических желез и желчь, необходимые для обеспечения нормального пищеварения. Большая часть этой жидкости абсорбируется в верхних отделах кишечника. Приблизительно 1 л жидкости, содержащей непереваренные остатки пищи и продукты распада клеток, проходит через илеоцекальный клапан в толстый кишечник. После экстенсивного процесса пищеварения и абсорбции в тонкой кишке сохраняется очень небольшая питательная ценность этой жидкости. Основная функция толстой кишки заключается в формировании из данной жидкости плотных каловых масс. Эту функцию в норме обеспечивают несколько процессов: абсорбция жидкости и электролитов, перистальтические сокращения (перемешивание, отжимание
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
влаги и прохождение каловых масс к прямой кишке) и, наконец, дефекация.
В средних широтах северного полушария содержание растительных волокон в употребляемой пище низкое, поэтому средняя суточная масса кала составляет менее 200 г, из которых 60—80 % приходится на воду. Таким образом, ежесуточно в толстой кишке в норме абсорбируется 80—90 % поступающей в нее воды и 800 мг натрия. Абсорбция жидкости происходит пассивно, осмотически, в основном в восходящей и поперечной ободочной кишках, вслед за активным транспортом ионов натрия и хлора. В обмен на хлор происходит секреция гидрокарбоната, который под действием кишечных бактерий превращается в диоксид углерода.
Термин «диарея» обычно обозначает частые или жидкие испражнения. Основываясь на вышеописанных физиологических закономерностях, диарею для проживающих в наших районах можно определить, как выделение более 200 г испражнений в сутки при низком содержании растительных волокон в употребляемой пище.
Диарею можно классифицировать по типам лежащих в ее основе механизмов. Краткая характеристика диарейного синдрома приведена в табл. 14, которая представляет собой модифицированную нами таблицу S. Goldfinger (1987).
Таблица 14. Характеристика типов диарейного синдрома
Тип диареи
1. Секреторная
Механизм
t секреции воды и электролитов I абсорбции воды и электролитов
Разные пусковые факторы (токсины бактерий, гастрин, кальци-тонин, проста-гландины, вазо-активный пептид кишечника и др.)
Характеристика испражнений
Светлые, водянистые, состоящие в основном из воды и электролитов, нет ней-трофильных лейкоцитов
Основные причины
Холера
Энтеротоксиген-ные эшерихиозы Синдром Золлин-гера-—Эллисона Медуллярный рак щитовидной железы Синдром «панкреатической холеры» Отравление бледной поганкой
Ворсинчатая опухоль прямой кишки
ДЕГИДРАТАЦИОННЫЙ ШОК 363
Продолжение табл. 14
Тип диареи |
Механизм |
Характеристика |
Основные |
|
|
испражнений |
причины |
2. Экссудативная |
Нарушение аб- |
Гнойные. Обя- |
Большинство |
|
сорбции в тол- |
зательно присут- |
шигеллезов |
|
стой кишке, ги- |
ствуют нейтро- |
Дизентерие- |
|
бель клеток не- |
фильные лейко- |
подобные эшери- |
|
кротизирован- |
циты и кровь (яв- |
хиозы |
|
ной слизистой |
но или скрыто) |
Протозойные бо- |
|
оболочки и изли- |
|
лезни кишечни- |
|
яние коллоидов |
|
ка (амебиаз, ба-лантидиаз и др.) Некоторые глистные инвазии (трихоцефалез, стронгилоидоз) Неспецифический язвенный колит |
3. Осмотическая |
Накопление не- |
Светлые, обиль- |
Вирусные гаст- |
|
абсорбируемых |
ные, не содержат |
роэнтериты |
|
молекул в про- |
нейтрофильных |
Лямблиоз |
|
свете кишечни- |
лейкоцитов |
Цестодозы |
|
ка, что приводит |
|
Тяжелые формы |
|
к снижению аб- |
|
аскаридоза |
|
сорбции за счет |
|
Дефицит лак- |
|
увеличения ос- |
|
тазы |
|
мотического гра- |
|
Панкреатичес- |
|
диента |
|
кая недостаточность |
4. Обуслов- |
Уменьшение пло- |
Изменчивые |
Субтотальная |
ленная анатоми- |
щади поверхнос- |
|
колонэктомия |
ческими наруше- |
ти, на которой |
|
Желудочно-тол- |
ниями |
происходит аб- |
|
стокишечный |
|
сорбция |
|
свищ |
5. Обусловлен- |
Снижение вре- |
Изменчивые |
Гипертиреоз |
ная расстрой- |
мени контакта |
|
Синдром раздра- |
ством двигатель- |
жидкости с по- |
|
женного кишеч- |
ной функции |
верхностью, где происходит абсорбция |
|
ника |
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
364
Продолжение табл. 14
Тип диареи |
Механизм |
Характеристика испражнений |
Основные причины |
6. Смешанная |
Вызванная соче- |
Изменчивые |
Сальмонеллезы |
|
танием механиз- |
|
Шигеллез Зонне |
|
мов |
|
Некоторые эше-рихиозы Кишечная инфекция у больных с анатомическими нарушениями и т.д. |
Сравнительное содержание белка и электролитов в плазме крови и кишечном транссудате (испражнениях) приведено в главе «Холера».
В зависимости от того, что происходит — потери жидкости или ее избыточное поступление, различают состояния дегидратации и гипергидратации. В соответствии с формирующейся в результате этих процессов осмолярностью плазмы крови дегидратация и гипергидратация могут быть гипертоническими, нормотоническими (изотоническими) и гипотоническими. Конечно, в клинической практике основное значение имеет дегидратация, так как организм может без особых проблем вынести увеличение объема внеклеточной жидкости на 200 %, тогда как острое уменьшение этого объема более чем на 20 % приводит к смерти. Поэтому остановимся на характеристике дегидратаций.
Гипертоническая дегидратация развивается в результате потери гипотонической жидкости при трахеобронхите, пневмонии, гипертермии, профузном поте, гипо- и изостенурии при многих хронических заболеваниях почек, в стадии полиурии периода реконвалес-ценции острой почечной недостаточности, при избыточном диурезе у больных сахарным и несахарным диабетом, назначении высоких доз осмодиуретиков. При этом уменьшается объем жидкости внутриклеточного пространства, так как во внутрисосудистом секторе вода еще достаточно удерживается за счет увеличения осмолярнос-ти плазмы крови. Нарушения кровообращения возникают лишь при крайне выраженном обезвоживании, при бессознательном состоянии больного в результате невозможности приема жидкости.
Изотоническая дегидратация развивается вследствие потерь жидкости со рвотой, диареей, через различные свищи из органов пищеварительного тракта; в результате неумеренного лечения не-
ДЕГИДРАТАЦИОННЫИ ШОК
365
осмотическими диуретиками, задержки жидкости в кишечнике при непроходимости, перитоните; при обильной секреции с раневой или ожоговой поверхности, при массивной кровопотере. Главным образом изменяется объем жидкости внеклеточного пространства, при этом уменьшается объем внутрисосудистого и интерстициального секторов. Однако осмолярность плазмы крови не изменяется.
Гипотоническая дегидратация (соледефицитный эксикоз) развивается при потерях солей в случае нерационального лечения изотонической дегидратации бессолевыми растворами (например, 5 % раствором глюкозы), особенно улиц с заболеваниями сердца, почек, печени, при обильном насыщении организма жидкостью (чаем, водой), а также после успешной реанимации при утоплении в пресной воде, при обильном промывании желудка обычной питьевой водой, голодании. Вследствии гипотонии (гипоосмолярности) плазмы крови вода уходит из интерстициального сектора в клетки, в результате появляется определенная гипергидратация клеток. Для этого состояния характерно превышение скорости выведения воды из организма над процессами восстановления водного баланса.
Значение электрически заряженных частиц (электролитов) для существования организма неоценимо. Они играют ведущую роль в гомеостазе, создавая мембранные потенциалы, участвуют в обмене веществ и воды, утилизации кислорода, переносе и сохранении энергии, деятельности органов и клеток. Основное значение в патогенезе нарушений электролитного обмена принадлежит натрию, калию, хлору, кальцию, магнию.
Натрий — важнейший катион внеклеточного пространства, который является основным фактором, поддерживающим осмотическое давление в нем. Даже незначительный дефицит натрия не восполняется другими катионами, поэтому в такой ситуации немедленно изменится осмотическое давление и объем внеклеточной жидкости. Увеличение концентрации натрия в интерстициальном секторе приводит к выходу воды из клеток, и наоборот, уменьшение — к перемещению воды в клетки. Нормальная концентрация натрия в плазме крови составляет 135—150 ммоль/л, уменьшение ее ниже 135ммоль/л расценивается как гипонатриемия, а увеличение выше 150 ммоль/л — как гипернатриемия.
Калий является основным катионом клеток. Большая часть его (98 %) концентрируется внутри клетки в виде непрочных соединений с белками, углеводами, креатинином, фосфором и небольшое количество — в виде свободных ионов. Вне клеток калий находится преимущественно в ионизированной форме. Калию принадлежит ведущая роль в поляризации клеточной мембраны, что является важнейшим фактором обмена клетки с окружающей средой. Он также участвует в белковом обмене, утилизации гликогена клетка-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 366
ми, процессах нервно-мышечного возбуждения и фосфорилирова-ния. Велико его значение в слаженной работе сердечно-сосудистой системы, пищеварительного тракта, почек. Нормальная концентрация калия в плазме крови составляет 3,5—5,5 ммоль/л, концентрация ниже 3,5 ммоль/л расценивается как гипокалиемия, выше 5,5 ммоль/л — как гиперкалиемия.
Кальций — катион внеклеточного пространства. Биологическая активность присуща только ионам кальция. Они оказывают влияние на возбудимость нервно-мышечной системы, проницаемость мембран, свертывание крови. В норме концентрация кальция в плазме крови равна 2,1—2,6 ммоль/л. Концентрация ниже 2,1 ммоль/л расценивается как гипокальциемия, выше 2,6 ммоль/л — как гипер-кальциемия.
Магний также, как и калий, является клеточным катионом. В клетке его концентрация значительно выше, чем вне ее. Он играет важную роль в ферментативных процессах — утилизации кислорода, гликолизе, выделении энергии. В норме концентрация магния в плазме крови составляет 0,8—1,2 ммоль/л. Гипомагниемия — это концентрация магния ниже 0,8 ммоль/л, гипермагниемия — концентрация выше 1,2 ммоль/л.
Хлор — основной анион внеклеточной жидкости, участвует в поляризации клеточных мембран, находясь при этом в равновесных отношениях с натрием. В норме его концентрация в плазме крови составляет 100—106 ммоль/л. Соответственно гипохлоремия диагностируется при концентрации его ниже 100 ммоль/л, а гиперхло-ремия — при увеличении выше 106 ммоль/л.
Клинические проявления дисбаланса электролитов приведены в табл. 15.
Таким образом, необходимо отметить, что патологические проявления, возникающие при дегидратационном шоке, многогранны и затрагивают большое количество органов, систем, механизмов регуляции и адаптации.
Наиболее тяжелые поражения развиваются в случаях изотонической дегидратации, которая в свою очередь быстро нарастает при секреторной или смешанной диарее. Тяжелые степени подобного процесса и приводят к развитию дегидратационного шока. Наиболее ярко этот вид шока развивается при холере. Подробно патогенез холеры изложен в соответствующей главе.
В энтероците происходит постоянный биохимический процесс перехода аденозинтрифосфата (АТФ) в аденозинмонофосфат (АМФ), в результате которого клетка получает энергию. Этот цикл имеет естественные фазы, катализируется ферментами. В первой фазе АТФ превращается в 3,5 циклический аденозинмонофосфат (3,5 цАМФ) и катализируется аденилатциклазой, вторая фаза — из недоокис-
ДЕГИДРАТАЦИОННЫЙ ШОК
367
Таблица 15. Характеристика нарушений баланса основных электролитов
|
|
Болезни, |
|
Болезни, |
Электролит |
Дефицит |
при которых наблюдается дефицит |
Избыток |
при которых наблюдается избыток |
Натрий |
Обусловлен со- |
Все забо- |
Обусловлен нару- |
Все забо- |
|
путствующими |
левания, |
шениями водного |
левания |
|
нарушениями |
что при- |
обмена |
и состоя- |
|
водного обмена |
водят к |
Жажда, гипертер- |
ния, со- |
|
Усталость, апа- |
гиперто- |
мия, тахикардия, |
провож- |
|
тия, головокру- |
нической |
повышение АД, |
дающие- |
|
жение, ортоста- |
или изо- |
появление отеков, |
ся гипер- |
|
тические кол- |
тоничес- |
заторможенность |
гидрата- |
|
лапсы, снижение |
кой де- |
В дальнейшем спу- |
цией |
|
систолического |
гидрата- |
танное сознание, |
|
|
АД В дальнейшем ступор,судороги, кома |
ции |
кома |
|
Калий |
Астенизация, |
Стеноз |
Повышение то- |
ОПНи |
|
сонливость, ади- |
верхних |
нуса скелетных |
ХПН |
|
намия, мышечная |
отделов |
мышц, рвота, по- |
Лептоспи- |
|
слабость, тета- |
пищева- |
нос, психотичес- |
роз |
|
ния, тенденция к апноэ, на ЭКГ уплощение зубца X удлинение ин- |
рительного тракта ОКИ Гиперкор - |
кие расстройства, нарушение чувствительности, бра-дикардия, на ЭКГ |
Стресс Острый гемолиз Тяжелые |
|
тервала 0—X тахикардия, экстра-систолия и дру- |
тицизм Панкреатиты |
высокий и узкий зубец Т, депрессия сегмента 5—Г |
травмы, ожоги Болезни с |
|
гие нарушения |
Свищи |
и зубца Р, расши- |
декомпен- |
|
ритма, остановка |
пищевари- |
рение комплекса |
сирован- |
|
сердца в систоле |
тельного |
ORS с удлинением |
ным аци- |
|
|
тракта Альдосте-ронизм Хронический пиелонефрит |
интервала Р—R, мерцание желудочков и остановка сердца в диастоле |
дозом |
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
368
Продолжение табл. 15
|
|
Болезни, |
|
Болезни, |
Электролит |
Дефицит |
при которых наблюдается дефицит |
Избыток |
при которых наблюдается избыток |
Кальций |
Повышение |
Гипопара- |
Снижение нервно- |
Гиперпа- |
|
нервно-мышеч- |
тирео- |
мышечной прово- |
ратирео- |
|
ной возбудимос- |
идизм |
димости, слабость, |
идизм |
|
ти, резкая сла- |
Дефицит |
заторможенность, |
Миелом- |
|
бость, головокру- |
витами- |
на ЭКГ укоро- |
ная бо- |
|
жение, тетания, |
на D |
чение интервала |
лезнь |
|
спазмофилия, на |
Панкреа- |
О—Т, повышение |
Болезнь |
|
ЭКГ уплощение |
тическая |
АД, возможность |
Педжета |
|
зубца Т, депрес- |
недоста- |
различных сердеч- |
Гипер- |
|
сия сегмента S—Т |
точность |
ных нарушений |
витами-ноз D |
Магний |
Повышенная |
Хроничес- |
Гипотензия, сон- |
Почечная |
|
нервно-мышеч- |
кий алко- |
ливость, отсут- |
недоста- |
|
ная возбуди- |
голизм |
ствие сухожиль- |
точность |
|
мость, судороги, |
Цирроз |
ных рефлексов, |
Тяжелый |
|
страх, рвота, де- |
печени |
угнетение дыха- |
сахарный |
|
прессия, психотические расстройства, иногда ларинго- и брон-хоспазм, снижение АД |
Острый панкреатит |
ния, кома |
диабет |
Хлор |
При небольших |
См. дефи- |
Проявляется |
См. избы- |
|
потерях наблюда- |
цит калия |
обычно теми же |
ток на- |
|
ются те же явления, как при дефиците калия, а также симптомы алкалоза и дегидратации, при больших потерях могут появляться судороги |
|
признаками, как при избытке натрия |
трия |
ДЕГИДРАТАЦИОННЫИ ШОК
369
ленной формы получается АМФ и катализатор — фосфодиэстера-за. В норме этот процесс сбалансирован и регулируется особой сигнальной белковой системой клетки. Образовавшийся в первой фазе реакции 3,5 цАМФ переходит тут же в АМФ.
При холере, холероподобныхэшерихиозахосновное значение имеет действие экзотоксина, встраивающегося в сигнальную систему клетки и изменяющего ее работу в сторону активизации образования 3,5 цАМФ. При действии же энтеротоксинов, присущих, например, сальмонеллам, шигелле Зонне и др., подобный патологический процесс запускается опосредованно, путем стимуляции выработки простагландинов. В результате этого развивающаяся диарея менее бурная, нарастает более постепенно, чем при холере. Кроме того, возбудителям, имеющим преимущественно энтеротоксин, свойственно повреждать непосредственно клетки кишечника, что снижает активность патологического секреторного процесса. Холерный же вибрион, некоторые штаммы патогенной кишечной палочки не обладают инвазивными свойствами, поэтому клетки кишечника не погибают. Особую быстроту развития дегидратационного шока при холере и тяжесть его течения объясняют еще и тем, что кроме экзотоксина эндотоксин холерного вибриона обладает сосудорасширяющим действием на уровне сосудистого русла кишечника, что увеличивает возможности патологической секреции. Дискутируется также вопрос о возможности активации эндотоксином синтеза простагландинов, что усиливает активность патологического секреторного процесса, непосредственно запускаемого холерогеном.
Несоответствие степени нарушения гемодинамики количеству потерянной жидкости при некоторых кишечных инфекциях (к примеру, тяжелые формы шигеллеза) может быть обусловлено утратой воды в результате обильного испарения с кожи за счет гипертермии при минимальном восполнении потерь на догоспитальном этапе. Наблюдаемое в ряде случаев сальмонеллеза выраженное нарушение гемодинамики при относительно небольших потерях жидкости должно насторожить врача в отношении возможности развития ин-фекционно-токсического шока, присущего этому заболеванию.
Необходимо помнить, что появление при кишечных инфекциях (особенно при пищевых токсикоинфекциях) у отдельных больных выраженной гипотензии при отсутствии адекватных потерь жидкости объясняется нейрососудистым действием токсинов. Поэтому подобная гипотензия не должна рассматриваться в этой ситуации как проявление дегидратационного шока и требует другой терапии.
Очень редко дегидратационный шок развивается при осмотической диарее, например при ротавирусном гастроэнтерите у детей. В этом случае вследствие накопления в просвете кишок крупных молекул нерасщепленных углеводов уменьшается абсорбция жид-
24 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
370
кости и она скапливается в просвете кишечника за счет увеличения осмотического давления в нем.
Итак, в результате повышенной активности аденилатцикла-зы в кишечной клетке накапливается недоокисленный продукт — 3,5 цАМФ, что вызывает патологический сброс в кишечник из кровеносного русла изотонической жидкости в виде воды и электролитов. Если в начале процесса избыточная жидкость частично абсорбируется в толстом кишечнике (каловые массы еще сохраняют при дефекации свою консистенцию), то в дальнейшем очень быстро появляется водянистая диарея. Скорость ее нарастания и обильность обусловлены особенностью этиологического фактора, а также сопутствующей патологией, возрастными особенностями макроорганизма. Рвота усугубляет патологический процесс. Очередность ее появления, обильность, частота, как и при диарее, обусловлены вышеуказанными факторами.
Вначале патологическая секреция достаточно компенсируется — происходит рефлекторная централизация кровообращения, т.е. уменьшение емкости сосудистой системы за счет сужения сосудов кожи, костей и др., что сохраняет адекватное кровоснабжение жизненно важных органов (сердца, мозга). Показатели гемодинамики сохраняются на достаточном для организма уровне, в некоторых случаях даже повышается АД. Потери жидкости из внутрисосу-дистого сектора замещаются за счет относительно большого объема интерстициального сектора. Снижение уровня натрия в крови, увеличение онкотического давления плазмы крови за счет того, что из нее не теряются белки, приводит к поступлению жидкости с электролитами в просвет кровеносной системы, что также компенсирует гемодинамику. Кроме того, стимулируется выработка антидиуретического гормона (АДГ), что вызывает торможение диуреза. В почках реабсорбируется калий, а затем и жидкость в целом. Усиленно начинают работать буферные системы, избыточное количество образуемого диоксида углерода выводится легкими.
Продолжение потерь жидкости из внутрисосудистого сектора через пищеварительный тракт приводит к тому, что для их восполнения объема интерстициального сектора становится недостаточно. Появляются нарушения гемодинамики, сначала определяемые в вертикальном положении больного, возможна преходящая ортоста-тическая гипотензия. Однако в дальнейшем довольно быстро стойко снижается АД, что заставляет больного лечь в постель. Именно выявляемые стойкие нарушения гемодинамики и знаменуют переход от «простой» дегидратации к развитию уже соответствующего вида шока.
Недостаточность кровообращения закономерно сочетается с ухудшением кровоснабжения органов и систем, нарушением выве-
ДЕГИДРАТАЦИОННЫИ ШОК
371
дения накопившихся шлаков, появлением, несмотря на усиленный расход буферных систем, метаболического ацидоза. При выраженной рвоте у больных старческого возраста могут преобладать явления алкалоза. За счет нарастающего дефицита ОЦК уменьшается венозный возврат к сердцу, что усугубляет нарушения кровоснабжения органов. В результате дефицита электролитов снижается сократительная способность миокарда, нарастают нарушения в проводящей системе сердца, что в ряде случаев уже на этом этапе развивающегося дегидратационного шока может вызвать остановку сердца, особенно у лиц с компрометацией его сопутствующими болезнями (ИБС, ревматизм, пороки сердца и т.д.).
Дальнейшее нарастание потерь жидкости сопровождается про-грессированием патологического процесса — появлением неэффективной для жизни гемодинамики, что обусловливает выход из строя мощной компенсаторной почечной системы в результате острой почечной преренальной недостаточности. Далее появляется и реналь-ная недостаточность в результате сильнейшего спазма почечных сосудов, резкого снижения почечного кровотока, что вызывает некроз паренхимы органа. Нарастает циркуляторная гипоксия, быстро приводящая к гипоксии гистотоксической. Развивается полиорганная недостаточность.
Исчерпывается «запас» буферных систем, что вызывает деком-пенсированные нарушения КОС (метаболический ацидоз). Если в ряде случаев в начале развития дегидратационного шока и наблюдался алкалоз, то на поздних стадиях он сменяется ацидозом. Легкие не справляются с выведением диоксида углерода, что приводит к развитию «шокового» легкого, респираторного ацидоза, дыхательной гипоксии, еще больше усугубляющих патологический процесс. Отек органов, как правило, незначителен, не наблюдается их набухания.
На поздней стадии шока смерть наступает вследствие прекращения сердечной деятельности в результате резкого дисбаланса и дефицита отдельных электролитов или ОПН. Упрощенно схема патогенеза дегидратационного шока представлена на рис. 25.
Клиника. Начальные клинические проявления дегидратации и дегидратационного шока зависят от особенностей действия того или иного этиологического фактора и описаны подробно в соответствующих разделах. В дальнейшем на первый план выступают клинические симптомы, обусловленные той или иной степенью дегидратации и деминерализации.
Для гипертонического варианта дегидратации характерны проявления, обусловленные внутриклеточным дефицитом воды. Появляются жажда, слабость, апатия, сонливость или беспокойство, сменяющиеся спутанностью сознания, галлюцинациями, судорогами,
24*
372-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Запускающие факторы
Токсины кишечных бактерий
Экзотоксины
Эндотоксины
Редко кишечные вирусы (у новорожденных)
Опосредованное
воздействие
на ферментную систему
энтероцита, накопление
в нем 3,5 цАМФ
Нейросо-
судистые
нарушения
Накопление крупных
углеводных молекул
в просвете кишечника,
Т осмотического
давления
Диарея, гиповолемия,
гипокалиемия, |_
сгущение крови |
Нарушение микроциркуляции
Ч
Циркулятор-ная и тканевая гипоксия
Запуск компенсаторных механизмов (централизация
кровообращения, Т АДГ,
^диуреза, Твыведения С02
легкими)
Одышка
I
Гемическая и дыхательная гипоксия
Декомпенсация компенсаторных механизмов, «порочный круг»
I
Токсическое
действие на ЦНС
Острая сердечная недостаточность
Jl
Субкомпенсированный метаболический ацидоз
I
Декомпенсированный метаболический и респираторный ацидоз
![]()
\,
Рис. 25
Патогенез дегидратационного шока при кишечных инфекциях
ДЕГИДРАТАЦИОННЫИ ШОК
373
комой. Кожа и слизистые оболочки сухие, язык красный, затруднено глотание из-за малого количества слюны, повышена температура тела. При высоких уровнях дегидратации появляется олигурия, часто с высокой относительной плотностью мочи. АД в норме и только при тяжелой дегидратации снижается, уменьшается сердечный выброс.
Клиническую картину изотонической дегидратации определяют особенности потерь и развитие быстро нарастающих нарушений кровообращения. При легких степенях развивается склонность к ор-тостатическому коллапсу, в горизонтальном же положении АД еще в норме. В дальнейшем АД прогрессивно снижается, нарастает тахикардия, появляется олигурия, характерно снижение тонуса мышц и тургора кожи, при потерях электролитов — судороги. Формируются продольные складки на языке.
В результате развития гипотонической дегидратации снижаются ОЦК, систолический выброс, падает АД, нарастает тахикардия. Симптомы во многом напоминают признаки изотонической дегидратации, однако нарушения прогрессируют быстрее, часто потеря сознания происходит в ранних стадиях из-за быстрого развития отека мозга.
Принято считать, что при дегидратации I степени по В.И. Покровскому дегидратационного шока еще нет — он проявляется при дегидратации II—IV степени. Но у лиц с дегидратацией даже малых степеней на фоне гипертермии, тяжелой сопутствующей патологии, сопровождающейся секвестрацией жидкости в организме (хроническая сердечная недостаточность, цирроз печени), может при этом нарушиться и без того хрупкий баланс работы сердечно-сосудистой системы и наступит смерть, хотя явления шока еще не развились.
Соотношение степеней дегидратации и основные клинические проявления приведены в главе «Холера». По существу, проявления дегидратационного шока представляют собой крайнее развитие проявлений того или иного варианта дегидратации параллельно с нарастающими нарушениями гемодинамики.
На начальном этапе развития дегидратационного шока нарушения кровообращения минимальны, в вертикальном положении больного можно обнаружить скоропреходящую гипотензию, появляется небольшая жажда. Если действие шокогенных факторов продолжается, то развиваются и выраженные нарушения гемодинамики — снижение АД, тахикардия, аритмии и фибрилляция желудочков. Вследствие выведения избыточного количества недоокисленных продуктов через легкие появляется одышка. Компенсаторно снижается диурез — возникает олигурия. Наблюдаются бледность кожи, похолодание конечностей, что связано с компенсаторным спазмом периферических сосудов. В дальнейшем развивается акроцианоз,
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
374
который быстро сменяется обширным цианозом кожи. Появляются судороги отдельных, преимущественно периферических скелетных мышц, однако по мере усиления дегидратации и деминерализации их частота и распространение нарастают. При прогрессировании шока судороги носят генерализованный характер, сопровождаются выраженной болью.
Наряду с судорогами изменения тургора кожи являются характерными проявлениями клинического течения дегидратационно-го шока при острых кишечных инфекциях. Они свидетельствуют о значительном обеднении жидкостью интерстициального сектора внеклеточной жидкости. По мере прогрессирования процесса складка кожи все медленнее расправляется, а в тяжелых случаях она не расправляется. Руки больного напоминают высушенные кисти прачек — кожа сухая, с крупными складками, бело-синюшная. Вместе с тем, у больных старческого возраста наблюдается естественное снижение тургора кожи, что может затруднять клиническую диагностику.
У больного заострены черты лица, глаза западают в орбиты. Сухие слизистые оболочки и язык создают трудности при разговоре. Голос становится осиплым, в тяжелых случаях возникает афония. Нарастают анурия, почечная недостаточность. Дыхание частое, поверхностное, неэффективное. Однако отека легких, как правило, нет. Если он и развивается, то чаще всего в результате неадекватного лечения. Довольно часто до самого финала сохраняется сознание, что является косвенным признаком отсутствия отека-набухания мозга при дегидратационном шоке. Вместе с тем, у больных с сопутствующей хронической токсической энцефалопатией (при алкоголизме, наркомании, ХПН, сахарном диабете, в пожилом возрасте) нередко наблюдаются нарушения сознания и даже его отсутствие.
В табл. 16. представлены причины, вызывающие основные клинические проявления дегидратационного шока.
Дегидратационный шок может развиться как внезапно, в течение нескольких минут (например, при холере), так и спустя несколько суток от начала заболевания (например, при сальмонеллезах) на фоне продолжающейся диареи, особенно при неоказании адекватной помощи.
Осложнения. Даже если в результате лечения гемодинамику удалось компенсировать, то иногда больной может все-таки погибнуть из-за наступившего некроза почечной паренхимы и развившейся почечной недостаточности, чему способствуют поздно начатое лечение или же проводившаяся ранее неадекватная, неправильная терапия. Аритмии чаще всего возникают при наличии у больного фоновых поражений сердца. Обездвиженность пациента в результате необходимости проведения регидратационной терапии способству-
ДЕГИДРАТАЦИОННЫИ ШОК
375
Показатель |
Причина |
Нарушение гемоди- |
Уменьшение ОЦК за счет потери воды и элект- |
намики (снижение |
ролитов, прогрессирующее снижение венозного |
АД, тахикардия) |
возврата к сердцу |
Диарея |
Действие токсинов бактерий на ферментную |
|
систему энтероцитов, на нервно-мышечный ап- |
|
парат кишечника |
|
Накопление крупных молекул углеводов в про- |
|
свете кишечника с увеличением осмотического |
|
давления в нем (в основном при вирусных ки- |
|
шечных инфекциях у новорожденных) |
Рвота |
Действие токсинов бактерий на нервно-мышеч- |
|
ный аппарат пищеварительного тракта |
|
Переполнение кишечника жидкостью при его |
|
парезе (например, при холере) |
|
В поздних стадиях — за счет дисметаболических |
|
нарушений |
Судороги |
Дефицит электролитов |
|
Накопление в мышцах недоокисленных продук- |
|
тов, ацидоз |
Снижение тургора |
Уменьшение объема интерстициального сектора |
кожи, «руки прач- |
внеклеточного водного пространства |
ки», сухость слизис- |
|
тых оболочек, осип- |
|
лость голоса, сниже- |
|
ние тонуса глазных |
|
яблок, подчеркну- |
|
тость черт лица |
|
Олигурия, анурия |
Компенсаторные реакции |
|
Преренальная, а затем и ренальная ОПН |
Бледность, в дальней- |
Перераспределение крови, спазм периферичес- |
шем цианоз кожи, |
ких сосудов |
похолодание конеч- |
|
ностей |
|
Сердечная слабость, |
Гипоксия |
аритмии |
Дисэлектролитяые нарушения |
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
376
ет присоединению гипостатическои пневмонии, а иногда у тяжелых больных возможна даже аспирация содержимого желудка при рвоте с последующим развитием гнилостно-некротического процесса в легких.
Осложнения, появление которых возможно при терапии шока, изложены в главе «Холера».
Исходы. Чем более выражена дегидратация, чем позднее начата терапия, тем более серьезен прогноз. Вероятность летального исхода определяется не только глубиной и длительностью шока, но и этиологией основного заболевания, фоновой патологией, возрастом больного и т.д. Смерть больных чаще наступает от остановки сердечной деятельности. Частой причиной летального исхода может быть ОПН или декомпенсация тяжелых фоновых заболеваний сердца, почек, печени. Залповая экстрасистолия может привести к смерти больного даже в разгар дегидратационного шока.
Методы диагностики. Общеклинические методы исследования. Общий анализ крови. Ввиду того что при дегидратациях и дегидра-тационном шоке закономерно сгущение крови, в общем анализе ее наблюдается эритроцитоз, увеличение количества гемоглобина, лейкоцитоз. Особенно важным является определение гематокрита как показателя обезвоживания. Его показатели выше нормы свидетельствуют о дегидратации. Но при изотонической дегидратации вследствие кровопотери гематокрит снижается]
Вместе с тем, необходимо помнить, что в настоящее время в популяции часто встречаются (особенно среди женщин) фоновые анемии различного генеза. При этом изначально низкий уровень гематокрита при обезвоживании может дойти до нормальных показателей, что служит основанием для диагностической ошибки. Поэтому в неясных случаях — рекомендуется проводить исследование относительной плотности плазмы крови, менее подверженной влиянию сопутствующих заболеваний. В норме этот показатель равен 1024— 1030. Считается, что увеличение его на единицу выше верхней границы нормы соответствует потере приблизительно 1 л жидкости. Изменения в формуле крови диктуются этиологическим фактором, вызвавшем дегидратационный шок, а также зависят от фоновых заболеваний.
В общем анализе мочи по мере прогрессирования почечной недостаточности наблюдаются протеинурия невысокой степени, цилин-друрия. При развитии ренальной ОПН нередко в осадке можно увидеть все виды цилиндров.
При биохимическом исследовании особое значение приобретает определение уровней основных электролитов крови, дефицит которых в плазме является подтверждением дегидратаций и дегидратационного шока.
ДЕГИДРАТАЦИОННЫИ ШОК
377
Особенно важно контролировать уровень калия, так как его дефицит или избыток (в случае развития дегидратационного шока на фоне ХПН) грозит сердечными нарушениями. Наличие при шоке «шоковой» почки диктует необходимость контроля креатинина, остаточного азота, мочевины крови. Изменения билирубина, АлАТ, АсАТ не характерны. Изменения в коагулограмме и тромбоэласто-грамме в сторону повышения свертываемости появляются только в терминальных стадиях этого вида шока.
Основные показатели, за которыми необходим контроль при развитии у больного дегидратационного шока, приведены в табл. 17. В ней же указана направленность изменений этих показателей, характеризующих тяжесть возникших нарушений.
При определении КОС отмечаются изначально признаки ацидоза или (значительно реже) алкалоза. По мере прогрессирования шока ацидоз (или алкалоз) становится декомпенсированным, часто появляется и респираторный ацидоз.
Дополнительные методы. ЭКГ отражает явления гипокалиемии (см. табл. 15). На поздних этапах вследствие развития ОПН может иногда появиться гиперкалиемия, что также отражается и на ЭКГ.
Для оценки степени тяжести и определения направлений дальнейшей терапии желательно исследование некоторых показателей гемодинамики, что подробно изложено в главе «Холера».
Специальные исследования необходимы для расшифровки этиологии заболевания, при котором развился дегидратационный шок. Они представлены в соответствующих главах раздела «Заболевания преимущественно с фекально-оральным механизмом передачи».
Критерии диагноза. Диагноз дегидратационного шока основан на таких данных:
эпиданамнез, подтверждающий возможность заражения теми или иными кишечными инфекциями;
наличие поноса и рвоты с большими потерями жидкости;
появление судорог мышц;
признаки уменьшения содержания внеклеточной жидкости (снижение тургора кожи, сухость слизистых оболочек, заострение черт лица, уменьшение фонации);
выраженные циркуляторные расстройства (тахикардия, снижение АД, бледность кожи, цианоз);
выявление сгущения крови с признаками эритроцитов, увеличения количества гемоглобина, гематокрита.
Дифференциальный диагноз. Дегидратационный шок необходимо дифференцировать от других вариантов гиповолемического шока (в частности, от геморрагического в результате желудочно-кишечного кровотечения), а также от инфекционно-токсического, анафилактического, кардиогенного шока, от некоторых пищевых
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
378
Таблица 17. Направленность изменений основных лабораторных показателей при дегидратационном шоке
Показатели |
Норма |
Изменения |
Общий объем жидкос- |
42—75 % от массы тела |
^L* —-~"~ ^L'^L' ~""— ^k^k'v' |
ти в организме |
в зависимости от конструкции (меньше — у лиц с ожирением, больше — у худых) |
|
рН артериальной крови |
7,35—7,45 |
Ф—^Ф—4"^Ф, очень редко на ранних этапах t но затем сновав |
Натрий в плазме крови |
135—150 моль/л |
*J^ ——— ^к^к —~~"~ ^к^к^к |
Калий —"— |
3,5—5,5 ммоль/л |
i ii iii, ИНОГ- Да на поздних этапах Т |
Кальций —"— |
2,1—2,6ы:*оль/л |
^L —— '^^*^' —~"~~ ^К^К^^ |
Магний —"— |
0,8—1,2 ммоль/л |
4,_4,i—Ш |
Хлор —"— |
100—106 ммоль/л |
^L* —-~— фХ —-— ^L'^^^L' |
Относительная плот- |
1024—1030 |
t |
ность плазмы крови |
|
|
Гемоглобин |
120—140 г/л у женщин 140—160 г/л у мужчин |
t |
Гематокрит |
0,38—0,46 у женщин 0,42—0,50 у мужчин |
Т |
Креатинин крови |
44—100 мкмоль/л у женщин 44—120 мкмоль/л у мужчин |
Tt |
Мочевина крови |
2,5—8,3 ммоль/л |
trr |
ЦВД |
6—12 см вод. ст. |
I |
оцк |
65 мл/кг у женщин 70 мл/кг у мужчин |
I |
токсикоинфекций, панкреатита, кишечной непроходимости, перитонита.
При геморрагическом шоке s результате желудочно-кишечного кровотечения также наблюдается прогрессирующее нарушение гемодинамики, так как это один из вариантов гиповолемического шо-
ДЕГИДРАТАЦИОННЫИ ШОК
379
ка. На догоспитальном этапе больной может указать на наличие поноса, ибо «мелена» всегда вызывает усиление перистальтики. Часто больные просто не замечают разницу в окраске испражнений или вообще не обращают на это внимание.
Геморрагический шок при желудочно-кишечном кровотечении имеет следующие отличия:
испражнения имеют характер «мелены», рвотные массы по типу «гематемезис»;
малая частота дефекаций не соответствует тяжести развивающейся гииотензии;
скорость расправления кожной складки уменьшается;
часто появляется влажность ладоней;
отсутствуют судороги мышц;
в анамнезе у больного нередко длительно существующая язвенная болезнь желудка и двенадцатиперстной кишки, хронический колит;
уменьшение количества эритроцитов, гемоглобина, гематокри-та.
Инфекционно-токсический шок имеет сходные проявления в виде нарастающих нарушений гемодинамики, нередко — сгущение крови. Его отличает:
выраженный токсикоз (наличие головной боли, ломоты в теле, миалгий) с самого начала заболевания, еще до развития шока;
преобладание признаков токсикоза над диареей в тех случаях, когда инфекционно-токсический шок развивается при острых кишечных инфекциях;
стремительное нарастание нарушений сознания вплоть до комы при тяжелом шоке;
—- при появлении судорожного синдрома он приобретает сразу же центральный генерализованный характер;
довольно быстрое расправление кожной складки;
в общем анализе крови появление абсолютного лейкоцитоза;
минимальное увеличение гематокрита, количества эритроцитов.
При анафилактическом шоке бурное нарушение гемодинамики связано с резким увеличением емкости сосудистого русла, а не с потерей ОЦК. Общими с дегидратационным шоком являются нарушение гемодинамики и сосудистая гиповолемия. Этот вид шока отличается:
наступлением катастрофических нарушений гемодинамики сразу же после введения лекарственного вещества или же укуса насекомыми;
иногда может наблюдаться небольшое послабление стула, явно не соответствующее тяжести состояния больного;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
380
жалобами больного на выраженное затруднение дыхания и связанную с этим одышку;
отсутствием, как правило, судорог;
обычной скоростью расправления кожной складки;
отсутствием признаков сгущения крови, особенно на ранних этапах.
При кардиогенном шоке, как и при дегидратационном, наблюдаются выраженные изменения гемодинамики. Однако при этом виде шока выявляются такие признаки;
частое появление как осложнения преимущественно в пожилом возрасте, при развитии инфаркта миокарда, на фоне длительно существовавшей ишемической болезни сердца;
в анамнезе психоэмоциональные перегрузки, физическое перенапряжение;
нередко внезапный болевой синдром, ощущение перебоев, дискомфорта в области сердца;
быстрое появление выраженного цианоза;
если и появляется риота, то частота ее явно не соответствует тяжести состояния;
отсутствие судорог периферического характера;
не изменяются лабораторные показатели, свидетельствующие о сгущении крови;
на ЭКГ — признаки инфаркта миокарда, разнообразные нарушения ритма.
При некоторых пищевых токсикоинфекциях (ПТИ) может наступать острая гипотензия без развития дегидратационного шока. Гипотензия появляется в результате патологического действия токсинов бактерий на сосудистую систему нередко еще до появления диареи. Такое часто встречается при стафилококковой ПТИ. Но при этом:
в эпиданамнезе имеется указание на употребление в пищу молочных продуктов, кондитерских и других скоропортящихся изделий, содержащих белки, причем инкубационный период бывает очень короткий, он может исчисляться минутами;
выражены слабость, головокружение, склонность к коллапсу, лабильность пульса;
снижение АД явно не соответствует потерям жидкости в результате рвоты и поноса;
не страдает быстрота расправления кожной складки;
иногда сразу же наблюдаются выраженные судороги, связанные с потерей хлора з результате рвоты, но их частота и распространенность явно не соответствуют объему потерянной в результате рвоты и поноса жидкости;
на начальном этапе признаков сгущения крови не отмечается.
ДЕГИДРАТАЦИОННЫИ ШОК
381
Некоторые формы панкреатита носят название «панкреатической холеры». При этом, как и при дегидратационном шоке, наблюдаются признаки обезвоживания, снижение АД, тахикардия. Но для таких состояний характерны следующие особенности:
развитие заболевания связано с обильным употреблением жирной, жареной пищи, алкоголя;
очень выражен болевой синдром, нередко боль отдает в спину;
тяжесть состояния явно не соответствует частоте дефекаций;
рвота нередко преобладает над поносом;
испражнения часто сохраняют каловый характер, нередко «ма-зеподобные», при копрологическом исследовании выявляют признаки выраженного нарушения пищеварения;
снижена пульсация брюшного отдела аорты;
часто после диареи появляются выраженное вздутие Живота, нарушение отхождения газов из кишечника, снижение перистальтики;
повышен уровень амилазы мочи, иногда — крови;
в крови абсолютный лейкоцитоз, нейтрофилез;
при УЗИ обнаруживают увеличение и изменение паренхимы поджелудочной железы.
При кишечной непроходимости, как и при дегидратационном шоке, также могут наблюдаться гипотензия и тахикардия в результате депонирования кишечного транссудата внутри кишок. Однако при этом:
возникает боль, нередко весьма интенсивная, локализующаяся в области препятствия, приведшего к непроходимости;
появившиеся в начальный период болезни жидкие испражнения сохраняют в дальнейшем каловый характер;
начальная диарея быстро сменяется запором, аускультативным нарушением перистальтики;
на фоне нарушения перистальтики нарастает интоксикация, появляется рвота токсического происхождения;
выражен и нарастает лейкоцитоз абсолютного характера, наблюдается значительный нейтрофилез;
при рентгенологическом исследовании брюшной полости выявляются чаши Клойбера (уровни жидкости) в кишечнике.
Как и при дегидратационном шоке, явления острой гипотензии и тахикардии могут наблюдаться при перитоните. При этом потери жидкости обусловлены экссудацией ее в брюшную полость. Характерными для перитонита являются:
— выраженная, часто резко, постоянного характера боль в живо те. Быстро появляется мышечное защитное напряжение, а за тем и разнообразные симптомы раздражения брюшины;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
382
выраженность боли, нарастающей интоксикации явно не соответствуют частоте рвоты и поноса;
рвота часто появляется уже при выраженном развитии болезни, на высоте интоксикации;
выражен абсолютный лейкоцитоз, нейтрофилез.
Лечение. Терапия при гипертонической дегидратации заключается в нормализации осмолярности плазмы крови путем инфузии 5 % раствора глюкозы без добавления солей. Рассчитывать объем вводимой жидкости необходимо по формуле:
количество вводимой жидкости = (концентрация Na в плазме — 142): 142 х массу тела в кг х 0,2.
Лечение изотонической дегидратации диктуется причиной — при кровопотере переливают кровь, при ожоговых поражениях — плазму крови и изотонические солевые растворы, в остальных случаях — изотонические сбалансированные солевые растворы с учетом необходимости коррекции расстройств КОС.
При лечении гипотонической дегидратации необходимо устранить дефицит натрия. Объем вводимого натрия рассчитывают по формуле:
общий дефицит Na = (142 — истинная концентрация Na в плазме) х массу тела в кг х 0,1.
В зависимости от сдвигов КОС его вводят или в виде растворов натрия хлорида (алкалоз), или в виде растворов натрия гидрокарбоната (ацидоз).
Вопрос о начальных лечебных мероприятиях решается в зависимости от причин, приведших к развитию дегидратационного шока. Так, на ранних этапах шока при сальмонеллезах, пищевых токсико-инфекциях, шигеллезе Зонне неотложным мероприятием является механическое удаление токсинов из пищеварительного тракта, как это изложено в разделах «Лечение» в соответствующих главах. В этих же случаях, если позволяет состояние больного, в качестве патогенетического средства для подавления синтеза простагланди-нов в кишечнике целесообразно назначить их ингибиторы — индо-метацин, ибупрофен, диклофенак в обычных терапевтических дозах на 1—2 сут. В последующем решают вопрос о целесообразности их дальнейшего использования, строго учитывая присущие им противопоказания и побочные эффекты. На поздних этапах шока при вышеназванных болезнях промывание желудка и кишечника проводят или параллельно с регидратационной терапией, или после проведения стартовой регидратации, когда появляется возможность их осуществить.
При холере, некоторых вариантах течения эшерихиозов, вирусных гастроэнтеритах пусковой механизм развития шока иной, в связи с чем механическое удаление токсинов из пищеварительного
ДЕГИДРАТАЦИОННЫИ ШОК
383
тракта нецелесообразно. Поэтому основное значение будет иметь регидратационная терапия, которая при ее правильном проведении позволит организму «собрать силы» для того, чтобы справиться с запустившими шок факторами (холероген, экзотоксины кишечной палочки, вирусы).
Если решить вопрос об этиологическом факторе, запустившем каскад механизмов развития дегидратационного шока, не представляется возможным, то главным является выведение из шока стандартными методами, а уже потом проводят необходимую дифференциацию.
Вопрос о необходимости назначения этиотропных средств при большинстве кишечных инфекций (кроме, разве что, шигеллезов) довольно дискутабелен и требует в каждом случае индивидуального решения о целесообразности их применения.
Отсутствие выраженных нарушений со стороны клеток при де-гидратационном шоке, относительная сохранность объема внутриклеточного водного пространства обусловливают достаточно хорошие возможности лечения. Вместе с тем, отсутствие адекватной терапии на ранних этапах шока, неправильно проводимое лечение, бурное развитие этого вида шока при некоторых заболеваниях (холера), наличие тяжелых сопутствующих болезней делают прогноз довольно серьезным.
Госпитализировать больных с дегидратационным шоком необходимо в ближайшие к месту выявления случая отделения — интенсивной терапии, общей или инфекционной реанимации. Недопустима длительная транспортировка в инфекционные стационары, которую часто объясняют надобностью строгой изоляции инфекционного больного. Больные кишечными инфекциями могут быть помещены и в обычные палаты, так как их заразность небольшая, но при этом ужесточаются требования к обеззараживанию их выделений.
При резком нарушении гемодинамики и обезвоживании с наличием шока любой степени лечение следует начинать на месте. Решать вопрос о возможности транспортировки больного для дальнейшей терапии в стационаре следует только после четкой стабилизации гемодинамики. Кроме того, в период транспортировки необходимо продолжать начатое ранее лечение, при этом строго учитывать объемы введенных солевых растворов и потерь.
Первостепенной задачей лечения больных с явлениями дегидратационного шока является немедленное восполнение потерь жидкости и электролитов, возникших до поступления в стационар (в течение первых двух часов)! Терапия дегидратационного шока проводится только парентерально^. В случае медленно развивающегося шока возможно капельное введение в периферические вены, однако на поздних этапах шока, при бурно развивающемся патологическом
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
384
процессе необходимым условием является струйное введение в катетеризированную центральную вену предварительно подогретых до температуры 36—38 °С сбалансированных солевых растворов. Скорость введения (от 80 до 120 мл/мин) устанавливается индивидуально в зависимости от степени обезвоживания. При тяжелом де-гидратационном шоке рекомендуется также такой метод: за первые 15 мин перелить струйно не менее 1,5 л сбалансированных солевых растворов, за следующие 45 мин с уже меньшей скоростью — 3,5— 4 л их же. За второй час терапии — все то количество, что осталось от необходимого (рассчитанного по формуле) для полного восполнения потерь, которые были до начала лечения. По мере улучшения клинических и лабораторных показателей переходят на капельное введение, необходимое для восполнения текущих потерь жидкости. В каждом случае целесообразность этого метода, как и возможности отмены внутривенного введения и перехода на оральный прием растворов (см. главу «Холера»), после выведения из шока решают строго индивидуально с учетом всех клинических и лабораторных показателей! Довольно часто при раннем прекращении внутривенной терапии возможен рецидив шока, поэтому целесообразно еще некоторое время (от нескольких часов до суток) не прекращать парентеральное введение, ограничив лишь количество вводимых растворов.
Как отмечалось, основным в лечении дегидратационного шока является парентеральная регидратлция и реминерализация интерсти-циального и внутрисосудистого сектора внеклеточного водного пространства организма. Поскольку потери из организма представляют собой практически воду с растворенными в ней электролитами, то и сущностью лечения является восполнение этих трат солевыми растворами. Требования, предъявляемые в настоящее время к ним, следующие:
растворы должны содержать основные электролиты — натрий, хлор, калий, кальций, магний в легко усваиваемой форме;
растворы обязательно должны иметь буферные свойства;
осмолярность вводимых растворов должна быть такова, что он довольно быстро будет попадать из сосудистого русла в межклеточное пространство;
состав растворов должен быть сбалансирован по отдельным электролитам;
вода в растворе дол лен а бьггъ апирогенной;
предпочтительнее введение растворов, изготовленных промышленным путем, а не ex tempore.
ДЕГИДРАТАЦИОННЫИШОК
385
В настоящее время в отечественном здравоохранении для парентеральной регидратации и реминерализации используют растворы, состав которых приведен в таблице в главе «Холера».
Не рекомендуется использовать при дегидратационном шоке для первичной регидратации изотонический раствор натрия хлорида, раствор Рингера—Локка, так как они являются или не-, или малосба-лансированными. Так, в 1 л раствора Рингера—Локка содержится 9 г натрия хлорида и всего лишь по 0,2 г калия хлорида и натрия гидрокарбоната, что делает такой раствор неподходящим для адекватного восполнения потерь организма при дегидратационном шоке. В крайнем случае, допускается введение комплекса растворов (например, изотонический раствор натрия хлорида + 3,5 % раствор калия хлорида + 5 % раствор натрия гидрокарбоната). Однако необходимость одновременного введения такого количества растворов в разные вены в случае тяжелого шока, расчет необходимого количества этих растворов по довольно сложным формулам, что трудновыполнимо в ургентных ситуациях, большая вероятность побочных реакций делают такой подход явно нецелесообразным.
Для начальной регидратации предпочтительнее использовать растворы «Квартасоль», «Трисоль». Однако необходимо помнить, что изредка на далеко зашедших этапах дегидратационного шока у лиц с ХПН в анамнезе возможна гиперкалиемия. В такой ситуации до получения результатов исследования калия в плазме крови и проведения ЭКГ целесообразно назначение растворов «Дисоль» или Рингера—Локка. После получения результатов проводят коррекцию в зависимости от изменений — или продолжают введение этих растворов, или назначают такие, которые содержат больше калия.
В ряде случаев возникает необходимость переливания очень большого количества солевых растворов из-за продолжения потерь жидкости в стационаре с диареей и рвотой, например при холере. Отдельным больным, по материалам холерных госпиталей, приходилось за сутки вливать 40—60 л солевых растворов. Конечно, введение такого количества сопровождается побочными эффектами. Наиболее часто возникает ознобоподобная реакция с выраженным ощущением холода, обычно тогда, когда флакон с раствором был слабо подогрет или успел охладиться до введения. Ни в коем случае нельзя прекращать вливание! В этой ситуации нужно медленно ввести во внутривенный катетер 5—10 мл 10 % раствора хлорида кальция, вызывающего чувство жара. Введение кальция является патогенетическим, особенно в тех случаях, когда переливаемые растворы его не содержат. Больного также согревают — укрывают дополнительными одеялами, обкладывают грелками.
Необходим тщательный уход за внутривенным катетером, так как
"25 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
386
введение такого количества растворов чревато развитием флебитов и нагноений.
Расчет адекватного количества вводимой жидкости, электролитов по формулам, приводящимся во многих руководствах по реаниматологии, возможен только тогда, когда можно быстро исследовать необходимые для расчета показатели. Формулы расчетов приведены и в главе «Холера». К сожалению, в большинстве стационаров в нашей стране нет возможности часто взвешивать больного в постели, экстренно определять электролиты (для пламенной фотометрии требуется до 30 мин), а тем более нет специальных диагностикумов, позволяющих определить объем внеклеточной жидкости. Поэтому важнейшими для контроля адекватности проводимой регидратации и реминерализации являются: строгий учет потерь жидкости больным (количество испражнений и рвотных масс, выделяемой мочи), наблюдение за частотой пульса и дыхания, динамикой АД, быстротой расправления складки кожи, степенью увлажнения слизистой оболочки ротовой полости, тонусом глазных яблок.
Одним из основных клинических показателей, свидетельствующих о достаточной реминерализации, является уменьшение частоты и распространенности судорог скелетных мышц. Контролем эффективности терапии является показатель ЦВД (норма — 6— 12 см вод. ст.). Если на начальном этапе лечения тяжелого шока ЦВД измерить невозможно из-за жизненноважной необходимости постоянного введения большого количества растворов, то после проведения стартовой терапии абсолютно необходимо его измерение. Повышение ЦВД до 7—10 см вод. ст. — свидетельство правильного проведения регидратации. Если же оно поднялось выше 12 см вод. ст., то это признак слабости правого желудочка, что может быть результатом нераспознанной ранее сердечной патологии, и при дальнейшем быстром введении растворов может привести к отеку легких. При продолжении терапии ЦВД необходимо исследовать максимально часто.
Большое значение для оценки адекватности терапии имеет контроль гематокрита, относительной плотности плазмы крови. На основании результатов исследований плазмы на электролиты вносят коррективы в проводимое лечение, хотя необходимо помнить, что с момента взятия крови на исследование уже прошло время и, скорее всего, концентрация их уже изменилась. Вот почему важным для контроля уровня калия является ЭКГ (ранее указывалось об электрокардиографических признаках гипо- и гиперкалиемии).
Особую осторожность з проведении дальнейшей терапии необходимо соблюдать при анурии на фоне значительного увеличения креатинина, мочевины, остаточного азота крови. Это свидетельствует о развитии на фоне дегидратационного шока ОПН. Особенности
ДЕГИДРА1АЦИОННЫИ ШОК
387
ее терапии изложены в главе «Острая почечная недостаточность». Если после проведения соответствующей терапии и даже применения мочегонных препаратов диурез отсутствует, может встать вопрос о проведении экстракорпоральной детоксикации.
Введение с целью регидратации 5—10% растворов глюкозы является одной из причин гипонатриемии, осмотической гипотензии внеклеточного пространства, снижения диуреза. Гипоглюкоземия при дегидратационном шоке не имеет решающего значения — выраженных энергетических потерь не наблюдается. Поэтому введение растворов глюкозы на этапе стартовой терапии этого вида шока оправдано лишь у больных с сопутствующим декомпенсированным инсулинзависимым сахарным диабетом. Однако и в этом случае количество глюкозы должно быть только жизненно необходимым. По выведению из шока при наличии показаний (анорексия) могут быть назначены растворы глюкозы с целью коррекции энергетического обмена.
Абсолютно неоправданно применение для терапии дегидратаци-онного шока крупномолекулярных объемзамещающих растворов. Производные декстранов (полиглюкин, реополиглюкин), желатина (желатиноль), поливинилпирролидона (неогемодез, гемодез) казалось бы возмещают потери ОЦК и восстанавливают гемодинамику, однако при этом они привлекают в сосудистое русло жидкость из и без того обедненного интерстициального сектора внеклеточного пространства, что усугубляет нарушения КОС, усиливает каскад нарушений функций клеток. Еще менее подходят такие плазмозаме-щающие средства, как раствор альбумина, сухая и замороженная плазма. Они резко увеличивают и без того значительно повышенное онкотическое давление крови, что приводит к тому, что в просвет сосудистого русла буквально устремляется вода из пустого интерстициального сектора. На 1 г альбумина выходит до 25 мл воды. К чему это приводит— ясно из вышеприведенного. Высказывания о возможности введения объемзамещающих и солевых растворов одномоментно могут позволить только те врачи, которые никогда на практике не сталкивались с лечением таких больных и поэтому не представляют этот процесс.
Практикуемое на догоспитальном этапе введение адреномимети-ков (адреналина и норадреналипа) с целью «поднять давление любой ценой» следует также признать абсолютно неправильным! Они вызывают сужение периферических сосудов (норадреналин больше) и за счет этого повышение АД. Однако при развившемся дегидратационном шоке это уже давно произошло и, к сожалению, спазм развился в почечных сосудах. Поэтому введение адреномиметиков приводит к еще более сильному нарушению почечного кровотока и, как правило, заканчивается некрозом паренхимы почек.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
388
На ранних этапах шока с целью улучшения гемодинамики, что может дать необходимый запас времени для проведения регидра-тационной терапии, можно использовать дофамин (допамин). Он не ускоряет ЧСС и, самое главное, даже несколько расширяет сосуды почек и спазмирует их в коже и скелетных мышцах, что приводит к удержанию АД на достаточном уровне.
Целесообразность назначения сердечных гликозидов спорна. Основное их лечебное действие заключается в усилении сократительной способности миокарда. При дегидратационном шоке миокард изначально не страдает, да и в дальнейшем нарушения работы сердца связаны с дисэлектролитными и гипоксическими нарушениями при сохранении функциональной потенции кардиомиоцитов. За счет удлинения диастолы сердечные гликозиды улучшают приток крови к правым отделам сердца, однако при снижении венозного возврата, что наблюдается при шоке, это их свойство решающего значения не имеет. Кроме того, сердечные гликозиды, пригодные для парентерального введения, выводятся через почки, поэтому способны быстро кумулироваться в организме при явлениях почечной недостаточности, которая неизменно в той или иной форме сопровождает течение дегидратационного шока. Кумуляция их может привести к развитию аритмий, которые и без того являются спутниками этого вида шока, а передозировка — к развитию брадикардии, что неблагоприятно в случае снижения ОЦК.
Глюкокортикостероиды издавна считаются «протишоковыми» средствами. Их противошоковый эффект связывают с укреплением мембран, поддержанием «гормональной» составляющей гемодинамики. Однако при дегидратационном шоке в укреплении нуждаются мембраны энтероцитов, которые мало чувствительны к этому классу веществ. Механизм повышения их проницаемости чаще всего связан не с воспалением, а с нарушением работы ферментных систем внутри клетки. Кроме того, парентеральное введение, только и возможное при шоке, не позволяет доставить необходимые концентрации препаратов в клетки кишечника. В отличие от других видов шока снижение АД при дегидратационном шоке обусловлено не нарушениями «гормональной» составляющей, а истинным уменьшением ОЦК, поэтому назначение глюкокортикостероидов в данном случае спорно. Введение их может быть рекомендовано только при подозрении на развитие некроза почек с целью стабилизации мембран клеток, а также при довольно редком развитии острой надпочечни-ковой недостаточности.
Нет необходимости в назначении противосудорожных средств — при дегидратационном шоке судороги связаны с дисэлектролитными и дисметаболическими нарушениями, а не с первичной судорожной активностью ЦНС. Кроме того, некоторые противосудорожные
ДЕГИДРАТАЦИОННЫЙ ШОК
389
препараты вообще противопоказаны при гиповолемии (например, дроперидол).
После выведения из шока проводят ту терапию, которая необходима при инфекционных заболеваниях, приведших к нему. Подробно это изложено в соответствующих главах.
Профилактика. Мероприятия по предупреждению инфекционных болезней, которые приводят к развитию дегидратационного шока, описаны в соответствующих главах раздела «Заболевания преимущественно с фекально-оральным механизмом передачи». Врачи поликлинического звена, «скорой помощи» должны помнить, что частота развития этого вида шока связана с возрастом, полом, конституцией, наличием тяжелых сопутствующих заболеваний. Поэтому при первых проявлениях кишечных инфекций необходимо срочно госпитализировать в стационар младенцев и пожилых, тучных лиц, пациентов с заболеваниями сердца, печени, почек, у которых прогнозируется развитие этого осложнения, и обязательно проводить начальную регидратацию на догоспитальном этапе.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
390
Анафилактический шок
Анафилактический шок — это комплекс патологических сдвигов в организме в результате развития генерализованной аллергической реакции немедленного типа с последующим высвобождением различных медиаторов, вызывающих резкое увеличение емкости сосудистого русла, повышение проницаемости сосудов, нарушение работы ЦНС, обструкцию дыхательных путей, спазм гладких мышц.
Лат. — shock anaphylacticum.
Англ. — anaphylactic shock, anaphylaxis.
Название этого вида шока происходит от греческих слов «ana» — обратный и «phylaxis» — защита.
Краткие исторические сведения. Упоминание о смерти египетского фараона Мензеса от ужаления осы или шершня в 2641 г. до н.э., возможно, является первым описанием анафилактического шока у человека.
Впервые анафилактическую реакцию у собак на повторное введение им экстракта из щупальцев актиний открыли в 1902 г. P. Portiern С. Richet, тогда же предложив термин «острая системная анафилаксия». В 1905 г. Г.П. Сахаров описал аналогичную анафилактическую реакцию на повторное введение лошадиной сыворотки у морских свинок.
С началом использования иммунных лошадиных сывороток с лечебной и профилактической целью аллергические реакции, сходные с описанным ранее экспериментальным феноменом анафилаксии, были отмечены у людей и стали обозначаться как анафилактический шок. До 40-х годов XX в. лечебные сыворотки считались основным этиологическим фактором этого вида шока. Но уже в 1949 г. G. Waldbott сообщил о первом смертельном исходе от шока после введения пенициллина.
Актуальность. С каждым годом увеличивается число анафилактических реакций, особенно на лекарства, наиболее часто — на пенициллин, при лечении которым они отмечаются у 0,5—1,6 % больных. Анафилактический шок с летальным исходом бывает в 1 случае на 7,5 млн инъекций пенициллина.
В середине 80-х годов XX в. частота смертельных исходов от анафилактического шока при использовании рентгенконтрастных препаратов возросла до 9 случаев на 1 млн урографических исследований.
АНАФИЛАКТИЧЕСКИЙ ШОК
391
Довольно часто анафилактический шок развивается после укуса перепончатокрылыми насекомыми. Как считают, в 10 % случаев смерть от «острой сердечной недостаточности» в летний период в США наступает вследствие этого.
Резкое увеличение во всем мире за последние 30 лет частоты анафилактического шока является результатом общего роста заболеваемости аллергическими болезнями в целом, которыми страдают до 10% населения земного шара. Это связывают с бурным развитием химической промышленности, загрязнением окружающей среды, широким использованием гербицидов, инсектицидов, с нарастающим применением лекарственных средств как при лечении людей, так и в животноводстве, растениеводстве.
Существует мнение, что увеличение аллергических заболеваний в промышленно развитых странах во многом связано с ликвидацией или резким уменьшением циркуляции некоторых инфекций. Предполагается, что иммунный ответ на сильные антигены возбудителей инфекционных заболеваний конкурентно тормозит развитие аллергических реакций организма на более слабые антигены. Не исключается, что неспецифическая сенсибилизация возрастает и в результате увеличения количества профилактических прививок.
Этиология. Анафилактический шок может возникнуть как вследствие истинной системной анафилаксии — опосредованной дегра-нуляции лаброцитов (тканевых базофилов, тучных клеток) и базо-филов крови в результате реакции антиген—антитело, так и вследствие анафилактоидной реакции, т.е. разрушения тех же клеток из-за непосредственного воздействия на них веществ без участия комплекса антиген—антитело.
Большинство таких химических соединений (в том числе и лекарственных препаратов) имеют относительно простую молекулярную структуру, не могут непосредственно индуцировать выработку антител (аллергенов) и приобретают антигенные свойства лишь после связывания с белками организма. После этого они могут индуцировать выработку антител—реагинов, а при повторном введении в организм — анафилактический шок вследствие развития истинной системной анафилаксии. Однако некоторые вещества (в том числе и те, что названы выше) могут вызывать и прямую дегрануляцию лаброцитов и базофилов крови — анафилактоидную реакцию, которая может возникнуть при первом же в жизни введении препарата и, приобретя системный характер, приводит к анафилактическому шоку. Такие вещества называются гаптенами. Системная анафилаксия и анафилактоидная реакция клинически неразличимы.
Полноценными аллергенами (истинными антигенами) являются обычно сложные высокомолекулярные соединения, способные непосредственно индуцировать синтез реагинов.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
392
Наиболее часто анафилактический шок возникает при введении лекарственных и диагностических препаратов, при укусе жалящими насекомыми, редко — при приеме пищевых продуктов. Почти любой лекарственный или профилактический препарат может сенсибилизировать организм человека и вызвать анафилактический шок при повторном его введении. Одни лекарства вызывают шок чаще, другие — реже, что связано как с их химическим строением, так и с особенностями метаболизма в организме человека. В табл. 18 приведена информация о медикаментах и препаратах, наиболее часто вызывающих анафилактический шок.
Таблица 18. Лекарственные препараты, часто вызывающие анафилактический шок с разными первоначальными пусковыми механизмами
Анафилактический шок, развивающийся чаще всего вследствие |
|
острой системной анафилаксии |
анафилактоидной реакции |
(обусловленной 1дЕ или IgG 4) |
(1дЕ-независимой) |
Антибиотики: |
Антибактериальные вещества: |
пенициллины |
ванкомицин |
цефалоспорины |
фторхинолоны |
тетрациклины |
эритромицин |
полимиксины |
линкомицин |
канамицин |
сульфаниламиды |
левомицетин |
стрептомицин |
амфотерицин В |
нитрофураны |
Донорские иммуноглобулины |
Рентгеноконтрастные вещества |
|
Нестероидные противовоспали- |
|
тельные препараты |
Плазма, сывороточный альбумин, |
Декстраны |
Интерфероны, интерлейкин-2 |
Поливинилпирролидоны |
Моноклональные антитела |
(гемодез, неогемодез) |
|
Реополиглюкин |
Гормональные вещества (инсулин, |
|
кортикотропин, вазопрессин, гор- |
|
моны гипофиза, паращитовидных |
|
желез) |
|
Аллергогенные экстракты |
Миорелаксанты |
Вакцины |
Местные анестетики |
Диагностические аллергены |
Тиопентал натрий |
(тулярин, токсоплазмин, |
|
бруцеллин и др.) |
|
АНАФИЛАКТИЧЕСКИЙ ШОК
393
Анафилактический шок, развивающийся чаще всего вследствие |
|
острой системной анафилаксии |
анафилактоидной реакции |
(обусловленной 1дЕ или IgG 4) |
(1дЕ-независимой) |
Гетерогенные лечебные сыворот- |
Протамин-сульфат |
ки (противостолбнячная, проти- |
|
водифтерийная, антирабическая |
|
идр-) |
|
Сыворотки-противоядия |
|
Лечебные иммуноглобулины (про- |
Гепарин |
тивосибиреязвенный, противо- |
Витамины группы В |
лептоспирозный, антилимфоци- |
|
тарный и др.) |
|
Ферментные препараты |
Аминокапроновая кислота |
(химопапаин, трипсин, химо- |
Опиоиды (морфий и др.) |
трипсин, пенициллиназа, аспара- |
|
гиназа, стрептокиназа, контри- |
|
кал, трасилол, гордокс) |
|
Латекс (медицинские перчатки) |
|
Примечание. Светлым курсивом выделены препараты и лекарства, часто используемые в профилактике, диагностике и лечении инфекционных болезней.
В настоящее время анафилактический шок чаще всего возникает при лечении антибиотиками, в первую очередь р-лактамными, из которых наиболее аллергогенен пенициллин из-за особенностей его строения и метаболизма в организме. Описаны случаи развития анафилактического шока при анамнестически первом в жизни введении пенициллина. Этот феномен объясняют предшествовавшей латентной сенсибилизацией больных к пенициллину в результате его попадания в организм с пищевыми продуктами, при вдыхании пыли, содержащей молекулы пенициллина.
У лиц с аллергией на пенициллин существует опасность развития анафилактического шока и на введение полусинтетических пени-циллинов (ампициллина, амоксициллина, оксациллина) или цефа-лоспоринов, молекулы которых тоже содержат (3-лактамное кольцо.
В клинике инфекционных болезней анафилактический шок встречается особенно часто как из-за широкого применения потенциально высокоаллергогенных препаратов {антибиотики, сыворотки и др.), так и из-за выраженного аллергического компонента в патогенезе многих инфекций. Полными, или истинными, аллергена-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
394
ми являются лечебные гетерогенные сыворотки, иммуноглобулины, диагностические препараты, нередко используемые для лечения и диагностики инфекционных болезней. Описано развитие анафилактического шока даже при постановке внутрикожных проб. Поэтому вышеназванные препараты должны применяться лишь по самым строгим показаниям.
Замена гетерогенных сывороток человеческими иммуноглобулинами уменьшила частоту анафилактического шока, но он может иногда развиться и при их применении, что объясняется плохой очисткой от балластных веществ. В результате загрязнения препаратов различными аллергенами анафилактический шок может возникнуть при переливании сывороточного альбумина, плазмы, фибриногена, эритроцитарной массы.
Анафилактический шок при введении вакцин обусловлен главным образом примесями белков, которые использовали для выращивания вирусов или бактерий, необходимых для приготовления этих профилактических препаратов. Другие ингредиенты, используемые для приготовления вакцин (например, антибиотики), так же могут быть причиной анафилактического шока при вакцинации. С улучшением технологии культивирования возбудителей, очистки вакцин, с заменой части из них синтетическими химическими препаратами частота анафилактического шока при вакцинации уменьшилась.
Анафилактический шок может возникнуть при некоторых гель-минтозах, особенно в фазе миграции личинок гельминтов в крови. В большинстве случаев анафилактический шок с тяжелым течением и высокой летальностью возникал у детей до 15 лет во время миграционной фазы аскарид. Аналогичные случаи описаны и у отдельных больных трихинеллезом, стронгилоидозом, вухерериозом, цисти-церкозом. Часто развивается этот вид шока при разрывах эхинококковых и альвеококковых пузырей в результате одномоментного массивного поступления продуктов жизнедеятельности гельминта в кровь.
Анафилактический шок на пищевые продукты также встречается редко, обычно он связан с наличием в пище примесей антибиотиков, ароматизаторов, химических красителей, гербицидов. Самыми опасными продуктами в этом отношении являются яйца, молоко, орехи, бобы, арахис, изделия из измельченного зерна (кукурузные хлопья), ракообразные и рыба (особенно треска). При острых кишечных инфекциях описаны случаи развития анафилактического шока на введение регидратационных смесей, содержавших как лечебный компонент шелуху зерен.
Классификация. Общепринятой клинической классификации анафилактического шока нет.
анафилактический шок
395
По степени тяжести выделяют легкую, средней степени тяжести, тяжелую и молниеносную формы анафилактического шока, что соответствует классификации анафилактического шока по степеням тяжести:
I степень — легкая форма шока;
II степень — средней тяжести форма;
степень — тяжелая форма;
степень — крайне тяжелая форма (молниеносная).
В зависимости от преобладания клинических симптомов возможно выделение сосудистого, кардиального, церебрального, респира-торно-пульмонального, абдоминального вариантов течения анафилактического шока.
Примерная формулировка диагноза. В диагнозе необходимо указать наиболее вероятную причину развития шока.
Анафилактический шок (на введение столбнячного анатоксина), тяжелая форма, церебральный вариант.
Анафилактический шок (на инъекцию пенициллина) средней степени тяжести, сосудистый вариант.
Патогенез. Анафилактический шок относится к аллергическим реакциям немедленного типа. Наследственная предрасположенность к анафилаксии отсутствует. На лекарственные препараты она возникает одинаково часто как у больных атопическими заболеваниями, так и у здоровых.
Выделяют иммунологическую, патохимическую и патоморфоло-гическую стадии анафилактического шока.
Иммунологическая стадия развивается при повторном контакте сенсибилизированного организма с аллергеном, который связывается с реагинами (по крайней мере, с двумя — преимущественно с IgE, реже— с IgG4), фиксированными на поверхности мембран лаброцитов и базофилов.
Реагины одним концом молекулы соединяются со специфическими рецепторами клеток-эффекторов (в первую очередь, лаброцитов), а другим — с соответствующими участками молекул аллергена. Последний, чтобы вызвать реакцию гиперчувствительности немедленного типа, должен иметь два и более мест связывания. Иммунный ответ может подавляться избытком одновалентных молекул антигенов (свободного препарата или его метаболитов) из-за конкуренции за одни и те же рецепторы с поливалентными молекулами того же лекарственного средства или соединения. Поэтому вероятность, скорость, сила развития аллергических реакций на лекарства определяются соотношением концентраций свободного и связанного с носителем гаптена. Существенно могут влиять и некоторые ферменты плазмы крови, способные удалять гаптены с молекул белков-носителей.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
396
В результате связывания поливалентных антигенов с реагинами образуются «мостики», стягивающие рецепторы мембран клеток-эффекторов, что вызывает их дегрануляцию с освобождением большого количества биологически активных веществ.
Особенности клиники анафилактического шока в какой-то мере объясняются преимущественным распределением лаброцитов в организме. Наибольшая их концентрация под эпителием верхних дыхательных путей, в подслизистом и слизистом слоях пищеварительного тракта, коже, костном мозге, нервной системе, в соединительной ткани вокруг артериол и венул. У разных индивидуумов распределение лаброцитов и количество базофилов в крови могут значительно варьировать, что, возможно, объясняет наличие различных вариантов течения анафилактического шока и определяет при всех их ведущую закономерность поражения сердечно-сосудистой, центральной нервной и дыхательной систем. Кроме того, и расположение плазматических клеток, продуцирующих IgE, так же может определять выраженность поражений различных систем при анафилактическом шоке. Эти клетки в большом количестве встречаются в лимфоидной ткани миндалин, мезентериальных и периброн-хиальных лимфоузлах, непосредственно в слизистых оболочках дыхательных путей и кишечника.
Патохимическая стадия начинается с активации лаброцитов и базофилов вследствие стягивания на их мембранах рецепторов (при связывании поливалентным антигеном двух и более соседних молекул IgE) и дегрануляции этих клеток с освобождением медиаторов. Причем активироваться может только часть мембраны лаброцита (например, обращенная к просвету сосуда).
Анафилактический шок развивается лишь при системной дегрануляции лаброцитов и базофилов. Их же местная дегрануляция носит защитный характер (например, при паразитарных заболеваниях). Она или ничем не проявляется, или вызывает местные симптомы немедленной аллергии.
Некоторые препараты (йодсодержащие контрастные вещества, опиаты, декстраны, миорелаксанты) могут вызывать системную дегрануляцию лаброцитов и базофилов как непосредственно, так и вследствие действия на лаброциты активированных лекарствами фрагментов системы комплемента. Могут действовать одновременно оба механизма такой анафилактоидной реакции, вызывая шок, клинически ничем не отличимый от анафилактического. Поскольку и патохимическая, и патофизиологическая стадии генерализованной анафилактоидной реакции и острой системной анафилаксии также ничем не отличаются, клиническая дифференциация анафилактического и анафилактоидного шоков нелогична, в отличие от иммунологической дифференциации анафилактической и ана-
анафилактический шок
397
филактоидной реакций. Последняя обычно характеризуется лишь более легким течением. Поэтому в дальнейшем мы рассматриваем патогенез и клинику анафилактического шока независимо от того, вследствие анафилактоидной реакции или системной анафилаксии он развился.
Считается, что именно медиаторы лаброцитов и базофилов играют основную роль в патогенезе анафилактического шока, быстрота и тяжесть развития которого зависят от количества освобождаемых медиаторов и их соотношений. Среди них выделяют медиаторы, депонированные в гранулах лаброцитов и сразу же освобождающиеся при их активации (гистамин, гепарин, серотонин, протеазы и др.), и медиаторы, синтезируемые лишь после активации клеток (фактор активации тромбоцитов, лейкотриены, простагландины и др.).
Синтез медиаторов требует затрат энергии клетками, поэтому блокада энергообразования тормозит дальнейшие синтез и выброс медиаторов анафилаксии. Активация лаброцитов и эозинофилов сопровождается уменьшением содержания в них цАМФ, поэтому препараты, увеличивающие его концентрацию (адреналин), патогенетически являются необходимыми и первоочередными при оказании неотложной помощи.
Часть первичных медиаторов анафилаксии вызывает миграцию в очаги дегрануляции лаброцитов других клеток — эозинофилов, макрофагов, нейтрофилов, которые, в свою очередь, выделяют вещества, обозначаемые как вторичные медиаторы анафилаксии. Некоторые из них (лейкотриены С4, D4, Е4, простагландин F2a) вызывают бронхоспазм, гиперсекрецию в дыхательных путях, повышенную проницаемость сосудов и их расширение на периферии, другие (к примеру, простагландин Е2) вызывают обратный эффект либо разрушают первичные медиаторы, как, в частности, гистамина-за разрушает гистамин. Таким образом, на клеточном уровне существует система обратных связей, регулирующая активность лаброцитов и базофилов. Лишь грубое нарушение этой регуляции вызывает анафилактический шок.
Вследствие системной дегрануляции лаброцитов и базофилов анафилактический шок развивается в первые 30 мин после введения аллергена. А системная активация эозинофилов, моноцитов и тромбоцитов тем же аллергеном приводит к развитию отсроченной фазы анафилактического шока — обычно через 4—8 ч. Таким образом, для системной реакции необходимо все же определенное время, поэтому говорить о смерти от шока «на конце иглы» неверно.
Одновременно или последовательно (что, возможно, определяет быстроту развития и тяжесть шока) происходит первичная и индуцированная медиаторами лаброцитов и базофилов вторичная активация других клеток иммунной системы: макрофагов, В-лимфо-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
398
цитов, плазматических клеток, эозинофилов, нейтрофилов с освобождением ими медиаторов как усиливающих, так и угнетающих анафилаксию. Суммарный эффект этих медиаторов и определяет быстроту развития, тяжесть, клинический вариант анафилактического шока.
В тканях органов-мишеней (прежде всего респираторного тракта и сосудов) под воздействием медиаторов анафилаксии активируется синтез простагландинов, прежде всего группы F, которые вызывают снижение в клетках содержания цАМФ и затем спазм гладких мышц бронхов, кишечника, матки, мочевого пузыря, гиперсекрецию назофарингеальной и бронхиальной слизи. Однако одновременно происходит накопление в тканях простагландинов Е, которые способствуют накоплению в клетках органов-мишеней анафилаксии цАМФ и вызывают обратный действию простагландинов группы F эффект. Суммарное воздействие на организм этих факторов зависит от соотношения их исходного содержания в тканях, а также от количества предшественников и ферментов их синтеза.
Патофизиологическая стадия. Вследствие комплексного действия перечисленных медиаторов анафилаксии на клетки-мишени снижается сосудистый тонус, катастрофически увеличивается емкость венозного русла и развивается сосудистый коллапс (сердце обычно вовлекается вторично). Одновременно повышается проницаемость капилляров микроциркуляторного русла, что вызывает выход жидкой части плазмы крови из сосудов в ткани с развитием отеков и серозного воспаления. Развиваются бронхо- и ларингоспазм, отек слизистых оболочек верхних дыхательных путей, гиперсекреция слизи. Последнее может стать причиной их обтурации. Спазм гладких мышц пищеварительного тракта и отек слизистых оболочек, гиперсекреция приводят к дисфагии, тошноте, рвоте. Может наблюдаться и кратковременная диарея. Возможны схваткообразная, резкая боль внизу живота, спазмы мочевого пузыря и матки с появлением кровянистых выделений, кожный зуд, крапивница, отеки губ, лица, половых органов.
Уменьшается венозный возврат крови к сердцу без существенного снижения сократительной способности миокарда, снижается ОЦК, падает АД, температура тела, ниже нормы, возникает компенсаторная тахикардия, нарастает одышка. К развивающейся цирку-ляторной гипоксии и метаболическому ацидозу в тканях присоединяются дыхательные гипоксия и алкалоз, что еще более нарушает функции жизненно важных органов и тканей. Может развиться инфаркт миокарда, закономерно появление ОПН.
Взаимосвязь основных клинических проявлений с действием отдельных медиаторов анафилаксии представлена в табл. 19.
анафилактический шок
399
Таблица 19. Проявления и причины анафилактических реакций (G.J. Lawlor Jr., H.M. Rosenblatt, 1995)
Локализация поражения |
Клинические проявления |
Медиаторы анафилаксии |
Кожа Слизистые оболочки Верхние дыхательные пути Бронхи Пищеварительный тракт Сердечно-сосудистая система ЦНС |
Крапивница, эритема, отек Отек век, заложенность и зуд в носу, отек Квинке, гиперемия или бледность, цианоз Чиханье, обильные выделения из носа, отек гортани, глотки, языка, дисфония, свистящее дыхание Одышка, бронхоспазм, повышенная секреция слизи Усиление перистальтики, рвота, дисфагия, тошнота, схваткообразная боль в животе, понос Тахикардия,артериальная гипотензия, сердечная недостаточность Беспокойство, слабость, судороги |
Гистамин, лейкотрие-ны, простагландины Гистамин, лейкотрие-ны, простагландины Гистамин, лейкотрие-ны, простагландины Гистамин, лейкотрие-ны, простагландины, фактор активации тромбоцитов Гистамин, лейкотрие-ны, простагландины Гистамин, лейкотрие-ны Возможно, гистамин и серотонин |
Таким образом, наиболее характерными для анафилактического шока являются следующие патофизиологические изменения:
расширение кровеносных сосудов, преимущественно органов брюшной полости, слизистых оболочек и кожи, с увеличением емкости кровеносного русла и развитием относительной гиповолемии;
повышение проницаемости капилляров, что приводит к абсолютной гиповолемии из-за поступления большого количества жидкой части плазмы в ткани;
спазм гладких мышц бронхов, бронхиол, трахеи, гортани, отек их слизистых оболочек с параллельным развитием бронхиальной и назофарингеальной гиперсекреции с последующей обструкцией дыхательных путей и респираторной гипоксией;
нарушение регуляторной функции ЦНС как в результате пря-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
400
мого действия медиаторов анафилаксии, так и вследствие гипоксии;
аллергическое воспаление кожи и слизистых оболочек с развитием их отека и гиперсекреции желез;
спазм гладких мышц пищеварительного тракта, мочевого пузыря, матки, усиление желудочной и кишечной перистальтики, секреции у части больных.
Смерть может наступить от острой сердечно-сосудистой и дыхательной недостаточности, отека легких и мозга, механической асфиксии из-за ларинго- и бронхоспазма, гиперсекреции слизи.
Внезапную смерть от остановки сердечной деятельности при укусе насекомыми сейчас рассматривают как кардиальныи вариант молниеносного анафилактического шока, а такую же смерть при явлениях отека-набухания головного мозга — как его церебральный вариант.
Суммарная схема всех стадий патогенеза анафилактического шока приведена на рис. 26.
При патологоанатомическом исследовании погибших от анафилактического шока обычно обнаруживают отек и спазм гладкомы-шечных элементов гортани, трахеи, бронхов, легких, повышенное содержание слизистого секрета, вплоть до полной обтурации им просвета дыхательных путей. В головном мозге — отек-набухание, мелкие геморрагии в его вещество. Застойные явления во внутренних органах, отек кожи и расширение ее сосудов. Описанные явления могут не успеть возникнуть при молниеносной форме анафилактического шока.
При гистоморфологическом исследовании препаратов внутренних органов определяются эозинофильные инфильтраты в стенках альвеол, бронхиол, бронхов и трахеи, невоспалительный отек паренхимы легких, почек, миокарда (нередко с признаками его инфаркта), вещества мозга, расширение и полнокровие венозной части капилляров. При смерти от анафилактического шока в первые часы выявляют дегрануляцию лаброцитов, отек дермы и признаки активации эндотелия сосудов. При смерти в более поздние сроки дополнительно к этому появляются инфильтрация органов-мишеней нейтрофи-лами, эозинофилами, базофилами, лимфоцитами, мононуклеарами, кровоизлияния, повреждения сосудистой стенки с отложениями фибрина и формированием картины васкулита, признаки выраженной гипоксии клеток и тканей.
Патогенез основных симптомов анафилактического шока представлен в табл. 20.
АНАФИЛАКТИЧЕСКИЙ ШОК
401
I. Иммунологическая стадия
Связь аллергена после его повторного введения и предшествовавшей сенсибилизации с реагинами (IgE) на поверхности мембран клеток-эффекторов (прежде всего лаброцитов и базофилов) с последующей их системной активацией и дегрануляцией
II. Патохимическая стадия
Выброс и синтез лаброцитами и базофилами медиаторов анафилаксии. Отсроченная фаза: активация эозинофилов, нейтрофилов, тромбоцитов
III. Патофизиологическая стадия
Воздействие медиаторов на ткани и органы-мишени: сосуды, гладкие мышцы бронхов, кишечника, матки, мочевого пузыря, на миокард, ЦНС
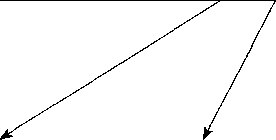
Увеличение
емкости
венозного
русла,
уменьшение
возврата
крови
Нарушение
нервной
регуляции
сосудистого
тонуса,
угнетение
ЦНС
Бронхоспазм, ларингоспазм, гиперсекреция слизи,
отек слизистых оболочек верхних дыхательных путей, отек легких
Гипоксия тканей, метаболический ацидоз и дыхательный алкалоз, падение
АД, отек-набухание мозга, острая дыхательная недостаточность, острая
почечная недостаточность —» смерть
Рис. 26
Патогенез анафилактического шока
26 — 2-3077
402-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Таблица 20. Патогенез основных клинических симптомов анафилактического шока
Симптомы
Основные причины их развития
Снижение АД
Снижение температуры тела Бронхоспазм
Гиперсекреция слизи
Ларингоспазм, отек гортани
Чиханье, рино-рея
Свистящее дыхание Одышка
Акроцианоз
Олигурия
Тахикардия
Паретическое расширение сосудов, увеличение венозной емкости сосудистого русла Уменьшение венозного возврата крови к сердцу Повышение проницаемости капилляров с развитием абсолютной гиповолемии
Иногда — снижение сократительной способности миокарда
Резкое нарушение микроциркуляции в сосудах Угнетение обменных процессов Прямое и опосредованное воздействие медиаторов анафилаксии на гладкие мышцы бронхов Прямая стимуляция медиаторами анафилаксии секреции клетками эпителия дыхательных путей Спазм гладких мышц, отек слизистых оболочек из-за прямого и опосредованного действия медиаторов анафилаксии
Воздействие медиаторов анафилаксии на слизистую оболочку носа с гиперсекрецией, отеком слизистых оболочек
Отек слизистых оболочек дыхательных путей Гиперсекреция с последующей обструкцией Бронхо- и ларингоспазм
Гиперсекреция слизи с обтурацией дыхательных путей
Циркуляторная гипоксемия
Следствие дыхательной и острой сосудистой недостаточности, нарушений микроциркуляции, тканевой гипоксии и ацидоза
Критическое снижение почечного кровотока, гипоксия и ацидоз в тканях почек
Прямое повреждение медиаторами ткани почек Чаще — компенсаторная реакция на острую сосудистую недостаточность, гипоксию и ацидоз тканей Дыхательная недостаточность Реже — следствие поражения миокарда
анафилактический шок
403
Симптомы |
Основные причины их развития |
Возбуждение, потеря сознания, судороги, мозговая кома. Возможно прямое воздействие медиаторов на ЦНС Боль внизу живота, метрорра-гии Зуд кожи, ур-тикарная сыпь, отеки типа Квинке Задержка мочи Боль в животе, диарея |
Отек-набухание головного мозга вследствие снижения мозгового кровотока, нарушений микроциркуляции, повышения проницаемости сосудов, ацидоза и гипоксии Непосредственное воздействие медиаторов анафилаксии на мышцы матки и влагалища, повышение проницаемости их сосудов Прямое действие гистамина и других медиаторов на кожный эпителий и микроциркуляторное русло кожных покровов, отек кожи и ее аллергическое воспаление Спазм мышц мочевого пузыря Острая почечная недостаточность Спазм гладких мышц пищеварительного тракта Усиление перистальтики и секреции |
Клиника. Проявления анафилактического шока отличаются разнообразием клинических симптомов, которые могут зависеть от пути введения аллергена (и гораздо в меньшей степени — от его дозы), от преморбидного фона и возраста больных. Наиболее тяжелое течение шока (нередко — молниеносное) отмечается у больных с сердечно-сосудистыми заболеваниями, улиц, страдающих рецидивирующей крапивницей, бронхиальной астмой, особенно длительно получавших (3-адреноблокаторы или ингибиторы ангиотензинпревра-щающего фермента, — при их применении происходит выраженное расширение периферических сосудов, что при действии анафилак-тогенного фактора приводит к параличу периферического кровотока. Смертельный исход чаще отмечается у больных старше 20 лет.
Основные симптомы анафилактического шока можно объединить в клинические синдромы, представленные в табл. 21, при этом характерно обязательное наличие и сочетание сосудистого, респи-раторно-пульмонального и церебрального синдромов независимо от тяжести.
26*
404-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Таблица 21. Клиническая характеристика и частота развития основных синдромов, возникающих при анафилактическом шоке
Синдромы
Частота возникновения
Краткая характеристика синдромов
Острая сосудистая недостаточность (кардио-васкулярный синдром)
Острая дыхательная недостаточность (бронхопульмо-нальный, респи-раторно-пульмо-нальный)
Острая церебральная недостаточность (церебральный)
Абдоминальный
Аллергическое поражение кожи и слизистых оболочек
Всегда
Очень часто
Часто, а его минимальные проявления — всегда
Часто после приема аллергена внутрь
Всегда — при нетяжелых формах, при тяжелых — по выходу из шока
Резкая слабость, головокружение, бледность кожи, акроцианоз, снижение температуры тела, АД и ЦВД, тахикардия, приглушенность тонов сердца, олигурия
Одышка, затрудненное дыхание, приступообразный мучительный кашель, стридорозное, клокочущее дыхание, участие в акте дыхания вспомогательных мышц, рассеянные сухие свистящие хрипы, тотальный цианоз, пена изо рта, отек слизистых оболочек трахеи, гортани до механической асфиксии
Возбуждение, страх смерти, заторможенность, спутанность сознания и его полная потеря, тонические и клонические судороги, парезы, параличи, непроизвольные дефекация и мочеиспускание, нарушения ритма сердечной деятельности, остановка сердца и дыхания
Тошнота, рвота, дисфагия, боль в животе без определенной локализации, послабление стула, болезненность и спазм петель тонкого кишечника, в меньшей степени — толстого
Сильный зуд, покраснение кожи, папулезная, крупнопятнисто-папулезная и уртикарная сыпь, отеки типа Квинке лица, губ, половых органов, слизистых оболочек носа, ротоглотки, гиперемия и отек конъюнктив, склер, слезотечение, чиханье, рино-рея, першение в горле, поверхностный приступообразный кашель
анафилактический шок
405
Синдромы |
Частота возникновения |
Краткая характеристика синдромов |
Ренальный синдром Печеночный синдром (острый аллергический гепатит) |
Всегда — при тяжелой форме, возможен — при средней тяжести АФ Редко, лишь при тяжелой форме |
Боль в пояснице, снижение диуреза, положительный симптом Пастернацкого, протеинурия, ци-линдрурия, эритроцитурия, анурия, уремическая кома Увеличение печени, ее болезненность с незначительным повышением показателей цитолиза, очень редко — желтуха и острая печеночная недостаточность |
Абдоминальный синдром встречается редко, но иногда может доминировать в клинической картине (абдоминальный вариант анафилактического шока) и быть причиной серьезных диагностических ошибок («ложный острый аллергический живот»).
Печеночный синдром редок, чаще отмечаются осложнения шока со стороны печени иммунного характера.
Преобладание синдрома аллергического поражения кожи и слизистых оболочек в клинике шока и начало анафилаксии с его проявлений прогностически благоприятно.
Основными критериями тяжести анафилактического шока в первую очередь являются продолжительность скрытого периода, выраженность и длительность продромального (начального) периода, сосудистого, церебрального, респираторно-пульмонального и реналь-ного синдромов. Дополнительные критерии — наличие и степень манифестации абдоминального синдрома, синдрома аллергического поражения кожи и слизистых оболочек. Необходимо отметить, что при определении тяжести анафилактического шока не следует ориентироваться исключительно на гемодинамические показатели, так как у молодых смерть наступает в 70 % случаев от дыхательной недостаточности вследствие отека гортани, ларинго- и бронхоспазма с последующей обструкцией дыхательных путей и асфиксией, а также от отека легких.
В течении анафилактического шока выделяют такие периоды:
скрытый («инкубационный») — от момента поступления аллергена до начала клинических проявлений;
продромальный — от появления первых клинических симптомов до развернутой картины шока;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 406
разгара;
восстановительный.
Скрытый («инкубационный») период шока может быть от нескольких секунд (смерть «на конце иглы» при молниеносной форме до 30 мин) до 6—8 ч.
Длительность скрытого периода соответствует длительности иммунологической и иммунохимической стадий развития шока. «Поздний», «отсроченный» шок обусловлен, возможно, преобладающей системной активацией не лаброцитов и базофилов, а моноцитов, эозинофилов и неитрофилов с превалированием в начальной фазе медиаторов, ингибирующих анафилаксию, и последующим истощением этих регуляторных механизмов.
Существует зависимость длительности скрытого периода от способа введения аллергена (лекарства): при внутривенном введении он наиболее короток, при приеме per os — обычно наиболее продолжителен. В последнем случае позднее развитие шока может быть обусловлено и тем, что его вызывает не само лекарство, а высоко-аллергогенные метаболиты в организме, а также преобладанием не иммуноопосредованных (анафилактоидных) реакций.
Для легкой формы анафилактического шока характерен длительный латентный («инкубационный») период — от 2 до 6—8 ч, что чаще наблюдается при приеме лекарств внутрь, реже — при внутримышечном их введении. Это же бывает и при внутривенном введении, если аллергеном является не само лекарство, а продукты его продолжительного метаболизма в организме. В таких случаях и внутрикожные, подъязычные предварительные пробы всегда отрицательны и лишены смысла перед введением препарата (например, перед введением цефалоспоринов, но не пенициллина!).
Для продромального периода легкой формы анафилактического шока характерны проявления в виде ощущения тепла, покалывания в конечностях, слабости, беспокойства, сильного зуда, уртикарной сыпи, отеков типа Квинке. Появляется приступообразный кашель, затрудненный выдох, царапанье в горле, обильное слезотечение, заложенность в носу с последующим обильным серозным отделяемым, несильная, разлитая боль в животе с легким послаблением стула, тошнота.
При осмотре больных выявляют гиперемию лица, склерит, конъюнктивит, отечность слизистых оболочек ротоглотки и гортани, учащенное дыхание, сухие хрипы, небольшую тахикардию и приглушенность тонов сердца.
Все эти явления длятся от нескольких десятков минут до 1 ч, если не оказывается медицинская помощь.
В период разгара легкой формы анафилактического шока предыдущие жалобы усиливаются. Появляются бледность и похолодание
анафилактический шок
407
кожи конечностей без акроцианоза, небольшая одышка, тахикардия (пульс 90—100 в 1 мин), АД нормальное или слегка снижено. Выслушиваются небольшая приглушенность тонов сердца, в легких — сухие свистящие хрипы. 1ДВД, диурез не снижены.
Восстановительный период легкой формы шока может длиться от нескольких часов до 1—2 сут с полным восстановлением гемодинамики, дыхания, исчезновением признаков аллергического поражения кожи и слизистых оболочек, абдоминального и ренального синдромов.
Дольше всего (до нескольких дней) могут сохраняться (а иногда и усиливаться) зуд кожи, сыпь, отеки. Осложнения очень редки и имеют преимущественно иммунный характер (артриты, нефрит, миокардит). Слабость, повышенная утомляемость сохраняются не более 2—3 дней.
Нередкие случаи самопроизвольного выхода больных из такого состояния больше характерны для анафилактоидных реакций. Летальных исходов при легкой форме этого вида шока, как правило, не бывает.
Иногда после выхода из анафилактического шока могут появиться сильный озноб, значительно повыситься температура тела, вновь нарасти сильная слабость, одышка, удушье, боль в области сердца, снижение АД. Такие приступы (рецидивы шока) могут повторяться до 3—4 раз. Это связывают с распространением медиаторов анафилаксии из мест их скопления в тканях при улучшении гемодинамики, с вторичной дегрануляцией эозинофилов, тромбоцитов, моноцитов и недостатком антагонистов сосудорасширяющих соединений, т. е. по существу формируется отсроченный шок более тяжелой степени.
Средней тяжести анафилактический шок, в отличие от его легкой формы, характеризуется более коротким скрытым периодом и от одной до нескольких минут выраженным продромальным периодом, меньшим зудом кожи, слабой распространенностью экзантемы и других проявлений аллергического синдрома, более бурным началом.
В период разгара шока больные чаще, чем при легкой форме, испытывают сильное беспокойство, страх смерти, может быть кратковременная потеря сознания, отдельные судороги. Более выражены одышка, головокружение, головная боль, разлитая боль в области сердца и в животе, тошнота, рвота, послабление стула, чувство стеснения за грудиной, нехватки воздуха, приступообразный кашель. У женщин возможны схваткообразные болезненные сокращения матки, метроррагия. Обычно развивается олигурия.
При осмотре: больные возбуждены, кожные покровы бледные, холодные, с небольшим акроцианозом. Не характерны, в отличие от легкой формы, кожно-слизистые проявления аллергического синд-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
408
рома. Более выражены одышка, достигающая 30 вдохов в 1 мин, тахикардия — до 100—ПО в 1 мин, умеренно снижены АД (100/60— 90/50 мм рт. ст.) и ЦВД (40—50 мм вод. ст.).
Восстановительный период более продолжителен — от 1 до 4 сут, характеризуется относительной артериальной гипотензией, лабильностью пульса, иногда рецидивами бронхоспазма, отдельных кожных проявлений анафилаксии. Нередки осложнения — миокардит, нефрит, артриты, реже — почечная недостаточность, демиелинизи-рующие поражения нервной системы.
Летальные исходы возможны чаще от осложнений иммунного генеза, которые могут развиваться уже после 4—5-го дня от начала шока.
Тяжелая форма анафилактического шока отличается коротким (от нескольких десятков секунд до нескольких минут, редко — до 10— 15 мин) скрытым периодом, бурным началом с очень коротким продромальным периодом, его сглаженностью, отсутствием или слабой выраженностью аллергического синдрома поражения кожи и слизистых оболочек, который чаще и сильнее проявляется при выходе из шока. Выраженное возбуждение, страх смерти быстро сменяются ощущением безысходности, заторможенностью, спутанностью сознания. Уже в начальный период превалируют одышка, бронхо- и ларингоспазм, бледность и акроцианоз, похолодание кожных покровов, тахикардия, приглушенность тонов сердца, снижение АД.
Для периода разгара характерны потеря сознания, выраженные дыхательная и сердечно-сосудистая недостаточность. Черты лица заострены, резкая бледность кожных покровов, цианоз, холодный липкий пот, нередко — пена изо рта, стридорозное дыхание. Одышка более 40 в 1 мин, тахикардия свыше 120 в 1 мин, часто — с нарушениями сердечного ритма, выраженная глухость сердечных тонов, АД ниже 70/40—60/30 мм рт. ст., ЦВД снижено до 20—10 мм вод. ст. Как проявления отека-набухания головного мозга и раздражения его оболочек, внутричерепной гипертензии часто отмечаются тонические и клонические судороги, парезы, параличи, Нередко бывают непроизвольные дефекация и мочеиспускание, развивается анурия.
Если больные в сознании, что при тяжелой форме шока отмечается редко, то могут появляться резкая схваткообразная боль по всему животу, вплоть до картины острого живота, а у женщин сильные частые спазмы матки, обильные кровянистые выделения из половых путей.
Очень часты, даже при своевременно начатой интенсивной терапии, летальные исходы при явлениях прогрессирующей сердечнососудистой, дыхательной недостаточности, отека-набухания головного мозга, ОПН.
АНАФИЛАКТИЧЕСКИЙ ШОК
409
Восстановительный период продолжителен, до недели и более, часты рецидивы в виде повторных, внезапных снижений АД, усиления респираторно-пульмонального и аллергического синдромов. Иногда гибель больного может наступить на фоне рецидива.
Гораздо более часто и раньше, чем при нетяжелых формах, уже на 2—4-е сутки, развиваются смертельные осложнения. Раньше развиваются и тяжелее протекают в первую очередь осложнения иммунного генеза, но часто появляются ОПН, гнойно-септические процессы.
Молниеносная форма анафилактического шока возникает после внутривенного введения лекарства, укуса насекомым, при попадании аллергена во время оперативных вмешательств (внезапная смерть на операционном столе). Характеризуется крайне непродолжительным скрытым периодом — от нескольких секунд до 1 мин, отсутствием продромального периода и синдрома аллергических сли-зисто-кожных поражений, галопирующим развитием сосудистой недостаточности с потерей сознания, судорогами, острой дыхательной недостаточностью. Обычно молниеносная форма заканчивается внезапной смертью от остановки сердца «на конце иглы». В таких случаях диагноз анафилактического шока устанавливают лишь ретроспективно. Реже причиной смерти являются острая дыхательная недостаточность с отеком легких и (или) механической асфиксией вследствие отека верхних дыхательных путей, гиперсекреции, брон-хоспазма, ларингоспазма или острая церебральная недостаточность («мозговая смерть»).
Осложнения при анафилактическом шоке могут быть специфические, связанные с теми же патогенетическими механизмами, которые обусловливают и сам шок, а также неспецифические.
К ранним специфическим осложнениям, которые обычно являются непосредственной причиной смерти при шоке, относят:
отек легких;
механическую асфиксию вследствие отека дыхательных путей и гиперсекреции бронхиальной слизи, ларингоспазма;
отек-набухание головного мозга;
ОПН;
— нарушения сердечного ритма с остановкой сердца.
Поздние осложнения носят преимущественно иммунный характер, они обусловлены развитием и прогрессированием аутоиммунных процессов, пусковым фактором которых был шок. К ним относят миокардиты, перикардиты, бронхиальную астму и астматический бронхит, гломерулонефрит, демиелинизирующие поражения нервной системы, энцефалит, аллергический гепатит, рецидивирующую крапивницу. Эти осложнения чаще и раньше (уже с 4—5-го дня) развиваются при тяжелой форме шока, но не редки и после лег-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
410
кой формы, хотя в этом случае протекают легче, обычно без летальных исходов.
Исходы зависят от тяжести анафилактического шока, возраста больных, преморбидного фона и, главное, напрямую связаны со своевременностью оказания медицинской помощи и ее адекватностью.
Молниеносная форма характеризуется почти 100% летальностью. При тяжелой форме она может достигать 60—70 % у пожилых больных с сердечно-сосудистыми заболеваниями и обычно наступает в первые 30 мин. У детей и молодых летальность при тяжелой форме существенно ниже, при этом до 70% ее случаев обусловлено острой дыхательной недостаточностью вследствие отека слизистых оболочек верхних дыхательных путей, гиперсекреции, бронхо- ила-рингоспазма. У пожилых непосредственной причиной смерти чаще являются нарушения сердечного ритма, отек мозга.
При характеристике исходов следует помнить о наличии рефрактерного периода от 2—3 до 5 нед после перенесенного анафилактического шока, в течение которого аллергические реакции немедленного типа угнетены, и у больного может не возникнуть никакой реакции даже на тот препарат, который вызвал шок. Это способствует неправильной диагностике причины, вызвавшей шок, что может повлечь за собой назначение этого же препарата несколько месяцев или лет спустя. Такая ошибка обычно приводит к повторному шоку еще более тяжелому, с высокой летальностью.
Исходы шока зависят и от характера его осложнений. Наиболее они неблагоприятны при развитии отека легких, отека-набухания головного мозга, ОПН, а также при раннем, с 4—5-го дня, развитии иммунных осложнений в виде миокардита, энцефалита, восходящих параличей типа Ландри, гломерулонефрита.
Описана гибель отдельных больных даже через 2 нед после выхода из анафилактического шока от аллергического энцефаломиело радикулоневрита, тяжелого миокардита с сердечной недостаточностью. Тяжелый аллергический гепатит развивается нечасто, но может быть пусковым фактором развития хронического аутоиммунного гепатита, а изредка и приводить к появлению фатальной острой печеночной недостаточности.
Методы диагностики. Общеклинические методы исследования. Изменения не носят специфического характера, но имеют ряд особенностей.
Общий анализ крова характеризуется нормальными показателями красной крови и гематокрита при легкой и среднетяжелой форме шока. При тяжелой форме и при затяжном течении (более 1 сут) нетяжелых форм выявляют умеренное повышение гематокрита вследствие гемоконцентрации. Количество лейкоцитов также
анафилактический шок
411
увеличивается в 1 -е сутки по этой причине, а при легкой и средне-тяжелой формах оно незначительно повышено лишь в первые часы. Одновременно могут отмечаться нейтрофилез, анэозинофилия (обычно при тяжелой форме), которые затем сменяются лейкопенией с относительным лимфоцитозом и небольшой эозинофилией (уже со 2-х суток болезни). Нередко такие же изменения отмечают и в 1-е сутки болезни при легкой форме, особенно при выраженном синдроме аллергического поражения кожи и слизистых оболочек. СОЭ нормальная, увеличивается лишь при появлении осложнений, особенно аутоиммунных или септических. Тромбоцитопения для легкой формы не характерна, но умеренно выражена при более тяжелых формах, не всегда пропорционально их тяжести. Необходимо отметить, что при молниеносной форме нередко изменения вообще не успевают развиться.
Изменения в общем анализе моча характерны для ОПН (см. соответствующий раздел). Они минимальны при легкой форме и резко выражены при тяжелой, при которой очень быстро развивается анурия. Длительные протеинурия, цилиндрурия и эритроцитурия в восстановительный период шока обычно свидетельствуют о развитии аутоиммунного гломерулонефрита.
Биохимические анализы крови. Изменения характеризуются прежде всего гипопротеинемией за счет гипоальбуминемии, которая пропорциональна тяжести и еще в большей степени — длительности шока. Она связана с выходом альбуминов крови в ткани через стенки сосудов с последующим снижением онкотического давления плазмы крови и развитием относительной гипергаммаглобули-немии. Пропорционально тяжести шока и повышение уровня креа-тинина, мочевины, остаточного азота, аммиака плазмы крови, отражающее тяжесть ОПН и ее стадию. Повышение билирубина в крови, активности АлАТ отмечается редко, обычно оно незначительное и наблюдается либо при тяжелой форме шока, либо при развитии его иммунных осложнений. Чаще отмечают небольшое повышение АсАТ в сочетании с повышением КФК, АДГ, что является следствием поражения мышцы сердца ишемического или аллергического характера, а также связывают с ухудшением кровоснабжения, гипоксией тканей. В начальный период шока может возникать транзиторная гипергликемия. Часто отмечается гиперкалиемия, что объясняется цитолизом клеток органов-мишеней и присоединением ОПН.
Показатели коагулограммы мало информативны, так как развитие ДВС-синдрома при анафилактическом шоке отмечают нечасто. В начальный период шока на показатели коагулограммы может влиять повышение содержания гепарина в крови, которое снижается в восстановительный период.
Показатели КОС крова изменяются пропорционально тяжести
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
412
шока и характеризуются снижением буферной емкости плазмы крови, рН, гипоксемией. Вначале показатели КОС отражают метаболический и циркуляторныи ацидоз, дыхательную гипоксию, к которым при тяжелом течении или при доминировании респираторно-легоч-ного синдрома присоединяются дыхательный алкалоз и гиперкап-ния. У больных с анафилактическим шоком следует контролировать те же лабораторные показатели, что и у больных ИТШ (см. соответствующий раздел).
Инструментальные методы исследования. Наиболее показательна ЭКГ, изменения которой не всегда пропорциональны тяжести шока и могут отражать острую ишемию миокарда, развивающийся миокардит, электролитные нарушения при ОПН. В 1-е сутки шока обязателен мониторинг, в дальнейшем — ежедневный контроль ЭКГ для исключения развития инфаркта миокарда, угрожающих нарушений ритма. В таких случаях необходима и эхокардиоскопия. Какие-либо специфические изменения ЭКГ у больных анафилактическим шоком не отмечаются.
Специфическая диагностика причин анафилактического шока находится в стадии научных разработок и большинству лечебных учреждений нашей страны недоступна.
Высокоспецифическим и высокочувствительным методом ретроспективной диагностики является определение специфических IgE, выявляемых с помощью кожных тестов и (или) иммунолабора-торных проб. Кожное тестирование остается методом выбора в случаях развития анафилактического шока на яды насекомых и пенициллин (ноне нацефалоспорины!). Присутствие специфических IgE подтверждают путем кожного тестирования с подозреваемым аллергеном, начиная с высоких разведений. Но оно применимо только для выявления аллергии немедленного типа к истинным аллергенам, а не к гаптенам. Лишь немногие лекарственные препараты образуют аллергогенные комплексы с белками кожи или полимеризуются в плазме крови с образованием молекул, содержащих несколько антигенных детерминант, и поэтому могут использоваться для кожного тестирования.
Разработаны тест-системы для определения специфических IgE в крови больных методом ИФА. Такое определение гораздо более безопасно и менее трудоемко по сравнению с кожным тестированием, его используют для ранней диагностики анафилактического шока, но этот метод значительно дороже.
Случаи шока с преобладанием только мозговой симптоматики с летальным исходом в течение нескольких секунд или минут («молниеносная мозговая смерть») не доступны даже дорогостоящей лабораторной диагностике из-за быстротечности анафилаксии. В подобных ситуациях анафилактический шок является таким диагно-
анафилактический шок
413
зом, который исключительно необходимо поставить по клиническим данным.
Критерии диагноза. Анафилактический шок характеризуется:
отчетливой связью с введением лекарственного препарата непосредственно перед резким ухудшением состояния больного (или укусом пчелы и т.д.), даже если больной ранее этот препарат не получал;
отягощенным аллергологическим анамнезом (но не всегда!);
быстрым развитием полиорганных нарушений;
наличием синдрома аллергического поражения кожи и слизистых оболочек в виде зуда кожи, уртикарной или пятнисто-папулезной сыпи, отеков типа Квинке, слезотечения, конъюнктивита, ринореи наряду с падением АД, тахикардией, похолоданием конечностей;
сочетанием острой сосудистой недостаточности с респиратор-но-пульмональным синдромом в виде бронхо- иларингоспазма, отека гортани, легких;
отсутствием вначале и на высоте сосудистой недостаточности повышения температуры тела или признаков дегидратации;
сочетанием кардиоваскулярного и респираторно-пульмональ-ного синдромов со спастическими сокращениями матки и кровянистыми выделениями из половых путей у женщин, абдоминальным синдромом;
появлением на выходе из шока аллергического синдрома поражения кожи и слизистых оболочек или его усилением у части больных.
Дифференциальная диагностика. При размежевании анафилактического шока и состояний, подобных ему по клинической картине и развивающихся внезапно, иногда возникают существенные трудности в связи с крайним дефицитом времени из-за быстроты развертывания проявлений шока и разнообразия его симптоматики.
При инфаркте миокарда, приступе сердечной аритмии, как и при анафилактическом шоке, могут появляться чувство страха смерти, боль в грудной клетке, падение АД, тахикардия. Иногда в подобных ситуациях в ближайшее время перед началом проявлений был прием медикаментов в связи с хроническими заболеваниями сердца, что создает трудности в размежевании, так как возникает подозрение в развитии анафилаксии на лекарства. Но в отличие от анафилактического шока при этих состояниях:
слабо выражены или часто отсутствуют респираторно-легоч-ный, церебральный и особенно абдоминальный синдромы;
отсутствуют кожный зуд, уртикарная сыпь, отеки типа Квинке, ринорея, чиханье, слезотечение, изменения конъюнктив;
отсутствует нейтрофильный лейкоцитоз в первые часы, в по-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
414
следующем не появляются лейкопения, лимфоцитоз и эозино-филия;
— наличие изменений, особенно ритма, на ЭКГ, повышение ак тивности АсАТ, КФК, ЛДГ пропорционально степени пораже ния сердечной мышцы.
Сосудистый коллапс (обморок), возникающий после болезненных парентеральных вмешательств, как и анафилактический шок, начинается внезапно, с резкой слабости, снижения АД, выраженной бледности кожных покровов, сильной тошноты. Он отличается от кардиоваскулярного варианта анафилактического шока тем, что:
у больных выражена брадикардия;
появляется обильное потоотделение одновременно со снижением АД;
отсутствуют цианоз, зуд кожи, уртикарная сыпь и отеки, затруднение дыхания;
— АД стабилизируется без введения симпатомиметиков.
Возможность анафилаксии на введение инсулина, особенно животного, требует дифференциации гипогликемической комы при передозировке инсулина от анафилактического шока на инсулин. Для них общими проявлениями будут быстрая потеря сознания, снижение АД. Отличают вышеназванное состояние от анафилактического шока:
— незначительность снижения АД;
отсутствие нарушения дыхания, одышки, гиперсекреции слизи в дыхательных путях и их отека;
минимальность или отсутствие болей в животе, тошноты, рвоты, кожных проявлений аллергии;
наличие характерной резко повышенной потливости;
появление возбуждения, чувства голода, тремора, которые обычно предшествуют потере сознания;
коматозное состояние с клоническими и тоническими судорогами, быстро проходящее после введения глюкозы;
выраженная гипогликемия, в то время как при анафилаксии возникает транзиторная гипергликемия.
Перфоративная язва желудка, как и анафилактический шок, начинается остро, с появления боли в верхней половине живота, внезапной слабости, бледности, тахикардии и снижения АД. В отличие от анафилактического шока при этом:
есть язвенный анамнез, отсутствует связь с введением лекарств;
начинается с острой, кинжальной боли в надчревье, лишь позднее и менее значительно снижается АД;
быстро развиваются симптомы перитонита и доминируют над
анафилактический шок
415
нарушениями гемодинамики при отсутствии полиорганности поражений; —отсутствуют респираторно-легочный, церебральный и карди-альный синдромы;
не возникают кожный зуд, уртикарная сыпь, отеки, ринорея, чиханье, слезотечение;
нарастают нейтрофильный лейкоцитоз и лимфопения с первых часов болезни пропорционально ее тяжести;
при рентгенологическом исследовании выявляется свободный газ в брюшной полости.
При внематочной беременности, как и при анафилактическом шоке, возможно развитие коллаптоидного состояния с резким падением АД, тахикардией, глухостью сердечных тонов, бледностью кожи и акроцианозом на фоне резкой, схваткообразной боли внизу живота и кровянистых выделений из влагалища. Но ее от анафилактического шока отличают:
отсутствие связи болезни с введением лекарства;
нет продромальных явлений в виде зуда кожи, слезотечения, заложенности носа и чиханья, чувства удушья, комка в горле, уртикарной сыпи, бронхо- и (или) ларингоспазма;
не характерен кардиальный и церебральный синдромы;
наличие нейтрофильного лейкоцитоза, лимфопении с первых часов болезни с последующим их нарастанием;
положительный результат тестов на беременность;
— имеются характерные данные ультразвукового исследования. Анафилактический шок имеет некоторое сходство с карциноид-
ным синдромом, при котором наблюдаются также снижение АД, тахикардия, боль в животе. При этом в отличие от анафилактического шока:
— отсутствует связь с введением лекарств;
преобладают симптомы сосудистого коллапса над полиорганными нарушениями;
увеличивается СОЭ, выражена анемия;
повышается в крови уровень серотонина и в моче 5-гидрокси-индолуксусной кислоты.
Иногда патологическая реакция на лекарства, нередко со сходными с анафилактическим шоком симптомами, может быть обусловлена и неиммунологическими, часто генетически обусловленными причинами. Ацетилсалициловая кислота и другие нестероидные противовоспалительные препараты, являясь ингибиторами синтеза некоторых простагландинов, у больных с бронхиальной астмой и по-липозом носовых ходов чаще вызывают не анафилактический шок, а клинически сходную с ним тяжелую реакцию непереносимости неиммунологического типа, связанную с нарушением обмена про-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 416
дуктов арахидоновои кислоты. Подобную реакцию может вызывать и пищевой краситель тартразин, который используют для окраски оболочек некоторых пероральных лекарств. В этих ситуациях клиническое размежевание сложно, поэтому в подобных случаях необходимо немедленно начинать терапию, как при истинном анафилактическом шоке.
Принципы дифференциальной диагностики анафилактического шока с дегидратационным, инфекционно-токсическим шоком приведены в соответствующих разделах.
Лечение. Общие принципы лечения больных анафилактическим шоком:
лечебные и диагностические мероприятия должны проводиться немедленно, независимо от профиля лечебного учреждения;
недопустима транспортировка больных до выхода из шока, неотложные мероприятия следует оказывать на месте, однако затем, даже при легкой форме, больные должны наблюдаться в отделении реанимации;
все препараты должны вводиться парентерально или ингаляци-онно для особо оговоренных (сальбутамол);
следует соблюдать строгую очередность оказания неотложной помощи, при этом недопустимо слепое следование известным схемам лечения, оно должно быть индивидуальным — необходимо учитывать возраст больных, преморбидный фон, тяжесть состояния, характер ранее проводившегося лечения.
Очередность неотложных мероприятий и принципы интенсивной терапии определяются тяжестью шока.
Следует прекратить введение препарата, который мог вызвать шок, при этом доступ к вене должен быть сохранен, если препарат вводился внутривенно.
Необходимо максимально быстро оценить степень проходимости дыхательных путей, показатели внешнего дыхания и гемодинамики, Иногда по жизненным показаниям необходима трахеостомия и перевод больного на ИВЛ. При остановке дыхания и кровообращения (молниеносный анафилактический шок) немедленно приступают к сердечно-легочной реанимации.
Больного следует уложить горизонтально, приподнять нижние конечности, тепло укрыть, обложить грелками и постоянно давать кислород.
Если анафилактогенный препарат вводился внутримышечно или попал в организм в результате укуса насекомых, следует обколоть место инъекции или укуса (за исключением головы, шеи, кистей и стоп) 0,3—0,4 мл 0,1 % раствора адреналина гидрохлорида (эпи-нефрина) и приложить лед. В этом же случае выше места инъек-
анафилактический шок
417
ции или укуса накладывают жгут, ослабляя его на 1—2 мин каждые 10 мин.
Параллельно необходимо развести 0,1—0,3 мл 0,1 % раствора адреналина в 10 мл изотонического раствора натрия хлорида и вводить внутривенно 5—10 мин. При необходимости дополнительно ввести 0,1—0,3 мл 0,1 % раствора адреналина в 200—300 мл изотонического раствора натрия хлорида внутривенно капельно, иногда повторяя введения каждые 10—15 мин, но не более 3 раз, чтобы общая доза 0,1 % раствора адреналина не превысила 1 мл.
Если не удается быстро получить доступа к вене, следует немедленно ввести в плечо или бедро подкожно 0,2—0,5 мл 0,1 % раствора адреналина, при необходимости повторять такое введение каждые 15—20 мин под контролем АД, частоты пульса. В ситуациях, когда срочная венепункция не получается, нужно адреналин ввести эн-дотрахеально.
При отсутствии адреналина можно внутривенно ввести норадре-налин (норэпинефрин), растворив 4—8 мг препарата в 1000 мл 5 % раствора глюкозы или изотонического раствора натрия хлорида, максимальная скорость инфузии полученного раствора 2 мл/мин у взрослых.
При неэффективности терапии адреналином и норадреналином следует использовать дофамин (допамин), 200 мг которого растворяют в 500 мл 5% раствора глюкозы и вводят с начальной скоростью 1—2 мг/мин.
Растворы «запасных» адреномиметиков для вливания необходимо срочно готовить параллельно проводимому введению первоначального, чтобы в любой момент иметь возможность заменить его в случае неэффективности.
Одновременно с введением этих препаратов больному нужно дать увлаженный кислород 5—10 л/мин с помощью маски или носового катетера и поддерживать свободную проходимость дыхательных путей.
Следует помнить, что до выхода из шока транспортировка больных категорически противопоказана, необходимо не больного транспортировать к аппарату для ИВЛ, а аппарат — к больному.
При сохраняющейся артериальной гипотензии (контролировать АД каждые 3—5 мин) внутривенно струйно вводят 250 мл 5 % раствора альбумина или 300 мл нативной плазмы, а затем 1000 мл подогретых до температуры тела солевых растворов (раствор Рингера— Локка или «Ацесоль») и одновременно внутривенно вводят гидрокортизон из расчета 7—10 мг/кг (500—700 мг), а затем 5 мг/кг внутривенно, при необходимости — каждые 6 ч.
Можно назначать и другие кортикостероиды из расчета на пред-
27 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
418
низолон до 5—10 мг/кг, продолжительность лечения при этом не должна превышать 2—3 сут.
При развитии отека легких, мозга проводят мероприятия, изложенные в соответствующих разделах руководства. Препаратом выбора является дексаметазон в дозе 0,5—1 мг/кг в сутки внутривенно. При судорожном синдроме, сопровождающемся сильным возбуждением, возможно введение внутривенно 2,5—5 мг (1—2 мл) дропе-ридола.
Характер первоначально вводимых растворов зависит от тяжести шока. При тяжелом и молниеносном анафилактическом шоке для наиболее быстрого увеличения ОЦК внутривенно струйно сначала вводят 200—400 мл нативной плазмы или 250 мл 5 % раствора сывороточного альбумина, а затем глюкозо-солевые растворы в количестве до 3000 мл/м2 в сутки. Инфузия их должна осуществляться через катетер с максимальным диаметром. Скорость введения должна быть достаточной для поддержания систолического АД не ниже 100 мм рт. ст.
При сохраняющемся бронхоспазме (но при уменьшении тахикардии и артериальной гипотензии) внутривенно вводят 10 мл 2,4 % раствора эуфиллина, хотя в последнее время отдают предпочтение введению Р2-адреностимуляторов (гексапреналин) внутривенно и (или) ингаляционно (сальбутамол). Эуфиллин (аминофиллин) вводят внутривенно из расчета 4—6 мг/кг в течение 15—20 мин, обычно 10 мл 2,4 % раствора эуфиллина на 10 мл изотонического раствора натрия хлорида. Далее, в зависимости от тяжести бронхоспазма и обструкции верхних дыхательных путей, эуфиллин вводят со скоростью 0,2—1,2 мг/кг в час или 4—5 мг/кг в течение 20—30 мин каждые 6 ч.
Антигистаминные препараты вводят также внутривенно. При сохраняющейся артериальной гипотензии лучше использовать суп-растин (1 мл 2% раствора) или тавегил (2 мл).
При проведении неотложных мероприятий по выведению из анафилактического шока необходимо учитывать многообразие его клинических вариантов, преморбидный фон, из-за которых возможна замена одних препаратов другими, коррекция доз в зависимости or индивидуальной чувствительности. Однако общие принципы и последовательность оказания неотложной помощи при анафилактическом шоке должны быть соблюдены.
Лечение после купирования основных проявлений шока зависит от его тяжести. При тяжелой форме продолжают внутривенное введение жидкости, кортикостероидов, бронхолитиков, антигиста-минных препаратов в течении 1—3 сут (в зависимости от состояния больного). Необходима профилактика (или лечение) ОПН (см. соответствующий раздел) и других ранних осложнений.
При анафилактическом шоке средней тяжести лечение при-
анафилактический шок
419
нципиально не отличается от вышеприведенной терапии тяжелой формы, лишь обычно не требуются реанимационные мероприятия (трахеостомия, интубация, ИВЛ), доза кортикостероидов меньше (до 5 мг/кг преднизолона в сутки), количество внутривенно вводимых растворов тоже обычно меньше (до 2000 мл в сугки), реже приходится повторно вводить адреналин и тем более заменять его дофамином. Больные должны находиться в отделении реанимации не менее 3 сут.
При легкой форме шока лечение отличается от терапии молниеносной и тяжелой форм часто возможностью эффективно справиться с развившимся патологическим состоянием подкожным введением адреналина, внутримышечным — кортикостероидов с меньшей их дозой (2,5 мг/кг в сутки по преднизолону), таким же введением антигистаминных препаратов, применением бронхолитиков в ингаляциях. И все же после устранения основных симптомов шока больные должны быть госпитализированы в отделения интенсивной терапии или реанимации минимум на сутки из-за возможности рецидива, иногда и более тяжелого.
Профилактика. Мероприятия по профилактике анафилактического шока аналогичны соответствующим действиям по предупреждению аллергических реакций немедленного типа. Основные принципы этого следующие:
необходим тщательный сбор аллергологического анамнеза перед назначением любого лечебного или диагностического препарата, особенно внутривенно, так как выявление аллергоген-ного препарата может быть основано исключительно на тщательно собранном анамнезе;
все случаи аллергии на препараты следует строго документировать, доступ к такой документации должен быть максимально быстрым (случаи тяжелых аллергических реакций заносят в специальный паспорт, постоянно находящийся с пациентом);
при наличии аллергических реакций в анамнезе на препарат его назначают лишь по жизненным показаниям и при невозможности заменить другим, при этом проводят кожное тестирование или определяют специфические IgE (например, к пенициллину) в сыворотке крови для окончательного решения вопроса о возможности назначения препарата;
степень риска развития серьезных побочных явлений после введения сывороток и иммуноглобулинов животного происхождения не должна превышать степень возможного положительного эффекта; поэтому при инфекциях (лептоспироз, сибирская язва), где этот эффект достоверно не доказан, от введения подобных препаратов следует воздержаться;
до постановки кожных проб на чувствительность к гетероген-
27*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
420
ному белку, предшествующих введению сывороток или иммуноглобулинов, следует оценить степень риска развития шока на эти пробы, поэтому должен быть тщательно собран аллер-гологический анамнез; постановку проб необходимо проводить только в стационаре в присутствии врача и при наличии средств для оказания неотложной помощи.
при наличии положительных кожных проб и невозможности отказаться от введения препарата или заменить его другим он должен вводиться в отделении реанимации или интенсивной терапии после предварительной гипосенсибилизации и введения кортикостероидов, антигистаминных препаратов, при наличии внутривенного катетера, аппарата для ИВЛ и т.д., по жизненным показаниям — даже под наркозом;
перед введением некоторых высокоаллергогенных препаратов (рентгенконтрастные вещества, протамина сульфат) по жизненным показаниям при наличии аллергии на них в анамнезе или у сенсибилизированных больных необходима превентивная лекарственная терапия глюкокортикостероидами и анти-гистаминными средствами;
не следует вообще увлекаться одновременным назначением большого числа лекарств, внутривенное или внутримышечное их введение должно осуществляться только по строгим показаниям, особенно у больных с лекарственной аллергией в анамнезе;
недопустимо назначение препаратов, имеющих сходную химическую структуру с ранее вызвавшими шок (цефалоспорины после шока на пенициллин) или которые могут дать перекрестную реакцию (сульфаниламиды после шока на новокаин).
Лица, страдающие аллергическими заболеваниями, должны оставаться не менее одного часа в медицинском учреждении после парентерального введения лечебного или диагностического препарата, особенно после введения сывороток, иммуноглобулинов, вакцин, антибиотиков, рентгенконтрастных препаратов; нельзя транспортировать таких больных в другой стационар немедленно после введения.
Больные, перенесшие анафилактический шок, обязаны иметь при себе специальную карточку с указанием препарата, его вызвавшего, времени и тяжести развития шока, других препаратов, на которые отмечались аллергические реакции (во многих странах мира таким больным выдают специальные наборы для оказания неотложной помощи); таким пациентам все препараты должны назначаться лишь по строгим показаниям, при возможности — внутрь, а не парентерально.
Больных, у которых была точно установлена причина анафилак-
АНАФИЛАКТИЧЕСКИЙ ШОК
421
тического шока (например, укус насекомого, пищевой продукт или лекарство), следует обучить обращению с «агентами риска», мерам предосторожности. Пациентов с лекарственной аллергией следует информировать обо всех препаратах, которые могут давать перекрестные аллергические реакции. Лиц, принимающих |3-адренобло-каторы или ингибиторы ангиотензинпревращающего фермента, необходимо информировать о повышенном риске развития у них анафилактического шока, на различные агенты.
В некоторых странах медики в общеобразовательных школах проводят специальные занятия с учителями и обслуживающим персоналом по предупреждению и лечению анафилактического шока, а школьникам из групп риска выдают специальные памятки для личного пользования.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
422
Острая дыхательная недостаточность
(общие положения)
Острая дыхательная недостаточность (ОДН) — синдром, при котором максимальное напряжение всех компенсаторных систем организма неспособно обеспечить его адекватное насыщение кислородом и выведение углекислого газа (А.П.Зильбер, 1984).
Лат. — acute resp/ratorium inssuficienta.
Англ. —acute respiratory failor.
ОДН является компонентом любого критического состояния, даже если первичного поражения легких не было. Проблема ОДН актуальна не только в пульмонологической и неврологической клиниках, но и в клинике инфекционных болезней.
Из всех критических состояний, наблюдающихся при инфекционных болезнях, ОДН встречается наиболее часто — она возникает при ОРЗ бактериальной и вирусной природы (грипп, парагрипп, аденовирусная, респираторно-синцитиальная инфекции), дифтерии, детских капельных инфекциях; при заболеваниях, сопровождающихся поражением нервной системы, при ботулизме, полиомиелите, столбняке, бешенстве. Частой причиной ОДН является респираторный дистресс-синдром взрослых, возникающий при сепсисе, тяжелом течении гриппа, ветряной оспы и пневмоний.
Последние десятилетия ознаменовались выходом в свет фундаментальных работ J. Comroe, М.К. Sykes, M.W. McNicol, E.J.M. Campbell (1974), H.H. Карнаева и Л.Л. Шика, S.A. Sarin (1980), Г.А.Рябова (1988), А.П. Зильбера (1995) и других, которые значительно обогатили наши представления о физиологии дыхания, этиологии и патогенезе дыхательной недостаточности, методах диагностики и лечения этого синдрома. Лечение больных с ОДН продолжает оставаться актуальной клинической проблемой. Несмотря на некоторые научные и клинические успехи в этой области, летальность при ОДН, независимо от вызвавшей ее причины, остается высокой.
Дыхательная система тесно связана с другими системами организма: нервной, сердечно-сосудистой, эндокринной и т.д. Поэтому ОДН может быть обусловлена не только патологическими изменениями в органах дыхания, но и нарушениями в других органах (например, нарушение регуляции дыхания при бульбарных расстрой-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
423
ствах, циркуляторная недостаточность вследствие недостаточности кровообращения и др.).
С учетом этого выделяют легочные и внелегочные причины ОДН.
Основные легочные факторы, способствующие развитию ОДН:
обструкция дыхательных путей (обструктивная ОДН);
поражение бронхов и легких [бронхолегочная ОДН);
нарушение вентиляции из-за плохой растяжимости легких (рестриктивная ОДН);
нарушение процессов диффузии {альвеолярно-капиллярная, блок-диффузионная ОДН);
нарушения легочного кровообращения. Внелегочные факторы:
поражение ЦНС (центрогенная ОДН);
поражения нервно-мышечного аппарата (нервно-мышечная ОДН);
поражения грудной клетки и диафрагмы (торакодиафрагмаль-наяОДН);
другие экстралегочные причины (левожелудочковая недостаточность, сепсис, дисбаланс электролитов, дефицит энергии, избыток жидкости, уремия и др.).
На рис. 27 представлены основные типы ОДН, причины ее возникновения и возможная взаимосвязь этих причин.
Классификация. По течению различают острую и хроническую дыхательную недостаточность. ОДН — декомпенсированое состояние, при котором быстро прогрессируют гиноксемия или дыхательный ацидоз, снижается рН крови.
М.Н. Аничков (1975) ОДН разделяет на первичную и вторичную. Первичная связана с нарушениями механизмов доставки кислорода из внешней среды в альвеолы легких. Чаще всего она возникает при некупированном болевом синдроме, нарушении проходимости дыхательных путей, поражении легочной ткани и дыхательного центра, при эндо- и экзогенных отравлениях с нарушениями проведения нервно-мышечных импульсов. Вторичная ДН обусловлена нарушением транспорта кислорода от альвеол к тканям организма. Причинами ее возникновения могут быть нарушения центральной гемодинамики, микроциркуляции, кардиогенный отек легких, тромбоэмболия легочной артерии и т.д.
В зависимости от выраженности и наличия гипоксии, гипоксе-мии, гипо- или гиперкапнии ДН подразделяют на гипоксемическую, гипо- и гиперкапническую. Клиническая картина при этом определяется их выраженностью, которая зависит от степени расстройств вентиляции, альвеолярно-капиллярной диффузии, нарушения метаболизма, влияния на функции жизненно важных органов и систем.
424-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ

 Поражение
органов дыхания
Поражение
органов дыхания
Поражение сердца
ОДН
Поражение
костно-мышечного
аппарата грудной
клетки
Поражение центров нервной
регуляции
Другие причины
Острый стеноз гортани (инородные тела, воспалительный процесс)
У у
Острая Травма,
левожелудоч- паралич ковая недо- мышц
статочность (инфаркт миокарда, гипертоническая болезнь)
Воспаление, кровоизлияние, действие токсинов и лекарств, отек мозга
Нарушение микроциркуляции, токсическое действие на окислительно-восстановительные процессы в тканях
Нарушение вентиляци-
онно-перфузионного
соотношения
(отек легких)
Уменьшение
функционального
объема легких
(пневмония,
пневмоторакс,
гемоторакс)
ОБСТРУК-ТИВНЫЙ ТИП ОДН
РЕСТРИК-ТИВНЫЙ ТИП ОДН
ДИФФУЗИОННЫЙ ТИП ОДН
НЕРВНО-ПАРАЛИТИЧЕСКИЙ ТИП ОДН
Рис. 27
Легочные и внелегочные причины, приводящие к развитию ОДН
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
425
По выраженности нарушений газообмена, отражающих в какой-то мере стадию развития ДН, выделяют:
латентную ДН, когда повышенная работа дыхания еще способна обеспечивать нормальный газовый состав крови;
парциальную ДН, характеризующуюся гипоксемией, т.е. снижением Ра02 до 80 мм рт. ст. и ниже и концентрации оксиге-моглобина до 95 % и ниже;
глобальную ДН, при которой, кроме гипоксемии, отмечается и гиперкапния — РаС02 увеличивается до 45 мм рт. ст. и выше.
Существуют различные критерии разделения ОДН по степени тяжести. Один из подходов к градации степеней тяжести предполагает выделение умеренной, выраженной и запредельной ОДН при значениях Ра02 соответственно 79—65; 64—55; 54—45 мм рт. ст. и Ра02 соответственно 46—55; 56—69; 70—85 мм рт. ст., а также респираторной комы, развивающейся обычно при Ра02ниже 45 мм рт. ст. и РаС02выше 85 мм рт. ст. (табл. 22).
Таблица 22. Зависимость степени ОДН от парциального давления С02 и 02 в артериальной крови (по Ю.Н. Шанину и др., 1980)
Состояние |
РаС02, мм рт. ст. |
Ра02, мм рт. ст. |
Норма |
36—44 |
80—96 |
Умеренная ОДН |
46—55 |
79—65 |
Выраженная ОДН |
56—65 |
64—55 |
Запредельная ОДН |
70—85 |
54—45 |
Гиперкапническая кома |
90—130 |
44—35 |
Поскольку выполнение лабораторных исследований, позволяющих определить содержание в крови кислорода и диоксида углерода (углекислого газа), требует времени и к тому же пока не всегда доступно лечебным учреждениям, о тяжести развившейся ОДН можно судить по клиническим проявлениям (табл. 23).
Как видно из приведенных в табл. 22 и 23 данных, 4 степени ОДН могут иметь разные названия, отражая одну и ту же стадию болезни. Это должен учитывать врач при изучении медицинской литературы.
Физиология и патофизиология дыхания. Основная функция легких — обмен кислорода и диоксида углерода между внешней средой и организмом — достигается сочетанием вентиляции, легочного кровообращения и диффузии газов.
К показателям легочной вентиляции относятся дыхательный объем (ДО), частота дыханий (ЧД) и минутный объем дыхания (МОД).
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
426
Таблица 23. Клинико-лабораторные показатели ОДН в зависимости от степени тяжести
Клинические признаки |
I степень ОДН (компенсированная) |
II степень ОДН (субкомпенсиро- ванная) |
III степень ОДН (декомпенсиро- ванная) |
IV степень ОДН (асфиксия) |
Сознание |
Сохранено |
Сохранено, но больной возбужден |
Затуманено |
Отсутствует, судороги |
Частота ды- |
16—20 |
24—36 |
Больше 40 |
Дыхание |
ханий |
Одышка |
|
|
Чейна— |
за 1 мин |
усиливается при нагрузке |
|
|
Стокса |
Участие |
Раздувание |
Активное |
Резко |
Резко выра- |
вспомога- |
крыльев |
участие |
выражено |
жено либо |
тельных ды- |
носа |
|
|
возможно |
хательных |
|
|
|
полное рас- |
мышц |
|
|
|
слабление |
Цвет кожи |
Незначи- |
Выражен |
Разлитой |
Мраморность |
|
тельный цианозносо-губного треугольника |
цианоз носо-губного треугольника |
цианоз |
кожи |
Цианоз ко- |
Отсутствует |
Слабо |
Выражен |
Значительно |
нечностей |
|
выражен |
|
выражен |
Показатели |
Стабильные |
АД в норме |
АД до 80— |
АД до 40- |
АД (систо- |
|
или повыше- |
90 мм рт. ст., |
50 мм рт. ст. и |
лическое) |
|
но, пульс до |
пульс до 120 |
ниже, пульс |
и пульса |
|
100 |
|
нитевидный |
(в 1 мин) |
|
|
|
|
Диурез |
Не изменен |
Несколько снижен |
Олигурия |
Олигоанурия |
РаС02, мм |
36—45 |
46—55 |
56—69 |
70—85 |
рт. ст. |
|
|
|
|
Ра02, мм |
80—96 |
79—65 |
66—55 |
54—45 |
рт. ст. |
|
|
|
. |
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 427
Эффективность легочной вентиляции определяется величиной альвеолярной вентиляции, т.е. разностью между МОД и минутным объемом вентиляции мертвого пространства.
Снижение альвеолярной вентиляции может быть следствием уменьшения МОД или увеличения объема мертвого пространства. Определяющим фактором является ДО, его отношение к непостоянной величине физиологического мертвого пространства. Последнее включает анатомическое мертвое пространство и объем вдыхаемого воздуха, вентилирующего альвеолы, в которых кровоток отсутствует или значительно уменьшен. Таким образом, альвеолярную вентиляцию следует рассматривать как вентиляцию перфузируемых кровью альвеол.
Диффузионная способность легких— скорость, с которой газ проходит через альвеолярно-капиллярную мембрану на единицу градиента парциального давления газа. На диффузионную способность легких могут влиять такие факторы: поверхность диффузии (поверхность функционирующих альвеол, соприкасающихся с функциональными капиллярами), составляющая в норме около 90 м2; расстояние диффузии, зависящее от толщины слоев, через которые диффундирует газ; функциональное состояние последних (отек, фиброз) и характеристика тканей на пути диффузии. В норме толщина легочной мембраны составляет 0,5 мкм, а поскольку средний диаметр эритроцита равен среднему диаметру легочных капилляров (7 мкм), то при прохождении по капиллярам эритроциты плотно прилегают к мембране и путь диффузии в самом эритроците длиннее пути через мембрану. Обычно поглощение кислорода зависит от легочного кровотока, но в некоторых случаях диффузионная способность легких становится определяющей (отек легких).
У здорового человека, дышащего воздухом, парциальное давление кислорода в альвеолярном газе (РА02) и в артериальной крови (Ра02) отличаются примерно на 10 мм рт. ст. Однако при ОДН аль-веолярно-артериальная разность (РА02 —Ра02) может значительно превышать указанную величину. Основным фактором, влияющим на (А—а) Р02, является веноартериальное шунтирование в легких. Нарушение диффузии и изменения РаС02 также воздействуют на этот показатель.
Ритм и глубина дыхания регулируются дыхательным центром, расположенным в продолговатом мозге и получающим импульсы от моста мозга, блуждающего и языко-глоточного нервов. Наибольшее значение в регуляции дыхания имеет газовый состав артериальной крови. Хеморецепторы продолговатого мозга особенно чувствительны к изменениям РаС02 — даже при небольшом (5 мм рт. ст.) его повышении легочная вентиляция возрастает в 3 раза.
Колебания Ра02 также вызывают изменения дыхания, но с помо-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
428
щью импульсов, идущих к продолговатому мозгу от каротидных и аортальных телец. Первые расположены в начальной части артериальной системы головного мозга, вторые — в начальной части всей артериальной системы. Падение Ра02 ниже 70 мм рт. ст. приводит к увеличению VE и умеренной гипокапнии, что поддерживает Ра02на уровне, близком к физиологическому. При значительном снижении Ра02 дыхательный центр становится менее чувствительным к диоксиду углерода и основную роль в поддержании гипервентиляции играет гипоксическая стимуляция дыхания. Дыхательный центр при этом приспосабливается к более низкому уровню РаС02, это же, по-видимому, происходит при длительной гипервентиляции, обусловленной гипоксией.
Хеморецепторы продолговатого мозга, каротидных и аортальных телец чувствительны и к изменениям концентрации Н+ спинномозговой жидкости и крови. Возможно, что дыхание регулируется клеточными Н + , поскольку при острых его нарушениях концентрация Н+ в клетках снижается или повышается параллельно изменениям РаС02.
Произвольный контроль дыхания осуществляется через кортико-медуллярный путь. Дыхательные пути являются важной рефлексогенной зоной для реализации таких защитных реакций, как чиханье и кашель. Механорецепторы в легких через систему блуждающего нерва обеспечивают обратную связь между легкими и дыхательным цетром (М.И. Навратили др., 1967).
В большинстве случаев в основе ДН лежит гиповентиляция альвеол легких, приводящая к снижению Р02 и повышению РС02 в альвеолярном воздухе, снижению градиента давления этих газов на альвеолярно-капиллярной мембране и, следовательно, газообмена между альвеолярным воздухом и кровью легочных капилляров. Это происходит в тех случаях, когда альвеолярная вентиляция (скорость обновления состава воздуха в альвеолах) снижается из-за патологического уменьшения ДО и МОД либо вследствие патологического увеличения функционального мертвого пространства (ФМП) — вентилируемого пространства, в котором не происходит газообмен. Избыточное повышение МОД или уменьшение ФМП, напротив, приводят к гипервентиляции альвеол, проявляющейся альвеолярной гипокапнией, при этом существенного прироста содержания кислорода в крови не отмечается, т.к. кровь практически полностью насыщена им и при нормальном уровне вентиляции.
Некоторые патологические состояния, сопровождающиеся гипервентиляцией, могут приводить к вымыванию диоксида углерода из организма и развитию гипокапнии, влияющей на активность дыхательного центра, что усугубляет тяжесть состояния пациента Гипокапния вызывает спазм мозговых сосудов и снижение внутри-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
429
черепного давления. При тяжелой и длительной гипокапнии может произойти ишемическое повреждение мозга.
Отношение вентиляция/кровоток. Эффективность легочного газообмена в значительной степени зависит от распределения вдыхаемого воздуха по альвеолам в соответствии с их перфузией кровью. Альвеолярная вентиляция у человека в покое составляет примерно 4 л/мин, а легочный кровоток — 5 л/мин. В идеальных условиях в единицу времени альвеолы получают 4 объема воздуха и 5 объемов крови; таким образом, отношение вентиляция/кровоток равно 4/5, или 0,8.
Нарушения отношения вентиляция/кровоток — преобладание вентиляции над кровотоком или кровотока над вентиляцией — ведут к нарушениям газообмена. Наиболее значительные изменения газообмена возникают при абсолютном преобладании вентиляции над кровотоком (эффект мертвого пространства) или кровотока над вентиляцией (эффект веноартериального шунта). В нормальных условиях легочный шунт не превышает 7 %. Этим объясняется тот факт, что в норме насыщение артериальной крови кислородом меньше 100 % — оно равно 97,1 %.
Примером эффекта мертвого пространства может быть эмболия легочной артерии. Шунтирование крови в легких возникает при тяжелых поражениях легочной паренхимы, респираторном дистрес-синдроме, массивной пневмонии, ателектазах и обтурации дыхательных путей любого генеза. Оба эффекта приводят к артериальной гипоксемии, устранить которую часто невозможно даже при применении высоких концентраций кислорода.
Значение кривой диссоциации оксигемоглобина (HbOj. Кислород в крови присутствует в двух формах — физически растворенный и химически связанный (SO ) с гемоглобином. Зависимость между Р02 и S02графически выражают в виде кривой диссоциации оксигемоглобина (КДО), имеющей S-образную форму. Такая форма КДО соответствует оптимальным условиям насыщения крови кислородом в легких и освобождения кислорода из крови в тканях. При Р02, равном 100 мм рт. ст., в 100 мл крови растворено всего 0,3 мл кислорода. В альвеолах Р02 составляет около 100 мм рт. ст. Основная часть кислорода переносится в связанном с гемоглобином состоянии. Для полного насыщения 1г гемоглобина связывает 1,34 мл кислорода. Если концентрация гемоглобина в крови 150 г/л, то содержание S02 составляет, 150 г/лх 1,34 мл/г = 201 мл/л. Эта величина называется кислородной емкостью крови. Поскольку содержание кислорода в смешанной венозной крови (Cv02) 150 мл/л, то 1 л крови, проходящей через легкие, должен присоединить 50 мл кислорода для превращения ее в артериальную. Соответственно 1 л крови, проходящей через ткани организма, оставляет в них 50 мл кислорода. Только
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
430
около 3 мл кислорода на 1 л крови переносится в растворенном состоянии.
Смещение КДО является важнейшим физиологическим механизмом, обеспечивающим транспорт кислорода в организме. Циркуляция крови от легких к тканям и от тканей к легким обусловлена изменениями, которые воздействуют на сродство кислорода к гемоглобину. На уровне тканей из-за снижения рН это сродство уменьшается (эффект Бора), благодаря чему улучшается отдача. В крови легочных капилляров сродство гемоглобина к кислороду увеличивается из-за снижения РаС02и возрастания рН по сравнению с аналогичными показателями венозной крови, что приводит к повышению насыщения артериальной крови кислородом.
В нормальных условиях 50% S02 достигается при Р02 около 27 мм рт. ст. Эта величина обозначается Р50 (например, до 30— 32 мм рт. ст.), что соответствует смещению КДО вправо и свидетельствует о снижении взаимодействия гемоглобина и кислорода. Благодаря S-образной форме КДО при довольно значительном снижении фракционной концентрации кислорода во вдыхаемом воздухе (до 0,15 вместо 0,21) перенос кислорода существенно не нарушается. При снижении РаО,2до 60 мм рт. ст. Sa02 снижается примерно до 90 % уровня, но цианоз при этом не развивается. Однако дальнейшее падение Ра02 сопровождается более быстрым падением Sa02 и содержания кислорода в артериальной крови. При падении Ра02 до 40 мм рт. ст. Sa02 снижается до 70%, что соответствует Р02и S02B смешанной венозной крови.
Описанные механизмы не являются единственными. Внутриклеточный органический фосфат — 2,3-дифосфоглицерат (2,3-ДФГ) — входит в молекулу гемоглобина, изменяя ее сродство к кислороду. Повышение уровня 2,3-ДФГ в эритроцитах уменьшает сродство гемоглобина к кислороду, а снижение его концентрации — увеличивает. Некоторые синдромы сопровождаются выраженными изменениями уровня 2,3-ДФГ. Например, при хронической гипоксии содержание 2,3-ДФГ в эритроцитах возрастает и соответственно уменьшается сродство гемоглобина к кислороду, что дает преимущество в снабжении тканей последним. Массивные трансфузии консервированной крови могут ухудшить высвобождение кислорода в тканях.
Таким образом, к факторам, приводящим к возрастанию сродства гемоглобина к кислороду и смещению КДО влево, относятся увеличение рН, уменьшение РаС02концентрации 2,3-ДФГ и неорганического фосфата, снижение температуры тела. И, наоборот, уменьшение рН, увеличение РаС02, концентрации 2,3-ДФГ и неорганического фосфата, повышение температуры тела приводят к уменьшению сродства гемоглобина к кислороду и смещению КДО вправо.
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
431
Важнейшие показатели дыхания, характеризующие их нормальный уровень, представлены в табл. 24.
Таблица 24. Нормальные величины функциональных проб легких (J. Comroe и соавт., 1961, с сокр.)
Показатель |
Обозначение |
Величина |
Жизненная емкость (ЖЕЛ) |
VC |
4800 мл |
Остаточный объем (ОО) |
RV |
1200 мл |
Функциональная остаточная емкость |
FRC |
2400 мл |
(ФОЕ) |
|
|
Общая емкость легких (ОЕЛ) |
TLC |
6000 мл |
Дыхательный объем (ДО) |
VT |
500 мл |
Частота дыхания (ЧД) |
I |
12 мин"' |
Минутный объем дыхания (МОД) |
vE |
бОООмлхмин-1 |
Мертвое пространство (МП) |
VD |
150 мл |
Альвеолярная вентиляция (АВ) |
VA |
4200 млхмин _1 |
Отношение вентиляция/кровоток |
VA/Q |
0,8 |
Физиологический шунт/МОС |
Qs/QT |
Менее 7% |
Парциальное давление кислорода в альве- |
PA02 |
104 мм рт. ст. |
олярном газе |
|
|
Парциальное давление диоксида углерода |
PAC02 |
40 мм рт. ст. |
в альвеолярном газе |
|
|
Парциальное давление кислорода в арте- |
Pa02 |
95 мм рт. ст. |
риальной крови |
|
|
Насыщение артериальной крови кислоро- |
Sa02 |
97,1% |
дом |
|
|
Парциальное давление диоксида углерода |
PaC02 |
40 мм рт. ст. |
в артериальной крови |
|
|
Растяжимость легких |
CL |
0,2 лхсм вод. стг1 |
Растяжимость легких и грудной клетки |
CT |
0,1 лхсм вод. ст.-1 |
Диффузионная способность легких для |
DL02 |
20 млхмин-'мм |
кислорода |
|
рт. стГ1 |
Данные приведены для здорового человека (поверхность тела 1,7 м2) в покое в положении лежа при дыхании воздухом. Легочные объемы и показатели вентиляции даны по BTPS, диффузионная способность легких — по STPD.
Нарушение вентиляции альвеол, перфузии легочных капилляров и диффузии газов через альвеолярно-капиллярную мембрану являются ведущими механизмами ОДН.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
432
Адекватность вентиляции зависит от следующих факторов:
состояния центральной регуляции дыхания;
активности дыхательных мышц;
целости и подвижности грудной клетки;
проходимости дыхательных путей;
податливости (растяжимости) легочной ткани;
внутрилегочного распределения газа соответственно степени перфузии различных отделов легкого.
Три первых фактора вентиляции можно назвать внелегочными; если при их патологии и возникает поражение легких, то уже вторично. Остальные связаны с поражением самих легких. При адекватной альвеолярной вентиляции поддерживается определенная концентрация газов альвеолярного пространства, обеспечивающая нормальный газообмен с кровью легочных капилляров.
К нарушениям проходимости дыхательных путей (обструктив-ные расстройства), приводят различные причины:
обструкция дыхательных путей мокротой (обычно на фоне ухудшения реологических свойств мокроты, нарушения муко-цилиарного транспорта и поражения кашлевого механизма) и инородными телами;
спазм, отек и воспаление дыхательных путей на различных уровнях — от ротовой полости до бронхиол;
экспираторное закрытие дыхательных путей (ЭЗДП) — возникает при бронхоастматическом состоянии, обструктивной эмфиземе легких, неправильном режиме ИВЛ.
ОДН может быть обусловлена рестриктивными расстройствами, которые имеют также название «патология податливости». В ее основе лежат:
потеря эластичности волокон;
отек интерстициальной ткани легких при старении, перерождении и т.п.;
недостаток сурфактанта — поверхностно-активного вещества, выстилающего внутреннюю стенку альвеол и облегчающего растяжение альвеолы при ее минимальном объеме.
К неадекватной вентиляции легких может приводить также нарушение внутрилегочного распределения газов при уменьшении перфузии отдельных легочных зон (пневмонии, ателектаз легкого и т.д.).
Расстройства вентиляции обычно сочетаются с нарушениями вентиляционно-перфузионного соотношения, т.е. отношения объема вентиляции к объему кровотока в легких. При гипервентиляции этот коэффициент превышает 1, при ги по вентиляции он меньше 0,8. Нормальное соотношение интегральных величин (МОД и минутного объема кровотока в легких) не исключает выраженного вентиляци-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
433
онно-перфузионного несоответствия в отдельных группах альвеол вследствие неравномерности нарушений вентиляции и кровотока в разных зонах легких, что при бронхолегочной патологии, особенно при обструктивной ДН, отмечается практически во всех случаях. Кроме того, альвеолярная вентиляция, соответствующая произведению ЧД и разницы между ДО и ФМП, утрачивает пропорциональность с МОД при изменении каждой из этих величин. Так, если в норме при ФМП, равном 0,175 л, ДО, равном 0,4 л, и ЧД 16 в 1 мин, МОД, равный 6,4 л/мин, обеспечивает обмен воздуха в альвеолах со скоростью 1бх(0,4—0,175) = 3,6 л/мин, то при сохранении такой же величины МОД в случае уменьшения ДО в 2 раза (т.е. до 0,2 л) и учащении дыхания тоже в 2 раза (до 32 в 1 мин) альвеолярная вентиляция снижается, причем значительно — до32х(0,2—0,175) = 0,8 л/мин, т.е. в 4,5 раза, так как МОД расходуется в основном на вентиляцию ФМП.
Нарушение кровотока в легких как причина вентиляционно-пер-фузионного несоответствия и ведущий патогенетический фактор развития ДН наблюдается при респираторном дистресс-синдроме взрослых, тромбоэмболии легочных артерий, в острой фазе крупозной или массивной очаговой пневмонии, а также при ингаляции веществ (в т.ч. некоторых средств для ингаляционного наркоза), открывающих артериовенозные анастомозы в легких. При тромбоэмболии легочных артерий выключение кровотока в вентилируемых участках легких приводит (если МОД не возрастает) к увеличению ФМП со снижением вентиляции кровоснабжаемых альвеол, а при рефлекторном увеличении МОД нередко возникает гипокапния от гипервентиляции. Однако последняя не устраняет полностью гипок-семию, обусловленную уменьшением площади диффузии кислорода, из-за выключения кровотока. При крупозной пневмонии в фазе прилива кровоток в пораженной доле легкого значительно превышает вентиляцию альвеол, в которых снижена также диффузия кислорода. В результате кровь, проходящая через участок воспаления, не артериализуется и, оставаясь венозной, примешивается к крови, поступающей в артерии большого круга кровообращения. Таков же патогенез гипоксемии, обусловленной патологическим открытием артериовенозных анастомозов в легких.
Причины нарушения (ограничения) диффузии газов через альвео-лярно-капиллярную мембрану:
уменьшение поверхности диффузии (поверхность функционирующих альвеол, соприкасающаяся с функционирующими капиллярами, в норме составляет 90 м2);
расстояние диффузии (толщина слоев, через которые диффундирует газ) может быть увеличено в результате изменений тканей на пути диффузии (утолщение стенок альвеол и ка-
28 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 434
пилляров, их отек, коллапс альвеол, заполнение их жидкостью и т.д.).
Нервно-паралитические нарушения регуляции дыхания возникают при поражении нервно-мышечных синапсов, обеспечивающих сокращение дыхательных мышц, при этом наблюдается их паралич, что приводит к развитию ОДН. Ритм и глубина дыхания регулируются дыхательным центром. Как отмечалось, наибольшее значение в регуляции дыхания имеет газовый состав артериальной крови: повышение РаС02 немедленно вызывает увеличение объема вентиляции (хеморецепторы продолговатого мозга); колебания Ра02 также изменяют дыхание (с помощью импульсов, идущих к продолговатому мозгу от каротидных и аортальных телец). Хеморецепторы продолговатого мозга, каротидных и аортальных телец чувствительны и к изменениям концентрации Н+ спинномозговой жидкости и крови. Эти механизмы регуляции могут быть нарушены при поражениях ЦНС, введении щелочных растворов, ИВЛ в режиме гипервентиляции, увеличении порога возбудимости дыхательного центра.
Таким образом, каждый тип ОДН сопровождается изменением основных функциональных показателей. Их направленность представлена в табл. 25.
Таблица 25. Изменения нормальных функциональных проб легких в зависимости от вида ОДН
Показатель |
Обструктив- |
Рестриктив- |
Диффузион- |
Нейропара-литическая |
|
ная ОДН |
ная ОДН |
ная ОДН |
одн |
Жизненная емкость |
11 |
1 |
1 |
1 |
(ЖЕЛ) |
|
|
|
|
Остаточный объем |
— |
1 |
— |
— |
(ОО) |
|
|
|
|
Общая емкость легких |
11 |
1 |
1 |
1 |
(ОЕЛ) |
|
|
|
|
Дыхательный объем |
11 |
— |
1 |
1 |
(ДО) |
|
|
|
|
Частота дыхания (ЧД) |
тт |
т |
ТТ |
т |
Минутный объем ды- |
|
|
|
|
хания (МОД) |
|
|
|
|
Мертвое пространство |
1 |
— |
тт |
1 |
(МП) |
|
|
|
|
Альвеолярная вентиля- |
1 |
— |
— |
— |
ция (АВ) |
|
|
|
|
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 435
Продолжение табл. 25
Показатель |
Обструктив- |
Рестриктив- |
Диффузион- |
Нейропара-литическая |
|
ная ОДН |
ная ОДН |
ная ОДН |
одн |
Отношение вентиля- |
— |
1 |
44 |
— |
ция/кровоток |
|
|
|
|
Парциальное давление |
и |
4 |
Т |
4 |
кислорода в артериаль- |
|
|
|
|
ной крови (Ра02) |
|
|
|
|
Насыщение артериаль- |
1 |
4 |
4 |
4 |
ной крови кислородом |
|
|
|
|
(Sa02) |
|
|
|
|
Парциальное давле- |
t |
Т |
Т |
Т |
ние диоксида углерода |
|
|
|
|
в артериальной крови |
|
|
|
|
(РаС02) |
|
|
|
|
Растяжимость легких |
— |
1 |
4 |
— |
Растяжимость легких и |
— |
4 |
4 |
4 |
грудной клетки |
|
|
|
|
Диффузионная способ- |
— |
4 |
4 |
— |
ность легких для кис- |
|
|
|
|
лорода |
|
|
|
|
Диффузионная способ- |
— |
4 |
4 |
— |
ность легких для диок- |
|
|
|
|
сида углерода |
|
|
|
|
Достаточное обеспечение тканей кислородом зависит также от функционального состояния эритроцитов, являющихся основными его переносчиками.
Нарушения транспорта кислорода к тканям. Как указывалось ранее, в 100 мл артериальной крови содержится приблизительно 20 мл кислорода. Если минутный объем сердца (МОС) в норме в покое 5 л/мин, а потребление кислорода 250 мл/мин, то это значит, что ткани извлекают 50 мл кислорода из 1 л циркулирующей крови. При тяжелой физической нагрузке потребление кислорода достигает 2500 мл/мин, МОС возрастает до 20 л/мин, но и в этом случае остается неиспользованным кислородный резерв крови. Ткани берут примерно 125 мл кислорода из 1 л циркулирующей крови. Содержание кислорода в артериальной крови 200 мл/л достаточное для обеспечения потребностей тканей в кислороде.
Однако при апноэ, полной обструкции дыхательных путей, дыха-
28*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
436
нии аноксическои смесью кислородный резерв истощается очень быстро — уже через несколько минут нарушается сознание, а через 4—6 мин наступает гипоксическая остановка сердца.
Одним из основных проявлений ОДН является дефицит кислорода в организме, т.е. гипоксия. Она вызывает нарушение обменных процессов в клетках, дистрофические изменения в органах. Кроме того, при гипоксии изменяются окислительно-восстановительные процессы, снижается аэробный и увеличивается анаэробный гликолиз, что вызывает накопление в организме недоокисленных продуктов обмена (Н.П.Чернобровый и соавт., 1989). В настоящее время выделяют следующие 4 основные формы гипоксических состояний.
Гипоксическая гипоксия— обусловлена расстройствами дыхания центрального и периферического генеза, снижением Р02 во вдыхаемом воздухе, нарушением взаимодействия между вентиляцией легких и кровотоком в легочных сосудах. Ее основной причиной является снижение или полное прекращение поступления кислорода (гиповентиляция, апноэ). К этому же виду гипоксии приводят изменения химических свойств гемоглобина (карбоксигемоглобин, метгемоглобин).
Гемическая гипоксия— возникает при уменьшении содержания гемоглобина в крови ниже 100 г/л (анемическая форма) или при нарушении его способности переносить кислород. Уровни гемоглобина ниже 50 г/л, гематокрита (Ht) ниже 0,20 представляют большую угрозу для жизни больного даже в случае, если МОС не снижен. Главной отличительной чертой анемической гипоксии является снижение содержания кислорода в артериальной крови при нормальных Ра02и Sa02.
Циркуляторная гипоксия. Данный вид гипоксии связан с неспособностью сердца доставлять кислород к органам и тканям (застойная и ишемическая формы). При этом кислородные параметры артериальной крови не изменены, однако Pv02 значительно снижено.
Возможно сочетание трех форм гипоксии — гипоксической , цир-куляторной и анемической, если ОДН развивается на фоне сердечно-сосудистой недостаточности и острой кровопотери.
4. Тканевая (гистотоксическая) гипоксия — обусловлена неспо собностью клеток тканей утилизировать доставленный им кисло род (некоторые отравления, повреждение ферментов, авитаминозы ит.п.).
Первые 3 формы гипоксии вызывают и венозную гипоксию, являющуюся достоверным показателем снижения Р02 в тканях. Парциальное давление кислорода в смешанной венозной крови — важный показатель гипоксии. Уровень Pv02, равный 30 мм рт. ст., определен как критический.
Различают также состояние недостаточного содержания кислоро-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 437
да в крови — гипоксемию. Она является основным критерием дыхательной недостаточности. Выделяют легкую, умеренную и тяжелую степени гипоксемии:
при легкой степени цианоз отсутствует, насыщение гемоглобина кислородом — не менее 80 %, Ра02 — более 50 мм рт. ст.;
при умеренной гипоксемии отмечается цианоз, насыщение гемоглобина кислородом — 60—80 %, Ра02 — более 30—50 мм рт.ст.;
при тяжелой гипоксемии наблюдается выраженный цианоз, насыщение гемоглобина кислородом — менее 60 %, Ра02 — ниже 30 мм рт.ст.
ОДН часто сопровождается развитием гиперкапнии— избыточным накоплением диоксида углерода в крови и тканях. Диоксид углерода является естественным стимулятором дыхательного центра, но избыточное его накопление угнетает дыхательный центр. Гиперкапния приводит также к нарушению диссоциации гемоглобина, гиперкатехоламинемии, артериолоспазму и повышению ОПСС.
При инфекционных болезнях причины, приводящие к развитию ОДН, могут быть самыми разнообразными (табл. 26), возможна и комбинация различных неблагоприятных факторов.
Таблица 26. Причины развития ОДН при инфекционных болезнях
Вид патологии |
Характер поражения |
Нарушения трахеоброн-хиальной проходимости (обструктивная ОДН) Парез дыхательных мышц (нервно-паралитическая ОДН) Уменьшение активной дыхательной поверхности альвеол(рестриктив-ная ОДН) Утолщение альвеолярно-капиллярной мембраны (диффузионная ОДН) |
Острый стеноз гортани (дифтерия, ОРВИ) Стенозирующийларинготрахеобронхит (ОРВИ) Бронхоспазм (столбняк, бешенство лекарственная аллергия) Паралич дыхательных мышц (ботулизм, полиомиелит) Бульбарные расстройства (полиомиелит, энтеровирусная инфекция) Воспалительные процессы в легких с нарушением вентиляционно-перфузионного баланса (пневмония вирусно-бактериаль-ная),РДСВ Отек легких |
Патогенез ОДН подразделяют на вентиляционную и паренхиматозную (Ю.Н. Шанин, А.Л. Костюченко, 1995). К вентиляционной от-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
438
носят дыхательную недостаточность, развивающуюся в результате поражения дыхательного центра любой этиологии, нарушения передачи импульсов в нервно-мышечном аппарате, повреждения грудной клетки, легких и т.п. Она определяется недостаточной вентиляцией всех или большинства респиронов; в результате затрудняются как оксигенация крови, так и выведение диоксида углерода; это приводит к артериальной гиперкапнии и гипоксемии. Нарастание РаС02 происходит линейно по отношению к вентиляции и может определяться как в артериальной крови, так и во вдыхаемом воздухе. Паренхиматозная форма может быть обусловлена патологией дыхательных путей, нарушениями диффузии газов и кровотока в легких, местными изменениями в паренхиме легких и возникающим несоответствием между вентиляцией и кровотоком в сосудах респиронов.
Основой патогенеза обструктивной ДН является сужение просвета бронхов, причинами которого могут быть бронхоспазм, аллергический или воспалительный отек, а также инфильтрация слизистой оболочки бронхов, закупорка их мокротой, склероз бронхиальных стенок и деструкция их каркаса с утратой упругих свойств. В последнем случае наблюдается так называемый клапанный механизм обструкции — спадение стенок пораженного бронха во время ускоренного (форсированного) выдоха, когда статическое давление воздуха на стенки бронха падает и становится ниже внутриплев-рального. Сужение просвета бронхов вызывает возрастание сопротивления в них воздушному потоку и снижение скорости последнего пропорционально IV«степени уменьшения радиуса бронхов (т.е. при уменьшении радиуса, например, в 2 раза, скорость воздушного потока снижается в 16 раз). Поэтому дыхательный акт обеспечивается значительным дополнительным усилием дыхательных мышц, но при выраженной бронхиальной обструкции оно недостаточно для увеличения разницы между давлением в плевральной полости и атмосферным давлением, адекватной возросшему сопротивлению воздушному потоку. Этим определяются два важных признака обструкции — значительная амплитуда дыхательных колебаний внут-риплеврального давления и снижение объемной скорости воздушного потока в бронхах, особенно выраженное в фазе выдоха, когда патологическое уменьшение просвета бронхов дополняется естественным экспираторным их сужением; выдох при обструктивной ДН всегда затруднен.
Некоторое уменьшение прироста бронхиального сопротивления на выдохе достигается непроизвольным смещением дыхательной паузы в инспираторную фазу (за счет использования резерва вдоха) в результате более низкого расположения диафрагмы и инспи-раторного напряжения дыхательных мышц грудной клетки. В таком
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
439
случае выдох завершается и последующий вдох начинается при некотором инспираторном растяжении альвеол, т.е. при увеличении объема остаточного воздуха, которое вначале имеет функциональный характер, а по мере атрофии альвеолярных стенок (в том числе из-за сдавления капилляров высоким внутригрудным давлением на выдохе) становится необратимым вследствие развития эмфиземы легких. Увеличение объема остаточного воздуха и ФМП, уменьшение скорости воздушного потока в бронхах приводят к гиповентиля-ции альвеол со снижением Р02и повышением РС02в альвеолярном воздухе и в крови.
Расстройства газообмена усугубляются неравномерностью нарушений вентиляции, т.к. степень обструкции бронхов при частом сочетании различных ее причин у одного больного неодинакова в разных отделах легких. Этим объясняется известная трудность коррекции нарушений газообмена у больных с обструктивной ДН даже с помощью ИВЛ. Существенно усложняет патогенез обструктивной ДН повышение работы дыхания, особенно значительное на выдохе, длительность которого по отношению к длительности вдоха может составлять 3:1 и более (при норме 1,2:1). Это означает, что около 16 ч в сутки дыхательные мышцы совершают тяжелую работу по преодолению экспираторного сопротивления бронхов, на которую может расходоваться до 50 % и более всего поглощенного организмом кислорода. Столь же длительно высокое внутригрудное давление воздействует на стенки сосудов легких, сжимая капилляры и вены. Это механическое воздействие, а также спазм артериол в зонах их резкой гиповентиляции (так называемый рефлекс Эйлера—Лильестранда) обусловливают значительное возрастание сопротивления кровотоку и вторичную гипертензию малого крута кровообращения с развитием в дальнейшем легочного сердца. В клинике инфекционных болезней это происходит при нарушении трахеобронхиальной проходимости — сопротивление воздуху возникает на уровне верхних (синдром крупа, острый стеноз гортани или стенозирующий ларин-готрахеит, ларингоспазм) или нижних отделов дыхательных путей (острый бронхоспазм).
Механизмы вентиляционных нарушений зависят от вида ДН. В большинстве случаев центрогенной и при нервно-мышечной ДН ведущую роль играет снижение МОД за счет уменьшения ДО, уре-жения дыхания или его аритмии с появлением периодов апноэ (при дыхании Чейна—Стокса, биотовском). Исключение составляет редкий вариант ДН, развивающийся в связи с поверхностным дыханием при центрогенном тахипноэ (например, у больных истерией), когда из-за учащения дыхания до 60 и более в 1 мин МОД может возрастать, но альвеолярная вентиляция резко снижается, т.к. ДО уменьшается до величины, сопоставимой с объемом ФМП.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 440
Нервно-паралитические расстройства дыхания возникают в результате полного или частичного выключения (паралича, пареза) дыхательных мышц. Развиваются они при ботулизме и паралитической форме полиомиелита.
Ботулотоксин является классическим блокатором механизма нервно-мышечной передачи в мионевральных синапсах, что приводит к возникновению параличей (офтальмоплегия, фоноплегия, фарингеальныи паралич и др.). Прогностически наиболее грозным является парез дыхательных мышц. Поначалу нарушения дыхания возникают при физическом напряжении, а в дальнейшем они сохраняются и в покое. Компенсаторно резко возрастает работа дыхания, что сопровождается увеличением потребности в кислороде и приближает фазу декомпенсации с развитием прогрессирующей гипоксии. Особенности характеристики ОДН определяются развитием инспираторной одышки. Это удается оценить и при аускульптации легких на основании отчетливого удлинения фазы вдоха. Парез диафрагмы сопровождается преимущественно нарушением механизма вдоха, поскольку выдох в значительной степени является немышечным актом. Недостаточность вдоха вызывает резкое уменьшение величины дыхательных объемов. Компенсаторно возрастает ЧД до 40—50 в 1 мин. Это, в свою очередь, сопровождается дальнейшим уменьшением дыхательного объема, который при тяжелом течении ботулизма снижается в среднем в 2 раза (В.В. Никифоров и др., 1988) и начинает приближаться к объему мертвого пространства. Дыхание превращается в бесполезное, маятникоподобное движение воздуха в верхней части дыхательных путей, недостигающего альвеол и не участвующего в газообмене. Такое возрастание ЧД резко увеличивает энергозатраты, растет «кислородная цена» дыхания. Возрастающая потребность в кислороде существенно усугубляет развитие кислородного голодания. Возникает «порочный круг», определяющий прогрессирующий характер нервно-паралитической ОДН, развивающейся при ботулизме. Наряду с нарастанием одышки и цианоза возникает аритмия дыхания с появлением вторичных апноэ. В дальнейшем развивается гипоксическая кома с полной потерей сознания. Наступает состояние клинической смерти, из которого больных удается вывести, если срочно проводятся реанимационные мероприятия.
ОДН является основной причиной смерти и обусловлена она парезом дыхательных мышц. Положение усугубляется нарушением проходимости дыхательных путей, так как парез надгортанника и мягкого нёба способствует затеканию слюны в дыхательные пути, аспирации рвотных масс, а парез брюшных мышц не позволяет полностью использовать защитную роль кашлевого рефлекса.
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
441
При полиомиелите патогенетически различают 3 группы факторов, определяющих ОДН:
связанные с нарушением механизма дыхания;
расстройства, обусловленные механической закупоркой дыхательных путей;
вызванные нарушением диффузии газов через альвеолы в случае развития отека легких, пневмонии, ателектазов.
Снижение МОД или ограничение резервов его прироста в ответ на нагрузку является также патогенетической основой торакоди-афрагмальной ДН в тех случаях, когда она развивается вследствие ограничения подвижности грудной клетки (из-за боли, при болезни Бехтерева, фибротораксе) без существенных изменений объема грудной полости и емкости легких. В других случаях, когда торако-диафрагмальная ДН связана с патологическими образованиями в грудной полости, уменьшающими ее объем и общую емкость легких (например, плевральный выпот, асцит, высоко поднимающие диафрагму) , патогенез нарушений дыхания и газообмена включает те же механизмы, что и при рестриктивной форме бронхолегочной ДН.
Рестриктивная ДН обусловлена уменьшением легочной паренхимы (при фиброзах, после пульмонэктомии) и общей емкости легких (ОЕЛ), что приводит к снижению площади диффузии газов. Несмотря на уменьшение при этом ЖЕЛ, прежде всего резервов вдоха и выдоха, вентиляция функционирующих альвеол обычно не снижается, т.к. уменьшен и общий объем вентилируемого пространства. Поскольку диффузионная способность диоксида углерода примерно в 20 раз выше, чем кислорода, уменьшение площади диффузии ограничивает в основном поступление в кровь кислорода, приводя к гипоксемии, в то время как РС02в альвеолах часто определяется на нижней границе нормы, и при любом приросте вентиляции (например, во время физической нагрузки) легко развивается дыхательный алкалоз. Патологические процессы, вызывающие рес-триктивную ДН, приводят, как правило, к уменьшению растяжимости легких, поэтому акт вдоха требует большего, чем в норме, усилия работы дыхательных мышц, что обусловливает инспираторный характер одышки. Нарушение координации вентиляции и перфузии представляет основной механизм развития рестриктивной ОДН. В клинике инфекционных болезней респираторный дистресс-синдром взрослых описан при сепсисе, тяжелом течении гриппа, ветряной оспе, пневмониях.
Патогенез диффузионной ДН состоит в нарушении проницаемости альвеолярно-капиллярных мембран для газов, что наблюдается только при грубых морфологических изменениях стенок альвеол — их утолщении за счет отека, инфильтрации, наложений фибрина, склероза, гиалиноза. Патологические процессы, приводящие к та-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
442
ким изменениям, обычно сопровождаются также значительными нарушениями вентиляции и кровотока в легких, поэтому диффузионная ДН не бывает изолированной. Однако нарушения диффузии могут быть ведущими в патогенезе ДН при РДСВ, пневмониях, раковом лимфангите и фиброзах легких, обычно сочетаясь с рестриктив-ной ДН. Из-за выраженных различий в проницаемости мембран для кислорода и диоксида углерода диффузионная ДН характеризуется в основном тяжелой гипоксемией (без гиперкапнии), устраняемой только значительным повышением Р02в альвеолах (ингаляция высококонцентрированных смесей кислорода или чистого кислорода).
В ответ на гипоксемию и гипоксию при любом типе ДН развиваются компенсаторные реакции систем организма, участвующих в газообмене. Наиболее закономерны эритроцитоз и гипергемогло-бинемия, повышающие кислородную емкость крови, а также увеличение минутного объема кровообращения, которые наряду с интенсификацией тканевого дыхания способствуют повышению мас-сообмена кислорода в тканях. Однако при значительном нарушении газообмена в легких эти реакции не способны заметно повлиять на развитие тканевой гипоксии, в то время как увеличение объема кровообращения и связанное с эритроцитозом повышение вязкости крови сами становятся патогенными факторами развития легочного сердца.
При тяжелой гипоксии нарушается окислительное фосфорили-рование в тканях со снижением синтеза АТФ и креатинфосфата, активируется гликолиз, накапливаются недоокисленные продукты обмена, что приводит к метаболическому ацидозу и нарушениям электролитного обмена, возможность коррекции которых почками в условиях их гипоксии снижена. КОС особенно резко нарушено при декомпенсированном дыхательном ацидозе у больных с прогрессирующей гиперкапнией. Сопутствующие гипоксии и ацидозу потеря клетками калия (нередко с повышением его концентрации в крови) и дефицит АТФ резко нарушают деятельность всех органов, обусловливают возникновение сердечных аритмий, набухание головного мозга и могут быть причиной развития респираторной (респи-раторно-ацидотической) комы.
Клинические проявления. Основными клиническими проявлениями ОДН являются одышка и диффузный цианоз, на фоне которых отмечаются симптомы расстройства деятельности различных органов и систем организма, обусловленные гипоксией. Клинический диагноз устанавливают по особенностям одышки и динамики клинических проявлений, зависящих от причины и темпов развития дыхательной недостаточности (табл. 27).
ОДН характеризуется быстрым нарастанием гипоксии головного мозга с ранним появлением психических расстройств, которые
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
443
Таблица 27. Критерии разграничения разных типов ОДН, встречающихся при тяжелых формах инфекционных болезней
Клинические признаки |
|
Типы ОДН |
|
||
Обструкт ивная |
Рестрик- |
Диффу- |
Нервно-паралитические |
||
|
Острый |
||||
|
Синдром |
бронхо- |
тивная |
зионная |
расстройства |
|
крупа |
спазм |
|
|
дыхания |
Инспираторная |
+ |
— |
± |
+ |
+ |
одышка |
|
|
|
|
|
Экспираторная |
— |
+ |
чь |
— |
— |
одышка |
|
|
|
|
|
Свистящее ды- |
— |
+ |
— |
— |
— |
хание |
|
|
|
|
|
Ортопноэ |
— |
+ |
± |
+ |
— |
Сухой присту- |
+ |
+ |
— |
— |
— |
пообразный ка- |
|
|
|
|
|
шель |
|
|
|
|
|
Влажный ка- |
— |
— |
+ |
+ |
— |
шель |
|
|
|
|
|
Пенистая мок- |
— |
— |
— |
+ |
— |
рота |
|
|
|
|
|
Очаговые изме- |
— |
— |
+ |
+ |
— |
нения в легких |
|
|
|
|
|
Симметричные |
— |
— |
— |
+ |
— |
незвонкие хри- |
|
|
|
|
|
пы в легких |
|
|
|
|
|
Нарушение речи |
— |
— |
— |
— |
+ |
Парезы разных |
— |
— |
— |
— |
+ |
групп мышц |
|
|
|
|
|
Примечание. (—) — Признак отсутствует; (+) — признак наблюдается; (±) — признак отмечается непостоянно.
в большинстве случаев начинаются с выраженного возбуждения и беспокойства больного («дыхательная паника»), а впоследствии сменяются угнетением сознания, вплоть до комы. Фаза психического возбуждения может отсутствовать при ОДН вследствие поражения ЦНС (при черепно-мозговой травме, стволовом инсульте, отравлении барбитуратами и наркотиками). Ее распознавание облегчается наличием грубых неврологических нарушений, обусловленных ос-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
444
новным заболеванием. В таких случаях наблюдается либо редкое и поверхностное дыхание (олигопноэ), либо дыхательная аритмия с периодами апноэ, во время которых цианоз нарастает, несколько уменьшаясь в периоды появления дыхания (при дыхании типа Чейна—Стокса, биотовском).
В соответствии с тяжестью возникших нарушений выделяют, как уже было сказано, степени тяжести ОДН.
При ОДН I степени даже незначительная физическая нагрузка вызывает одышку, тахикардию, цианоз носогубного треугольника, напряжение крыльев носа; АД нормальное, Ра02 снижено до 80— 65 мм рт. ст.
При ОДН II степени одышка и тахикардия сохраняются в покое (соотношение частоты дыхания к частоте пульса— 1:2,5), выявляется стойкий акроцианоз и цианоз носогубного треугольника, кожа бледная, АД повышено, наблюдаются эйфория, беспокойство, могут быть вялость, адинамия, гипотония мышц. МОД повышается до 150—160 %. Резерв дыхания снижается на 30%, Ра02 — до 64—51 мм рт. ст., РаС02в норме или незначительно повышено (до 46—50 мм рт. ст.), рН в норме или снижен незначительно. При вдыхании 40% кислорода состояние значительно улучшается, парциальное давление газов крови нормализуется.
ОДН III степени характеризуется выраженной одышкой. В дыхании участвуют вспомогательные мышцы. Отмечаются аритмия дыхания, тахикардия, соотношение частоты дыхания к частоте пульса— 1:2, АД снижено. Аритмия дыхания и апноэ приводят к снижению его частоты. Наблюдаются бледность, акроцианоз, или общий цианоз кожи и слизистых оболочек, или мраморность кожи. Появляются заторможенность, вялость, адинамия; Ра02 снижается до 50 мм рт. ст., РаС02повышается до 75—100 мм рт. ст., рН снижен до 7,25—7,20. Вдыхание 40% кислорода не дает положительного эффекта.
При ОДН IV степени (гипоксическая кома) сознание отсутствует, кожа землистого цвета, губы и лицо цианотичны, на конечностях и туловище синюшные или синюшно-багровые пятна. Дыхание судорожное, рот открыт. Частота дыханий снижается и становится почти нормальной или даже уменьшается до 8—10 в 1 мин за счет длительных апноэ. Отмечается тахикардия или брадикардия, пульс нитевидный, АД резко снижено или не определяется, Ра02ниже 50 мм рт. ст., РаС02более 100 мм рт. ст.; рН 7,15 или ниже.
В случае развития гипокапнии (РаС02ниже 35 мм рт. ст.) вследствие гипервентиляции, которая у детей наблюдается чаще, чем у взрослых, отмечаются вялость, сонливость, бледность и сухость кожи, гипотония мышц, тахи- или брадикардия, алкалоз (рН выше 7,45),
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 445
щелочная реакция мочи. При нарастании гипокапнии возможны обмороки, отмечается гипокальциемия, приводящая к судорогам.
Клинические проявления интерстициального отека легких ха-рактерезуются не столько признаками отека, сколько прогресиро-ванием ОДН, нарастанием одышки и цианоза. Возникают чувство сжатия грудной клетки, недостатка воздуха, беспокойство, отрывистый сухой кашель. При переходе в альвеолярную фазу отека кашель становится влажным, количество мокроты быстро увеличивается. Больной стремится сесть (ортопноэ). Вдох затруднен, требует усилий. Начинают выявляться характерные физикальные изменения: тимпаническии перкуторный звук, рассеянные мелкопузырчатые хрипы, в дальнейшем разноколиберные, преимущественно в нижних отделах легких.
Паралич дыхательных мышц у больных ботулизмом проявляется прогрессирующим снижением ДО с параллельным повышением ЧД, вплоть до выраженного тахипноэ; больные беспокойны, пытаются найти положение, облегчающее вдох; лицо часто гиперемировано, кожа влажная; диффузный цианоз усиливается постепенно; обычно имеются признаки паралича других мышц (двоение в глазах, расстройства глотания и др.).
Появляется постоянное ощущение сжатия в груди, недостатка воздуха. Дыхание очень частое (40—60 в 1 мин), поверхностное. Парез диафрагмы и межреберных мышц сказывается преимущественно в фазе вдоха. Одышка сочетается с диффузным цианозом. В результате пареза мышц мягкого нёба и надгортанника, подавления глотательного и кашлевого рефлексов легко возникает аспирация жидкости и пищи в дыхательные пути с развитием аспирацион-ной пневмонии.
Для ОДН при обтурации дыхательных путей инородным телом характерно резкое психическое и двигательное возбуждение; с первых секунд появляется и быстро прогрессирует диффузный цианоз, более всего выраженный на лице; сознание утрачивается в ближайшие 2 мин, возможны судороги; дыхательные движения грудной клетки и живота становятся хаотичными, затем прекращаются.
При ларингостенозе вследствие острого воспаления (например, при дифтерийном крупе) или аллергического отека гортани возникает резкая инспираторная одышка, появляется так называемое стридорозное дыхание с затрудненным шумным вдохом. В фазе вдоха отмечается втяжение кожи в яремной, надключичной и подключичной ямках, в межреберьях; часто наблюдается охриплость голоса, иногда афония; по мере прогрессирования стеноза дыхание становится поверхностным, появляется и быстро нарастает диффузный цианоз, наступает асфиксия (подробнее см. «Дифтерия», «Анафилактический шок»).
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
446
При ОДН в зависимости от ее причины кома может развиться в интервале от нескольких минут (при асфиксии) до нескольких часов (реже — дней) от начала развития ДН. Кроме потери сознания характерны нарастающие одышка и цианоз, тахикардия, аритмия сердца, возможна фибрилляция его желудочков. Смерть наступает от остановки дыхания или нарушения сердечной деятельности.
Диагностика респираторной комы основывается на выявлении признаков прогрессирующей ОДН и основного заболевания, с которым связано ее развитие. Всегда определяется диффузный цианоз, иногда резко выраженный («чугунный»), но при значительной гиперкапнии лицо больного становится багровым, покрыто крупными каплями пота. При исследовании легких перкуторно обнаруживаются либо обширные поля притупления (при пневмонии, ателектазах, плевральном выпоте, пневмосклерозе), либо признаки резко выраженной эмфиземы (при обструктивной ОДН); выслушиваются обильные хрипы либо, напротив, выявляется феномен «немого легкого» (при астматическом статусе). В крови определяются полиците-мия, лейкоцитоз, гиперкапния, резкое снижение Р02, рН и щелочного резерва.
Диагностика ОДН основана на клинических признаках, показателях парциального давления газов артериальной крови и рН.
Признаки ОДН.
острое нарушение дыхания (олигопноэ, брадипноэ, тахипноэ, апноэ, патологические ритмы);
прогрессирующая артериальная гипоксемия (РаС02 < 50 мм рт.ст. при дыхании воздухом);
прогрессирующая гиперкапния (Ра С02 > 50 мм рт.ст.);
рН<7,3.
Все эти признаки выявляются не всегда. Диагноз ставят при наличии хотя бы двух из них.
В диагностике гипоксемической формы ОДН следует обращать внимание на характер дыхания: инспираторный стридор наблюдается при нарушении проходимости верхних дыхательных путей; экспираторная одышка — при бронхообструктивном синдроме; парадоксальное дыхание — при травме грудной клетки; прогрессирующее олигопноэ (поверхностное дыхание, снижение МОД) с возможностью апноэ — при параличах, парезах. Другие клинические признаки вначале почти не выражены — определяется тахикардия с умеренной артериальной гипертензией, возможны неспецифические неврологические проявления (неадекватность мышления, спутанность сознания и речи, заторможенность и т.д.), цианоз не выражен. Лишь при прогрессировании гипоксии цианоз становится интенсивным, внезапно нарушается сознание, затем наступает кома (гипоксическая) с отсутствием рефлексов, падает АД и наступает ос-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
447
тановка сердца. Продолжительность гипоксемической ОДН может колебаться от нескольких минут (при аспирации, асфиксии, синдроме Мендельсона) до нескольких часов и дней (РДСВ).
В отличие от гипоксемической гиперкапническая ОДН сопровождается многими клиническими проявлениями, зависящими от стимуляции адренергической системы в ответ на повышение РаС02. Нарастание РаС02 приводит к стимуляции дыхательного центра, следствием которой должно быть значительное повышение всех параметров внешнего дыхания. Однако этого не происходит из-за патологического процесса. Если в данном случае проводится активная оксигенация, то может наступить апноэ в результате депрессии дыхательного центра. Повышение АД при гиперкапнии обычно более значительно и стойко, чем при гипоксии. Оно может возрастать до 200 мм рт. ст. и более. Мозговые симптомы тем более выражены, чем медленнее развивается гиперкапния. При легочном сердце артериальная гипертензия менее выражена и переходит в гипотензию в связи с декомпенсацией правых отделов сердца. Очень характерными симптомами гиперкапнии являются значительная потливость и заторможенность. Если помочь больному откашляться и ликвидировать бронхиальную обструкцию, то заторможенность исчезает. Гиперкапнии также свойственна олигурия, которая всегда есть при выраженном дыхательном ацидозе.
Декомпенсация состояния наступает в тот момент, когда высокий уровень РаС02 перестает стимулировать дыхательный центр. Признаками декомпенсации служат резкое снижение МОД, расстройство кровообращения и развитие комы, которая при прогрессирующей гиперкапнии представляет собой С02-наркоз. РаС02 при этом достигает 100 мм рт.ст., но кома может наступить раньше из-за имеющейся гипоксемии. В этой стадии необходимо не только проводить оксигенацию, но и ИВЛ для элиминации диоксида углерода. Развитие шока на фоне коматозного состояния означает начало быстрого повреждения клеточных структур мозга, внутренних органов и тканей.
Клинические признаки прогрессирующей гиперкапнии:
нарушения дыхания (одышка, постепенное уменьшение ДО и МОД олигопноэ, бронхиальная гиперсекреция, невыраженный цианоз);
нарастающая неврологическая симптоматика (безразличие, агрессивность, возбуждение, заторможенность, кома);
сердечно-сосудистые нарушения (тахикардия, стойкое повышение АД, затем декомпенсация сердечной деятельности, ги-поксическая остановка сердца на фоне гиперкапнии).
Основные критерии диагностики ОДН и оценки степени ее выраженности — клинические. Первостепенное значение имеет появ-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
448
ление одышки. Одышка рассматривается как интегральное клиническое проявление функциональной недостаточности системы дыхания, включения компенсаторно-приспособительных механизмов, показатель усиленной работы дыхательных мышц, напряжения механизмов центральной регуляции дыхания. Возникновение одышки в зависимости от степени физической нагрузки либо в покое традиционно учитывается в градации степени ОДН.
Менее информативный признак ОДН — цианоз, появление которого зависит от содержания эритроцитов, изменений реологических свойств крови и состояния микроциркуляции. Для ОДН характерен так называемый центральный диффузный цианоз, не столько синего, сколько пепельно-серого оттенка. При этом кожа больного остается теплой. Острое развитие центрального цианоза манифестирует быстрое прогрессирование ОДН.
Из лабораторных методов исследования основное значение в диагностике ОДН имеет газовый состав артериальной крови (см. табл. 22). Важное значение имеют также показатели КОС. При развитии метаболического ацидоза возникает необходимость в дополнительном определении содержания в крови молочной и пировиног-радной кислот, средняя норма которых составляет соответственно (1035,0±72,2) ммоль/ли (89,1 ±6,3) ммоль/л.
Общие принципы лечения ОДН. Принципы лечения ОДН базируются на динамичном определении параметров внешнего дыхания, газового состава крови и КОС. Полученные данные необходимо сопоставить с параметрами транспорта кислорода, функциями сердечно-сосудистой системы и других органов.
Общие мероприятия:
частые изменения положения тела;
возвышенное положение головы и грудной клетки;
физиотерапия на область грудной клетки;
частые глубокие вдохи и кашель. Предупреждение и лечение инфекций:
адекватный баланс жидкости с поддержанием тканевой перфузии;
назначение при повышенном сопротивлении дыхательных путей бронхорасширяющих средств;
применение кортикостероидов. Если показана ИВЛ:
использование респираторов различной модификации;
поддержание оптимальной растяжимости легких;
создание минимальной Fi02 для поддержания адекватных Ра02 (не менее 60 мм рт. ст.) и Pv02 (не менее 30 мм рт. ст.);
обеспечение минимального давления в дыхательных путях во время вдоха;
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ 44д
— адекватное увлажнение вдыхаемой смеси.
Лечение больных с ОДН должно быть комплексным, включающим при необходимости коррекцию нарушений газообмена, кислотно-основного и электролитного баланса, этиотропную и патогенетическую терапию, применение симптоматических средств. Объем и очередность лечебных воздействий определяются причиной и темпами ее развития.
При ОДН с быстрым прогрессированием больные после оказания им возможной помощи на месте (ингаляция кислорода, введение бронхолитика) часто нуждаются в проведении интенсивной терапии в условиях стационара. Обязательной госпитализации подлежат все больные с ОДН, причина и проявления которой на месте не ликвидированы. Первоочередным должно быть немедленное устранение причины ОДН (например, удаление инородного тела из дыхательных путей при механической асфиксии) или воздействие на ведущее звено ее патогенеза. Патогенетическая терапия предполагает: введение бронхолитиков или глюкокортикоидов и дренирование бронхов при бронхиальной обструкции; применение дыхательных аналептиков при угнетении дыхательного центра; сибазона или морфина (урежает и углубляет дыхание) — при центрогенном тахипноэ, холиномиметиков — при миастеническом кризе (см. «Миастения»), обезболивание при травме грудной клетки и др. Во многих случаях при ОДН необходима ИВЛ, на фоне которой проводят остальные лечебные мероприятия.
При обтурационной ОДН часто бывает необходимо удаление из бронхов слизи (мокроты) электроотсосом или с помощью бронхо-скопа. При ОДН I u II степени слизь удаляется с кашлем или электроотсосом после ее разжижения, которое достигается ингаляцией щелочных растворов (2 % раствор натрия гидрокарбоната, минеральные воды), протеолитических ферментов (химотрипсин кристаллический, фибринолизин) или муколитических препаратов (ацетил-цистеин). Для уменьшения отека слизистой оболочки бронхов при воспалительных и аллергических заболеваниях на одну ингаляцию добавляют 12—15 мг гидрокортизона гемисукцината. Способствуют отхождению слизи отвары трав в ингаляциях и внутрь. Для устранения бронхоспазма, уменьшения легочной гипертензии и повышения диуреза показан эуфиллин, который при бронхиальной обструкции воспалительного происхождения назначают по 5—7 мг/кг в сутки внутрь и внутримышечно, а при бронхиальной астме— до 15— 20 мг/кг в сутки внутримышечно или внутрь. Кислородную терапию проводят сразу же после восстановления проходимости бронхов. Она должна быть длительной, до устранения ДН.
При ОДН III—IV степени необходима интенсивная терапия и реанимация с подачей кислорода через аппарат ИВЛ, а при восстанов-
29 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
450
лении самостоятельного дыхания — метод спонтанного дыхания под положительным давлением или гипербарическая оксигенация. При ОДН I и II степени увлажненный 40 % кислород подается через носовой катетер, маску или под положительным давлением и лишь при ОДН III—IV степени на короткое время показаны более высокие его концентрации.
При декомпенсированном дыхательном ацидозе необходимо проводить коррекцию КОС путем внутривенного введения 4 % раствора натрия гидрокарбоната, аскорбиновой кислоты.
При ОДН нередко происходит большая потеря жидкости, поэтому для восстановления водно-электролитного обмена назначают повышенное количество жидкости либо в виде питья (морсы, соки, растворы глюкозы, щелочные минеральные воды), либо внутривенно капельно (растворы глюкозы, солевые растворы, препараты калия), внутримышечно — кокарбоксилазу, АТФ.
Лечение больных с респираторной комой начинают с перевода на ИВЛ, без которой проведение кислородной терапии противопоказано из-за угрозы остановки дыхания, т.к. деятельность дыхательного центра при выраженной гиперкапнии регулируется по низкому Р02 крови (рефлекторно с каротидных хеморецепторов). Используют кислородно-воздушные или кислородно-гелиевые (при бронхиальной обструкции) смеси, содержащие 40—80 % кислорода. При возможности применяют высокочастотную вспомогательную вентиляцию легких под положительным давлением 1—2 атм с частотой циклов 100—150 в 1 мин, при ее использовании гипоксемия и ги-перкапния ликвидируются быстрее. К перспективным способам лечения гипоксии относят экстракорпоральную малопоточную оксиге-нацию крови и эритроцитоферез. Проводят интенсивную терапию основного заболевания. В большинстве случаев показано введение преднизолона гемисукцината (60—120 мг внутригенно). С целью дезинтоксикации и улучшения реологических свойств крови внутривенно капельно вводят изотонический раствор натрия хлорида, 5 % раствор глюкозы общим объемом до 1,5 л, а при обезвоживании — до 2,5 л в сутки. Для улучшения усвоения кислорода тканями в эти растворы через каждые 6—8 ч добавляют кокарбоксилазу (по 100— 200 мг), цитохром С (по 15—20 мг); внутримышечно вводят 1—2 мл 1 % раствора рибофлавин-мононуклеотида. В связи с декомпенсиро-ванным дыхательным ацидозом внутривенно капельно вводят 400 мл 4—5 % раствора натрия гидрокарбоната, а для компенсации потерь внутриклеточного калия — 1—3 г калия хлорида или панангина (по 10—20 мл) в 400 мл 5 % раствора глюкозы с добавлением инсулина (6—8ЕД). При необходимости промывают бронхи, устанавливают эндотрахеально зонд для отсасывания мокроты. Терапию проводят под контролем динамики рН, Р02, РС02, гематокрита и концентра-
ОСТРАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
ции электролитов в крови. Эти показатели определяют каждые 3— 4 ч, после выведения из комы — каждые 12 ч в течение 2—3 сут. В процессе лечения ОДН возможны такие осложнения:
сердечные аритмии (политопная суправентрикулярная тахикардия и др.), которые связывают с гипоксией и повышением рН крови. Они могут возникать в результате действия различных препаратов, обладающих кардиотоксическим свойством;
левожелудочковая недостаточность. Следует помнить, что гипоксия приводит к повышению давления в легочной артерии. При исходной патологии сердечно-сосудистой системы на фоне гипоксии в клинической картине может доминировать лево-желудочковая декомпенсация. Сердечные гликозиды назначают лишь при восстановленном газовом составе крови. В случае застоя в малом круге кровообращения или общей гипергидратации необходимо применять салуретики, контролируя при этом концентрацию калия и других электролитов в крови;
тромбоэмболия легочной артерии (ТЭЛА) — нередкое трудно-диагностируемое осложнение;
желудочно-кишечные кровотечения. Они возможны при образовании стрессовых язв на слизистой оболочке желудка и кишечника.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
452
Острая дыхательная недостаточность при нарушении
трахеобронхиальной проходимости
Такой тип ОДН возникает при сопротивлении дыханию на уровне верхних и нижних дыхательных путей — обструктивная ОДН. Она возникает при синдроме крупа, остром стенозе гортани, стенозиру-ющем ларинготрахеите, ларингоспазме, бронхоспазме, при обтура-ции дыхательных путей инородными телами, скоплением слизистого и гнойного секрета при нарушении процесса откашливания или при повышении секреции слизи, при обезвоживании (сгущении секрета и образование пробок в дыхательных путях).
Синдром крупа является одной из причин ОДН. Препятствие потоку воздуха возникает на уровне голосовой щели — самого узкого места верхних дыхательных путей — за счет воспалительных изменений (отек, пленки при дифтерии) либо спазма мышц гортани, часто ларинготрахеит сочетается с ларингоспазмом.
Из бактериальных инфекций, играющих роль в возникновении крупа, следует отметить дифтерию и скарлатину. Особую опасность представляет дифтерия гортани, при которой оторвавшаяся пленка может внезапно перекрыть голосовую щель и вызвать рефлекторную остановку дыхания.
Основной этиологической причиной развития синдрома крупа на современном этапе являются ОРВИ, что определяет правомерность термина «вирусный круп». Наиболее частыми возбудителями являются миксовирусы парагриппа, особенно I группы, и гриппа. Относительно реже круп возникает при аденовирусной и рес-пираторно-синцитиальной инфекциях, а также при кори, ветряной оспе и др. Нередко круп возникает при респираторной инфекции, вызванной ассоциацией вирусов. Первостепенное значение имеет присоединение вторичной бактериальной флоры, но вирусы в данном случае играют роль пускового фактора. Возникающие у больных острый ларингит, ларинготрахеит, ларинготрахеобронхит имеют смешанное (вирусно-бактериальное) происхождение, при этом из мокроты закономерно высевается кокковая флора — стафилококки, стрептококки.
Патогенез. Ведущим в патогенезе нарушений трахеобронхиаль-
ОДН ПРИ НАРУШЕНИИ ТРАХЕОБРОНХИАЛЬНОЙ ПРОХОДИМОСТИ
453
ной проходимости является активный воспалительный процесс, сопровождающийся повреждением мерцательного эпителия, выстилающего слизистые оболочки верхних дыхательных путей и выполняющего дренажную (очистительную) функцию. При остром ларин-готрахеите усиленная секреция слизи в условиях мукоцилиарнои недостаточности приводит к задержке в дыхательных путях секрета, накоплению вязкой слизи, а блокада носовых ходов и дыхание через рот неувлажненным воздухом определяют ее быстрое высыхание. Образуются плотные корки, закупоривающие просвет гортани и трахеи. Преимущественно поражается подскладочное пространство (участок гортани от истинных голосовых связок до трахеи), в физиологических условиях являющееся самым узким и самым уязвимым местом дыхательных путей. Важное значение в формировании крупа имеют воспалительный отек-набухание слизистой оболочки, а также развивающееся при остром ларинготрахеите нарушение координации нервно-мышечного аппарата гортани, определяющее легкость возникновения спастических реакций.
Критическое уменьшение просвета трахеи, бронхов соответствует развитию крупа или острого стеноза гортани. Его нарастание приводит к обструктивной ОДН, вплоть до полной асфиксии. Критическое повышение сопротивления в дыхательных путях определяет неизбежное увеличение работы дыхания. Возрастают энергозатраты, увеличивается «кислородная цена» дыхания. Создается «порочный круг», определяющий быстрое прогрессирование обструктивной ОДН.
В том случае, если поражается все трахеобронхиальное дерево, симптомы нарастают очень быстро — от момента появления первых признаков ОДН до смерти от асфиксии проходит не более 2—3 сут. Особую угрозу представляет наличие пленок в трахее — двигательное беспокойство, кашель способствуют их отделению, и они могут, «сев» на бифуркацию трахеи, вызвать моментальную обтурацию и смерть.
При некоторых инфекционных болезнях, преимущественно ней-роинфекциях, острый стеноз гортани обусловлен не воспалением слизистой оболочки гортани и трахеи, а резчайшим ларингоспаз-мом. Так, при тяжелых формах генерализованного столбняка судорожный приступ может привести к асфиксическому кризу — полному закрытию голосовой щели с остановкой дыхания и наступлением смерти. В развитии ОДН при столбняке основную роль играют спастические сокращения дыхательных мышц (диафрагма, межреберные мышцы), а также нередкое присоединение аспирационной пневмонии.
Клиника. Отличительной особенностью крупа при дифтерии является постепенное (2—4 дня) нарастание признаков стеноза горта-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
454
ни на фоне умеренной лихорадки, интоксикации — переход осиплости голоса в полную афонию и грубого лающего кашля — в беззвучный, сиплый. Тяжесть состояния определяется степенью выраженности обструктивной ОДН, обусловленной сужением просвета гортани в результате отека слизистой оболочки, образования в ней фибринозных налетов и нарушения подвижности истинных голосовых складок (следствие поражения дифтерийным токсином мышц, обеспечивающих движение черпаловидных хрящей).
Клинически принято различать 3 стадии крупа.
/ стадия— катаральная (компенсированная). Общее состояние больного изменяется мало. Появляются беспокойство, осиплость голоса, учащенное дыхание, цианоз носогубного треугольника, грубый кашель; раздувание крыльев носа и незначительное втяжение податливых мест грудной клетки заметны только при возбуждении. Гипоксия выражена незначительно. Изменения РаС02 непостоянны. В связи с компенсаторной гипервентиляцией легких может даже развиться гиперкапния.
II стадия — стенотическая. Вначале сознание сохранено, но бес покойство становится постоянным. Дыхание шумное, свистящее, с участием вспомогательных мышц, втяжением податливых мест грудной клетки. Отчетливый цианоз носогубного треугольника, Тахикардия 140—160 в 1 мин. Прогрессирует гипоксемия, часто в сочетании с некоторым повышением РаС02. Постепенно состоя ние больных становится тяжелым. Сознание временами спутанное. Дыхание стенотическое, с затрудненным и удлиненным вдохом, слышно на расстоянии (вместе с тем, при аускультации легких ед ва прослушивается). Резко выражено втяжение уступчивых мест грудной клетки при дыхании. Разлитой цианоз. Отчетливые при знаки сосудистой недостаточности. Холодный пот. Частота сердеч ных сокращений— 180—200 в 1 мин. Несмотря на резко возрос шую работу дыхания, нарушения газообмена прогрессируют: Ра02 становится ниже 70 мм рт. ст., РаС02 достигает 50 мм рт.ст. и выше. Стабилизации возникающих нарушений способствует неизбежное при крупе дыхание через рот, приводящее к высыханию слизистых оболочек, превращению воспалительного экссудата в плотные кор ки, уменьшающие или даже закупоривающие просвет дыхательных путей.
III стадия — асфиксическая. Сознание отсутствует. Зрачки рас ширены. Судороги. Наблюдаются отдельные дыхательные движе ния. Разлитой интенсивный цианоз. Пульс едва прощупывается. Переход тахикардии в брадикардию предшествует остановке сер дца. Непосредственной причиной смерти чаще является не полная обструкция дыхательных путей, а гипоксический отек-набухание го ловного мозга с развитием комы.
ОДН ПРИ НАРУШЕНИИ ТРАХЕОБРОНХИАЛЬНОЙ ПРОХОДИМОСТИ
455
При вирусном крупе, осложняющем течение ОРВИ, признаки острого стеноза гортани сочетаются с характерными клиническими проявлениями респираторной вирусной инфекции (лихорадка, интоксикация, диффузное воспаление верхних дыхательных путей). В результате воспалительных изменений дыхательные пути сужаются на уровне подсвязочного пространства, анатомическим ориентиром которого является перстневидный хрящ. Симптомы сужения обычно возникают через несколько дней после начала заболевания. На фоне нормальной или слегка повышенной температуры тела развивается одышка.
Дифференциальная диагностика проводится с:
анафилаксией— возникает как специфическая реакция по типу антиген—антитело или реакция повышенной чувствительности к определенным, чаще всего лекарственным веществам. Реакция возникает немедленно и протекает с картиной выраженного ларинго- и бронхоспазма, прогрессирующего удушья, иногда — на фоне вазомоторной атонии.
обтурацией дыхательных путей инородным телом— чаще всего локализуется в трахее или в одном из бронхов. Попадание в дыхательные пути даже небольшого инородного тела (рыбья кость, горошина) может вызвать сильнейший ларинго- и брон-хоспазм и привести к летальному исходу. Застревание инородного тела в заглоточном пространстве может полностью обту-рировать вход в гортань. Это приводит к афонии, апноэ, быстрому нарастанию цианоза. В случае частичной обструкции дыхательных путей возникают кашель, одышка, стридор, втягивание надключичных областей при вдохе и цианоз.
Дифференциальная диагностика приведена в табл. 28, которая поможет разграничить разные типы ОДН по данным клинического обследования больных. При всех видах ОДН развиваются одышка, цианоз той или иной степени выраженности в зависимости от ее стадии, поэтому данные симптомы в таблицу не включены. Дифференциально-диагностическое значение признаков также сугубо ориентировочное. Приходится учитывать нередкое развитие сочетан-ных вариантов ОДН, в генезе которых участвуют разные факторы.
Стенозирующий ларинготрахеобронхит. Тяжелые диффузные воспалительные процессы в дыхательных путях с нарушением их проходимости могут возникать в любом возрасте. Они захватывают практически все трахеобронхиальное дерево с развитием ларинго-трахеобронхита. Значительное набухание слизистой оболочки в сочетании с гиперсекрецией, нарушением дренажной функции и скоплением вязкой слизи резко увеличивает сопротивление дыханию. Этому способствует обычно присоединяющийся бронхоспазм.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
456
Таблица 28. Дифференциальная диагностика при стенозе гортани
Признаки |
|
Заболевания |
|
|
|
Дифтерия гортани |
Стенозирую- щий ларинго- трахеоброн- хит |
Инородные тела гортани |
Ботулизм |
Столбняк |
|
Развитие |
Прогресси- |
Возникает |
Возникает |
Прогрес- |
Приступ |
симпто- |
рующий |
внезапно, |
внезапно, |
сирую- |
во время |
мов сте- |
стеноз |
чаще в ноч- |
на фоне |
щий па- |
судорог |
ноза |
(кашель, |
ное время |
полного |
рез дыха- |
|
|
асфиксия) |
на фоне ОРВИ |
здоровья |
тельных мышц |
|
Темпера- |
Повышена |
Повышена |
Нормаль- |
Нормаль- |
Повы- |
тура тела |
|
|
ная |
ная |
шена |
Интокси- |
Умеренная |
Выражен- |
Отсут- |
Умерен- |
Выражен |
кация |
|
ная |
ствует |
ная |
|
Кашель |
Грубый, |
Грубый, |
Сухой, |
Отсут- |
Отсут- |
|
сухой, по- |
лающий, |
приступо- |
ствует |
ствует |
|
том беззвучный |
влажный |
образный |
|
|
Насморк |
Отсут- |
Характерен |
Отсут- |
Отсут- |
Отсут- |
|
ствует |
|
ствует |
ствует |
ствует |
Окраска |
Бледность, |
Гиперемия, |
Цианоз |
Блед- |
Блед- |
кожи |
цианоз |
цианоз |
|
ность, цианоз |
ность, цианоз |
Длитель- |
Длитель- |
Может про- |
Прекраща- |
Длитель- |
Длитель- |
ность сте- |
ный |
ходитьсамо- |
ется после |
ный, при- |
ный, при- |
ноза |
|
стоятельно |
удаления |
ступооб- |
ступооб- |
|
|
|
инородного тела |
разный |
разный |
Отек сли- |
Умерен- |
Выражен- |
Отсут- |
Отсут- |
Отсут- |
зистых |
ный |
ный |
ствует |
ствует |
ствует |
оболочек |
|
|
|
|
|
Гипере- |
Умеренная |
Резкая |
Отсут- |
Отсут- |
Отсут- |
мия |
|
|
ствует |
ствует |
ствует |
слизис- |
|
|
|
|
|
тых обо- |
|
|
|
|
|
лочек |
|
|
|
|
|
Налеты |
Харак- |
Отсут- |
Отсут- |
Отсут- |
Отсут- |
|
терны |
ствуют |
ствуют |
ствуют |
ствуют |
ОДН ПРИ НАРУШЕНИИ ТРАХЕОБРОНХИАЛЬНОЙ ПРОХОДИМОСТИ 457
Обтурация бронхов приводит к ателектазам отдельных участков легких.
Данный вид ОДН возникает в основном при тяжелых формах гриппа. Протекает с резко выраженной одышкой (число дыханий достигает 30—40 и более в 1 мин) и разлитым цианозом. Прогрессирующая ОДН сочетается с признаками диффузного трахеобронхита. Кашель мучительный, с трудноотделяемой вязкой гнойной мокротой, иногда приступообразный, с переходом в асфиксический криз. При аус-культации легких дыхание местами ослабленное, местами жесткое. Трахеобронхит часто сочетается с бронхиолитом и бронхопневмонией.
Стенозирующий ларинготрахеобронхит может развиться и при тяжелых формах кори, натуральной и ветряной оспы.
В клинике инфекционных болезней признаки острого бронхо-спазма выявляются главным образом у детей младшего возраста с аллергией в анамнезе, при тяжелом течении гриппа и других респираторных вирусных инфекций — парагриппа, респираторно-синци-тиальной, аденовирусной, кори и др. Развивается картина острого бронхита или бронхобронхиолита с выраженным астматическим компонентом. Появляются мучительный, надсадный кашель, практически без отделяемого, тяжелые, повторяющиеся приступы удушья продолжительностью от нескольких минут до часов. Грудная клетка в значительной мере фиксирована в состоянии вдоха, ее дыхательные экскурсии резко ограничены. Дыхание шумное, со свистящими хрипами, слышными на расстоянии. Кожные покровы циа-нотичные, влажные. Тахипноэ обычно сочетается с тахикардией.
При некоторых инфекционных болезнях (преимущественно нейроинфекциях — столбняке, бешенстве) острый стеноз гортани обусловлен не воспалением слизистой оболочки гортани и трахеи, а резчайшим ларингоспазмом. Так, при тяжелых формах генерализованного столбняка судорожный приступ может привести к асфикси-ческому кризу — полному закрытию голосовой щели с остановкой дыхания и наступлением смерти. В развитии ОДН при столбняке существенную роль играют спастические сокращения дыхательных мышц, а также нередкое присоединение аспирационной пневмонии.
Тяжелый болезненный спазм мышц гортани возникает при пароксизмах бешенства — лицо больного становится синюшным, развивается тяжелейшая одышка с затрудненным свистящим вдохом (стридор), напряжением всех вспомогательных дыхательных мышц и судорожным сокращением диафрагмы.
Лечение. Основные этапы — восстановление ларинготрахеоброн-хиальной проходимости (противовоспалительная, противоотечная, антигистаминная, антиспастическая терапия, механический отсос
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
458
слизи), подавление возбудителя, борьба с вторичной инфекцией, дезинтоксикация, обеспечение хорошей аэрации, кислородная терапия. При необходимости — катетеризация трахеи, эндотрахеальная интубация или даже трахеостомия с переходом на ИВЛ. При резко выраженной ОДН спонтанное дыхание становится недостаточными единственным жизнеспасающим мероприятием является ИВЛ.
Лечение острого ларинготрахеобронхита с синдромом крупа направлено на восстановление проходимости дыхательных путей, снятие интоксикации. Так как при ОРВИ воспалительный процесс с явлениями отека обусловлен не только инфекционно-аллергическим процессом, вызванным вирусом, но и присоединившейся бактериальной инфекцией, чаще всего стафилококковой, лечение включает специфическую этиотропную терапию: противовирусные препараты и антибиотики. Эффективным может оказаться дополнительное применение противоотечных (лазикс) и отвлекающих мер (горчичные ножные ванны).
Дезинтоксикационная терапия не только снимает токсикоз, но и останавливает прогрессирование отека дыхательных путей; она включает дозированное введение в вену изотонического раствора натрия хлорида, 5 % раствора глюкозы.
В целях очищения дыхательных путей от вязкой мокроты назначают паро-кислородно-медикаментозные аэрозоли. Так, на одну ингаляцию в аэрозоль вводят 4 мл 4 % натрия гидрокарбоната, 25— 50 мг дезоксирибонуклеазы, растворенной в 3 мл изотонического раствора натрия хлорида, 25—50 мг преднизолона, 5 мл 2,4 % раствора эуфиллина, 1 мл 1 % раствора димедрола и 5 мл раствора хлоро-филлипта. Аэрозоль способствует разжижению мокроты, предупреждает образование корок, закупоривающих дыхательные пути. Отсутствие эффекта от аэрозольной терапии является показанием к проведению под наркозом ларингоскопии и удалению обтуриру-ющих корок. Интубацию или трахеостомию производят при отсутствии эффекта от предыдущей терапии.
Эффективность лечебных мер при остром стенозе гортани зависит прежде всего от своевременности их применения. Интенсивную терапию ДН надо начинать не с трахеостомии и даже не с интубации трахеи, а с непрерывной аэрозольной ингаляции сосудосуживающих, антиаллергических и противовоспалительных средств.
Аэрозольную ингаляцию следует начинать с нафтизина (санори-на), который при нанесении на слизистую оболочку вызывает быстрое и достаточно стойкое сужение сосудов. Благоприятный, хотя и временный эффект от такой аэрозольной ингаляции при стенозе верхних дыхательных путей наступает очень быстро — в первые 2-3 мин. Сосуды слизистой оболочки суживаются, что вызывает вне-
ОДН ПРИ НАРУШЕНИИ ТРАХЕОБРОНХИАЛЬНОЙ ПРОХОДИМОСТИ
459
запное, хотя и не слишком выраженное, расширение просвета дыхательных путей в области стеноза.
Сразу же после ингаляции нафтизина дают аэрозоль 1 % гидрокарбоната натрия, который размягчает сгустки мокроты, пленки фибрина и облегчает их откашливание. В результате этого еще больше расширяется просвет верхних дыхательных путей, закрепляя благоприятный эффект аэрозольной ингаляции нафтизина. В комплекс аэрозольной терапии должны входить глюкокортикостероид-ные гормоны (преднизолон и др.), снижающие отек, воспаление и аллергию, а также муколитические препараты (трипсин, химопсин, ацетилцистеин).
Если консервативная терапия оказалась неэффективной, необходимо переходить к более энергичной тактике, предполагающей тра-хеостомию или переведение больных на ИВЛ.
Лечение ларингоспазма при столбняке, бешенстве, ботулизме, полиомиелите достаточно подробно изложено в соответствующих главах руководства (см.).
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 460
Респираторный дистресс-синдром взрослых
Респираторный дистресс-синдром взрослых (РДСВ) — тяжелая, прогрессирующая дыхательная недостаточность, развивающаяся на фоне различных, угрожающих жизни критических состояний и характеризующаяся развитием гипоксии, резистентной к оксигенотерапии.
Лат.— disfunctiones respiratirium syndrome in adultorium.
Англ. — adult respiratory distress syndrome (ARDS).
Острое повреждение легких и острый респираторный дистресс-синдром (ОРДС)представляют серьезную проблему клинической медицины. Клиницисты находятся в постоянном изучении причин развития острого респираторного дистресс-синдрома и поиске новых методов его диагностики и лечения. На основании работ 1967— 1975 гг. возникла концепция, что ОРДС должен рассматриваться как крайнее проявление процесса, именуемого «острое повреждение легких». Имеется значительный прогресс в установлении провоцирующих факторов и патогенеза, однако до сих пор не существует единой оценки диагностических критериев, которые могут быть использованы для верификации этого состояния и уточнения его фазы. Поэтому имеющиеся в литературе сведения о РДСВ достаточно противоречивы, а данные, свидетельствующие о наличии этого синдрома, не всегда убедительны. Затрудняют анализ и сопоставление приведенной в научной литературе информации многообразие патологических состояний, которые являются пусковыми механизмами РДСВ.
Традиционно диагноз «острый респираторный дистресс-синдром» ставится на основании характерной клинической картины и ее динамики, двухсторонней инфильтрации легких, выявляемой на рентгенограмме, и тяжелой гипоксемии при отсутствии признаков кардиогенного отека.
Значительная дискуссия развернулась относительно различий между острым повреждением легких и ОРДС, на основе величины индекса оксигенации (Pa02/Fi02). Американо-европейская согласительная конференция по проблеме ОРДС (1992) рекомендует считать, что этот уровень при ОРДС должен быть < 150 мм рт. ст., тогда как при остром повреждении легких (ОПЛ) — в пределах > 200 и < 300 мм рт. ст. Так как ОРДС является крайним проявлением ОПЛ, то у больных при истинном ОРДС всегда выявляется также та или иная степень полиорганной недостаточности.
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
ОРД С включает 2 вида — респираторный дистресс-синдром новорожденных (РДСН), имеющий целый ряд особенностей, и респираторный дистресс-синдром взрослых (РДСВ).
Представление о РДСВ является относительно новым и еще не вполне очерченным. Термин «Adult respiratory distress syndrome» (ARDS) предложили D. Ashbaugh и соавторы в 1967 г. В литературе до сих пор употребляется еще около 20 названий этого синдрома («шоковое легкое», «влажное легкое», «посттравматическая легочная недостаточность», «легкие Дананга», «синдром дыхательных расстройств» и т.д.), что отражает как его широкое распространение, так и наличие противоречий в понимании сущности РДСВ. Представление о связи глубокой, прогрессирующей легочной патологии с перенесенной травмой впервые появилось в период американской агрессии во Вьетнаме; недаром одно из первых названий синдрома— «легкие Дананга». В дальнейшем стало очевидно, что травма — не единственная причина дыхательной недостаточности — синдром часто развивается у больных с анафилактическим и септическим шоком, после массивных кровопотерь, при перитоните, панкреатите и других тяжелых заболеваниях. Стало очевидным, что для возникновения РДСВ обязательно крайне тяжелое состояние больного, обусловленное прежде всего нарушением системного кровообращения и полиорганной дисфункцией. Вероятно поэтому, стараясь подчеркнуть его неспецифичность, но пытаясь в то же время сохранить представление об особенностях его патогенеза у взрослых, этот синдром стали называть «респираторный дистресс-синдром взрослых».
РДСН — это поражение легких, при котором требуется слишком большое усилие для их расправления при вдохе новорожденного. Слабые мышцы новорожденного не могут долго развивать такое усилие, постепенно объем вдоха снижается и ребенок погибает, если не применяются ИВЛ и другие методы интенсивной терапии. На вскрытии обнаруживают выраженные ателектазы и специфическую пленку, покрывающую внутреннюю поверхность некоторой части альвеол и бронхов, — так называемую гиалиновую мембрану. РДСН является следствием ишемии легочной ткани, в основе которой лежат 2 основных генетических механизма, усиливающих еще больше гипоксию:
нарушение при ишемии легких продукции сурфактанта — фос-фолипидов, снижающих поверхностное натяжения альвеол при уменьшении их размеров (выдох) и позволяющих поэтому приложить меньше усилий для увеличения их объема (вдох);
ишемия легких увеличивает проницаемость альвеолярно-ка-пиллярной мембраны, фибриноген плазмы крови проникает в
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
462
альвеолы и образует пленку — гиалиновую мембрану. Таким образом, гиалиновая пленка — следствие, а не причина РДСН. В основе подтверждения РДСВ при различных состояниях лежат критерии, предложенные А.В. Cooper и соавторами (1999):
1. Сепсис — при наличии двух и более из перечисленных ниже пя ти факторов:
температура тела больного > 38,5 °С или < 36 "С;
количество лейкоцитов в периферической крови > 12х109/л или < 3,5хЮ9/л или >20 % незрелых форм;
выделение патогенной культуры из крови (чаще это грамот-рицательная микрофлора, смешанная, стафилококковая, анаэробная);
большой внутриполостной гнойник;
плюс один или более из следующих трех факторов:
• системная артериальная гипотензия более 2 ч
(при АДсист < 90 мм рт.ст.; 40 < АДс < 85 мм рт.ст.), необходимость применения инотропных препаратов для поддержания АДс > 85 мм рт.ст,;
системное сосудистое сопротивление < 800 динхсхсм"5 (при наличии катетера Свена—Ганса в легочной артерии);
метаболический ацидоз (BE < —5 ммоль/л).
Документированная аспирация желудочного содержимого.
Контузия легких: локализованный инфильтрат, появившийся на рентгенограмме в течение 6 ч после тупой травмы груди.
Массивные гемотрансфузии: замещение более 40—50 % ОЦК в течение 24 ч — инфузия 5 стандартных доз (450 мл) цельной крови, которая в настоящее время практически не применяется, или более 4—5 стандартных пакетов эритроцитарнои массы (200 мл эритроцитов и лейкоцитов + 100 мл плазмы).
Множественные переломы: переломы двух и более трубчатых костей.
Пневмония: наличие инфильтрата на рентгенограмме, плюс любые 3 из следующих четырех факторов:
наличие гнойной мокроты;
патогенные культуры в посевах мокроты или крови;
температура тела больного > 38,5 °С или < 36 °С;
количество лейкоцитов в периферической крови > 12х109/л или < 3,5хЮ9/л или > 20 % незрелых форм.
Ингаляционные повреждения, приводящие к развитию гипо-ксемии в течение 3—6 сут.
Ожог более 28 % поверхности тела 11—111 степени.
Острый панкреатит при уровне амилазы, трехкратно превышающем верхнюю границу нормы.
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
463
Передозировка некоторых лекарственных препаратов (опиаты, барбитураты, некоторые сердечно-сосудистые средства).
Шок: системная артериальная гипотензия более 2 ч (АД <90 ммрт.ст.; 40<АДс <85 ммрт.ст., необходимость применения инотропных препаратов для поддержания ДД > 85 мм рт.ст.).
Легкие больного, находящегося в критическом состоянии, являются наиболее уязвимым местом для инфекции. В большинстве случаев бактериальная инфекция играет главную роль в патогенезе заболевания, хотя развитие РДСВ возможно и при действии неинфекционных факторов, но лишь на конечных стадиях. Выделяют следующие пути проникновения инфекции в легкие:
из первичного очага инфекции (панкреатит, перитонит, инфицированная рана и т.д.);
из окружающей атмосферы (госпитальная инфекция);
гематогенный — кровь больного сепсисом;
активация собственной кишечной микрофлоры, ставшей для больного высоковирулентной.
При наличии септического фокуса в виде абсцесса, перитонита и других на фоне генерализации процесса обязательно вовлекаются в этот процесс легкие, играющие роль одного из главных барьеров, в котором происходит аккумуляция микроорганизмов. Сроки возникновения поражения легких зависят от состояния больного, характера, локализации первичного очага и вида инфекции.
Больным, перенесшим тяжелый шок и находящимся в критическом состоянии в течение нескольких дней, угрожает опасность проникновения инфекции в легкие из собственного пищеварительного тракта. Наличие микроорганизмов в ротоглотке, верхних дыхательных путях и в кишечнике — норма для здорового человека. Обычно эти микроорганизмы не патогенны, но они становятся высоковирулентными, когда в силу тех или иных причин попадают в ткань легких и кровеносное русло. После наложения трахеостомы флора приобретает особую вирулентность уже через несколько дней. Больные в критических состояниях чрезвычайно восприимчивы и к госпитальной инфекции, которая для здорового человека не опасна.
Длительное лечение соматических больных антибиотиками широкого спектра действия без учета чувствительности флоры иногда не только не способно приостановить инфекционный процесс в легких, но и повышает активность бактерий, находящихся вне сферы действия данного препарата. В этой связи особенно опасно раннее проникновение в легкие колибациллярной инфекции, в результате чего РДСВ приобретает молниеносное течение, приводящее к гибели еще до развития дыхательной недостаточности. Число легочных осложнений у больных в реанимационных отделениях резко возрастает, когда в этих отделениях появляется даже один крайне тяжело-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
464
больной с устойчивым инфекционным процессом. Стафилококковая инфекция, хотя и часто встречается, является самостоятельной инфекционной проблемой. Она проявляется в виде стафилококковой пневмонии лишь спустя несколько дней после начала заболевания, когда в организме образовалось уже несколько популяций бактерий. На поздних стадиях заболевания может выделяться и грибковая флора. В дебюте болезни самостоятельного значения она, как правило, не имеет. Обычно из крови, мокроты, кала, половых органов высевается и белая кандида. Если применялись антибиотики широкого спектра действия и особенно в сочетании с глюкокортикоидами, риск серьезных грибковых поражений значительно повышается. Нормальная колибациллярная флора препятствует проникновению грибов в организм. Клинические наблюдения свидетельствуют, что предпосылкой для развития грибковой инфекции является полное расстройство и подавление собственной нормальной микрофлоры кишечника длительным применением антибиотиков.
Интерес к РДСВ растет, тем более, что летальность при его развитии остается высокой. В США РДСВ выявляется ежегодно у 150 тыс. больных; частота его не снижается, остается высокой и летальность (последние 20 лет она составляла 50 % и выше). В США в 1995— 1996 гг. РДСВ отмечался в 75 случаях на 100 000 населения в год, в то время как в Великобритании он регистрировался в 4,5 случаях на 100 000 населения в год. Частота развития РДСВ только при тяжелых травматических повреждениях колеблется от 2 до 5 %. Последние исследования, проведенные в Европе, показывают, что РДСВ встречается с частотой 1,5—10,5 на 100 000 населения в год. В Берлине (Германия), мегаполисе с населением 3,4 млн, в 1999 г. частота РДСВ составляла 3 на 100 000 населения в год.
Патогенез. C.J. Van der Merwe и соавторы (1985) рассматривают РДСВ как некоронарогенный отек легких в связи с повышением проницаемости альвеолярных капилляров, развивающейся вторично вследствие гетерогенной группы заболеваний, а не в результате левожелудочковой недостаточности.
Обращает внимание то, что механизмы, лежащие в основе этих изменений, варьируют от прямого повреждения мембраны альвеолярных капилляров до закупорки микрососудистого русла тромбоцитами и/или полиморфноядерными гранулоцитами. РДСВ является морфофункциональной основой тяжелого повреждения легких, развивающегося и при повреждении собственно ткани легких, в том числе при пневмонии, абсцедировании, ателектазе, пневмотораксе и др.
Основным отличием патогенетического механизма РДСВ является повышение проницаемости легочных капилляров, а не значительное повышение капиллярного давления, как это происходит при
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ 465
кардиогенном отеке легких. Повреждение мембран альвеолярных капилляров является инициирующим фактором РДСВ независимо от вызвавшей его причины.
В каждом конкретном случае особенности развития РДСВ в значительной степени определяются природой повреждающего фактора.
На первых этапах развития РДСВ включаются компенсаторные механизмы, в т.ч. и механизмы поверхностного натяжения легких. Величина поверхностного натяжения экстрактов или смывов с альвеолярной поверхности легких, а также отечной жидкости, вытекающей из легких, составляет около 40—50 дин/см, т.е. ниже, чем у плазмы крови. Величины поверхностного натяжения различных жидкостей следующие:
плазма — 73 дин/см;
кровь — 58 дин/см;
тканевая жидкость — 50 дин/см;
вода при температуре 20 °С — 73 дин/см, при 37 "С — 70 дин/см. Поверхностное натяжение альвеолярного слоя меняется в ходе
дыхательного цикла от 0—5 дин/см в начале вдоха до 50—70 дин/см в его конце. Силы поверхностного натяжения стремятся сократить любую поверхность. Размеры поверхности, ограничивающей какой-то объем, бывают наименьшими при сферической форме. Силы поверхностного натяжения делают альвеолярную сфероидную поверхность минимальной и поэтому действуют в том же направлении, что и эластическая тяга легочной ткани.
На ранних этапах легкие подвержены воздействию повреждающих факторов как через дыхательные пути (аспирационный синдром, утопление, токсические газы и т.д.), так и через легочные сосуды (бактериальные токсины, агреганты клеток крови, иммунные комплексы, микроэмболы, биологически активные вещества, лекарственные препараты при передозировке, в том числе барбитураты, наркотические анальгетики, героин, цитостатики и др.). При одномоментном попадании больших доз эндотоксина в кровоток, особенно если это происходит на фоне предшествующего снижения защитных сил организма, развивается эндотоксический шок.
Возникновение РДСВ возможно и в период поздних проявлений патологического процесса (например, при развернутой картине травматической болезни в связи с развитием перитонита, высоковирулентной раневой инфекции, сепсиса, синдрома длительного раздавливания), когда предпосылками для его развития являются травматический шок, длительная и глубокая гипоксия различного происхождения.
Немаловажная роль принадлежит ишемическому, постгипокси-ческому и травматическому повреждению головного мозга, оказывающему нейротрофическое влияние на легочную паренхиму и син-
30 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
466
тез сурфактанта. Наконец, нельзя исключить и влияния ятрогенных факторов: избыточная неконтролируемая инфузия кровезаменителей, в том числе кристаллоидных.
Таким образом, в патогенез РДСВ вовлечено значительное количество механизмов, однако критическим фактором является повреждение мембраны альвеолярных капилляров и повышение их проницаемости.
РДСВ рассматривается как стадийный процесс. Клиническим проявлениям соответствуют 4 стадии патогенеза.
1-я стадия (фаза) — первичного интерстициального отека легких. Эта стадия может быть определена как «легкое в шоке», в противоположность полностью развившемуся «шоковому легкому». Она представляет собой собственно момент травмы (в широком смысле). После травмы ранние изменения в состоянии легочной ткани сопровождаются значительным потреблением комплемента. В результате общее количество комплемента снижается по меньшей мере в течение 6 ч после травмы. Ранней реакцией на травму и первым этапом иммунного ответа является активация комплемента через альтернативный путь. Патофизиологические исследования подтвердили важность активации комплемента в развитии РДСВ и то, что уровень С5а повышается до того, как РДСВ будет диагностирован клинически,
Развивающаяся гипервентиляция вызывает умеренный сопутствующий алкалоз. Это должно вызвать у клиницистов настороженность в связи с развитием в дальнейшем значительных легочных осложнений. Образующиеся токсины и биологически активные вещества способствуют повреждению эндотелия легочных капилляров. Умеренно проявляется проницаемость альвеолярно-капилляр-ной мембраны, что приводит к началу формирования интерстициального некоронарогенного отека легких. Ранняя выраженная эндогенная интоксикация вызывает нарушения системного и легочного кровообращения.
2-я стадия (фаза) — болезнь гиалиновых мембран. Наблюдается микрососудистый стаз гранулоцитов и тромбоцитов, что является ранним проявлением РДСВ, и связан с активацией системы комплемента. Гранулоциты и их агреганты повреждают капиллярную мембрану, высвобождая токсичные кислородные радикалы — супероксид и перекись водорода, а агрегация тромбоцитов вызывает выраженный спазм легочных сосудов и гладких мышц бронхов, увеличивая проницаемость капилляров. Эта стадия характеризуется гипердинамической реакцией кровообращения с повышением сердечного выброса — СИ 4,5—6 л/(мин/м2)~' и более. При этом изменяетсяи легочная гемодинамика — повышается давление в легочной артерии и в меньшей мере — в легочных капиллярах, что вызывает возрастание работы правого желудочка. Развивается бронхоконстрикция,
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
467
которая предшествует интерстициальному или альвеолярному отеку. У ряда больных появляется пастозность нижних конечностей. На фоне сохраняющейся гипокапнии снижается Ра02, прогрессируют метаболические нарушения, выражающиеся в увеличении показателя BE, особенно в артериальной крови. Поддержание рН в пределах физиологических колебаний происходит за счет гипервентиляции, гипокапнии, перенапряжения дыхательной системы. Это так называемый светлый промежуток, во время которого АД, перфузия тканей и функция почек могут оставаться в пределах нормы, благодаря активации компенсаторных механизмов.
3-я стадия (фаза) — отечно-геморрагический синдром. Резко увеличивается проницаемость альвеолярно-капиллярнои мембраны, что приводит к формированию интерстициального некоронарогенного отека легких. В его основе лежат перегрузка организма кислыми и токсичными метаболитами и истощение (дистресс) метаболических функций легких, ультраструктурные повреждения респираторного эпителия и сурфактантпродуцирующих клеток (пневмоцитов II типа) с развитием ателектазов и нарушения вентиляционно-перфузи-онного соотношения. Повреждение распространяется не только на эндотелий легких, но и на эпителий. Значительное повреждение последнего — неблагоприятный прогностический фактор. В альвеолах обнаруживают отечную жидкость, содержащую большое количество белка и остатки клеток. Белок осаждается в виде гиалиновых мембран. Это приводит к тому, что плевральная полость не в состоянии осуществлять дренажную функцию легких, отечная жидкость аккумулируется и не удаляется из нее по лимфатическим путям.
В связи с шунтированием кровотока в легких Ра02 прогрессивно снижается. Считается, что если Ра02 не превышает 100 мм рт.ст. через 30 мин вентиляции смесью кислорода, то легочной шунт находится в пределах 30—50 %. В этот момент состояние пациента очень серьезное, но еще не критическое. Микроагрегантами в легочных артериолах выступают гранулоциты и тромбоциты, которые повреждают клетки капиллярного эндотелия и дополнительно могут (как сами по себе, так и в комплексе) закупоривать капилляры. Внутрисосудистая агрегация тромбоцитов вызывает выраженный спазм легочного микроциркуляторного русла, повышает проницаемость капилляров в альвеолах и приводит к сокращению дыхательных пространств. Эти процессы могут быть задействованы и при шоке, когда ток крови в микрососудистом русле замедлен. Активируется как система комплемента, так и системы коагуляции, фибринолиза и калликреиновая. Для пациентов, получавших гемотрансфузии, дополнительным предрасполагающим фактором служит клеточный дендрит, находящийся в переливаемой крови. Эти клетки подвергаются цитолизу и высвобождают гидролитические ферменты, дей-
30*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
468
ствующие на легочную ткань. Во время патологического процесса, приводящего к развитию РДСВ, повреждаются пневмоциты II типа. Они снижают выработку сурфактанта, вызывая спадение альвеол и нарушение вентиляционно-перфузионного соотношения.
Взаимосвязь ИВЛ и продукции сурфактанта не так уж проста. Если легкое гипервентилируется или совсем не участвует в вентиляции, в нем сокращается кровоток, снижается продукция сурфактанта, возникает ателектаз. Естественно, что в такой ситуации ИВЛ способствует увеличению легочного кровотока, образованию сурфактанта и является средством ликвидации ателектаза. Но длительная ИВЛ по принципу «вдувания» ведет к деструкции сурфактанта и его замедленному образованию. В данном случае сказывается и токсический эффект кислорода, и уменьшение капиллярного кровотока, который может быть достаточным для газообмена, но слишком малым для питания альвеолярной ткани. Установлено, что чем раньше удается восстановить спонтанную вентиляцию, тем «меньше придется думать об ателектазах и сурфактанте». Вызванное ИВЛ нарушение дренажа дыхательных путей в сочетании со снижением поверхностного натяжения альвеол увеличивает аэродинамическое и эластическое сопротивления, которые мешают своевременно восстановить спонтанную вентиляцию легких.
4-я стадия (фаза) — критическая. У больного развивается гипок-сическая кома и полиорганная недостаточность, проявляющая пече-ночно-почечной недостаточностью, нарушением белкового обмена, водно-электролитного баланса и т.д. Сердечный выброс резко снижен — СИ меньше 1,5 л/(мин/м2)-1 и поддерживается только благодаря медикаментозной терапии (введением допамина). Отмечаются высокие показатели ПСС и ЦВД, которые в этих условиях указывают на недостаточность как правого, так и левого желудочков сердца, выраженные признаки нарушения периферического кровообращения. Параллельно с нарастанием РаС02 становится выраженной ги-поксемия. На этой стадии отдельные альвеолы хорошо перфузиру-ются, но не вентилируются, в то время как другие альвеолы вентилируются, но не перфузируются. Развивается синдром «плотного» легкого.
В целом патофизиологические изменения при РДСВ — это повреждение мембран альвеолярных капилляров агрегантами поли-морфноядерных гранулоцитов, высвобождающих супероксиды, и последующее повышение проницаемости этих мембран, что приводит к выходу жидкости и ее накоплению в легких.
Основные этапы патогенеза РДСВ, развивающегося при генерализованной инфекции, обобщены J.F.Murphy (1995) и представлены на рис. 28.
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
469
Генерализация инфекции
Гуморальный
иммунитет
Нарушение местных
защитных механизмов
Септический шок (полиорганная недостаточность)
Дефицит
сурфак-
танта
Активация нейтрофи-
лов, повреждение эндотелия
легочных капилляров
Интенсификация пе-рекисного окисления липидов
Дисбаланс
протео-
лиза
Выброс биологически активных веществ
Повышение концент рации острофазовых протеинов
Повышение концентрации фибриногена
Z
Острый респираторный дистресс-синдром
Летальный исход
Выздоровление
Гипоксическая кома, полиорганная недостаточность
Фибринозные изменения легких
Очаговая, сливная, плевропневмония, полисегментар-ная инфильтрация легких
Рис. 28
Патогенез РДСВ (J.F. Murfy, 1995)
Инфекционная деструкция легких:
абсцессы легких, плевриты, пиопнев-
моторакс, легочные кровотечения
Остаточные буллезно-склеротичес-кие изменения в легких
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
470
Патоморфология. Патоморфологические изменения в легких имеют ряд сходных изменений вне зависимости от причинного фактора: легкие отечные, безвоздушны, с участками геморрагии, ателектазов и уплотнений. При световой микроскопии выявляют отек и клеточную инфильтрацию межальвеолярных перегородок и интерстици-ального пространства, окружающего воздухоносные пути, а также гиалиновые мембраны во многих участках легких, стаз эритроцитов, тромбоцитарные и гранулоцитарные агрегаты в очагах альвеолярных и интерстициальных геморрагии. Выявляется интенсивная пролиферация альвеолярного эпителия II типа. Увеличивается количество фибробластов и образование коллагена. При этом в альвеолярном пространстве мало нейтрофилов и много лимфоцитов, плазматических клеток, моноцитов и остатков других клеток.
Если РДСВ продолжается более Юсут, то в дополнение к вышеуказанным морфологическим проявлениям присоединяется фиброз легочной ткани, в результате которого развиваются необратимые изменения со стороны дыхательной системы в виде хронической дыхательной недостаточности по типу диффузионно-перфузионных нарушений — фиброзный альвеолит и/или васкулит.
При патологоанатомическом исследовании умерших от сепсиса выявляется картина прогрессирующего «уплотнения» легких вследствие периваскулярного и перибронхиального отека, распространяющегося на интерстиций альвеолярных перегородок и завершающегося альвеолярным отеком. Одновременно наблюдаются признаки диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), дистрофические изменения, вплоть до некроза эндотелия капилляров и эпителия альвеолярной выстилки. На поверхности диффузионной мембраны образуются так называемые гиалиновые мембраны, ограничивающие возможность быстрого восстановления механических свойств легких.
Летальность в определенной степени зависит от причины, вызвавшей РДСВ. При РДСВ, развившемся после аспирации содержимого желудка, летальность составляет 94 %, при возникновении РДСВ при септических состояниях — 78 %, на фоне ожоговой болезни — 50 %, на фоне ДВС-синдрома — 56 %.
Клиника. Клинически РДСВ проявляется артериальной гипотен-зией, малым сердечным выбросом, олигурией, спутанностью сознания, но особенно характерно наличие спонтанной гипервентиляции с гипокапнией и гипоксемией. Все эти признаки могут возникать не сразу, а постепенно (через 24—72 ч) и обусловлены двумя основными факторами: отеком интерстиция и ателектазами альвеол.
Клинику РДСВ рассматривают как стадийный процесс (4 стадии). При этом отмечают соответствие клинических симптомов РДСВ оп-
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
471
ределенным рентгенологическим и морфологическим изменениям в легких.
1-я стадия — первичный интерстициальный отек легких. Симптоматика РДСВ развивается иногда исподволь, постепенно, а в других случаях довольно быстро, уже в первые часы после тяжелой травмы, отравления, заболевания, операции, врачебной манипуляции (переливание крови, перевязка и т.д.) и может достигать максимальной выраженности через 24—36 ч.
В этой стадии состояние больного часто расценивается как средней тяжести. Сознание, кроме случаев травмы головного мозга, как правило, ясное. Нередко наблюдаются эйфория, снижение способности к критической оценке своего состояния, что связано с гипоксией головного мозга. Кожные покровы бледные, иногда с серо-землистым оттенком.
Характерным начальным симптомом является тахипноэ с увеличением дыхательных усилий (инспираторная одышка).
При перкуссии грудной клетки определяется легочный звук с умеренно выраженным притуплением в нижнезадних отделах. Аускультативно над легкими жесткое дыхание, сухие рассеянные хрипы в небольшом количестве. Усилена бронхофония в нижнезадних отделах.
Со стороны сердечно-сосудистой системы отмечается тахикардия. Часто выслушивается акцент II тона над легочной артерией. Уровень АД, как правило, определяется адекватностью коррекции ОЦК, введением вазопрессорных препаратов и довольно часто имеет тенденцию к повышению. Уже эти относительно нерезкие физи-кальные симптомы должны настораживать врача-интерниста.
При рентгенологическом исследовании органов грудной клетки, если нет травматического повреждения легкого, 1-я стадия РДСВ характеризуется малоинтенсивными пятнистыми затемнениями с нечеткими контурами диаметром до 0,3 см, расположенными по периферии, на фоне умеренного снижения прозрачности легочной ткани и значительного усиления легочного рисунка с некоторым увеличением размеров и плотности корней легкого. В целом рентгенологическую картину 1-й стадии трудно отличить от обычного полнокровия, встречающегося при массивной инфузионно-трансфузионной терапии.
При оценке показателей газов крови следует ориентироваться на «равнинные» и «местные» нормы с учетом горных условий. При исследовании газов крови и КОС улиц с инфекционными заболеваниями, огнестрельными ранениями, перенесших шок, кровопотерю, в начальной стадии РДСВ определяется гипоксия смешанного типа.
Учет факторов агрессивного экологического окружения, безусловно, необходим, так как позволяет уточнить влияние дизадап-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
472
тационного синдрома на патогенез и клиническую симптоматику РДСВ у каждого конкретного больного. В экспедициях и особых условиях, включая стихийные бедствия и боевые действия, кроме неблагоприятных экологических факторов, приходится считаться с такими сопутствующими состояниями, как обезвоживание, обессо-ливание, патологический дефицит массы тела (белково-витаминная недостаточность). Указанные факторы обусловливают повышенную «готовность» организма к отеку легких.
Лабораторно определяется накопление недоокисленных продуктов метаболизма тканей и увеличение дефицита оснований (BE) до (6,57 ±1,61) ммоль/л. Развивающийся при этом метаболический ацидоз (рН ниже 7,37) компенсирован за счет напряжения функции внешнего дыхания. Доказательством этого служит снижение содержания диоксида углерода как в артериальной, так и в венозной крови, поддержание Ра02 на пределе физиологических колебаний за счет гипервентиляции, хотя ЖЕЛ составляет лишь (55,8±3) % от должной.
Если воздействие повреждающих патогенетических факторов не купировано, то, как правило, РДСВ переходит во 2-ю стадию.
2-я стадия — болезнь гиалиновых мембран Состояние расценивается как тяжелое. Больные сонливы или возбуждены, могут говорить достаточно долго, но при этом заметно увеличивается частота дыханий, так как при разговоре дополнительно увеличивается вентиляция, а при синдроме «уплотнения» легких на это расходуется свыше 50 % ЖЕЛ. Рот открыт во время вдоха. Это снижает энергетические затраты организма, «цену» дыхания. Выдох происходит через несомкнутые губы, что создает дополнительное сопротивление на выдохе, препятствующее экспираторному закрытию мелких дыхательных путей. Крылья носа участвуют в акте дыхания. На фоне инспираторной одышки у ряда больных определяется бледный цианоз кожи. Значительно чаще выявляется цианоз языка, что связано с особенностями его сосудистой архитектоники (обилие артерий и артериальных сплетений и малое количество вен).
При перкуссии грудной клетки определяются неравномерно «разбросанные» очаги притупления перкуторного звука. При выслушивании легких в зонах притупления — ослабление дыхательных шумов на фоне жесткого дыхания; значительное ослабление дыханияв нижнезадних отделах, где выслушиваются немногочисленные влажные хрипы. Бронхофония более выражена, чем в 1-й стадии.
АД в большинстве случаев имеет тенденцию к повышению. Отмечается упорная тахикардия даже при отсутствии сопутствующей гемодинамически значимой патологии сердца.
Рентгенологическая картина характеризуется усилением мелю очаговой пятнистости, располагающейся по всему легочному полю
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ 473
с преобладанием на периферии, на фоне снижения прозрачности легочной ткани. Эти изменения более выражены, чем в 1-й стадии. Корни легких обычно мало структурны, очертания их несколько сглажены.
ЖЕЛ снижается до 25—30 % от нормы.
3-я стадия — отечно-геморрагический синдром. Состояние пациента, как правило, крайне тяжелое. Отмечается дальнейшее помрачение сознания, сопровождающееся значительным возбуждением, а иногда и бредом. Больные односложно, с видимым усилием отвечают на вопросы, рот постоянно открыт.
Наблюдаются выраженное участие крыльев носа в акте дыхания, несогласованность движений межреберных мышц и подергивания трахеи, участие в дыхании вспомогательных мышц, усиление инспираторной одышки. Тахипноэ достигает 40 и более в 1 мин. Перкуторно определяются большие очаги притупления, над которыми выслушивается бронхиальное дыхание, в остальных отделах — жесткое. Над всеми легкими выслушиваются рассеянные сухие хрипы, а в задненижних отделах — влажные.
Показатели АД и центральной гемодинамики колеблются в широких пределах, что часто связано с мероприятиями интенсивной терапии. Сохраняется выраженная тахикардия.
Появляются признаки нарушения периферического кровообращения: похолодание и бледный цианоз кожных покровов, особенно концевых фаланг пальцев, ушей, носа. Нередки отеки ног и кистей на фоне снижения содержания белка в плазме крови. Появляются или усиливаются имевшиеся признаки почечной и печеночной недостаточности, нарастают метаболические нарушения.
Рентгенологическая симптоматика характеризуется дальнейшим понижением прозрачности легких, преимущественно в области ранее расширенных сосудов. Появляется большое количество сред-неочаговых теней в виде хлопьев различного размера. Тень сердца достаточно хорошо прослеживается. Столь резко выраженные изменения угрожают жизни больного. Поэтому переход к 3-й стадии служит абсолютным показанием к переводу на ИВЛ в режиме оптимально положительного давления в конце выдоха (ПДКВ).
ЖЕЛ катастрофически снижается и достигает 10—15% от нормы. Артериальная гипоксемия (Ра02 ниже 55 мм рт. ст.) сохраняется даже при содержании 80 % кислорода во вдыхаемой газовой смеси (Fi02 = 0,8). рН в пределах должных величин продолжает поддерживаться за счет гипервентиляции, гипокапнии, перенапряжения респираторной системы. О глубине расстройств кислородного режима периферического сектора свидетельствует высокий уровень BE ( — 4,5; — 5,5 ммоль/л и более). Повышается ЦВД, что указывает на
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
474
недостаточность функции правого желудочка сердца на фоне увеличения давления в легочной артерии.
В 4-й стадии РДСВ состояние больных характеризуется как критическое. Нарастает и становится выраженной дыхательная недостаточность. Пациент находится на ИВЛ. Сознание спутанное, прогрессирует гипоксемическая кома. Отмечается артериальная гипо-тензия и предельная тахикардия.
Характерны выраженная одышка и учащенное дыхание, которое можно четко выслушать только в передневерхних отделах. Перкуторно определяется коробочный звук. От нижнего угла или даже от середины лопатки и книзу — резкое притупление перкуторного звука. Аускультативно в этой зоне едва выслушивается дыхание, но много сухих и разнокалиберных влажных хрипов.
Рентгенологически отмечается прогрессирующее затемнение легочных полей. На фоне чрезмерной плотности или «снежной бури» очень сложно выявить пневмонию и абсцедирование легкого, осложняющих, как правило, поздние стадии РДСВ.
Ра02, несмотря на увеличение концентрации кислорода во вдыхаемой смеси, остается на уровне критического (50 мм рт. ст.), РаС02в большей степени зависит от режима ИВЛ.
Критерии диагноза РДВС. Американо-европейская согласительная конференция по РДСВ (1992) рекомендует использовать следующие критерии:
острое начало заболевания;
отношение напряжения кислорода в артериальной крови (Ра02) к фракции кислорода во вдыхаемом воздухе (Fi02) < 200 мм рт. ст., невзирая на уровень положительного давления в конце вдоха (ПДКВ);
двухсторонняя инфильтрация легких на фронтальной рентгенограмме органов грудной клетки;
давление заклинивания в легочной артерии (ДЗЛА) < 18 мм рт. ст.
Для оценки тяжести поражений легких при РДСВ предложен ряд формализованных способов. Чаще всего используют балльную оценку (табл. 29), предложенную J.F. Murray и соавторами (1988, 1994).
Методы диагностики. Общеклинические показатели (анализ крови общий, анализ мочи общий и др.) в значительной степени определяются характером основного заболевания.
Существует ряд биохимических показателей, исследование которых в динамике позволяет четче установить стадию РДСВ, оценить эффективность проводимого лечения и возможный прогноз. Биохимические показатели при РДСВ приведены в табл. 30.
Обязательными являются постоянный ЭКГ-мониторинг и рентгенологическое исследование легких в динамике.
Дифференциальная диагностика РДСВ представляет объектив-
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ
475
Таблица 29. Шкала тяжести поражения легких (J.F. Murray и соавт., 1988, 1994)
Рентгенограмма |
Баллы |
Гипоксия |
Баллы |
Инфильтратов нет Инфильтраты в 1 квадранте Инфильтраты в 2 квадрантах Инфильтраты в 3 квадрантах Инфильтраты в 4 квадрантах |
0 1 2 3 4 |
Pa02/Fi02 >300 Pa02/Fi02 225—299 Pa02/Fi02 175—224 Pa02/Fi02 100—174 PaO„/FiO? <100 |
0 1 2 3 4 |
Необходимость в ПДКВ |
Баллы |
Растяжимость |
Баллы |
ПДКВ 0—5 см вод. ст. ПДКВ 6—8 см вод. ст. ПДКВ 9—11 см вод. ст. ПДКВ 12—15 см вод. ст. ПДКВ >15 см вод. ст. |
0 1 2 3 4 |
>80 мл / см вод. ст. 60—79 мл / см вод. ст. 40—59 мл / см вод. ст. 20—39 мл / см вод. ст. <19 мл / см вод. ст. |
0 1 2 3 4 |
Примечание. ПДКВ — положительное давление в конце выдоха.
Pa02/Fi02 —величина индекса оксигенации.
Степень поражения легких = сумма баллов/число параметров,
использованных при оценке;
0 — поражения легких отсутствуют;
0,1—2,5 — умеренное поражение легких;
выше 2,5 — тяжелое поражение легких.
Таблица 30. Биохимические показатели при РДСВ в зависимости от стадии
Показатели |
Единицы |
Стадия РДСВ |
|||
I |
II |
in |
IV |
||
рсо2 рН Лактат (Л) Пируват (П) Избыток лактата Л/П, отношение С02, содержание BE Физиологический шунт |
мм рт.ст. ед. ммоль/л ммоль/л ммоль/л ммоль/л ммоль/л % к сердечному выбросу |
N Т t N t t N t N |
4, tt tt I tt tt U tt t |
t и tt i tt tt и и tt |
tt ttt U ttt ttt YVV YYY ttt |
Примечание. N — показатель в пределах физиологической нормы; t— показатель выше физиологической нормы; 4— показатель ниже физиологической нормы.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
476
ные трудности. Необходимо исключить все другие возможные причины отека легких.
При альвеолярном отеке легких (острой левожелудочковой недостаточности) отмечаются следующие особенности:
удушье нарастает, а при кашле начинает выделяться пенистая мокрота белого или розового цвета, которая иногда выходит «полным ртом»;
дыхание шумное, на расстоянии слышны клокочущие хрипы на вдохе и выдохе, вследствие чего, образно говоря, диагноз ставят «с порога комнаты»;
больные значительно возбуждены, появляется страх смерти от удушья;
нарастает холодный цианоз;
крепитация быстро сменяется мелкопузырчатыми хрипами, а при заполнении транссудатом бронхов все более крупного калибра — разнокалиберными средне- и крупнопузырчатыми хрипами по всей поверхности легких;
при рентгенологическом исследовании заполнение жидкостью альвеол обусловливает появление негомогенного затемнения, которое занимает средние Щ легочных полей в виде крыльев бабочки. Поскольку при этом полного замещения воздуха не происходит, интенсивность тени меньше.
Крупозную пневмонию от РДСВ отличают:
кашель сухой в начальный период и с выделением слизисто-гнойной, кровянистой мокроты в разгар болезни;
кровохарканье в сочетании с болью в боку — частый признак инфарктной пневмонии;
боль в боку, усиливающаяся при глубоком дыхании и кашле характерна чаще для плевропневмонии (крупозной пневмококковой плевропневмонии);
— отставание при дыхании пораженной стороны грудной клетки. Лечение РДСВ должно быть комплексным, патогенетическим, по
возможности ранним, индивидуализированным. Последнее не исключает, а предполагает разработку и внедрение стандартов оказания неотложной помощи, интенсивной терапии. Чем раньше начата терапия, тем она успешнее.
Учитывая особую сложность диагностики и лечения РДСВ, пациентов с этим синдромом необходимо госпитализировать в отделения интенсивной терапии и реанимации, оснащенные современным оборудованием, позволяющим осуществлять мониторинг и экспресс-контроль за всеми жизненно важными органами, искусственное поддержание функций легких, почек, печени и сердца и др.
Важное значение имеет полноценное питание, а если искусственное, то по возможности энтеральное.
1-я стадия— необходимо выявлять и лечить основное заболева-
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ ВЗРОСЛЫХ 477
ние и предупреждать развитие РДСВ. Своевременное устранение гипотензии, гипоксии и интоксикации в большинстве случаев позволяет предупредить развитие и/или снизить тяжесть респираторных нарушений.
Назначают нестероидные противовоспалительные и антигиста-минные препараты.
Так, интерес представляют новые факты, касающиеся изменений тканей в зоне молекулярного сотрясения. Оказалось, что эти изменения можно характеризовать как свободнорадикальный механо-химический процесс, а в комплексной терапии эффективны антиок-сиданты. Данное направление фармакотерапии оказалось полезным и при лечении РДСВ, развившемся на фоне других патологических состояний.
Перспективным является упреждающее применение при угрозе развития РДСВ экстракорпоральной детоксикации, оксигенобаро-терапии, лазерного и ультрафиолетового облучения крови.
2-я стадия— гипотензия является показанием к назначению значительных доз кортикостероидов: гидрокортизона до 1 г, преднизо-лона до 10—15 мг/кг и более. При этом необходимо быстрое устранение дефицита объема циркулирующих эритроцитов и плазмы (гемоглобин должен быть не ниже 100 г/л).
Программа лечения включает респираторную терапию, направленную на предупреждение микроателектазирования с дегидратацией легочной паренхимы (обоснованное ограничение инфузион-ной терапии и спонтанное дыхание с ПДВ), предупреждение и лечение микроэмболизации легких (гепарин 1000 ЕД/ч, реополиглюкин до 10 мл/кг в сочетании с тренталом).
Целесообразно подавление отрицательных нейротрофических воздействий на легочную паренхиму, если таковые есть (эпидураль-ная анестезия, ретроплевральные блокады местными анестетиками либо введение пентамина с миотропными спазмолитиками — эуфил-лином, ксантинолом).
Проводится массивная эмпирическая антибактериальная терапия коротким курсом, перекрывающая весь спектр возможных инфекционных возбудителей. В последующем, после идентификации инфекции, назначают этиотропные антибиотики. При этом обязателен мониторинг за бронхолегочной инфекцией; необходимо проводить посевы крови на содержание бактериальной флоры и определять ее чувствительность к антибиотикам.
3-я стадия— при клинических и рентгенологических признаках прогрессирования РДСВ, т.е. при переходе в 3-ю стадию, показан перевод на ИВЛ в режиме гипервентиляции (MOB 12—15 л/мин) с ПДКВ 5—10 см вод. ст. или создание положительного давления (плато) на вдохе, составляющего 20—30% от времени вдоха. Проведение
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
478
длительной ИВЛ требует специальных мер по защите бронхиального дерева (кондиционирование дыхательной смеси, аспирация мокроты, постуральный дренаж, массаж грудной клетки, применение опиатов, сибазона и др.).
Проводят коррекцию показателей центральной и периферической гемодинамики под контролем мониторинга ЭКГ, давления в легочной артерии, ЦВД, динамической рентгенографии грудной клетки, показателей систем гемостаза и фибринолиза (тромбоциты, фибриноген, D-димер фибриногена, антитромбин III, активированное частичное тромбопластиновое время и др.), кислородной емкости крови, КОС, коллоидно-осмотического давления плазмы крови.
При появлении признаков сердечной недостаточности используют инотропную стимуляцию сердца допамином, добутамином на фоне различных (в зависимости от показаний) вариантов разгрузки сердца: объемной (фуросемид), гемодинамической (препараты нитроглицерина, ингибиторы АПФ), нейрогуморальной ((3-адренобло-каторы, альдактон). Проводят коррекцию электролитных нарушений (К+, Na+, Mg2+, Ca2+, C1").
4-я стадия— учитывая критическое состояние больного, лечение проводят по тем же принципам, что и в 3-й стадии, с постоянной коррекцией всех гемодинамических показателей.
В настоящее время концепция РДСВ представляется как развивающееся учение, которое постоянно обогащается новыми данными относительно этиологии, патогенеза, клиники, диагностики и лечения инфекционных болезней и их осложнений, отравлений, разных видов травм.
Следует также отметить важность создания таких организационно-методических условий, когда в лечении больного с РДСВ принимают постоянное участие, помимо анестезиолога-реаниматолога, также терапевт, инфекционист, хирург, пульмонолог, кардиолог и другие специалисты.
Прогноз при РДСВ зависит:
от причины;
своевременности начатого лечения;
от клинической стадии РДСВ (1—2-я стадии — благоприятный исход, 3—4-я стадии — часто неблагоприятный);
— исходного состояния функции системы органов дыхания.
Если РДСВ развился на фоне употребления/передозировки наркотиков, прогноз более оптимистичен, чем у больных с шоком или с мультиорганной патологией.
Профилактика. Предупреждение развития РДСВ заключается в возможном исключении причин, его вызвавших, и в своевременно начатом лечении с целью исключения его дальнейшего развития.
ОТЕКЛЕГКИХ
479
Отек легких
Отек легких — тяжелое осложнение самых разнообразных заболеваний, обусловленное избыточным пропотеванием плазмы крови в интерстициальную ткань, а затем в альвеолы и последующим развитием дыхательной недостаточности. Клинически отек легких характеризуется тяжелым удушьем, цианозом и клокочущим дыханием.
Лат. — oedema pulmonum.
Англ. — pulmonary edema.
Первые клинические описания отека легких относятся к середине XVIII в. (A.R. Maloet, 1752; Z. Barrere, W.M. Albertini, 1753). Определение отека легких как «инфильтрации сыворотки в ткань этого органа в такой степени, что ее проходимость для воздуха при дыхании явно уменьшается», дано М. Laennec в 1819 г.
В последующие годы изучались клиника и лечение отека легких при различных заболеваниях. Так, в 1864 г. A.D. Legendre описал клиническую картину отека легких при заболеваниях почек. Затем появились первые сообщения, посвященные изучению патогенеза отека легких, в частности теория повышенной проницаемости легочных капилляров (В. Cohnheim, R.L. Lichtheim, 1877), а также острой недостаточности левого желудочка (R.Z. Welsch, 1878).
В XX в. значительно возрос интерес к изучению различных аспектов отека легких. Исследования кардиологов посвящены выяснению механизмов этого синдрома при инфаркте миокарда, гипертонической болезни, атеросклерозе; невропатологов — при остром нарушении мозгового кровообращения, травме черепа; хирургов — при операциях на органах брюшной полости и грудной клетки; педиатров — при остром гломерулонефрите или ревматическом кардите; инфекционистов — при гриппе, пневмонии, менингококковой инфекции, вирусном гепатите и др.
Отек легких представляет непосредственную угрозу жизни больных, осложняя течение ряда заболеваний. Так, по данным I. Sova и соавторов (1989), это осложнение выявляется у 26,3% умерших в клинике внутренних болезней. Поданным G.R. Cameron (1994), частота атонального отека легких при артериальной гипертензии любой этиологии (исключая поражение почек) составляет 86 %, при заболеваниях почек — 74 %, при инфаркте миокарда — 68 %, при мозговом инсульте — 67 %, при митральном стенозе — 65 %, при переломе черепа, множественных переломах костей — 62 %, при тромбоэмболии легочной артерии — 31 %.
Отек легких — один из наиболее грозных синдромов, с которым
КРИТИЧЕСКИЕ СОСТОЯНИЯ Б КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
480
встречается врач почти любой специальности. Так, на догоспитальном этапе в условиях работы скорой медицинской помощи, по данным Н.С. Гильмар и соавторов (1987), 6,5 % от общего числа вызовов составляют вызовы к больным с отеком легких.
Отсутствие единой точки зрения на патогенез, а следовательно, и на терапевтические мероприятия при отеке легких обусловливают неослабевающий интерес к изучению этой патологии.
В последние годы значительно увеличилось количество опубликованных работ о легочном отеке; в эти же годы состоялось несколько посвященных ему конференций, съездов, симпозиумов (Япония, Англия, Россия, Франция, США).
Несмотря на достигнутые успехи в изучении различных аспектов этой проблемы, вопросы патогенеза и рациональной терапии данного синдрома сохраняют свою актуальность.
Патогенез. Многофакторность механизмов, участвующих в развитии отека легких, обусловливает сложный патогенез этой патологии. И все же его основу составляют механизмы нарушения обмена воды, которые свойственны отеку вообще.
Обмен жидкости между сосудами и тканями происходит через капиллярную стенку. Эта стенка является довольно сложной биологической структурой, способной транспортировать воду, электролиты и некоторые органические соединения и задерживать белки. Вследствие этого концентрация белков в плазме крови составляет 64—83 г/л, а в тканевой жидкости — до 15—30 г/л.
Сущность развития отека легких заключается в обильном про-потевании жидкой части крови в легочную ткань, а затем — в альвеолы, которое не уравновешивается ее обратным всасыванием в кровяное русло. При отеке легких транссудат крови переходит в альвеолы, где, смешиваясь с воздухом, образует стойкую пену (из 100 мл жидкости образуется 1000—1500 мл пены), которая заполняет воздухоносные пути и препятствует доступу кислорода в газообменную зону легких и к альвеолярно-капиллярной мембране. В результате нарушается оксигенация крови в легких и развивается гипоксия, которая осложняет течение основного заболевания и по механизму «порочного круга» нередко обусловливает прогрессиро-вание отека легких.
Существенным фактором патогенеза отека легких является кол-лабирование (спадение) альвеол. В норме поверхность альвеолы изнутри покрыта поверхностно-активным веществом липопротеидной природы — сурфактатом, который уменьшает поверхностное натяжение альвеол, сохраняя их структуру. При отеке легких пена вымывает некоторую часть сурфактанта, что приводит к спадению альвеол. Располагаясь в виде тонкой пленки на поверхности газовых пузырьков, сурфактант почти полностью нейтрализует поверхностное
ОТЕК ЛЕГКИХ
481
натяжение окружающей жидкости, что придает пене еще большую стабильность, и блокирует переход газов через альвеолярную мембрану. С началом пенообразования сокращается и воспроизводство сурфактанта. Закупорка альвеол пузырьками пены уменьшает общую эффективную площадь газообмена, что ведет к местной гипоксии. А любой патологический процесс, вызывающий альвеолярную гипоксию, нарушает, по-видимому, воспроизводство сурфактанта, создавая тем самым предпосылки для развития отека легких.
Независимо от причины выделяют несколько основных факторов, определяющих возникновение и развитие отека легких:
увеличение гидростатического давления в легочных капиллярах;
повышение проницаемости альвеолярно-капиллярных мембран;
снижение онкотического давления плазмы крови;
нарушение лимфооттока.
Появление одного из указанных факторов или их сочетание ведет к развитию отека легких при различных патологических состояниях
(табл.31).
Таблица 31. Причины и факторы развития отека легких (А.Н. Пархоменко ,1996)
Повышение капиллярного давления в легких |
|
Венозная гипертен- |
• Левожелудочковая недостаточность (инфаркт |
зия |
миокарда, кардиосклероз, гипертонический |
|
криз, кардиомиопатии, аортальный стеноз, не- |
|
которые врожденные пороки, др.) |
|
• Митральный стеноз |
|
• Локальный и/или констриктивный перикар- |
|
дит |
|
• Миксома левого предсердия |
|
• Тромбоз левого предсердия |
|
• Тромбоз легочных вен |
Капиллярная гипер- |
• Гипоксические состояния (высокогорье, про- |
тензия легких при |
фессиональные условия) |
нормальном веноз- |
• Увеличение объема плазмы крови |
ном давлении |
|
Острая легочная ги- |
Гиперкинетический статус (тиреотоксикоз) |
пертензия |
Тромбоэмболия легочной артерии |
|
Коллагеновые заболевания |
|
Идиопатическая легочная гипертензия (болезнь |
|
Аэрза) |
|
Вследствие высвобождения катехоламинов (за- |
|
болевания ЦНС, др.) |
31—2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
482
Продолжение табл.31
Снижение осмотического давления плазмы крови
Гипопротеинемия • Нефротический синдром
Печеночная недостаточность
Синдром малого всасывания
Энтеропатия с потерей протеинов
Сниженное питание Гипергидратация • Почечная недостаточность
Недостаточность надпочечников
Гипервазопрессинемия
Нарушение проницаемости капилляров
Высвобождение биологически активных веществ (катехоламины, гистамин, брадикинин, серотонин, метаболиты арахидоновой кислоты)
Воспалительный и иммунный ответ при гипо-волемическом шоке и закрытой травме тела, тяжелой легочной инфекции, септицемии, геморрагическом панкреатите, др.
Прямое химическое воздействие (гипоксия, отравление кислородом, дымом, соединениями аммиака, двуокиси серы и др.)
Недостаточность клиренса лимфы (лимфатическая обструкция)
Медиастинальная обструкция (опухоли средостения)
Карциноматозная лимфатическая инфильтрация
Соединительнотканные или воспалительные заболевания
Длительная неадекватная вентиляция легких с положительным дыханием на выдохе
Чаще всего отек легких развивается вследствие острого повышения гидростатического давления в сосудах малого круга кровообращения. Это наблюдается при хронической сердечной недостаточности в результате повышения диастолического давления в левом желудочке, развития легочной гипертензии и вторичного роста венозного возврата крови к сердцу, у больных ИБС при остром инфаркте миокарда, при тромбоэмболии легочной артерии, остром миокардите, атеросклеротическом кардиосклерозе, пороках сердца и др.
ОТЕКЛЕГКИХ
483
Слабость левого желудочка может быть обусловлена острым нарушением ритма сердца (пароксизмальная тахикардия, желудочковая тахикардия и т.д.), при этом наблюдается повышение внутрисо-судистого гидростатического давления.
Повышение гидростатического давления в системе легочных вен и артерий возможно и за счет некардиогенных причин. Оно может повыситься в результате заболеваний и травм ЦНС — внутримозго-вых кровоизлияний, черепно-мозговой травмы, тромбоза или эмболии мозговых сосудов, отека мозга, припадков различного происхождения, хотя патогенез этого вида отека легких не совсем ясен.
Отек легких может быть вызван острой гиперволемией вследствие массивной трансфузионной терапии без учета сопутствующих заболеваний, особенно у больных пожилого возраста, при нарушении функции почек, сердечной недостаточности или гиперальдостеро-низме. Быстрое введение больших объемов, особенно охлажденных, кристаллоидных или коллоидных растворов может повысить гидростатическое давление в легочных капиллярах за счет рефлекторного раздражения барорецепторов сосудистой стенки. Массивная инфузионная терапия требует соблюдения важнейших условий: измерение ЦВД и диуреза, расчета водного баланса. Предупредить это осложнение позволяют также правильная оценка ряда показателей (АД, ЦВД, ЧСС, осмолярность плазмы крови и мочи, темп диуреза).
При обструкции верхних дыхательных путей, наблюдаемой вследствие ларингоспазма, стенозирующего отека гортани, трахео-бронхита при различных инфекционных заболеваниях (грипп, дифтерия, энтеровирусные заболевания и др.), снижается гидростатическое давление в интерстициальном пространстве легких при росте отрицательного внутриплеврального давления.
В механизме развития отека легких значительное место занимают изменения коллоидно-осмотического давления. Воду в сосудах удерживают белки плазмы крови (в норме 74 г/л), создающие определенное онкотическое давление крови. Важную роль играют также нарушения физиологического соотношения гидростатического давления и КОД в сосудах легких. В норме гидростатическое давление в капиллярах легких равно 8 мм рт. ст., а КОД, создаваемое белками плазмы, — 25 мм рт. ст. Разность этих показателей, составляющая 17 мм рт. ст., предупреждает выход воды из легочных сосудов в ин-терстициальное пространство легких. При изменении этой разницы, значительном повышении гидростатического давления в легочных капиллярах или резком снижении КОД происходит заметная транссудация жидкости в интерстициальное пространство, а затем — в альвеолы. В случаях одновременного повышения гидростатического давления и уменьшения КОД увеличивается разность показателей, что является фактором развития отека легких. Если снижается раз-
31*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
484
ность гидростатического давления и КОД, увеличивается фильтрация воды в легкие. Таким образом, развитие отека легких может зависеть как от уменьшения КОД, так и от увеличения гидростатического давления либо от обоих факторов.
Важное значение в развитии отека легких отводится состоянию их лимфатического дренажа. При недостаточном оттоке лимфы в ответ на незначительное повышение гидростатического давления у больных может развиться клиника отека легких, тогда как при достаточном лимфооттоке такое же повышение давления вызывает лишь незначительную одышку.
Одной из причин отека легких может быть значительное повышение давления в дыхательных путях или большие перепады внут-ритрахеального давления при ИВА, что способствует росту гидростатического давления.
В настоящее время описан «высотный отек легких», возникающий при быстром подъеме на высоту более 3—5 км над уровнем моря, вследствие альвеолярной гипоксии, являющийся гидростатическим по природе.
В патогенезе отека легких при токсикозе беременных значительную роль играют задержка жидкости в организме, повышение проницаемости тканевых барьеров и нарушение кислородного режима организма на фоне гиподинамических и почечных расстройств.
Токсический отек легких возникает после вдыхания промышленных или бытовых ядов (фреон, пары фосгена, оксиды углерода, метан, хлор и др.) в результате непосредственного повреждения легочного эпителия.
Развитию отека легких может способствовать снижение онкот ческого давления крови, возникающее в результате воспалительных и онкологических заболеваний, а также при гиперволемии вследствие лечебных мероприятий, приводящих к гипопротеинемии и ги-поальбуминемии.
Повышение проницаемости альвеолярно-капиллярного барьер является ведущим фактором в патогенезе отека легких, наблюдаемом при респираторном диспресс-синдроме взрослых (РДСВ), который развивается вследствие активации каскада воспалительных реакций с накоплением гранулоцитов в микроциркуляторном русле и повреждением эндотелия. В результате этого в легочную ткань проникает не только вода, но и небольшие ионы, протеины. Эта форма отека легких встречается при таких инфекционных заболевания!, как грипп, кокковые инфекции, при анафилактическом шоке, а также при эндогенной (печеночная недостаточность, уремия) или экзогенной интоксикации (отравления промышленными или бытовым ядами).
В клинике инфекционных болезней отек легких, как правило,
ОТЕК ЛЕГКИХ
485
обусловлен повышением проницаемости альвеолярно-капиллярной мембраны вследствие воздействия бактериальных и вирусных токсинов с последующим выделением биологически активных веществ, повышающих тканевую проницаемость (ацетилхолин, катехолами-ны, гистамин, серотонин, гиалуронидаза и др.), а также механическим растяжением легочных капилляров.
В частности, вирус гриппа после внедрения в клетки верхних дыхательных путей и его репродукции разрушает эти клетки с освобождением токсина и продуктов метаболизма. В результате этого происходит агрегация тромбоцитов и блокада тромбоцитарными пробками капилляров с нарушением в них микроциркуляции, которая наиболее выражена в легких. Нарушение микроциркуляции вызывает застойные явления и образование мелкоочаговых ателектазов в легких. Блокада сосудов микроциркуляторного русла способствует усилению гипоксии, развитию коагулопатии потребления, нарушению сосудистой проницаемости, диапедезу эритроцитов и выходу жидкой части крови в интерстициальное пространство и альвеолы. ДВС-синдром в стадии глубокой гипокоагуляции является одним из элементов патогенеза отека легких при гриппе. Имеет значение и альвеолярная гипоксия, развивающаяся при воспалительных и деструктивных процессах в легочной ткани, при острой обструкции дыхательных путей, ларингоспазме или при их сочетании. Эти явления могут наблюдаться при парагриппе, аденовирусной и респира-торно-синцитиальной инфекции, энтеровирусных заболеваниях в результате диффузного воспаления трахеи, бронхов, бронхиол, обструкции их просвета вязкой слизью и как следствие — острое нарушение проходимости в нижних отделах дыхательных путей.
Нарушение проницаемости сосудистой и альвеолярной стенок является ведущим механизмом развития отека легких при эндогенных интоксикациях на фоне инфекционных заболеваний: печеночная недостаточность при вирусных гепатитах, лептоспирозе и т.д. При вирусных гепатитах отек легких наблюдается в случаях развития печеночной недостаточности с массивным некрозом печени. Основными причинами его развития являются нарушение важнейших функций гепатоцитов, в частности белковообразующей, и метаболизма аммиака, накопление в крови повышенного количества аминокислот и продуктов их окисления — фенолов и аминов, вызывающих поражение дыхательной и других систем организма с явлениями повышения проницаемости сосудистой и альвеолярной стенок.
Причиной развития отека легких может быть диффузное поражение капиллярных стенок эндотоксинами при тяжелом течении таких инфекционных заболеваний, как тифы, чума, дифтерия, грипп и др.
В патогенезе отека легких у больных инфекционными болезнями важное значение придается воздействию токсинов на вегетативные
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
486
центры и миокард, в результате которого развиваются миокардит и левожелудочковая недостаточность, способствующие повышению гидростатического давления в капиллярах малого круга кровообращения, их расширению, увеличению фильтрационной поверхности малого круга.
В физиологических условиях гидростатическое давление крови в артериальном конце капилляра равно в среднем 25 мм рт. ст., а в легочных капиллярах — 7—9 мм рт. ст. Следовательно, даже незначительное его увеличение в легочном сосудистом русле неизбежно создает условия для избыточной транссудации жидкости в интер-стициальное пространство. Этот процесс может значительно усиливаться при повышенной проницаемости стенки капилляров, что постоянно наблюдается при инфекционных заболеваниях (грипп, лептоспироз, чума, пневмония, сыпной тиф, геморрагические лихорадки, сепсис и др.).
Тяжелый отек легких возникает иногда как следствие аллергической реакции на введение лекарственных препаратов (антибиотики, сыворотки, инсулин, препараты йода и др.) и может развиться после приема внутрь или парентерального введения минимальных их доз. Ведущее значение в патогенезе аллергического отека легких имеет резкое повышение проницаемости капилляров под влиянием гуморальных факторов (гистамин, серотонин и др.), высвобождающихся в большом количестве из разрушенных лаброцитов (тучных клеток) и тромбоцитов в момент анафилаксии.
Одной из причин отека легких является глубокое угнетение функции дыхательного центра (менингиты, энцефалиты), приводящее к альвеолярной гипоксии, с последующим нарушением тонуса легочных сосудов, регулирующих Р02 в альвеолах.
Важную роль в формировании отека легких отводят диссемини-рованному внутрисосудистому свертыванию — ДВС-синдрому (сепсис, лептоспироз, менингококковая инфекция, чума, малярия и др.), вызывающему нарушение микроциркуляции, развитие гипоксии, выделение биологически активных веществ, повышающих тканевую проницаемость.
Морфологические изменения при отеке легких разделяют на две стадии: интерстициального и альвеолярного отека.
Первая стадия (интерстициальный отек) морфологически характеризуется расстройством микроциркуляции, набуханием стенки капилляров, дистрофией, некрозом эпителия и альвеолоцитов, скоплением жидкости в периваскулярной и перибронхиальной областях; местами обнаруживаются фибрин, макрофаги и эритроциты.
При альвеолярной стадии встречаются очаги кровоизлияний и ателектазов, краевое стояние лейкоцитов и агрегация тромбоцитов. Альвеолярная стенка утолщается за счет отека, небольшого количе-
ОТЕК ЛЕГКИХ
487
ства лейкоцитов, лимфоидных клеток и макрофагов, которые располагаются преимущественно вокруг капилляров. В просвете альвеол содержится отечная жидкость с примесью десквамированных макрофагов и единичных лейкоцитов, а также волокон фибрина.
Если отек легких затяжной или часто рецидивирует, то наблюдаются диапедез эритроцитов, а позднее — склероз межальвеолярных перегородок.
Классификация. По длительности течения отека легких различают:
молниеносный— приводит к летальному исходу в течение нескольких минут;
острый (до 4 ч) — обычно наблюдается при инфаркте миокарда, черепно-мозговой травме, анафилактическом шоке и др. Клинически характеризуется столь бурным течением, что даже немедленные реанимационные мероприятия не всегда предупреждают летальный исход;
подострый— отличается волнообразным течением: симптомы его нередко нарастают постепенно, то усиливаясь, то ослабевая. Чаще это свойственно эндогенной интоксикации (печеночная недостаточность, уремия и др.);
затяжной (от 12 ч до нескольких суток) — возникает, если заболевание протекает на фоне хронической сердечной недостаточности, хронических неспецифических заболеваний легких. При этом такие характерные клинические признаки отека легких, как одышка, цианоз, пенистая мокрота и влажные хрипы в легких, могут отсутствовать.
Пусковые механизмы лежат в основе клинической классификацииотека легких. С учетом этого выделено три основные клинические формы отека легких:
токсический отек— обычно наблюдается при таких инфекционных заболеваниях, как грипп, пневмония и другие кокковые инфекции, дифтерия, корь, вирусный гепатит и др., в результате поражения альвеолярно-капиллярных мембран токсинами и повышения их проницаемости. Эта форма отека характерна также для отравлений бытовыми и промышленными ядами (аммиаком, хлором, угарным газом, сероводородом, парами кислот, фосгеном и др.);
кардиогенный отек— может развиться при остром инфаркте миокарда, митральном или аортальном пороке сердца, гипертоническом кризе, остром гломерулонефрите, гипергидратации. Эта форма отека легких развивается вследствие резкого повышения давления в капиллярах легочной артерии, уменьшения оттока крови из малого круга кровообращения или увеличения ее поступления в систему легочных артерий;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
488
— неврогенный отек — встречается как осложнение заболеваний ЦНС (черепно-мозговая травма, острое нарушение мозгового кровообращения, опухоли мозга, эпилептический припадок, гнойные менингиты, коматозные состояния различной этиологии).
Клиника. Патофизиологически различают интерстициальную и альвеолярную стадии отека легких, каждая из них имеет свои клинические особенности.
Интерстициальный отек легких (сердечная астма) нередко наблюдается вследствие психоэмоционального напряжения, при перемене положения больного из вертикального в горизонтальное, переохлаждении, при этом легочный объем крови увеличивается в среднем на 300—350 мл. Интерстициальный отек легких может проявиться внезапно, остро, в виде приступа сердечной астмы, иногда — под-остро, в течение нескольких часов; приступ начинается в любое время суток, но чаще в ночные или предутренние часы. Появляются головокружение и головная боль, чувство сдавления в груди, одышка, которые усиливаются при малейшем физическом напряжении. Дыхание становится затрудненным, больной принимает типичное вынужденное положение с фиксацией плечевого пояса (сидит, спустив ноги на пол и опираясь руками о край кровати), плечи при этом приподняты, а голова запрокинута назад (положение ортопноэ).
Одышка перерастает в удушье, частота дыханий достигает 40— 60 в 1 мин. В акте дыхания участвуют вспомогательные дыхательные мышцы. В связи с ощущением нехватки воздуха больной открывает все окна и двери или пытается подойти к открытому окну, Появляется сухой, поверхностный или надсадный кашель.
Характерно возбуждение, большинство больных испытывают страх смерти. Сознание нередко помрачено. Лицо резко гипереми-ровано (при бактериальной пневмонии, артериальной гипертензии и т.д.) или может быть бледным (при почечной недостаточности, артериальной гипотензии и т.д.), крылья носа раздуваются, появляется цианоз кожи и слизистых оболочек, усиливается потоотделение; конечности холодные.
Перкуторно над легкими определяется тимпанический звук или несколько укороченный над нижними отделами легких, а при аус-культации — большое количество сухих свистящих хрипов по всем отделам легких. Дыхание усиленное, громкое. Отсутствие на этом этапе влажных хрипов объясняется, вероятно, накоплением отечной жидкости в межуточной ткани. Затем появляются мелко- и сред-непузырчатые хрипы, сначала — в нижних отделах легких, но быстро распространяются вверх (вследствие наличия пены в альвеолах и терминальных бронхах). АД чаще повышено, характерна тахикар-
ОТЕК ЛЕГКИХ
489
дия, тоны сердца выслушиваются с трудом из-за шумного дыхания и хрипов.
Альвеолярный отек легких обусловлен проникновением транссудата в полость альвеол и пенообразованием и характеризуется резкой дыхательной недостаточностью. В связи с этим дыхание становится шумным, клокочущим, слышным на расстоянии нескольких метров. Больной чаще сидит, беспокоен, сознание спутанное. Кожные покровы влажные, лицо одутловатое, вены шеи набухшие. Пульс слабого наполнения и напряжения, частый— до 120—140 в 1 мин. АД вначале нормальное или нерезко повышено, затем диасто-лическое остается повышенным, а систолическое резко падает.
Над легкими выявляется отчетливое притупление перкуторного звука с участками тимпанита, при аускультации — разнокалиберные влажные хрипы (мелко-, средне- и крупнопузырчатые). Во время кашля и/или выдоха выделяется пенистая мокрота, нередко розового цвета за счет проникновения в альвеолы форменных элементов крови, что характерно для гриппа, крупозной пневмонии. Тоны сердца резко приглушены, часто не прослушиваются из-за шумного дыхания и обилия хрипов в легких. Сохраняется тахикардия, но уже с частыми экстрасистолами, иногда выслушивается ритм галопа. Тахипноэ до 40 в 1 мин. В крови отмечается выраженный метаболический ацидоз.
В терминальной стадии усиливаются беспокойство и возбуждение. Сознание спутанное или отсутствует. Дыхание типа Чейна— Стокса. Пульс становится нитевидным, АД прогрессивно снижается. Смерть наступает в результате асфиксии.
Аллергический отек легких может развиться уже через несколько секунд после попадания в кровь антигена, при этом появляется ощущение зуда и покалывания в руках, лице, языке. Затем возникают чувство сдавления в груди, одышка, слабость, боль в области сердца. Возникает и быстро нарастает акроцианоз. Над легкими сначала в нижних долях, а затем с быстрым распространением на всю поверхность легочных полей прослушиваются влажные хрипы. Возможны тошнота, рвота, боль в области поясницы, судороги.
Исходы. Независимо от формы проявления прогноз отека легких всегда очень серьезен. Острый альвеолярный отек легких нередко заканчивается летально в результате прогрессирующей асфиксии.
Благополучное купирование приступа еще не исключает рецидива отека легких, а также развития в дальнейшем гипостатической пневмонии, ателектазов или тяжелой недостаточности кровообращения.
Затяжной отек легких может переходить в острый и заканчиваться летально.
Общая летальность при альвеолярном отеке легких составляет
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
490
20—50 %. При сочетании отека легких с ИТШ или анафилактическим шоком летальность превышает 90 %.
Методы диагностики. Диагноз отека легких ставится в основном на характерных клинических признаках. Лабораторные и рентгенологические исследования имеют лишь вспомогательное значение. Так, показатели общего анализа крови, мочи и другие зависят от нозологической формы основного заболевания.
При биохимическом исследовании крови выявляют дыхательный алкалоз, сменяющийся дыхательным ацидозом.
Критерии диагноза. При постановке диагноза следует основываться на таких данных:
1. Интерстициальный отек легких (сердечная астма):
обычно острое начало с ощущения нехватки воздуха — удушья, сопровождающегося страхом смерти;
характерное положение больного в постели (сидит, опустив ноги, опираясь руками о кровать, плечи приподняты, а голова откинута назад — ортопноэ);
страдальческое выражение лица;
кожа лба, шеи и туловища гиперемирована, нередко с цианозом, покрыта каплями пота;
обычно психомоторное возбуждение, сознание помрачено;
тахипноэ до 30—40 в 1 мин;
тахикардия, тоны сердца глухие, иногда выявляется ритм галопа;
застойные хрипы в нижних отделах легких;
при рентгенологическом исследовании легких в прямой и боковых проекциях выявляются понижение прозрачности прикорневых отделов, нечеткость легочного рисунка, расширение ин-терлобарных перегородок, а также перибронхиальные и пери-васкулярные «манжеты» вследствие накопления транссудата в межуточной ткани.
2. При альвеолярном отеке легких дополнительно наблюдаются:
клокочущее дыхание, слышное на расстоянии нескольких метров;
одышка, тахипноэ до 60 в 1 мин, вдох и выдох чередуются без заметных пауз;
обильная пенистая мокрота, нередко розового цвета;
увеличение размеров относительной тупости сердца, глухость тонов, ритм галопа; выраженная тахикардия;
АД чаще повышено, но может быть нормальным или даже пониженным;
над легкими выслушиваются разнокалиберные влажные хрипы;
снижение диуреза;
ОТЕКЛЕГКИХ
491
— при рентгенологическом исследовании: часто выявляется изменение конфигурации сердца; симметричное гомогенное затемнение высокой интенсивности в центральных отделах легочных полей или диффузные тени различной интенсивности и протяженности. Дифференциальный диагноз. Клиническая картина острого ин-терстициального отека легких сходна с приступом бронхиальной астмы, что нередко требует тщательной дифференциальной диагностики, основные критерии которой представлены в табл. 32.
Таблица 32. Дифференциальная диагностика сердечной и бронхиальной астмы
Основные показатели |
Приступ сердечной астмы |
Приступ бронхиальной астмы |
Причины приступа |
Обычно психическое |
Психогенный фактор, |
|
и/или физическое на- |
контакт с аллергеном, |
|
пряжение, перемена |
обострение воспалитель- |
|
положения туловища |
ного процесса в органах |
|
из вертикального в го- |
дыхания, изменение ме- |
|
ризонтальное |
теорологических условий |
Предшествующие |
Заболевания сердеч- |
Хронические бронхоле- |
заболевания |
но-сосудистой систе- |
гочные заболевания, пов- |
|
мы или почек: ИБС, |
торные пневмонии, ва- |
|
острый инфаркт мио- |
зомоторный ринит. Ал- |
|
карда, гипертоничес- |
лергические заболевания |
|
кая болезнь, митраль- |
(сенсибилизация к раз- |
|
ный или аортальный |
личным медикаментам, |
|
порок сердца, гломе- |
повышенная чувстви- |
|
рулонефрит и др. |
тельность к всевозможным запахам и т.д.) |
Одышка |
Чувство нехватки воздуха, преимущественно затруднен вдох |
Экспираторная |
Цианоз |
Акроцианоз |
Центральный |
Бронхоспазм |
Отсутствует или вторичный |
Первичный |
Мокрота |
Отсутствует |
Стекловидная, вязкая, выделяется в конце приступа |
Аускультативные |
Шумное дыхание |
Обильные рассеянные |
данные |
|
сухие хрипы, свистящие и жужжащие хрипы преимущественно на выдохе |
КРИТИЧЕСКИЕ СОСТОЯНИЯ Б КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
492
Продолжение табл. 32
Основные показатели |
Приступ сердечной астмы |
Приступ бронхиальной астмы |
Сердечно-сосудистая система Эозинофилия Рентгенологические данные Лечебный эффект |
Обычно недостаточность левого желудочка Отсутствует Смазанность легочного рисунка, понижение прозрачности прикорневых отделов легких Наркотические анальгетики, а-адренобло-каторы,диуретики |
Недостаточность правого желудочка Имеется Патологические изменения не выявляются Бронхолитики |
Острый альвеолярный отек легких отличают от очаговой, долевой или инфарктной пневмонии такие признаки:
в чередовании вдоха и выдоха не наблюдается заметных пауз;
при кашле выделяется пенистая мокрота, часто розового цвета;
перкуторно над легочными полями определяется укороченный или коробочный звук;
при аускультации — разнокалиберные влажные хрипы не в нижних, а в средних и верхних отделах легких;
быстрая аускулътативная динамика дыхательных шумов над одним и тем же участком легких (звонкие мелкопузырчатые хрипы нередко сменяются внезапно сухими и свистящими или глухими среднепузырчатыми);
рентгенологические изменения преобладают в прикорневых и базальных отделах.
Лечение. Успех терапии при отеке легких зависит прежде всего от экстренности принятых мер. Лечение должно начинаться немедленно, быть интенсивным, комплексным, рациональным, с обязательным проведением общих мероприятий, а именно:
— придать больному полусидячее или сидячее положение в кро вати, что способствует ограничению притока крови в сосуды легких и скоплению ее в венозной системе большого круга кровообращения, имеющего значительно большую емкость. С этой же целью на все конечности накладывают жгуты на 30- 60 мин (сделать отметку на жгуте о времени его наложения). Конечности пережимают таким образом, чтобы пульсация на артериях сохранялась. После купирования отека жгуты рас-
ОТЕКЛЕГКИХ
493
пускают медленно из-за опасности резкого увеличения массы циркулирующей крови. При тромбофлебите наложение турникетов противопоказано. Могут быть использованы горячие ножные ванны;
больному необходимо обеспечить приток свежего воздуха;
если отек развивается на фоне повышенного или нормального АД может быть произведено кровопускание из локтевой вены. После кровопускания объем циркулирующей крови уменьшается на 200—400 мл, что снижает приток крови в малый крут и уменьшает давление в легочных капиллярах;
организовать немедленную аспирацию пены из верхних дыхательных путей, затем ингаляцию воздушно-кислородно-спиртовой смеси, если возможно, — под повышенным давлением (в увлажнитель добавляют 96 % спирт для взрослых и 30 % раствор спирта — для детей), или ингаляцию пеногасителя с антифом-силаном— 1мл 10% спиртового раствора. Ингаляции паров спирта проводят по 10—15 мин, чередуя их с ингаляциями чистого кислорода или кислородно-воздушной смеси. Пенистую жидкость из верхних дыхательных путей отсасывают через носовой катетер с помощью электроотсоса.
Лечебные мероприятия должны проводиться с учетом премор-бидного состояния и быть направлены на устранение или хотя бы уменьшение действия тех основных причин, которые привели к этому осложнению. Дальнейшую тактику лечения определяют: основное заболевание, эффективность первичных лечебных мероприятий, особенности процессов компенсации кровообращения в каждом отдельном случае. Поэтому дальнейшая терапия включает мероприятия, направленные на восстановление проходимости дыхательных путей, уплотнение альвеолярно-капиллярных мембран, снижение гидростатического давления в сосудах малого крута кровообращения, на уменьшение ОЦК, дегидратации легких, снижение действия биологически активных веществ, улучшение сократительной способности миокарда, устранение гипоксии, нормализацию тканевого метаболизма.
Во всех случаях начинать медикаментозное лечение больных с отеком легких, находящихся в сознании, следует с нормализации их эмоционального фона, часто с устранения болевого синдрома или снятия реакции на стрессовую ситуацию, которые нередко являются пусковым механизмом развития отека легких. Для этого целесообразно внутривенное медленное введение морфина — 0,5—1 мл 1 % раствора на 10—15 мл изотонического раствора натрия хрорида или 5 % раствора глюкозы в комбинации с антигистаминными препаратами (1—2 мл 1 % раствора димедрола, 2% раствора супрасти-на или 2,5 % раствора пипольфена). Морфин в малых дозах снижает
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
494
возбудимость дыхательного центра, вызывая урежение и увеличение глубины дыхательных движений, а также снижает чувство страха и тревоги. Одновременно морфин, расширяя вены и артериолы, уменьшает возврат венозной крови к сердцу, снижает давление в легочной артерии, ОПСС и АД. Побочные действия морфина — активация рвотного центра и усиление бронхоспазма — устраняются в какой-то степени комбинацией с 2 мл 0,25 % раствора дроперидола, который несколько отличается по действию. Он уменьшает периферическое сопротивление, блокируя а-рецепторы, умеренно увеличивая минутный объем крови. При появлении признаков угнетения дыхательного центра, что иногда наблюдается при назначении морфина, вводят 0,4—0,8 мг (1—2 мл) налоксона — антагониста опиатов. Можно назначить 2—4 мл 0,5 % раствора седуксена (реланиума) или 2 мл 2,5 % раствора дипразина. Введение морфина противопоказано при бронхоспазме и больным с малым объемом дыхания (гиповенти-ляция). Больным с пониженным АД предпочтительнее назначать натрия оксибутират внутривенно 20—30 мл 20 % раствора (4—5 г препарата) очень медленно — в течение 8—10 мин. Натрия оксибутират стабилизирует АД и способствует его нормализации. Для нормализации эмоционального фона иногда используют гексенал— 1—2 мл 1—2 % раствора внутривенно или тиопентал-натрий — 20 мл 2% раствора внутривенно под контролем АД.
Седативная терапия приводит к нормализации содержания ка-техоламинов в крови, а следовательно, значительно уменьшается периферический сосудистый спазм, снижается приток крови к легким, стимулируется отток крови из малого круга кровообращения и таким образом уменьшается фильтрация тканевой жидкости через альвеолярно-капиллярную мембрану. Седативные препараты также снижают интенсивность обменных процессов, что облегчает переносимость гипоксии.
Наркотические анальгетики противопоказаны при отеке мозга, острой обструкции дыхательных путей, беременности, хроническом легочном сердце, а нейролептики — при тяжелых органически поражениях ЦНС.
Для обезвоживания легочной паренхимы, разгрузки малого круга кровообращения путем уменьшения ОЦК используют диуретики лазикс (фуросемид) в дозе 80—160 мг внутривенно струйно (лучше дробно — по 40—80 мг во избежание некроза почечных канальцев) или урегит (этакриновая кислота) в дозе 50—150 мг. При резкой нарушении гемодинамики диуретики показаны после нормализации АД. Диурез должен быть не очень обильным (не более 2—За в первые сутки) из-за возможности электролитных расстроит После внутривенного введения лазикса положительный эффект развивается через несколько минут и сохраняется 2—3 ч.
ОТЕКЛЕГКИХ
495
Осмотические диуретики (мочевину, маннитол, маннит и др.) использовать для купирования острого отека легких не рекомендуется. Эти препараты в первой фазе своего действия могут увеличить объем циркулирующей жидкости, а следовательно, усилить отек легких, поэтому их назначают при затянувшемся отеке легких, когда эффект от вводимых препаратов отсутствует; мочевину вводят из расчета 1 г сухого вещества на 1 кг массы тела в минимальном количестве жидкости или маннитол из расчета 1—1,5 г/кг, при этом суточная доза не должна превышать 140—180 г.
Применяют осмотические диуретики в сочетании с лазиксом. Диуретический эффект при назначении осмотических диуретиков наступает обычно через 15—30 мин, достигает максимума через 1 — 1,5 ч от начала введения раствора и длится 5—б ч и более (до 14ч).
Существенного уменьшения ОЦК в сосудах легких можно добиться с помощью ганглиоблокаторов короткого и среднего действия. Однако их вводят только под контролем АД, так как они, расширяя вены большого круга кровообращения, депонинируют в них часть циркулирующей крови, а следовательно, и снижают системное АД. К этой группе препаратов относятся арфонад и пентами-дин. Введение их прекращают при АД 120 мм рт. ст. Арфонад (гиг-роний) вводят внутривенно капельно в дозе 250 мг 1 % раствора в 250 мл изотонического раствора натрия хлорида или 5 % глюкозы. Вначале препарат вводят со скоростью 80—100 капель в 1 мин, а по мере снижения АД темп введения уменьшают до 10—15 капель в 1 мин. Пентамидин (50—100 мг) вводят в вену дробно шприцем. Для этого 1—2 мл 5 % раствора препарата разводят в 20 мл изотонического раствора натрия хлорида и вводят внутривенно по 3—5 мл через 5—10 мин. Назначают также бензогексоний (10—40 мг) или нано-фин (50—100 мг), их вводят внутривенно медленно шприцем в 20 мл 40 % раствора глюкозы под контролем АД; введение прекращают при 110—120 мм рт. ст. Снижение давления в малом круге кровообращения можно достичь использованием препаратов нитроглицерина. Нитроглицерин вводят очень медленно внутривенно по 1 мл 1 % спиртового раствора, разведенного в 290—300 мл 5 % раствора глюкозы или дают под язык по 1—2 таблетки. Трансфузию осуществляют под контролем АД. Аналогичного эффекта можно добиться назначением нитросорбида в дозе 20—30 мг (2—3 таблетки) каждые 4—5 ч.
Их действие основано на снижении венозного тонуса и венозного возврата к сердцу, снятии спазма легочных сосудов и снижении общего легочного сопротивления; они уменьшают одышку, удушье, цианоз. Следует иметь в виду возможность применения ганглиоблокаторов и периферических вазодилататоров не только при высоком, но также при умеренно повышенном и даже нормальном АД.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
496
Применение эуфиллина при отеке легких целесообразно только в случаях сопутствующего бронхоспазма, при отеке мозга с развитием брадикардии, митральном стенозе, гипертоническом кризе. Эуфиллин вводят внутривенно медленно (10 мл 2,4 % раствора). Назначение эуфиллина ограничено его побочными действиями: он вызывает тахикардию, повышает потребность миокарда в кислороде, активирует дыхательный центр.
Использование сердечных гликозидов как средств, улучшающих сократительную способность миокарда и снижающих ЧСС, при отеке легких ограничено из-за возможного токсического действия, повышения сократительной функции правого желудочка. Их применяют только при отеке легких на фоне хронической сердечной недостаточности, кардиогенном шоке при инфаркте миокарда в небольших дозах (строфантин по 0,25—0,5 мл 0,05 % раствора или кор-гликон по 0,5—1 мл 0,06 % раствора внутривенно медленно под контролем ЧСС).
Когда отек легких протекает при низком АД, то попытки купировать его с помощью седативных, мочегонных препаратов, ганглиоб-локаторов не всегда дают положительный результат. В этих случаях для выведения избытка жидкости из организма используют перито-неальный диализ или гемодиализ.
В ходе интенсивной терапии следует предпринимать меры, обеспечивающие необходимое содержание кислорода во вдыхаемом больным воздухе, а также уменьшение пенообразования. Иногда проводят гипербарическую оксигенацию.
Важным компонентом интенсивной терапии при отеке легких является противодействие фильтрации в альвеолах и затруднение перехода в них транссудата крови из капилляров малого круга, что достигается спонтанным дыханием с сопротивлением на выдохе (5-10 мм вод. ст.) с режимом положительного давления в конце выдоха (используют аппараты РО-2, РО-4, АНД-2, «Энгстрем» и др.).
При отеке легких на фоне анафилактического шока, тяжелой интоксикации медикаментозными и промышленными ядами, острого гемолитического криза, трансфузии несовместимой крови, малярии, некоторых заболеваний крови необходимо назначение преднизолона в дозе 100—150 мг и более или гидрокортизона в дозе 200—350 мг внутривенно капельно в изотоническом растворе натрия хлорида или 5 % растворе глюкозы. Глюкокортикоидные препараты также назначают для уменьшения отека слизистой оболочи дыхательных путей (преднизолон по 40—60 мг и более или гидрокортизон по 125 мг внутривенно).
В комплексном лечении отека легких при инфекционных болезнях следует учитывать этиологический фактор основного заболевания и продолжать адекватную этиотропную терапию.
ОТЕКЛЕГКИХ
497
Для очищения дыхательных путей от вязкой мокроты (вязкость обусловлена волокнами кислого гликопротеида) показаны трипсин, химотрипсин или их комбинация — химопсин. При гнойном характере секрета (содержащем волокна рибонуклеида) более выраженное разжижающее действие оказывают рибонуклеаза и дезокси-рибонуклеаза. Вводят муколитические средства непосредственно в дыхательные пути в виде аэрозоля или через трахеальный зонд (разовая доза 25—50 мг, растворенных в 3 мл изотонического раствора натрия хлорида или 4 % раствора натрия гидрокарбоната). Введение протеолитических ферментов при кровохарканье противопоказано. В состав аэрозоля включают антигистаминные препараты (супрастин, димедрол), производные пурина (эуфиллин), бронхо-литики (эфедрина гидрохлорид, нафтизин, изадрин), холинолити-ки (атропина сульфат), а также официнальные смеси (солутан или эфатин и др.). При необходимости в смесь включают антибиотики, глюкокортикоиды или другие химиотерапевтические препараты. Ингаляции проводят с помощью ингаляторов, обеспечивающих образование мелкодисперсных аэрозолей, легко проникающих не только в верхние, но и в нижние отделы дыхательных путей, вплоть до бронхиол и альвеол.
Эффективный кашель является необходимым для поддержания трахеобронхиальной проходимости. Стимуляции кашля способствуют изменения положения тела больного в постели, перкуссион-но-вибрационный массаж грудной клетки, надавливание на болевые точки вдоль трахеи, применение аппарата искусственного кашля ИКАР-2. В этих случаях наркотические анальгетики (морфин, про-медол, текодин, фентанил и др.), подавляющие кашель, назначают с большой осторожностью.
Развитие отека легких на фоне ларингоспазма, стенозирующего отека гортани требует катетеризации трахеи и бронхов и лечебной ларинготрахеобронхоскопии. Лекарственные препараты эндотрахе-ально вводят после предварительного промывания трахеобронхи-ального дерева подогретым до 38 °С изотоническим раствором натрия хлорида или 4 % раствором натрия гидрокарбоната (по 3—5 мл), способствующих разжижению мокроты. При необходимости выполняют повторную лечебную ларинготрахеобронхоскопию. В комплексном лечении ларингоспазма решающее значение имеет про-тивосудорожная терапия, заключающаяся в назначении седуксена (2 мл 0,5 % раствора) с натрия оксибутиратом (20 мл 20 % раствора, вводят внутривенно медленно — в течение 6—10 мин), а также лити-ческих смесей разного состава (аминазина 2,5 % раствора 2 мл, про-медола 2 % раствора 2 мл, димедрола 2 % раствора 2 мл).
Таким образом, с учетом вышеизложенного оказание экстренной
32 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
498
помощи при отеке легких может быть рекомендовано в такой последовательности:
придание больному полусидячего или сидячего положения в постели;
наложение жгутов на конечности;
аспирация пены из верхних дыхательных путей;
внутривенное введение морфина;
ингаляция кислорода с пеногасителем;
внутривенное введение диуретиков (лазикс);
назначение ганглиоблокаторов;
применение глюкокортикоидов;
использование сердечных гликозидов или сосудорасширяющих средств (или инфузия крови);
ИВЛ при крайней тяжести;
антибиотики — при необходимости.
Мероприятия, которые проводятся при этом, более детально изложены в табл. 33.
Таблица 33. Неотложные мероприятия при отеке легких
Последовательность и показания |
Лечебные мероприятия, лекарственные препараты |
Методы введения |
Цель проведения |
Примечание |
Немедленно |
Придание больному полусидячего, сидячего положения Наложение жгутов на конечности (на 25—40 мин) Кислород, увлажненный спиртом Отсасывание слизи из верхних дыхательных путей |
Ингаляция паров спирта Электроотсосом |
Разгрузка малого круга кровообращения Уменьшение венозного притока к правому желудочку сердца Прекращение пено-образования Уменьшение гипоксии, ацидоза Восстановление проходимости дыхательных путей |
Антифом-силан 10% вместо спирта |
ОТЕКЛЕГКИХ
499
Последовательность и показания |
Лечебные мероприятия, лекарственные препараты |
Методы введения |
Цель проведения |
Примечание |
Психомотор- |
5—10 мг морфи- |
Внутри- |
Угнетение |
|
ное возбуж- |
на (0,5—1 мл 1% |
венно |
дыхатель- |
|
дение |
раствора) |
|
ного центра, |
|
Болевой |
Промедол 1 мл |
fr |
уменьше- |
|
синдром |
2 % раствора |
|
ние одышки, |
|
|
Аминазин 0,5 мл 2,5% раствора |
~"~ |
снижение венозного |
|
|
Кальция глю-конат 10 мл 10 % раствора |
гг |
возврата, снятие болевых ощущений, уменьшение проницаемости сосудистой стенки |
|
|
Аскорбиновая кислота 5 мл 5 % раствора |
Внутривенно струйно |
То же |
|
|
Нитроглицерин |
0,5мг (1 таб- |
Снижение |
Или изо- |
|
|
летка) |
венозно- |
сорбида |
|
|
под язык |
го возврата |
динитрат |
|
|
каждые |
к сердцу и |
(изокет) |
|
|
10—15 мин |
давления в |
10—20 мг в |
|
|
или внут- |
системе ма- |
150 мл изо- |
|
|
ривенно |
лого круга |
тоническо- |
|
|
капельно |
кровообра- |
го раство- |
|
|
10—15 мг в 150 мл изотонического раствора натрия хлорида (8—16 капель в 1 мин) |
щения |
ра (глюкозы, натрия хлорида, Рингера) в течение 45—90 мин |
32*
500-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Продолжение табл. 33
Последовательность и показания |
Лечебные мероприятия, лекарственные препараты |
Методы введения |
Цель проведения |
Примечание |
При повышенном, нормальном АД |
Изотонический раствор натрия хлорида 200 мл Лазикс 80— 160 мг |
Внутривенно капель-но Внутривенно, внутримышечно |
Снижение объема циркулирующей крови и давления в системе ле- |
Контроль АД, диуреза |
|
Эуфиллин 2,4 % раствора 10 мл Маннитол 60 мл Коргликон 0,06 % раствора 0,5 мл |
Внутривенно струйно Внутривенно капель-но Внутривенно |
гочной артерии Ликвидация сердечнососудистой недостаточности |
Диурез не более 2— 3 л первые сутки |
При низком АД |
Преднизолон 40—60 мг |
Внутривенно |
Уменьшение явлений отека, стабили- |
Повторно по показаниям |
|
Оксибутират натрия 4—5 мг (20—30 мл 20 % раствора, очень медленно — в течение 8— 10 мин) |
Внутривенно |
зация гемодинамики Стабилизирует АД |
|
Выраженный токси- |
Гидрокортизон 125 мг, изотони- |
Внутривенно |
|
|
коз |
ческий раствор натрия хлорида 100 мл Натрия гидрокарбоната 200 мл 4 % раствора |
Внутривенно ка-пельно |
|
|
ОТЕКЛЕГКИХ
501
Последовательность и показания |
Лечебные мероприятия, лекарственные препараты |
Методы введения |
Цель проведения |
Примечание |
Обязательно сосудорасширяющие средства При отсутствии эффекта Крайняя тяжесть |
Дроперидол 0,25 % раствора 2 мл Пипольфен 2,5 % раствора 1 мл Арфонад 250 мг на 200 мл изотонического раствора натрия хлорида или 5 % раствора глюкозы Кровопускание 500 мл ИВЛ |
Внутривенно на 20 % растворе глюкозы Внутривенно, внутримышечно Внутривенно капель-но Путем венепункции или венесекции Управляемое дыхание |
Ликвидация спазма периферических сосудов, снижение АД Уменьшение венозного притока к правому желудочку сердца |
Под контролем АД, прекращая курс при 120 мм рт.ст., пентамин 50—100 мг или бензо-гексоний 10—40 мг Вызов реаниматологов |
Диагностика заболевания, осложнением которого явился отек легких, необходима для профильной госпитализации в специализированное отделение реанимации. Госпитализация должна быть максимально бережной, в условиях абсолютного покоя. К машине больного доставляют на носилках с приподнятой верхней половиной туловища, а в случаях артериальной гипотензии положение тела должно быть строго горизонтальным. Перед транспортировкой целесообразно ввести дроперидол или натрия оксибутират в сочетании с антигистаминными препаратами. Этим достигаются успокоение
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
502
больного, уменьшение одышки, предупреждение рвоты. В машине «скорой помощи» проводят масочную ингаляцию кислорода, при необходимости — продолжают лечебные мероприятия под контролем ЧСС и показателей АД.
Больных с отеком легких необходимо транспортировать специализированной бригадой «скорой помощи». Госпитализация в профильное отделение обеспечивает преемственность в лечении между бригадой «скорой помощи» и стационаром.
Больных госпитализируют сразу же после купирования отека легких. Тактика немедленной госпитализации после выведения из критического состояния имеет преимущество по сравнению с тактикой отсроченной госпитализации: тяжесть состояния требует монитор-ного наблюдения за основными гемодинамическими показателями, на обслуживание больных затрачивается меньше времени, а раннее комплексное стационарное лечение и наблюдение позволяют в более короткие сроки компенсировать состояние и улучшить прогноз основного заболевания.
Порядок выписки из стационара. Вопрос о выписке из стационара решается лечащим врачом индивидуализированно, в зависимости от клинических проявлений основного заболевания.
Профилактика. Своевременное устранение причин, приводящих к развитию отека легких, является основой его профилактики. При начавшемся отеке легких экстренность, интенсивность, полнота и рациональность лечебных мероприятий позволяют предупредить его дальнейшее прогрессирование.
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 503
Острая почечная недостаточность
Острая почечная недостаточность (ОПН) — внезапно возникшее патологическое состояние, характеризующееся нарушением функции почек с задержкой выведения из организма продуктов азотистого обмена, расстройством водного и электролитного баланса, нарушением осмотического и кислотно-основного равновесия.
Лат. — insufficienceae renale acutae.
Англ. — acute Renal Failure.
Актуальность. Своевременная диагностика, предупреждение и лечение ОПН у больных с инфекционными заболеваниями остается одной из основных проблем современной практической медицины. В год она регистрируется у 30—50 человек на 1 млн жителей нашей планеты. В США среди всех госпитализированных больных в стационары общего профиля на долю ОПН приходилось 5 %, а в отделениях интенсивной терапии ОПН выявлялась у 10—30 % больных, 60 % составляли хирургические больные, 40 % — терапевтические, 1—2 % — беременные. Больные с инфекционной патологией составляют 30—70 % среди общего числа пациентов терапевтического профиля с ОПН. Начиная с 90-х годов XX в., ОПН все чаще становится следствием синдрома полиорганной недостаточности, в том числе и на фоне септического течения многих инфекций, при этом летальность достигает 90 %.
По данным отечественной и зарубежной литературы, ОПН — одно из наиболее частых осложнений инфекционных заболеваний, ведущих к летальному исходу. Многофакторность поражения почек при большинстве инфекций обусловливает тяжелое течение ОПН и высокую летальность. При многих инфекциях ОПН является «осложнением осложнений»: инфекционно-токсического, дегидрата-ционного шока, ДВС-синдрома, острого внутрисосудистого гемолиза. При инфекционных заболеваниях с закономерным поражением почек (лептоспироз, ГЛПС) летальность колеблется от 5 до 30 % и большей частью обусловлена именно ОПН.
Этиология и классификация. Выделяют 5 групп причин развития ОПН (Г.П. Кулаков, 1982).
/. Острая циркуляторная нефропатия вследствие:
травматического шока;
размозжения и некроза мышц (crush-синдрома);
электротравмы;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
504
ожогов и обморожений;
операционной травмы (шока);
кровопотери;
анафилактического шока;
переливания несовместимой крови;
перитонита;
острого панкреатита, панкреатонекроза;
острого холецистита;
обезвоживания и потери электролитов;
тяжелых инфекционных заболеваний;
бактериального шока;
акушерских осложнений (септический аборт, преждевременная отслойка плаценты на фоне нефропатии, предлежание плаценты, эклампсия, послеродовое кровотечение и др.);
— инфаркта миокарда (кардиогенный шок). //. Острая токсическая нефропатии вследствие:
— отравления ядовитыми веществами, применяемыми в промыш ленности, сельском хозяйстве и в быту:
а) солями тяжелых металлов (ртути, меди, хрома, урана, золота и др.);
б) хлорированными углеводородами (четыреххлористым угле родом, дихлорэтаном);
в) алкоголями (этиленгликолем, метиловым спиртом) и их сур рогатами;
г) крепкими кислотами;
интоксикации ядами растительного и животного происхождения (грибным, змеиным, насекомых);
интоксикации лекарственными препаратами и реакции на медикаменты (антибиотики, сульфаниламиды, хинин, акрихин, пахикарпин и др.).
///. Острая инфекционная нефропатия вследствие:
геморрагической лихорадки с почечным синдромом (ГЛПС);
лептоспироза.
IV. Острая сосудистая нефропатия вследствие:
тромбоза и эмболии почечных артерий;
тромбоза почечных вен;
острого гломерулонефрита;
острого пиелонефрита (абсцедирующего, папиллярного некроза).
V. Обстукция мочевых путей вследствие:
камней мочеточников;
опухоли мочеточников;
опухолей органов таза;
радиационного отека (склероза) забрюшинной клетчатки;
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
505
— ретроперитонеального фиброза (болезни Ормонда).
В инфекционной клинике можно встретить патологические состояния, которые относятся почти ко всем этим 5 группам острых нефропатий:
циркуляторная (обезвоживание при холере и ПТИ, шоки);
токсическая (действие антибактериальных и антипаразитарных препаратов);
инфекционная (ГЛПС, желтая лихорадка, лептоспироз);
сосудистая (гемоглобинурийная лихорадка).
По механизму развития и в зависимости от этиологических факторов ОПН может быть разделена на 3 формы (СИ. Рябов, 2000):
1. Преренальная, являющаяся следствием снижения клубочково- го кровотока из-за:
снижения сократительной способности миокарда (при сердечной недостаточности, инфаркте миокарда);
уменьшения ОЦК (при массивных кровопотерях, при снижении объема внеклеточной жидкости вследствие диареи, рвоты, ожогов и т.д.);
системной вазодилатации (при сепсисе, развитии ИТШ);
почечной вазоконстрикции (при сепсисе, приеме вазопрессор-ных препаратов, стенозе почечных сосудов).
Ренальная — развивается вследствие повреждения почечных и канальцевых сосудов, а также при остром канальцевом некрозе.
Постренальная — развивающаяся вследствие обструкции мочевых путей.
Для инфекционных болезней характерны либо преренальный, либо ренальный типы ОПН. Случаи постренальной ОПН у инфекционных больных крайне редки (обструкция кристаллами сульфаниламидов мочевых канальцев в процессе лечения и т. д.).
Причины возникновения преренальной и ренальной ОПН, как и механизмы их развития, отличаются.
Основные причины преренальной ОПН у больных с инфекционной патологией;
массивная кровопотеря (постгеморрагическая ОПН при геморрагических лихорадках, брюшном тифе);
дегидратационный шок (при холере, ПТИ, холероподобном и сальмонеллезоподобном эшерихиозе, гастроинтестинальной форме сальмонеллеза);
ИТШ (менингококцемия, чума, септическая форма сибирской язвы, брюшной тиф, генерализованные формы сальмонеллеза, кишечный иерсиниоз, кампилобактериоз, колитическая форма шигеллеза, дифтерия);
— анафилактический шок (при лечении любых инфекций). Основные причины ренальной ОПН у инфекционных больных:
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
506
синдром массивного нетравматического рабдомиолиза, при котором происходит выброс в кровь значительного количества миоглобина, а в дальнейшем развивается миоглобинурия (при тяжелом гриппе, болезни легионеров, в период судорожного сокращения мышц при столбняке);
массивный внутрисосудистый гемолиз (малярия falciparum);
применение нефротоксических препаратов при лечении инфекционных больных (аминогликозиды, сульфаниламиды и т.д.);
непосредственное поражение клубочков (ГЛПС);
преимущественное поражение мочевых канальцев (лептоспи-роз);
массивный некроз тканей с освобождением протеаз лизосом (при фульминантных вирусных гепатитах).
По степени выраженности клинической симптоматики различают формы ОПН:
латентную;
малосимптомную;
с выраженными клиническими симптомами, которая может быть средней тяжести, тяжелой и молниеносной.
В случае молниеносного течения ОПН с момента воздействия патогенных факторов на почку до развития анурии и гибели больного проходит менее суток. Легкая и малосимптомная формы ОПН принципиальных отличий не имеют.
При снижении скорости клубочковой фильтрации (СКФ) на протяжении нескольких недель — течение ОПН медленно прогрессирующее, на протяжении нескольких часов и дней — быстро прогрессирующее. Однако существует обоснованное мнение, что медленно прогрессирующее течение следует считать не острой, а быстро прогрессирующей почечной недостаточностью, которая отличается от ОПН не только патогенетически, но и этиологически (для большинства острых инфекций быстро прогрессирующая почечная недостаточность не характерна). Предлагается также такой критерий различия, как развитие при ОПН поражения исходно здоровой почки, в отличие от быстро прогрессирующей почечной недостаточности.
Выделяют также стадии ОПН начальную (инициальную, пред-олигоанурическую), олигоанурическую, полиурическую и восстановительную.
Олигурия — снижение суточного диуреза до 500 мл и менее (почасового < 40 мл), анурия —до 100 мл и менее за сутки.
Примерная формулировка диагноза. ОПН у инфекционных больных обычно развивается как осложнение основного (инфекционного) патологического процесса. Поэтому это должно быть отражено и в диагнозе.
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 507
Лептоспироз, тяжелая желтушная форма, осложненная средней тяжести ОПН по ренальному типу, олигурическая стадия.
ГЛПС, тяжелая форма, осложненная тяжелой ОПН по ренальному типу, полиурическая стадия.
Патогенез. Прежде чем описывать основные патогенетические механизмы поражения почек с развитием ОПН у инфекционных больных, необходимо напомнить о строении почек и их основных функциях.
Структура и функция почек. Строение и функция различных отделов почки взаимосвязаны. Почка человека состоит примерно из 1 млн нефронов, имеющих высокую структурно-функциональную специализацию. Каждый нефрон состоит из сосудистого клубочка, его капсулы и почечных канальцев.
Сосудистый клубочек нефрона состоит примерно из 50 капиллярных петель, имеющих анастомозы друг с другом. Это позволяет функционировать клубочку как диализирующей системе. Капилляры клубочков представляют собой клубочковый фильтр, состоящий из эпителия, эндотелия и базальной (основной) мембраны между ними.
От каждой эпителиальной клетки ( эпителиоцита) отходят большие отростки, охватывающие значительную поверхность капилляра. Между малыми отростками эпителиоцитов расположены фибриллярные структуры, образующие щелевую диафрагму. Ей отводится значительная роль в процессах гломерулярной фильтрации. Эту функцию осуществляют и миофиламенты цитоплазмы, с помощью которых сокращаются эпителиальные клетки. При этом ультрафильтрат плазмы крови перекачивается в полость капсулы клубочка. Транспортную функцию выполняет и система микротрубочек эпителиоцитов клубочков. Эти же клетки участвуют в синтезе материала для основной мембраны клубочков.
Основная (базальная) мембрана состоит из трех слоев: центрального плотного слоя (lamina densa)n из более тонких слоев — наружного (lamina rara externa) и внутреннего (lamina rara interna). Наружный и внутренний слои являются по существу гликокаликсом эпителиоцитов и эндотелиоцитов капилляров клубочков. В образовании основной мембраны участвуют и мезангиальные клетки.
Коллагеноподобные филаменты центрального слоя мембраны образуют поры фильтрации. При снижении гидростатического давления в капиллярах клубочков изменяется взаиморасположение коллагеноподобных филаментов центрального слоя основной мембраны и размеры пор увеличиваются и наоборот. Поры способны пропускать молекулы альбумина, IgG, некоторых ферментов. Но из-за высокой скорости фильтрации проникновение этих веществ ограничено. Следующим барьером, препятствующим в норме фильтрации низкомолекулярных белков, является гликокаликс, который
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
508
расположен между основной мембраной и эндотелием капилляров клубочков. Этот барьер повреждается даже при незначительных нарушениях клубочкового кровотока.
Через фильтр (поры) базальной мембраны свободно проходят молекулы размером менее 2,5 нм (например, воды, глюкозы, мочевины и ионы). Для молекул размером свыше 4 нм фильтрация становится ограниченной; она затрудняется также для отрицательно заряженных и нейтральных молекул. Например, у главного белка плазмы крови — альбумина размеры молекулы примерно 3,6 нм и отрицательный заряд при физиологической рН крови. Поэтому его фильтрация затруднена главным образом из-за его заряда, а не из-за размера. В норме соотношение концентрации альбумина в плазме крови и концентрации его в клубочковом фильтрате приблизительно составляет 4000:1. Отрицательный заряд, создающий барьер для подобных альбумину молекул, имеют клетки эндотелия, основной мембраны и ножек (отростков) эпицитов (подоцитов).
Нормальная клубочковая фильтрация поддерживается отрицательным зарядом стенки капилляров. Благодаря ему от стенки отталкиваются белковые молекулы плазмы крови, имеющие, как отмечалось, при нормальных физиологических значениях рН тоже отрицательный заряд.
При гибели клеток участки основной мембраны оголяются, белки крови выходят в полость капсулы клубочков, изменяя отрицательный заряд стенок капилляров. Это еще больше усиливает фильтрацию белков через клубочковый фильтр и приводит к протеинурии.
Мезангиальные клетки основной мембраны состоят из 3 типов: гладкомышечных (синтез всех компонентов гладкомышечного комплекса), клеток костномозгового происхождения (фагоцитоз различных макромолекул, в том числе и циркулирующих иммунных комплексов) и транзиторных— типа моноцитов. Мезангиальные клетки обладают иммунной функцией, очищают клубочек, его соединительную ткань, т. е. обладают фагоцитозом. Эти клетки синтезируют медиаторы (оксид азота), регулирующие тонус капиллярных петель и пролиферацию клеток почечного клубочка (интерлейкин-1, трансформирующий фактор роста).
Мезангиальные клетки являются составной частью юкстагломе-рулярного аппарата, они выделяют в кровь ренин через отростки, перфорирующие эндотелий капилляров клубочков и проникающие в их просвет.
Клетки мезангия способны сокращаться, участвуют в фильтрационной функции клубочков. Как и эндотелиоциты, эпителиоциты клубочков, эти клетки синтезируют и выделяют различные лейкотрие-ны, простагландины, тромбоксаны, регулирующие тонус клеток, их функцию и иммунные реакции в них, клубочковый кровоток.
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТА ТОЧНОСТЬ
509
Мезангиальный матрикс, образующий систему каналов, выполняет функцию «мусоропровода» для микроорганизмов, нейтральных и положительно заряженных макромолекул.
Эндотелий клубочков имеет поры и специальную диафрагму. Через поры осуществляется основной путь ультрафильтрации, дополнительным путем является пиноцитоз эндотелия. Эти клетки играют важную роль в регуляции клубочкового кровотока за счет секреции эндотелинов, вызывающих сужение сосудов, и за счет выделения оксида азота, расширяющего их. При повреждении эндоте-лиальных клеток на их поверхности появляются выросты, способствующие возникновению турбулентных завихрений кровотока и адгезии лейкоцитов.
Капсула клубочка состоит из основной мембраны и эпителия. Основная мембрана продолжается в главный отдел канальцев. На ней фиксированы с помощью филаментов, содержащих актомио-зин, эпителиальные клетки. Поэтому объем капсулы может изменяться, способствуя фильтрации. В области полюса клубочка эпителий капсулы переходит в эндотелий.
Почечные канальцы состоят из 4 отделов: главного (проксимального), тонкого сегмента петли нефрона (Генле), дистального и собирательной трубки.
Проксимальный отдел состоит из прямой и извитой частей. Клетки проксимального отдела за счет лабиринта внутриклеточных мембран и щеточной каемки, внутриклеточных ферментных систем обеспечивают реабсорбцию глюкозы, аминокислот, фосфатов, воды. В них же происходит реабсорбция всего фильтрующегося в клубочках белка. В эпителии проксимального отдела функционирует вакуолярно-лизосомальная система реабсорбции белка.
Клетки тонкого сегмента петли нефрона, имеющие в цитоплазме своеобразные щели, обеспечивают пассивную резорбцию воды, уменьшая до минимума ее фильтрационный заряд. Синхронная работа тонкой части петли нефрона, дистального отдела, собирательных трубок и прямых сосудов пирамид обеспечивает осмотическое концентрирование мочи.
Дистальный отдел почечных канальцев состоит из восходящей и извитой частей. Клетки macula densa извитой части в месте соприкосновения с полюсом сосудистого клубочка имеют тесные контакты с клетками юкстагломерулярного аппарата. Это обеспечивает взаимное влияние гломерулярного кровотока и химического состава мочи дистального отдела канальцев. Эпителий этого отдела секрети-рует калликреин. Клетки дистального отдела наиболее чувствительны к недостатку кислорода, что объясняет их избирательное поражение при ухудшении почечного кровотока.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
510
Эпителий собирательных трубок высокопроницаем для воды, в них же происходит секреция ионов водорода (Н + ).
Из-за различного строения клубочков и канальцев, особенностей кровоснабжения выделяют кортикальные и юкстагломерулярные нефроны.
Особенности строения сосудистой системы почек обеспечивают ауторегуляцию кровообращения в органе с дифференциацией кровотока в его корковом и мозговом веществе.
В почке функционируют два круга кровообращения: большой (в корковом веществе) и малый (юкстамедуллярный).
В большой круг входят междольковые артерии, приносящие арте-риолы и сеть основной массы клубочков, выносящие сосуды, пост-гломерулярная капиллярная и венозная сеть коркового вещества.
Юкстамедуллярный (малый) круг состоит из проксимальных отрезков междольковых артерий, приносящих и выносящих артериол юкстамедуллярных клубочков, сосудистой сети артериальных и венозных сосудов пирамид, проксимальных отрезков интралобуляр-ных вен. К малому кругу относятся также межканальцевые капилляры кортикомедуллярнои зоны, перигломерулярные сосудистые сплетения, связывающие афферентные и эфферентные артериолы юкстамедуллярных клубочков, артериовенозные анастомозы пограничного слоя почки.
В сосудах пограничного слоя происходит перераспределение крови между корой и пирамидами. В норме на кортикальный путь приходится 90—85% почечного кровотока, а на юкстамедуллярный — 10—15%. Но последний в патологических условиях может становиться своеобразным шунтом, по которому кровь минует корковое вещество и сбрасывается в пирамиды. Это приводит к избирательной ишемии коры, вплоть до развития некрозов.
У человека массой 70 кг почечный кровоток составляет 1100 мл мин, или более 1200 мл/мин на 1,73 м2 поверхности тела, или от 20 до 25 % артериального кровотока, хотя масса обеих почек меньше 0,5 % массы тела; плазмоток составляет 600 мл/мин. Особенно интенсивен кровоток в корковом веществе — он в 1000 раз сильнее, чем в покоящейся мышце. Клубочек каждого нефрона представляет собой видоизмененный кровеносный сосуд. При этом афферентная артериола разветвляется на 3—4 ветви, образующие клубок капилляров, которые вновь собираются в эфферентную артериолу, выносящую кровь из клубочка.
Клубочковая фильтрация является важным почечным механизмом поддержания водно-электролитного гомеостаза в организме, но она также зависит от многих факторов (табл. 34)
Благодаря гидростатическому давлению (силы Старлинга), действующему против онкотического давления, обеспечиваются образо-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
511
Таблица 34. Физиологические факторы, влияющие на скорость клубочковой фильтрации — СКФ (Джеймс А.Шейман, 1999)
Факторы, определяющие СКФ |
Физиологические факторы |
Коэффициент ультрафильтрации (К1) Давление в гломеруляр-ных капиллярах Онкотическое давление в гломерулярных капиллярах (Рдс) |
Размер поверхности гломерулярных капилляров (К1 и СКФ увеличиваются при расслаблении и уменьшаются при сокращении мезангиальных клеток) Давление в артериях почки, сопротивление афферентных и эфферентных артери-ол (увеличение артериального давления, уменьшение сопротивления афферентных артериол и увеличение сопротивления эфферентных артериол повышают СКФ) Концентрация коллоидов в системном плаз-мотоке (увеличенная концентрация коллоидов в плазме и уменьшенный плазмоток будут повышать Рдс и уменьшать СКФ) |
вание и движение фильтрата крови через стенку капиллярных петель клубочка. Фильтруемая фракция крови регулируется системой ренин — ангиотензин (ангиотензин II вызывает сужение эфферентных артериол и увеличивает количество фильтрата). Количество фильтруемой в обеих почках плазмы крови у человека массой 70 кг составляет в норме 125 мл/мин, или 180 л /сут, что примерно в 60 раз больше общего объема плазмы. До поступления в почечный каналец фильтрат собирается в капсуле почечного клубочка (боуменовой).
Таким образом, особенностями гемодинамики почки являются исключительно большой кровоток и развитая система его саморегуляции, которая обеспечивает постоянство кровотока и объема клубочковой фильтрации при широких колебаниях АД — от 90 до 190 мм рт. ст.
Суточное количество мочи, которое выделяет человек, — это результат двух противоположных процессов в почках: ультрафильтрации через капилляры клубочков (в норме от 180 л, или 125 мл/мин) и реабсорбции образовавшегося фильтрата (до 99%) в почечных канальцах. Для нормального процесса ультрафильтрации мочи в первую очередь необходимо АД на уровне клубочков выше 60 мм рт. ст. Оно обеспечивается высоким артериальным притоком крови к поч-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
512
кам, который составляет 20—25 % минутного объема сердца. При расчете на единицу массы ткани артериальный приток крови к почкам выше, чем к легким, печени и даже к головному мозгу.
Лимфатическая система почки подчинена реабсорбционной работе канальцев и является вторым звеном реабсорбции.
Особенности строения иннервационного аппарата почек обусловливают снижение почечного кровотока и увеличение фильтрации мочи при слабой стимуляции симпатических нервов почки, а при сильной их стимуляции — снижение кровотока, фильтрации воды и натрия. Почечная гемодинамика контролируется а-адре-норецепторами, а выделение ренина — р-адренорецепторами. В результате стимуляции последних происходит расширение почечных сосудов, а вследствие блокады а-адренорецепторов — некоторое их сужение.
Таким образом, в почках происходит взаимосвязанная работа клубочковых и околоклубочковых структур, канальцев и стромы пирамид с нейрогуморальной и почечно-эндокринной ее регуляцией.
Особенности строения почек определяют их основные функции в организме:
регуляция распределения воды и электролитов, осмолярности плазмы крови и межтканевой жидкости, КОС при помощи изменения экскреции воды и ионов (Na+, K+, Ca2+, Mg2+, Н-, О", Р04+), неорганических и органических кислот с мочой;
барьерная (в том числе поддержание белкового гомеостаза, он-котического давления плазмы крови);
эндокринная (образование ренина, ангиотензина, эритропоэ-тина, преобразование витамина D3 в активную форму);
регуляция АД (через систему ренин — ангиотензин);
дезинтоксикационная (путем активной экскреции почками органических кислот и органических оснований, а также других токсинов и лекарств с мочой);
регуляция азотистого обмена.
Регуляция содержания воды и электролитов, осмолярности плазмы крови и межтканевой жидкости, КОС осуществляется благодаря:
клубочковой фильтрации;
реабсорбции, секреции и синтезу веществ в канальцах;
выделению неорганических веществ, в том числе кислот;
выделению воды (осмотическое концентрирование и разведение мочи);
выделению Н+.
Регуляция обмена натрия и хлора. Среди осмотически активных веществ доля этих ионов наиболее высока в клубочковом ультрафильтрате. Для нормально функционирующей почки характерен широкий диапазон колебаний содержания натрия и хлора в моче. В
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
513
проксимальном отделе нефрона из фильтрата всасывается около 2/з воды, почти полностью реабсорбируются аминокислоты, глюкоза. В конечной части проксимального извитого канальца всасывается основная масса гидрокарбоната, многие органические вещества, но концентрация хлора становится выше. В прямой части проксимального канальца, в отличие от извитой, высокая проницаемость межклеточных контактов для хлоридов. Из-за более высокой их концентрации в просвете канальца, чем в околоканальцевои жидкости и крови, хлориды начинают пассивно реабсорбироваться по градиенту концентрации, увлекая за собой воду и натрий. Регуляция скорости пассивной реабсорбции хлоридов (а вместе с ними воды и натрия) в проксимальном отделе канальцев осуществляется:
изменением соотношения между уровнем гидростатического давления в почечных артериях, венах и мочеточнике;
изменением онкотического давления в околоканальцевых капиллярах;
изменением проницаемости межклеточных промежутков.
В тонкой нисходящей части петли нефрона высокая проницаемость лишь для воды, существенной реабсорбции натрия и хлора в ней не происходит.
В толстом восходящем отделе петли нефрона стенка мало проницаема для воды, но в нем происходит активная реабсорбция хлора, натрия и калия за счет систем активного транспорта в мембранах эпителия с участием фермента К+, Na+- зависимой АТФазы.
В дистальном извитом канальце ведущим механизмом реабсорбции солей является натриевый насос, обеспечивающий реабсорб-цию натрия против высокого электрохимического градиента (однако здесь может всосаться не более 10% профильтровавшегося натрия и скорость его реабсорбции меньше, чем в проксимальном канальце). Реабсорбция хлора происходит вслед за реабсорбцией натрия и пассивно.
Регуляция объема жидкости и баланса Na+ почками заключается прежде всего в поддержании гомеостаза Na+, который в основном определяет регуляцию объема внеклеточной жидкости и ее осмо-лярности.
Регуляция обмена натрия заключается в изменениях его количества, фильтрующегося в клубочках и реабсорбирующегося на 70 % в проксимальных канальцах. Дальнейшая его реабсорбция происходит в петле нефрона, что играет важную роль в создании осмотического градиента почечного интерстиция. В дистальных канальцах одновременно реабсорбируются натрий и хлор.
В физиологических условиях в ответ на увеличение объема внеклеточной жидкости усиливается выделение натрия с уменьшением
33 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
514
его реабсорбции и увеличением выделения воды. При уменьшении объема внеклеточной жидкости натрий задерживается почками.
Основные механизмы регуляции почками постоянства содержания натрия:
изменение СКФ (ее увеличение на 1 % при неизмененной реабсорбции натрия приводит к увеличению в 2 раза его экскреции с мочой);
феномен клубочково-канальцевого баланса (наличие прямой связи между СКФ и величиной реабсорбции натрия в канальцах);
основным фактором регуляции экскреции натрия является уровень канальцевой реабсорбции, которую контролируют альдостерон, предсердный натрийурический атриопептид, ка-техоламины, простагландины, калликреин-кининовая система, перераспределение почечного кровотока и физические факторы, действующие в области проксимального канальца. Регуляция канальцевой реабсорбции натрия осуществляется:
увеличением альдостероном реабсорбции натрия при одновременном усилении секреции калия в просвет почечного канальца;
снижением реабсорбции натрия с усилением выделения его и хлора с мочой, увеличением диуреза при воздействии предсерд-ного натрийурического атриопептида;
снижением реабсорбции натрия и увеличением натрийуреза при уменьшении онкотического давления в околоканальцевых капиллярах и (или) при увеличении гидростатического давления в них;
выраженным натрийурическим и диуретическим действием кининов;
— выраженным натрийурическим действием простагландина Е. Не менее важны для поддержания водно-электролитного баланса
в организме почечные механизмы регуляции обмена калия.
В норме обычно почкой экскретируется 10—15 % калия от всего фильтруемого в клубочках. Регуляция выделения почкой калия происходит благодаря:
изменению СКФ (количество фильтруемого в клубочках калия);
реабсорбции в проксимальном извитом канальце (реабсорби-руется около 50 % фильтруемого калия при помощи диффузии, осуществляемой за счет градиента концентрации);
реабсорбции калия в толстом восходящем отделе петли нефро на (за счет как пассивных механизмов — из-за положительного электрохимического потенциала просвета канальцев, так и активных — из-за котранспорта натрия, хлора и калия);
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
515
секреции калия в прямой части проксимального мочевого канальца и в тонкой нисходящей части петли нефрона (обусловлена высокой концентрацией калия в мозговом веществе почки и положительным градиентом концентрации для его перемещения в просвет нефрона);
секреции калия, которая зависит прежде всего от его транспорта в собирательных канальцах коркового вещества почек (главные клетки собирательных канальцев определяют истинную величину секреции калия, которая происходит за счет переноса калия Na+, K + - зависимой АТФазой из интерстициальной жидкости через основную мембрану в главные клетки собирательных канальцев);
физико-химическим свойствам основной мембраны и мембран клеток мочевых канальцев;
регуляции альдостероном (стимуляция секреции калия из плазмы крови в просвет нефрона путем увеличения количества Na+, K + - зависимой АТФазы в основной мембране и увеличения числа калиевых каналов, находящихся в открытом состоянии в lamina rara interna);
влиянию факторов, изменяющих электрохимический градиент для калия в канальцах;
изменению трансэпителиальной разности потенциалов за счет доставки в просвет канальцев непроникающих анионов (анионы сульфата в дистальном канальце способствуют экскреции калия с мочой).
Таким образом, выделение калия почками зависит от:
количества функционирующих нефронов;
СКФ;
адекватной доставки натрия и воды к дистальным отделам нефрона;
секреции альдостерона;
наличия или отсутствия метаболического ацидоза в почечной ткани;
состояния эпителия дистального отдела канальцев и состояния механизмов секреции калия.
Образование избыточного количества калия в плазме крови (что часто бывает при инфекциях за счет разрушения тканей, некроза клеток, гемолиза эритроцитов) усиливает фильтрацию калия в клубочках, его транспорт через основную мембрану канальцев и повышает секрецию клетками эпителия канальцев. В нормальных условиях около 5 ммоль калия теряется при потоотделении, 10 % его удаляется с калом. При ОПН до 75 % поступившего в кровь калия может удаляться через пищеварительный тракт, особенно при наличии рвоты.
33*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
516
Не физиологическими причинами, усиливающими выделение калия почками, могут быть:
полиурия вследствие нарушения концентрационной способности почек,
снижение СКФ из-за спазма сосудов почки;
гиперальдостеронизм;
истощение запасов магния в организме;
алкалоз;
стимуляция секреции калия клетками дистального отдела канальцев анионными молекулами некоторых антибиотиков (пенициллин и его производные);
выведение калия из-за непосредственного повреждения эпителия канальцев аминогликозидами.
При противоположном действии первых пяти факторов возникает гиперкалиемия и перераспределение калия между клеткой и внеклеточной жидкостью. Гиперкалиемия с уменьшением количества внутриклеточного калия может быть следствием ацидоза, недостатка инсулина, блокады Р2-адренорецепторов. Однако только ацидоз, вызванный избытком неорганических кислот (что характерно для ОПН) или гиперхлоремиеи, приводит к выходу калия из клеток и увеличивает его концентрацию во внеклеточной жидкости и плазме крови. Однако это несправедливо для метаболического ацидоза, обусловленного накоплением органических кислот (например, лак-тата). При метаболическом ацидозе степень гиперкалиемии и перераспределения калия выше, чем при дыхательном ацидозе.
Гиперкалиемия у больных с ОПН может развиваться и при адекватной, лишь сниженной относительно имеющихся потребностей организма СКФ (неолигурическая форма ОПН!):
вследствие первичного дефекта секреции калия эпителием дистальных канальцев;
вследствие недостаточной секреции альдостерона (при первичном поражении надпочечников, например при менингококце-мии);
вследствие нарушения синтеза альдостерона некоторыми лекарствами (гепарин, индометацин, ингибиторы ангиотензин-превращающего фермента, спиронолактон).
Не менее важны и другие почечные механизмы регуляции КОСъ организме:
фильтрация НСОэ" в клубочках;
реабсорбция НС03~ в канальцах через основную мембрану при участии обменника О-, НС03~;
выделение в собирательных канальцах нелетучих кислот при условии реабсорбции НС03~ и секреции протонов (Н+), сучао
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 517
тием в качестве буферных систем фосфатов, сульфатов и аммиака;
секреция кислот в проксимальном отделе нефрона;
секреция некарбоновых кислот вставочными клетками собирательных канальцев коркового вещества и наружного мозгового вещества;
— секреция Н+ в просвет канальца при участии Н + -АТФазы. Факторы, регулирующие секрецию кислых продуктов в прокси мальном отделе нефрона и в собирательных трубках:
основная часть Н+ в моче выводится в виде буферов — в соединении с фосфатами и аммиаком (концентрация аммиака также регулируется преимущественно почками и колеблется в зависимости от состояния КОС);
повышение РС02 в плазме крови (гиперкапния дыхательного или метаболического генеза) увеличивает экскрецию аммиака почкой и усиливает канальцевую реабсорбцию НС03_;
дыхательный алкалоз (респираторная гипокапния) снижает секрецию Н+ с уменьшением секреции аммиака и угнетает реабсорбцию НС03~~ (для адаптации к алкалозу за счет почечных механизмов необходимо 2—3 сут);
количество буферов и транспорт протонов зависят от электрохимического градиента;
минералокортикоиды стимулируют реабсорбцию натрия и повышают отрицательный заряд просвета канальцев, что облегчает секрецию Н + ;
— стимуляция альдостероном непосредственно Н + -АТФазы.
Нормально функционирующие почки поддерживают концентрацию в крови основного щелочного буфера — гидрокарбонатного, регенерируя НСОэ~. В дополнение к этому в почках реабсорбиру-ется почти все количество НС03~, поступающее в ультрафильтрат. Реабсорбция происходит главным образом в проксимальном канальце. В качестве дополнительного буфера, необходимого для удаления кислот с мочой, клетки почечных канальцев дополнительно синтезируют аммиак, выделяющийся в просвет канальцев и соединяющийся в них с Н+ с образованием NH4+. Усиление синтеза аммиака в клетках проксимальной части канальца является быстрой реакцией на снижение буферной емкости крови и развитие ацидоза.
Почки гораздо медленнее, чем легкие, реагируют на изменения КОС в организме. Так, например, если стимуляция канальцевой секреции Н+ из-за повышения РС02 начинается через несколько минут, то стимуляция секреции Н+ альдостероном в дистальных канальцах начинается лишь через несколько часов. Другие факторы, влияющие на выделение Н+ почками, могут быть реализованы лишь через
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
518
2—3 дня. Компенсаторная адаптация почек к ацидозу или алкалозу также носит длительный характер.
В зависимости от того, нарушено образование гидрокарбоната или нарушена секреция кислот в дистальном или проксимальном отделе нефрона, развивается почечный канальцевыи ацидоз I или II типа.
Регуляция обмена кальция почками значительная. При потреблении кальция около 1 г/сут, 80 % его выделяется через кишечник, а 20 % — с мочой (от 2,5 до 7,5 ммоль/сут). При этом в клубочках фильтруется до 11 г/сут ионизированного или находящегося в составе низкомолекулярных комплексов кальция. 50 % этого количества реабсорбируется в проксимальном канальце, 20—25% — в толстом восходящем отделе петли нефрона, 5—10 % — в дистальном извитом канальце и 0,5—1 % — в собирательных трубках. Секреции кальция в почках человека не происходит. Транспорт кальция в почках регулируется:
величиной СКФ;
паратгормоном (уменьшает выделение кальция почкой за счет стимуляции его всасывания в дистальном отделе нефрона);
тирокальцитонином (увеличивает экскрецию кальция почками);
активной формой витамина D3, повышающей реабсорбцию кальция в проксимальном отделе нефрона.
Предшественник витамина D3 синтезируется в печени и проходит второй этап гидроксилирования в почках, превращаясь в активную форму. Она способствует усилению абсорбции кальция и фосфора в кишечнике, увеличивает резорбцию этих ионов из костей, Одновременно активная форма витамина D3 противодействует фосфатурическому действию паратгормона на уровне почечных канальцев.
Регуляция обмена магния почками осуществляется благодаря:
изменению СКФ (при резком снижении повышается концентрация магния в крови);
изменениям процессов реабсорбции магния в проксимальном канальце в толстом восходящем отделе петли нефрона (до 60%);
увеличению скорости экскреции магния при остром увеличении объема внеклеточной жидкости;
увеличению экскреции магния при действии тирокальцитони-на и вазопрессина;
уменьшению выделения с мочой при действии паратгормона;
увеличению выделения с мочой при гиперкальциемии.
В поддержании постоянства концентрации фосфатов в жидкостях
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
519
внутренней среды организма почки играют исключительную роль, при этом важны следующие механизмы:
величина СКФ (при нормальной СКФ 125 мл/мин и концентрации фосфатов в плазме крови 1,14 ммоль/л в клубочках фильтруется около 0,132 ммоль/мин);
величина реабсорбции в канальцах (до 90% профильтровавшихся фосфатов);
регуляция паратгормоном (его дефицит стимулирует реабсорб-цию фосфатов);
стимуляция в проксимальном канальце реабсорбции фосфатов активной формой витамина D3, гормоном роста.
Регуляция концентрации сульфатов в крови почками осуществляется:
изменением СКФ;
изменением способности к реабсорбции в канальцах (возрастает при действии гормона роста и глюкокортикоидов, снижается при повышении в крови концентрации фосфатов, при введении ацетата, тиосульфата).
Физиологические особенности транспорта белков определяются в основном строением и функцией клубочкового фильтра (см. выше). Однако белки, появляющиеся в моче, представляют собой всего лишь небольшую часть фильтруемых белков, основная часть (98%) которых реабсорбируется в проксимальном извитом канальце. Реабсорбированные белки гидролизируются в вакуолях эпителия канальцев до аминокислот, до небольших пептидов. Полной реабсорбции в норме обычно не подвергаются низкомолекулярные белки (Р2-микроглобулин, (Xj- и а2-микроглобулины).
Однако в моче, помимо белков, что фильтруются в клубочке и не реабсорбируются в канальцах, содержатся и другие. Они образуются в мочевом тракте и составляют в норме примерно 50 % всех белков мочи. Главным из них является белок Тамма—Хорсфалля, сек-ретируемый эпителием толстой восходящей петли нефрона и являющийся главным белковым компонентом гиалиновых цилиндров. В норме в анализе мочи находят единичные гиалиновые цилиндры, а вот появление восковидных цилиндров указывает на тяжелое поражение почек.
Белок мочи в норме состоит из 40 % альбумина, 10 % — IgG, 5 % — IgM с легкими цепями и 3 % — IgA. Остальную часть составляют белок Тамма—Хорсфалля, лизоцим и другие белки, образующиеся в эпителии мочеточников и мочевого пузыря. Нормальное выделение общего белка с мочой у взрослого человека за сутки не превышает 150 мг.
Основные механизмы развития патологической протеинурии:
— нарушение барьерных свойств клубочкового фильтра (потеря
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
520
заряда гломерулярного барьера, нарушение барьерных свойств по отношению к размеру фильтруемых частиц); —очень высокое содержание белков в плазме крови, способных к фильтрации в клубочках (перегрузочная протеинурия);
— снижение способности эпителия проксимальных канальцев ре- абсорбировать белок.
Потери иммуноглобулинов с мочой при массивной протеинурии обусловливают появление гуморального иммунодефицита и развитие гнойно-септических осложнений. Потери с мочой антитромбина III и других ингибиторов и регуляторов свертывающей системы крови могут приводить как к усиленному тромбообразованию (тромбофлебиты, эмболии), так и к геморрагическому синдрому. Нарушается в организме также метаболизм лекарств и гормонов (например, тиреоидных), в норме связывающихся и переносящихся белками крови.
Механизмы задержки солей и воды в организме вследствие протеинурии (нефротический синдром) представлены на рис. 29 (Джеймс А.Шейман, 1999).
Эндокринная функция почек. Эндокринный аппарат почек состоит из:
юкстагломерулярного аппарата (выделяет ренин и эритропоэ-тин);
интерстициальных клеток мозгового вещества и эпителиоци-тов собирательных трубок (выработка простагландинов, лей-котриенов, тромбоксана);
нефроцитов дистальных канальцев (синтез калликреина);
— клеток APUD-системы (выделяют серотонин).
Ренин участвует в ауторегуляции СКФ путем изменения тонуса сосудов почек. С другой стороны, повышенная продукция вазопрес-сорных веществ почкой при снижении активности их антагонистов приводит к развитию почечной артериальной гипертензии.
В обмене глюкозы в организме почки также играют важную роль. В течение суток фильтруется около 1000 ммоль глюкозы, но в норме она практически вся реабсорбируется (в основном в проксимальном сегменте нефрона).
Почки играют также важную роль в выделении органических веществ. Многие из них секретируются в просвет мочевых канальцев клетками проксимального отдела нефрона (табл. 35).
Выделение с мочой кислот и оснований во многом зависит от рН внутриканальцевой жидкости. Эта зависимость реабсорбции кислот и оснований получила название «неионная диффузия». Для ускорения выделения некоторых лекарственных веществ почкой изменяют рН мочи соответственно в кислую или в щелочную сторону.
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
521
Потеря белка с мочой (протеинурия)
у
Гипопротеинемия
у
Уменьшение онкотического давления плазмы
4
Транскапиллярная утечка жидкости из плазмы в интерстиций и развитие отека
4
Относительное уменьшение объема плазмы
4
Уменьшение кровоснабжения почки
4
Увеличение содержания ренина, ангиотензина II, альдостерона и повышение реабсорбции натрия
4
Задержка солей и воды
4
Транскапиллярная утечка жидкости из плазмы в интерстиций, способствующая развитию отека
Рис. 29
Механизмы повышенной задержки солей и воды при нефротическом синдроме
Важнейшая функция почек — это выделение конечных продуктов азотистого обмена.
Один из важнейших конечных продуктов азотистого обмена — мочевая кислота. В норме почки за сутки выделяют около 500 мг мочевой кислоты, около 200 мг ее удаляется с калом. Она свободно фильтруется в клубочках, в почечных канальцах как реабсорбиру-ется (до 98 % профильтрованной мочевины), так и секретируется. Повышение концентрации мочевой кислоты в крови вызывают следующие причины, связанные с почками:
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
522
Таблица 35. Органические вещества, секретируемые клетками проксимального нефрона (Тареева Е.И., 2000}
Вещества эндогенного происхождения |
Вещества, введенные в организм |
Органические |
кислоты |
Желчные кислоты |
Диодраст |
Мочевая кислота |
Индометацин |
Щавелевая кислота |
Парааминогиппуровая кислота |
цАМФ |
Пенициллин |
|
Салициловая кислота |
|
Фенолсульфофталеин |
|
Фуросемид |
|
Этакриновая кислота |
Органические |
основания |
Адреналин |
Амилорид |
Ацетилхолин |
Атропин |
Гистамин |
Морфин |
Серотонин |
Неостигмин |
Тиамин |
Прокаин |
|
Хинин |
уменьшение СКФ;
увеличение канальцевой реабсорбции;
снижение канальцевой секреции.
Креатинин образуется из креатининфосфата, который является важным компонентом мышечных клеток. Содержание креатининав крови и выделение его с мочой определяют:
пол, возраст;
развитие мышечной массы;
интенсивность обмена.
Характер питания гораздо в меньшей степени влияет на обмен креатинина. Он полностью фильтруется в клубочках. Небольшое количество креатинина секретируется клетками проксимального отдела канальцев. Секрецию креатинина угнетает кортизол. При низкой скорости мочеотделения (<0,5 мл/мин) значительное количество креатинина может реабсорбироваться. В обычной клинической практике клиренс креатинина довольно точно отражает величину клубочковой фильтрации. Поэтому увеличение концентрации креатинина в крови пропорционально уменьшению СКФ.
Мочевина является важнейшим конечным продуктом азотисто-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
—. 52з
го обмена. Почки с мочой выделяют в виде мочевины до 90 % азота (0,43—0,71 ммоль/сут). В почках мочевина необходима для осмотического концентрирования мочи в канальцах. Мочевина свободно фильтруется в клубочках. В проксимальном отделе нефрона реаб-сорбируется около 50 % мочевины. В петле нефрона она из око-локанальцевой жидкости вновь поступает в просвет канальца и к началу дистального извитого канальца ее концентрация в просвете значительно превышает концентрацию в первичном фильтрате. Экскреция мочевины резко уменьшается при воздействии ва-зопрессина на проницаемость стенок собирательных трубок (тогда в них увеличивается всасывание мочевины). В почках функционирует система кругооборота (рециркуляции) мочевины, которая в значительной степени определяет степень осмотического концентрирования мочи и уровень экскреции мочевины почкой.
Многообразие функций почек определяет необходимость контроля за основными показателями, характеризующими их. Физиологические величины этих показателей представлены далее, в разделе «Методы диагностики» (табл. 37).
Патофизиология почек при ОПН. Гистоморфология. Патоморфо-логические изменения в почках при ОПН зависят от ее генеза, стадии и длительности.
При аутопсии у умерших от преренальной ОПН обнаруживают повреждения почечных кровеносных сосудов и клубочков, разрушение эндотелия сосудов, отек окружающих тканей. Макроскопически отмечают побледнение коркового вещества при выраженном полнокровии юкстамедуллярной зоны («шоковая почка»). При шоке также считают типичным тубулорексис (разрыв почечных канальцев). Микроскопически в клубочках находят малокровие, десквамацию и гибель эндотелиоцитов, оголение основных мембран, иногда — субэндотелиальные отложения фибрина. Тромбоз капилляров клубочков обнаруживают чаще при ИТШ как проявление диссемини-рованного внутрисосудистого свертывания крови. При этом также отмечают симметричный кортикальный некроз почек различной степени выраженности. При тотальной форме некроза сохраняются почечные пирамиды, при субтотальной — ив корковом веществе встречаются островки непораженной ткани, при сегментарной — очаги некроза имеют вид инфарктов, окруженных геморрагиями. При затянувшейся ОПН некротизированное корковое вещество почки истончается. Зона некроза ограничена демаркационным валом из лейкоцитов.
У умерших от ОПН по ренальному типу находят различную степень некроза канальцев, внутриканальцевые цилиндры, коллапс канальцев или их расширение, периканальцевый интерстициальный отек и клеточную инфильтрацию. Часты микро- и макрогеморрагии
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
524
в паренхиме почек, полнокровие капилляров, микротромбирование их, нарушения целости мембран. На основании проведенных гистологических исследований выделены два типа поражения почек:
В результате прямого токсического воздействия на эпителий мочевых канальцев развивается однородный диффузный некроз клеток эпителия извитых и прямых проксимальных канальцев. При этом основная мембрана остается неповрежденной. Такие изменения характерны лишь для инфекций, возбудители которых или (и) их токсины обладают прямой нефротропностью с преимущественным поражением эпителия мочевых канальцев (например, лептоспиры). Поскольку при большинстве инфекций одновременно поражаются клубочковый аппарат почек, эндотелий микрососудов, снижается почечный кровоток, то этот тип гистоморфологического повреждения почек наблюдается у инфекционных больных редко.
При ишемии почек, поражении преимущественно клубочков развивается слабый пятнистый некроз, наиболее выраженный в отделах канальцев, находящихся на границе коры и мозгового вещества. Особенно ранимы юкстамедуллярный прямой проксимальный каналец и толстая восходящая часть петли нефрона, находящаяся в мозговом веществе. При этом наблюдается разрыв основной мембраны канальцев. Этот тип повреждений встречается гораздо чаще, особенно при инфекциях, которые осложняются дегидратационным или инфекционно-токсическим шоком. Однако в последнем случае часто имеется тропность токсинов или возбудителей и к эпителию мочевых канальцев (например, при сальмонеллезе, брюшном тифе), поэтому в таких случаях чаще обнаруживают гистоморфологичес-кие изменения обоих типов.
Корреляция между гистологическими повреждениями в почках и их функцией недостоверна, что подтверждают прижизненной биопсией.
Общие патогенетические механизмы поражения почек и нарушения их функции при преренальной и ренальной ОПН у инфекционных больных. При ОПН страдают все функции почек, но в первую очередь нарушается функция, регулирующая водный обмен.
Ткани почек весьма чувствительны к снижению кровотока, ишемии и гипоксии. Снижение кровотока в почечных сосудах вызывает снижение фильтрационного давления в клубочках с уменьшением образования ультрафильтрата, но при малонарушенной его реаб-сорбции, что приводит к олигурии, внеклеточной гипергидратации в сочетании с клеточной дегидратацией.
Скорость клубочковой ультрафильтрации определяется 3 основными факторами:
— соотношением гидростатического и онкотического давлений в капиллярах клубочков и в полости их капсул;
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
525
скоростью тока плазмы крови через клубочки;
суммарной площадью поверхности фильтрующих капилляров и их проницаемостью.
При инфекционных заболеваниях, осложняющихся ОПН, уменьшение скорости клубочковой фильтрации отмечают в случаях:
снижения гидростатического давления в клубочках (при ин-фекционно-токсическом и дегидратационном шоке);
повышения гидростатического давления в канальцах (закупорка их просвета преципитатами продуктов распада гемоглобина при гемоглобинурийной лихорадке, миоглобина — при массивном рабдомиолизе);
повышения онкотического давления плазмы крови вследствие ее сгущения при дегидратационном шоке;
снижения тока крови через клубочки вследствие острой недостаточности кровообращения при инфекционно-токсическом, анафилактическом, дегидратационном шоке;
снижения проницаемости и (или) суммарной площади фильтрующей поверхности клубочков при инфекциях, протекающих по типу острого гломерулонефрита (ГЛПС).
При наличии указанных процессов может нарушаться функция почек, обеспечивающая поддержание белкового гомеостаза.
Основными барьерами для белков плазмы крови являются основная мембрана капилляров клубочков и щелевидные диафрагмы между отростками эпителиальных клеток на мочевой стороне капилляров клубочков. Они могут серьезно повреждаться при некоторых инфекциях,особенно при ГЛПС, что приводит к значительной, внезапной, но непродолжительной протеинурии («мочевой белковый выстрел»). Для лептоспироза поврежение этого барьера менее характерно, поэтому он и сопровождается менее выраженной про-теинурией. В ультрафильтрат попадают в первую очередь альбумины, что вызывает в конечном счете гипоальбуминемию, снижение онкотического давления плазмы крови, относительную гипергамма-глобулинемию, еще большее снижение скорости клубочковой фильтрации и прогрессирование олигоанурии.
Нарушение электростатического барьера на поверхности клеток эпителия клубочков за счет ацидоза и гипоксии при развитии ОПН также приводит в первую очередь к альбуминурии.
При ОПН страдает экскреторная функция почек, которые являются важным органом регуляции азотистого обмена в организме.
Такие вещества, как мочевина и креатинин, выделяются с мочой в основном в зависимости от скорости клубочковой фильтрации; секреция их при этом имеет гораздо меньшее значение. Поэтому при снижении скорости клубочковой фильтрации в плазме крови постепенно увеличивается концентрация мочевины, азота мочевины и
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
526
креатинина. Их содержание в плазме крови весьма чувствительно к скорости клубочковой фильтрации и достаточно хорошо ее отражает. Уровень мочевины в крови в меньшей степени отражает скорость клубочковой фильтрации, чем уровень креатинина, так как мочевина синтезируется в печени (и может снижаться при ее недостаточности), а ее концентрация в большей степени отражает характер питания, интенсивность белкового распада.
При ОПН нарушается функция почек, регулирующая электролитный обмен и КОС. При ОПН содержание в крови К+, Н+, фосфатов, магния (а также уратов) не возрастает обычно до тех пор, пока скорость клубочковой фильтрации не снижается до нескольких процентов от нормы, что отмечается в клинике инфекционных болезней лишь при тяжелых поражениях почек. По мере снижения скорости клубочковой фильтрации канальцы способствуют экскреции указанных веществ путем увеличения самой их секреции и (или) увеличения реабсорбции.
Повышенная секреция уратов, калия, фосфатов обеспечивает их нормальный уровень в плазме крови до тех пор, пока скорость клубочковой фильтрации не снижается до 25 % от нормальной.
Концентрация Na+ и С1~ в плазме крови при ОПН поддерживается длительно на нормальном уровне за счет прогрессирующего уменьшения процессов реабсорбции Na+ в сохранившихся канальцах, в результате чего возрастающая часть его фильтрующейся порции не реабсорбируется и попадает в конечную порцию мочи.
При ОПН, сопровождающейся снижением количества функционирующих нефронов, для сохранения стабильной концентрации натрия хлорида в плазме крови необходимо возрастание его фракционной экскреции по мере снижения скорости клубочковой фильтрации.
Нарушение концентрационной способности почек связано не только с гибелью части нефронов, но и с нарушениями этой функции в оставшихся. Способность почек концентрировать мочу вызывают нарушения структуры петель нефронов, прямых канальцев, ухудшение кровотока в мозговом веществе почек и нарушения транспорта натрия хлорида в восходящей части петли нефрона. Существует мнение, что уремия сама по себе может нарушать реакцию терминальных отделов нефрона на действие антидиуретического гормона.
При ОПН снижение концентрации фосфатов в плазме крови происходит вследствие снижения их реабсорбции в канальцах, что обусловлено повышением концентрации паратгормона. Но уменьшение массы паренхимы почек приводит к снижению их способности разрушать паратгормон. При снижении скорости клубочковой
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
527
фильтрации до 25 % от нормальной начинается задержка фосфатов в организме и развивается гипокальциемия.
При скорости клубочковой фильтрации ниже 50 % от нормы отмечаются снижение содержания гидрокарбоната в плазме крови, а также ее буферной емкости и развитие метаболического ацидоза. Параллельное нарушение экскреции кислот, их накопление в тканях приводит к выраженному тканевому ацидозу с нарушением клеточных механизмов, регулирующих трансмембранный транспорт ионов. Происходит выход К+ из клетки с развитием внутриклеточной дегидратации и внеклеточной гипергидратации. Метаболический ацидоз при ОПН у инфекционных больных является следствием гиперпродукции кислых продуктов в тканях, уменьшения синтеза аммиака в почках, реабсорбции и продукции НС03~. Падение содержания НС03" в плазме крови в сочетании с задержкой С1~ почками приводит вначале к развитию гиперхлоремического ацидоза. Однако дальнейшее снижение скорости клубочковой фильтрации с развитием выраженной азотемии вызывает задержку фосфатов, сульфатов, что сопровождается снижением концентрации С1" в плазме крови, несмотря на продолжающееся снижение содержания НС03". Это приводит к развитию нормохлоремического ацидоза.
Внутри- и внеклеточный баланс калия поддерживается его суточной экскрецией в мочу в количестве, примерно равном его суточному поступлению с пищей, за вычетом небольших потерь с потом и калом (но они могут существенно возратать при инфекциях, сопровождающихся обильным потоотделением или диареей, рвотой). Увеличению секреции калия способствует повышенная активность альдостерона, однако у больных с ОПН чувствительность клеток эпителия мочевых канальцев к альдостерону может нарушаться.
При ОПН нарушается функция обмена витамина D3. Биотрансформация его в почках не нарушается до снижения скорости клубочковой фильтрации до 25 % по сравнению с нормой. Снижение массы нефрона при ОПН сопровождается уменьшением синтеза активной формы D3, что вызывает уменьшение абсорбции кальция в кишечнике и усиление гипокальциемии.
При ишемии паренхимы почек происходит активация ренин-ан-гиотензинной системы, однако это приводит к спазму афферентных артериол и к еще большему снижению кровотока в капиллярах клубочков. При шоке у инфекционных больных возможно истощение ренин-ангиотензинной системы еще до развития выраженной ОПН, истощаются и другие механизмы повышения АД. Поэтому ОПН, развивающаяся на фоне ИТШ при многих инфекциях, не сопровождается значительным повышением АД или оно повышается незначительно. Последнее создает предпосылки гиподиагностики шока
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
528
(особенно дегидратациоиного), в первую очередь при ориентировании врача только на «шоковый индекс».
Важной (первой) особенностью патогенеза ОПН при некоторых инфекциях (лептоспироз) является то, что первичные нарушения могут происходить на уровне канальцев, при этом вначале скорость клубочковой фильтрации может не снижаться. В таком случае на начальном этапе ОПН характер нарушений азотистого, водно-электролитного обмена и КОС будет зависеть от преобладания поражения того или иного отдела петли нефрона, отличающегося своей специфической функцией (реабсорбция или секреция калия и т.д.). Это объясняет случаи ОПН с выраженной гиперазотемией, ацидозом, но без гиперкалиемии и т.д.
Второй особенностью патофизиологии ОПН у инфекционных больных является то, что нарушения функции почек происходят чаще всего в организме с уже исходно имеющимися выраженными нарушениями водно-солевого обмена, КОС, метаболизма белков, гормонов и т.д. Так, у больных холерой ОПН развивается вначале только по преренальному типу на фоне дегидратационного шока с уже развившимися метаболическим ацидозом, гипоксией, внеклеточной дегидратацией, гипонатриемией, гипокалиемией, гипохлоремией. Эти нарушения сами по себе способны вызвать ОПН с гибелью ка-нальцевого эпителия вследствие гипоксии, ацидоза, дисэлектролит-ных нарушений. Поэтому ОПН у таких больных имеет свои особенности.
Третьей особенностью ОПН у инфекционных больных является повышенный катаболизм белков при тяжелых инфекциях, что сопровождается быстрым нарастанием азотемии.
Таким образом, при ОПН происходит нарушение жизненно важных функций почек, что приводит к азотемии, метаболическому ацидозу, гиперкалиемии, гиперфосфатемии, гипермагниемии, гипо-кальциемии, внутриклеточной дегидратации и внеклеточной гипергидратации.
Ранее существовавшие две теории патогенеза ОПН — сосудистая и канальцевая представляют собой скорее исторический интерес. Согласно первой теории, ОПН развивается вследствие поражения почечных канальцев; согласно второй — почечных сосудов.
Особенности патогенеза преренальной ОПН у инфекционных больных. Преренальная ОПН развивается на фоне дегидратационного шока или ИТШ вследствие снижения артериального почечного кровотока и ишемии почки. Ишемия почки наступает в результате спазма афферентных артериол и (или) вазодилатации эфферентных артериол, что вызывает уменьшение тока плазмы крови через клубочки и снижение гидростатического давления до уровня, при кото-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
32д
ром снижается СКФ. Уменьшение ее до 50 % от нормы уже приводит к развитию азотемии, электролитных и метаболических нарушений. Снижение СКФ при почечной гипоперфузии вызывает компенсаторное усиление реабсорбции воды и натрия в канальцах и снижение суточного диуреза до 500 мл и менее (олигурия).
Вследствие олигурии почечный клиренс мочевины снижается с постепенным повышением ее уровня в крови. Снижается клиренс креатинина (хотя и в меньшей степени, чем мочевины). Выделяющаяся моча становится концентрированной, Осмолярность мочи в 2 раза превышает осмолярность плазмы крови. Содержание натрия в моче резко падает, концентрация калия может быть высокой за счет явлений вторичного альдостеронизма, обусловленного снижением почечного кровотока.
Показатели концентрации натрия в моче при преренальной ОПН могут быть неоднозначны. При возникновении преренальной олигурии на фоне выраженного метаболического алкалоза (например, вследствие упорной рвоты) из-за усиленной экскреции гидрокарбоната концентрация натрия в моче может быть высокой даже при гиповолемии и низкой СКФ. Одновременно наблюдается низкое содержание хлора в моче в сочетании с ее щелочной реакцией.
Местное выделение вазоактивных веществ способствует спазму артериол сосудистого русла почек. Его вызывают в первую очередь «регулирующие» почечный кровоток катехоламины и ангиотен-зин П. В результате еще больше снижаются почечный кровоток и СКФ.
Помимо снижения почечного кровотока при преренальной ОПН снижается гидростатическое давление в капиллярной сети клубочков. Соответственно падает и СКФ. К преренальной азотемии может приводить и снижение объема внеклеточной жидкости вследствие потерь натрия (при дегидратационном шоке у больных холерой — см. соответствующий раздел).
На первых этапах олигурия преренального генеза обратима при условии быстрого устранения причин, вызвавших ее (своевременная адекватная регидратационная терапия при гиповолемическом шоке, быстрое восстановление гемодинамики и почечного кровотока при лечении ИТШ). Однако при сохранении снижения почечного кровотока преренальная олигурия заканчивается присоединением органических поражений, а в дальнейшем может развиться анурия. В почечных канальцах возникают явления некроза, повышается внутриканальцевое давление, происходит отек окружающей почечной паренхимы, вызывающий сдавление канальцев снаружи, что еще больше повышает в них давление и снижает СКФ. Основные этапы патогенеза преренальной ОПН представлены на рис. 30.
34 — 2-3077
530-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
![]()
Уменьшение объема циркулирующей жидкости
Абсолютное или относительное уменьшение эффективного объема крови
Вазоконстрикция в
различных органах, кроме жизненно
важных Т
Гидростатическое
давление в капиллярах
почечных клубочков I
 Центральные
барорецепторы
Центральные
барорецепторы
Почечный кровоток i
Сократительная способность сердца Т
Периферические барорецепторы
Скорость клубочковой фильтрации I
Концентрация в сыворотке мочевины и креатинина Т
Рис. 30
Схема патогенеза преренальной ОПН (Джеймс А.Шейман, 1999)
Однако приведенная на рис. 30 схема патогенеза преренальной ОПН больше отражает патогенетические механизмы ее развития при дегидратационном гиповолемическом шоке. В «чистом» виде таков механизм развития ОПН при холере, холероподобном эше-рихиозе. Но уже при гиповолемическом шоке на фоне гастроинтес-тинальной формы сальмонеллеза или на фоне ПТИ стафилококковой этиологии в патогенезе ОПН могут существенную роль играть и другие факторы (например, поражение почечной паренхимы непосредственно токсинами возбудителей и т.д.). Тем более, патогенез преренальной ОПН на фоне ИТШ еще несколько сложнее из-за возможного добавочного воздействия на почку таких факторов, как рабдомиолиз, гемолиз, ДВС-синдром, активация протеаз сыворотки крови. Поэтому ОПН при ИТШ нельзя рассматривать только как преренальную. С самого начала она может носить смешанный характер и быть обусловлена как преренальными, так и ренальными факторами (рис. 31).
Патогенез ренальной ОПН у инфекционных больных обусловлен преимущественным поражением либо клубочков, либо мочевых ка-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
531
Шок, недостаточность кровообращения
Гипоперфузия почек
Гемолиз, рабдомиолиз
Образование ангиотензина II
Освобождение ренина
Гемоглобину-
рия, миогло-
бинурия
Снижение клубочковой фильтрации и почечного плазмотока
Образование пигментных конгломератов
|
Дисфункция канальцев |
|
|||
|
< |
г |
|
>' |
|
,-, |
|
Азотемия |
|||
ил игу |
м |
1* |
|
||
Рис.31
Формирование почечной недостаточности при шоке (Г.А. Рябов., 1994)
нальцев, а чаще всего и тех, и других. Поражение канальцев возникает при закупорке их просвета цилиндрами и осколками клеток, иммунными комплексами, содержащими возбудителей или их антигены, что вызывает значительное повышение внутриканальцево-го давления, а в дальнейшем — и снижение давления фильтрации. Важную роль в развитии ОПН играет обратный ток клубочкового фильтрата через поврежденный эпителий почечных канальцев, что сопровождается отеком паренхимы почек с последующим дополнительным сдавлением канальцев извне. Это, в свою очередь, приводит к еще большему повышению внутриканальцевого давления и к еще большему снижению давления фильтрации первичной мочи, СКФ.
Первичное поражение клубочков возбудителями, их токсинами или иммунными комплексами вызывает повышение проницаемости эндотелия и мембраны, выход жидкой части плазмы в интерстици-альное пространство и последующее сдавление сосудистой капиллярной сети, что ухудшает микроциркуляцию и усугубляет отек. Это приводит к снижению СКФ и развитию азотемии.
По мнению многих исследователей, в развитии ОПН у инфекционных больных задействованы оба механизма, т.е. патологические процессы, происходящие в клубочках, канальцах и сосудах, взаимосвязаны и взаимозависимы. При прогрессировании процесса пато-
34*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
532
генетические механизмы становятся все более сходными, хотя пусковые существенно различаются, что мы и попытались отразить на рис. 32.
На фоне шока снижение почечного кровотока в течение 6—8 ч и более вызывает прекращение фильтрации мочи в почечных клубочках. Также развиваются необратимые структурные изменения в почечных канальцах, особенно в тех отделах, которые расположены в корковом веществе, вследствие гипоксии, ацидоза, нарушения микроциркуляции. Поврежденные канальцы неспособны реабсорбиро-вать натрий, вследствие чего теряется его значительное количество. В результате катаболизма белков, нарушений экскреции почками увеличивается содержание свободного калия. Этому способствуют гипонатриемия, гипокальциемия, ацидоз. Происходит перемещение калия из внутриклеточного во внеклеточное пространство, накопление его в плазме крови. Развивается метаболический ацидоз, происходит накопление кислот в тканях. Это в свою очередь усиливает клеточную дегидратацию с потерей калия клетками и внеклеточную гипергидратацию, что усугубляет отек паренхимы почек, вызывает сдавление мочевых канальцев и еще большее повышение внутрика-нальцевого давления, уменьшение давления фильтрации первичной мочи и СКФ. Усиление тканевого ацидоза, гипоксии, дисэлектролит-ные нарушения и внеклеточная гипергидратация, гиперазотемия приводят к развитию отека легких, мозга, остановке дыхания и кровообращения центрального генеза.
При быстром и полном восстановлении гемодинамики и микроциркуляции функция почек чаще всего нормализуется, признаки ОПН ликвидируются, хотя эпителий почечных канальцев, высокочувствительный к гипоксии, быстро гибнет. Даже при быстром выведении из шока может развиться длительная олигурия, что соответствует ренальному типу ОПН. Критерии перехода функциональной почечной недостаточности («почки при шоке») в тяжелое поражение почек («шоковая почка») до сих пор отчетливо не определены и требуют дорогостоящих, часто трудоемких дополнительных инструментальных и лабораторных исследований.
В последнее время все больше внимания уделяется так называемой протеазной теории патогенеза ОПН. Согласно этой теории, при инфекционно-токсическом и анафилактическом шоке происходит активация протеаз вследствие активной секреции их клетками пораженных тканей или (и) выхода протеаз из лизосом разрушенных клеток. Одновременно снижается и истощается активность ингибиторов протеаз, в результате чего протеолитические ферменты оказывают повреждающее действие на эндотелий микрососудов почек с гибелью части эпителия клубочков и иовышением проницаемости их мембран. Это приводит к выходу жидкой части плазмы крови
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
533
Ишемическое или токсическое воздействие на почку
Сосудистые факторы i
Клубочковые факторы i
Канальцевые факторы i
Снижение почечного перфузионного давления Спазм афферентных артериол Дилатация эфферентных артериол
Повышение проницаемости клубочков Уменьшение площади фильтрационной поверхности
Обструкция
канальцев
Обратный ток мочи
в канальцах
и коллапс
Гибель эпителия
канальцев
Снижение гидростатического давления в клубочках 4-
Уменьшение
клубочковой
ультрафильтрации 4-
Сближение внут-риканальцевого давления с давлением клубочковой фильтрации 4
/
Снижение скорости клубочковой фильтрации 4
Олигоанурия Т
Нарушение выведения азотистых соединений, водно-электролитного
баланса, КОС Т
Тканевый ацидоз, клеточная дегидратация, внеклеточная гипергидратация Т
Отек мозга, легких Асистолия из-за гиперкалиемии
Рис. 32
Основные патогенетические механизмы, участвующие в развитии ОПН
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
534
в интерстициальное пространство почки с отеком ее паренхимы и сдавлением мочевых канальцев. В свою очередь, повышается внут-риканальцевое давление и снижаются давление ультрафильтрации и СКФ. Повышенная проницаемость мембран клубочков приводит к попаданию протеаз в ультрафильтрат, что вызывает лизис эпителия мочевых канальцев, обструкцию просвета тонкой части петли нефрона погибшими клетками, белковыми преципитатами, это еще больше повышает внутриканальцевое давление и уменьшает СКФ. Однако подобный механизм, вероятно возможный при развитии ОПН при фульминантном вирусном гепатите (особенно с выраженными явлениями панкреатита), представляется лишь вторичным при развитии ОПН у больных холерой, где основным пусковым фактором является резкое снижение почечного кровотока вследствие дегидратации и потери электролитов.
При тяжелой форме ОПН вследствие возникающей гиперазотемии происходят нарушения в свертывающей системе крови: нарушается тромбоцитообразование, приводящее к выраженной кровоточивости, массивным кровотечениям.
Особенности патогенеза ОПН при некоторых инфекционных заболеваниях. Причина ОПН при ГЛПС— серозно-геморрагический отек межуточного вещества пирамид с последующим сдавлением канальцев и клубочковыми нарушениями, обусловленными иммунопатологическими процессами. Клубочковая фильтрация снижается вследствие фиксации на основной мембране клубочков иммунных комплексов — специфических и аутоиммунных. Это обусловливает гибель клеток эндотелия клубочков, повышение проницаемости их мембран и выход плазмы крови в паренхиму почки, отек паренхимы с последующим сдавлением мочевых канальцев. Давление в последних повышается, что способствует снижению СКФ и развитию олигоанурии. Большую роль играют и нарушения микроциркуляции в почках при ГЛПС, что сопровождается микротромбозами капилляров, гипоксией тканей и ацидозом, развитием отека межуточного вещества и микрогеморрагий. Быстрое повышение проницаемости мембран клубочков для белков крови обусловливает «белковый пушечный мочевой выстрел» — внезапную, массивную, но кратковременную протеинурию. Концентрационная способность почек при ГЛПС восстанавливается гораздо медленнее, поэтому у больных наблюдается длительная изогипостенурия. Поскольку длительность вирусемии при ГЛПС составляет от 4 до 7 дней, действие факторов, повреждающих почки, прекращается к 8—10-му дню болезни. Благодаря высокой регенераторной способности нефронов их функция восстанавливается относительно быстро (если больной не погиб). Возбудитель ГЛПС, циркулирующий в странах Европы, в отличие от азиатского варианта, обычно не приводит к развитию
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
535
ИТШ, острой недостаточности коры надпочечников, выраженному ДВС-синдрому. Поэтому ОПН у таких больных развивается преимущественно по ренальному типу, характеризуется более доброкачественным течением и меньшей летальностью.
При гемоглобинурийной лихорадке, осложняющей лечение маля-рии-vivax, отложение гемоглобина в просвете канальцев является не столько причиной, сколько следствием олигоанурии. При этом основной причиной развития ОПН является гемолитический криз с шоковой реакцией, что вызывает снижение почечного кровотока и нарушение микроциркуляции в сосудах почек. Массивный гемолиз при тропической малярии или лекарственный гемолиз при vivax-ма-лярии сопровождается образованием продуктов распада гемоглобина, вызывающих «цитокиновый взрыв»: выброс большого количества цитокинов, резко ухудшающих микроциркуляцию в почках, снижающих кровоток в клубочках и повышающих проницаемость их мембран. В результате этого продукты распада гемоглобина и эритроцитов попадают в ультрафильтрат и мочевые канальцы, давление в которых снижается, что способствует образованию цилиндров и преципитатов с последующей вторичной обструкцией мочевых канальцев.
Факторами, поражающими почки при тропической малярии, являются:
гемодинамический (при развитии ИТШ или малярийного алги-да);
гемолитический (острый внутрисосудистый гемолиз эритроцитов);
поражение печени;
в одно-электролитные нарушения, ацидоз, гипоксия (особенно при малярийном алгиде и малярийной коме);
нарушения микроциркуляции в капиллярах почки вследствие сладжа пораженных паразитами эритроцитов;
спазм афферентных артериол почек во время малярийного пароксизма.
Сходные черты имеет патогенез ОПН при инфекциях, сопровождающихся гемолизом эритроцитов (гемолитический компонент желтухи при лептоспирозе, сепсисе и генерализованных формах инфекций, протекающих по типу сепсиса).
Патогенетические механизмы ОПН при инфекциях, сопровождающихся выраженной гибелью исчерченных мышц (лептоспироз, столбняк) — рабдомиолизом, идентичны механизмам ОПН при гемолизе эритроцитов. Продукты распада миоглобина оказывают действие на микрососуды почек, аналогичное действию продуктов распада гемоглобина. Обструкция мочевых канальцев миоглобином также является вторичной. Массивный рабдомиолиз описывают ча-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
536
ще всего при столбняке, однако сообщалось об ОПН такого же ге-неза при тяжелом лептоспирозе, трихинеллезе, легионеллезе и даже гриппе. О развитии ОПН вследствие массивного рабдомиолиза следует помнить при всех инфекциях, которые могут сопровождаться поражением мышц любого генеза (микроциркуляторные, гипокси-ческие, трофические поражения, чрезмерная работа, непосредственное воздействие возбудителей или их токсинов, иммунокомп-лексные поражения).
В Украине особенно часто ОПН развивается при лептоспирозе. Основной причиной при этом является интерстициальный нефрит (см. соответствующий раздел). Однако иногда преобладают и другие механизмы поражения почек при иктерогеморрагическои форме лептоспироза с последующим развитим ренальной ОПН. Непосредственное действие токсинов лептоспир и иммунных комплексов на эпителиальные клетки канальцев и основную мембрану (некроз) приводит к повреждениям канальцев, коркового и подкоркового вещества почек. Наиболее выраженные поражения почек могут начинаться при исчезновении лептоспиремии и высокой лихорадки — с 6—8-го дня болезни. Они обусловлены длительным сохранением лептоспир в почках (до 2—3 нед, иногда— до 40 дней). При этом может страдать преимущественно эпителий мочевых канальцев, особенно отделы нефрона коркового вещества почек, где наиболее интенсивен кровоток. Однако лептоспиры не проникают внутрь клеток почечного эпителия, а располагаются на поверхности мембран клеток мочевых канальцев. Продукты гибели лептоспир, их токсины вызывают гибель эпителия, повышение проницаемости основной мембраны канальца с выходом ультрафильтрата в паренхиму почки, что вызывает отек, сдавление мочевых канальцев и повышение внутриканальцевого давления, вплоть до канальцевого коллапса и обратного тока мочи. Снижается скорость клубочковой фильтрации, усиливаются гипоксия, ацидоз, что вызывает замедление кровотока в клубочках и капиллярах почки, повышение проницаемости мембран клубочков, гибель эндотелия клубочков, попадание эритроцитов в ультрафильтрат и последующую выраженную эритроциту-рию и цилиндрурию, характерные для лептоспироза. Наибольшее повреждающее действие на почечный эпителий оказывают иммунные комплексы, содержащие IgM к лептоспирам и антигены лептоспир. Эти комплексы, благодаря наличию у части лептоспир специфических белковых рецепторов, не блокирующихся иммуноглобулинами, фиксируются на поверхности мембран клеток мочевых канальцев и активируют систему комплемента и лизосом почечных клеток. Однако аналогично может происходить поражение эпителия клубочков, что сопровождается, помимо эритроцитурии, еще и альбуминурией. Последняя развивается более постепенно (параллель-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
537
но нарастанию иммунных реакций замедленного типа), менее выражена, но сохраняется более длительно, чем протеинурия при ГЛПС. Указанные факторы в основном определяют развитие «поздней» ОПН при лептоспирозе — на 2-й неделе болезни. Однако, помимо перечисленных, факторами, способствующими (а иногда и определяющими) развитию ОПН при лептоспирозе, являются:
гемодинамический (раннее, на 2—4-е сутки развитие ОПН вследствие ИТШ);
микроциркуляторный (выраженные нарушения микроциркуляции в почках без ИТШ и при давлении в почечных артериях не ниже 60 мм рт. ст., но с микротромбозами, эритроцитарны-ми и тромбоцитарными сладжами в микрососудах почек, особенно при развитии ДВС-синдрома, что может отмечаться уже к концу 1-й недели болезни);
рабдомиолиз вследствие массивного поражения исчерченных мышц;
массивные некрозы тканей, особенно поджелудочной железы, с высвобождением большого количества протеаз, которые в последующем оказывают повреждающее действие на почечный эпителий, мембраны клубочков и мочевых канальцев;
печеночная недостаточность с образованием соединений, обладающих не только нейротоксическим, но и нефротоксическим действием, с выбросом в кровь большого количества протеаз вследствие разрушения лизосом печеночных клеток, с нарушениями гормонального (нарушение инактивации альдостерона в печени), белкового (гипоальбуминемия со снижением онкоти-ческого давления плазмы крови) и других видов обмена, что вызывает нарушения функции и гибель клеток соответствующих отделов нефрона;
водно-электролитные нарушения, метаболический ацидоз (к которым весьма чувствительны клетки почечного эпителия), развивающиеся при лептоспирозе вследствие обильной рвоты центрального генеза, гипертермии в первые дни болезни и т. д.
Таким образом, при лептоспирозе к развитию ОПН приводит очень много повреждающих почку факторов, действующих почти одновременно. Это определяет необычную тяжесть ОПН при лептоспирозе с очень высокой летальностью.
Особенности патогенеза редко развивающейся ОПН при дифтерии обусловлены различным возможным поражением почек. Ранняя ОПН развивается при гипертоксической форме дифтерии вследствие ИТШ и ДВС-синдрома, начинается преимущественно по пре-ренальному типу с последующим присоединением канальцевых механизмов. По пререналъному типу развивается и ОПН при тяжелой дифтерии, осложненной тяжелым миокардитом с явлениями выра-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
538
женной сердечной недостаточности и нарушениями гемодинамики, в том числе и почечной (см. соответствующий раздел). В дальнейшем развитию ОПН способствует поражение дифтерийным токсином в первую очередь нервных волокон, регулирующих тонус почечных сосудов, трофику паренхимы почки. Дополнительными повреждающими факторами являются циркулирующие иммунные комплексы и почечные аутоантитела, вызывающие поражения главным образом на уровне клубочков с развитием ОПН преимущественно по реналь-ному типу. Не исключают и прямое повреждающее действие дифтерийного токсина на эпителий мочевых канальцев.
Особенность ОПН при желтой лихорадке (см. соответствующий раздел) заключается в большом количестве повреждающих почки факторов — тех же, что и при лептоспирозе, за исключением прямого повреждающего действия возбудителя и иммунных комплексов на эпителий мочевых канальцев и выраженного гемолиза и рабдо-миолиза. Несколько чаще, чем при лептоспирозе, ОПН при желтой лихорадке развивается вследствие гиповолемического, геморрагического шока и ДВС-синдрома.
Этим же отличается патогенез ОПН при геморрагических лихорадках Ласса, Эбола, Марбург. Помимо специфического поражения почек (вирусами и иммунными комплексами), при этих заболеваниях ОПН может быть вызвана:
гемодинамическими факторами (ИТШ, дегидратационный шок);
микроциркуляторными нарушениями и ДВС-синдромом;
поражением печени;
водно-электролитными нарушениями, ацидозом и гипоксией паренхимы почек, эпителия мочевых канальцев вследствие дегидратации, гипертермии;
активацией протеолитических ферментов.
Эти же факторы, за исключением дегидратационного шока и выраженного поражения печени, могут обусловить развитие ОПН у больных тяжелой лихорадкой Конго-Крым. Однако при ней они выражены в меньшей степени, чем при африканских геморрагических лихорадках, а ОПН чаще всего развивается вследствие гиповолемического геморрагического шока на фоне массивных кровотечений.
ОПН на фоне вирусных гепатитов, осложненных ОПЭ, может присоединяться в терминальных ее стадиях, за исключением ВГЕ, при котором признаки тяжелого поражения почек иногда опережают первые симптомы печеночной прекомы, особенно у беременных (при ВГЕ не исключают как прямое вирусное, так и иммунокомплекс-ное поражение почек). При ОПЭ, осложняющей течение вирусных гепатитов, ОПН развивается вследствие:
— выраженного поражения почек токсическими продуктами, в
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 53д
том числе ароматическими соединениями, в норме обезвреживаемыми печенью;
снижения белковосинтетической функции печени и гипоаль-буминемии с последующим снижением онкотического давления плазмы крови и фильтрационного давления в клубочках;
выраженного увеличения протеазной активности крови, особенно при сопутствующем поражении поджелудочной железы, что вызывает лизис эндотелия клубочков и эпителия мочевых канальцев, повышение проницаемости мембран, отек паренхимы почек и последующее вторичное сдавление мочевых канальцев, повышение внутриканальцевого давления и снижение СКФ;
нарушения эндокринной регуляции функции почек в результате нарушения инактивации в печени гормонов (например, аль-достерона);
водно-элекролитных нарушений (гипокалиемия) и ацидоза (у пожилых людей — алкалоза);
нарушения микроциркуляции, в том числе и в сосудах почек, нередко с развитием ДВС-синдрома.
При инфекциях, осложняющихся дегидратационным шоком (холера, ПТИ, гастроинтестинальные формы сальмонеллеза, кишечного иерсиниоза, кампилобактериоза, эшерихиозов, гастроэнтеро-колитическая форма шигеллеза и др.), развивается преренальная ОПН, ее патогенез обусловлен относительной и абсолютной гипово-лемией, снижением почечного кровотока вследствие дегидратации и потери электролитов.
Гемодинамическим фактором с развитием ОПН преимущественно по преренальному типу обусловлено поражение почек и при инфекциях, часто осложняющихся инфекционно-токсическим шоком (менингококцемия, брюшной и сыпной тифы, чума, септическая форма сибирской язвы, генерализованный сальмонеллез, тяжелая колитическая форма шигеллеза и т. д.). Однако при этих инфекциях важную роль, в отличие от холеры и других инфекций, осложняющихся дегидратационным шоком, играют к тому же развитие ДВС-синдрома, активация протеаз, а нередко (например, при генерализованном сальмонеллезе, брюшном тифе, легионеллезе) и поражение самими возбудителями и (или) их токсинами тех или иных отделов нефрона («ренотиф»).
Критерии разграничения преренальной и ренальной ОПН при инфекционных заболеваниях часто весьма условны. Даже при ги-поволемическом (дегидратационном) шоке нельзя говорить о чисто преренальной ОПН.
В табл. 36 представлен патогенез ведущих клинических симптомов ОПН, имеющих наибольшее значение для ее диагностики у ин-
540-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Таблица 36. Патогенез ведущих клинических симптомов ОПН
Клинические симптомы ОПН
Патогенез клинических симптомов
Сухость во рту, жажда, осиплость голоса Повышение АД
Периферические отеки (при поражении почек по типу нефроза) Брадикардия, нарушения ритма сердца
Слабость, головокружение, нарушение сна, неврологические симптомы Нарушение зрения, «мушки», «туман» перед глазами Фибриллярное подергивание мышц
Судорожный синдром
Нарушение сознания
Кома
Тошнота, рвота, боль в животе, диарея
Геморрагический синдром Анемия, тромбоцитопения Присоединение вторичной' микрофлоры с развитием гнойно-септических осложнений
Внутриклеточная дегидратация, ацидоз
Повышение образования ангиотензино-гена II, вторичный альдостеронизм Снижение онкотического давления плазмы крови Альдостеронизм Гиперкалиемия
Поражение азотистыми шлаками ЦНС, уремия, метаболический ацидоз
Поражение ЦНС, отек дисков зрительных нервов
Гиперкалиемия и метаболический ацидоз
Азотемия с поражением ЦНС Отек-набухание головного мозга Уремия, азотемия с поражением ЦНС Отек-набухание головного мозга Отек мозга, терминальная азотемия (уремическая кома)
Поражение ЦНС, азотемия, метаболический ацидоз, дисэлектролитные нарушения
Азотемия, ацидоз, тромбоцитопения
Азотемия
Иммунодепрессивное действие избытка
продуктов азотистого обмена
Дефицит иммуноглобулинов
фекционных больных и для дифференциации ОПН с другими неотложными состояниями.
Клиника. В течении ОПН различают 4 стадии:
предолигурическая (начальная, или инициальная);
олигоанурическая, в которой можно выделить фазы:
а) олигурии;
б) анурии;
— полиурическая;
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
541
— реконвалесценции (восстановительная).
/. Клиника начальной стадии соответствует клинической картине того инфекционного заболевания, при котором развивается ОПН, т.е. не имеет каких-либо специфических проявлений. Данный период еще называют инкубационным, хотя в это время ОПН может быть диагностирована инструментальными и лабораторными методами (измерение СКФ, допплерография сосудов почек, радиоизотопная ренография, измерение клиренса креатинина, мочевины, натрия, соотношения осмолярности плазмы крови и мочи и т.д.). Между тяжестью течения ОПН и длительностью ее начального периода существует обратная зависимость: чем короче этот период, тем тяжелее ОПН.
//. Олигоанурическая стадия. А. При субклиническом течении ОПН протекает легко, с относительным снижением диуреза (неоли-гурическая форма ОПН, ОПН без олигоанурии), который может составлять более 1000 мл/сут, не сопровождается какими-либо клиническими симптомами, характерными для ОПН, выявляется лишь лабораторно и инструментально. Против «чисто» функциональных нарушений почек в таких случаях свидетельствуют результаты прижизненного морфологического исследования биоптатов почек, а также появление слабо выраженной полиурической фазы у таких больных. Эта форма ОПН чаще всего развивается при сальмонелле-зе с умеренной, вовремя не устраненной дегидратацией, а также при средней тяжести формах ГЛПС, лептоспироза. Продолжительность олигоанурической стадии при субклиническом (малосимптомном) течении ОПН обычно от 1 до 2 сут.
Основные критерии тяжести ОПН:
степень выраженности неврологических нарушений (заторможенность или возбуждение, степень нарушения сознания, изменения сухожильных и брюшных рефлексов, появление патологических рефлексов и судорожного синдрома) как проявление уремического синдрома;
степень желудочно-кишечных расстройств (тошнота, рвота, боль в животе, развитие острых язв желудка и кишечника, диарея или парез кишечника) также как проявление уремии;
степень выраженности геморрагического синдрома — от мик-рогеморрагий и повышенной кровоточивости до массивных смертельных кровотечений и гематом;
степень выраженности гемодинамических нарушений;
степень и длительность азотемии (содержание мочевины, креатинина, мочевой кислоты, аммиака в крови);
степень и выраженность электролитных нарушений, в первую очередь — гиперкалиемии, в том числе по клиническим прояв-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
542
лениям (частота пульса, наличие аритмии, изменения на ЭКГ, перистальтика кишечника, судорожные подергивания мышц);
степень ацидоза, внутриклеточной дегидратации и внеклеточной гипергидратации (периферические отеки, отек легких, мозга, судорожный синдром, повышение ЦВД, одышка, цианоз);
степень угнетения иммунного ответа при уремическом синдроме, проявляющаяся частотой и тяжестью бактериальных и грибковых суперинфекций, которые могут быть непосредственной причиной гибели больных.
Б. Олигурическая стадия при легкой форме ОПН ничем принципиально не отличается от субклинической формы и также нередко протекает без олигурии, но характеризуется появлением нескольких симптомов, характерных для уремии и не характерных для соответствующего периода того инфекционного заболевания, на фоне которого возникла ОПН. У больных появляются небольшая сухость во рту, незначительная жажда, слабость, головная боль, подташнива-ние без рвоты, повышенная возбудимость, снижается аппетит, ухудшается сон. Нарушения рефлексов, появление патологических рефлексов не характерны. Может быть небольшое послабление стула и несильная боль в животе. Геморрагический синдром не характерен, однако может усилиться до этого имевшийся (если он закономерно развивается при данной инфекции). Эта стадия при легкой форме ОПН обычно составляет от 1 до 3 сут. Почасовой диурез редко снижается ниже 30 мл/ч, отеки, нарушения сердечного ритма, одышка, повышение АД не характерны.
В. При средней тяжести ОПН в стадии олигурии характерны жалобы на жажду, сухость языка, глухой голос, что свидетельствуете внутриклеточной дегидратации, а также на головную боль, бессонницу, возбуждение, умеренную тошноту (рвота— редко), умеренную боль в животе, послабление стула. Объективно выявляют бледность кожных покровов без акроцианоза, умеренную тахикардию и приглушенность тонов сердца (может быть брадикардия за счет ги-перкалиемии), незначительно повышенные АД и ЦВД, небольшую одышку в покое, болезненность при пальпации живота, его вздутие, усиление перистальтики кишечника, микропризнаки геморрагического синдрома, повышение сухожильных рефлексов, анизорефлек-сию, снижение брюшных рефлексов, появление патологических рефлексов Гордона, Бабинского, Оппенгейма и др.
Кроме того, ОПН средней тяжести характеризуется относительно менее продолжительным начальным периодом (до 2—4 сут), чем при легком течении, большей продолжительностью олигурическо-го периода (до 4 сут), постоянством развития олигурии со снижением почасового диуреза менее 45—35 мл /ч в течение более суток.
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
543
Выраженный судорожный синдром и нарушения сознания, а также летальные исходы непосредственно от уремии не характерны.
Полиурическая стадия обычно выражена и может длиться несколько дней. Летальные исходы не характерны. Средней тяжести ОПН чаще всего отмечается при дифтерии, ГЛПС, инфекциях, осложненных дегидратационным шоком при относительно своевременном оказании неотложной помощи, при гемоглобинурийной лихорадке на фоне лечения vivax-малярии.
Г. Тяжелая форма ОПН отличается коротким (1—2 сут) начальным периодом, бурным началом без продромальных явлений. Больных беспокоят выраженная сухость во рту, сильные жажда и головная боль, тошнота, рвота, судороги, сильная боль в животе, которая наряду со вздутием живота и резкой болезненностью при пальпации без четкой локализации может имитировать острый живот. Для тяжелой формы характерен быстрый (в течение нескольких суток) переход олигурической фазы в анурическую.
В анурической фазе развивается значительная гиперкалиемия (концентрация калия в плазме крови > бммоль/л), которая клинически выражается резкой заторможенностью, парестезиями, снижением сухожильных рефлексов, фибрилляцией мышц. Кроме того, наблюдается абдоминальный синдром, для которого характерны метеоризм и боль в животе. На ЭКГ появляются признаки нарушения проводимости, может наступить остановка сердца. Бывают приступы судорог, но они в большей степени обусловлены азотемией.
Выраженный уремический синдром развивается в результате значительного накопления азотистых шлаков, что проявляется яркими признаками поражения ЦНС — усталостью, головной болью, фибрилляцией отдельных групп мышц, а в дальнейшем — анорексией, упорными тошнотой, икотой, рвотой (рвотные массы с запахом аммиака). При прогрессировании уремии возникает диарея (уремический понос), чередующаяся с запорами; нередко в последующем развивается динамическая непроходимость кишечника. При указанном синдроме иногда развиваются острые язвы желудка и кишечника, нередко осложняющиеся кишечными и желудочными кровотечениями, прободениями с развитием картины острого живота.
В дальнейшем нарастают заторможенность, сонливость, вялость, вплоть до возбуждения, потери сознания и развития комы. Типичным является зуд кожи. Со стороны органов дыхания отмечается аритмия дыхания по типу Чейна—Стокса.
Поражения органов кровообращения многообразны, но в основном выражаются перикардитом, иногда — полисерозитом. Уремия при тяжелой ОПН приводит к прогрессирующей анемии.
При тяжелой ОПН может быть гемолитико-уремический синдром, чаще возникающий у детей, но иногда встречающийся и у взрос-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
544
лых. Основными его клиническими проявлениями являются: сильная боль в животе, озноб, рвота, судороги, резкая боль в поясничной области. Возникает внутрисосудистый гемолиз вследствие токсического поражения эритроцитов и тромбоцитов с последующей их фрагментацией и блокадой ретикуло-эндотелиальной системы.
Вследствие растущей гиперазотемии нарушается тромбоцитооб-разование, приводящее к выраженной кровоточивости, массивным кровотечениям.
При выраженной азотемии часто угнетается иммунитет и присоединяются вторичные инфекции (вирусные, бактериальные, грибковые), которые могут быть непосредственной причиной гибели больных (сепсис, абсцессы головного мозга, тяжелые пневмонии).
Наиболее частыми причинами гибели больных в анурической фазе являются асистолия вследствие гиперкалиемии, отеки мозга, легких вследствие уремии, уремические кровотечения.
Полиурическая стадия может продолжаться до 1 нед, и в первые дни, несмотря на возросший диурез, может сопровождаться нарастанием азотемии и гибелью больных от прогрессирующей анемии. Следующей причиной гибели больных в этой стадии тяжелой ОПН являются выраженные потери воды и калия. В полиурической стадии при тяжелом течении ОПН наблюдают до 20 % случаев летальных исходов.
Восстановительная стадия характеризуется длительной (до 1 мес и более) астенизацией, нормализацией диуреза (но нередко с сохранением изогипостенурии и альбуминурии), исчезновением геморрагического синдрома, диспептических явлений и неврологических нарушений.
При крайне тяжелой (молниеносной) форме ОПН отсутствует начальный период, характерны бурное начало, крайняя выраженность всех перечисленных при тяжелой форме нарушений, быстрая гибель больных — в течение первых суток анурии. Сходна с фульми-нантной формой вирусных гепатитов по быстроте и внезапности развития и прогнозу, чаще всего возникает на фоне тяжелого ИТШ, анафилактического шока, холерного и малярийного алгида.
Клиника ОПН при инфекционных заболеваниях представляет собой отнюдь не простую сумму клиники собственно инфекции и симптомов ОПН. Так, при холере, осложненной ОПН, не отмечают повышения АД, периферических отеков, геморрагического синдрома. Своевременно проведенная регидратация даже при холерном ал-гиде приводит к быстрому восстановлению диуреза, купированию явлений дегидратационного шока с одновременным исчезновением уремии.
Своеобразной формой, преимущественно по ренальному типу, является ОПН при лептоспирозе, ГЛПС и некоторых других гемор-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
545
рагических лихорадках (желтой, Ласса, Марбург, Эбола), при фуль-минантной форме ВТ. Особенности клиники этих заболеваний, осложненных ОПН, изложены в соответствующих разделах.
При инфекционных заболеваниях, которые часто осложняются ИТШ (менингококцемия, чума, септические формы иерсинио-за, кампилобактериоза, сальмонеллеза, сибирской язвы, брюшной тиф), также часто развивается ОПН с соответствующим изменением клинической картины этих инфекций.
Осложнения. Большинство осложнений, возникающих на фоне ОПН, обусловлены азотемией, нарушениями КОС и водно-электролитного баланса. Наиболее характерны:
отек легких;
отек головного мозга;
плевральный выпот;
асцит;
экссудативный перикардит;
нарушения ритма сердца, асистолия;
судорожный синдром;
уремическая кома;
геморрагический синдром;
гемолитико-уремический синдром;
анемия;
острые уремические язвы желудка и кишечника, развитие острого живота;
кишечная непроходимость;
иммунодепрессия с развитием гнойно-септических осложнений (сепсис, тяжелые пневмонии, абсцессы внутренних органов).
Часть из перечисленных осложнений ОПН является непосредственной причиной гибели больных. Их наличие — это дополнительные критерии тяжести ОПН, требующие инвазивных методов экстракорпоральной интенсивной терапии (гемодиализ, перитонеаль-ный диализ, ультра фильтрация).
Исходы ОПН у инфекционных больных зависят в первую очередь от нозологической формы, на фоне которой развилось поражение почек. Так, септические формы чумы и сибирской язвы, осложненные ОПН, характеризуются 100% летальностью даже при массивной адекватной антибиотикотерапии в сочетании с противошоковыми мероприятиями. Высокая летальность (до 50 %) от ОПН наблюдается при желтушной форме лептоспироза, в то время как при ГЛПС, осложенной ОПН, в Европе летальность не превышает 1 %. Дальневосточный вариант возбудителя ГЛПС вызывал вспышки заболевания, при котором летальность от ОПН достигала 20 % и даже 30 %.
35 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
546
В олигоанурической стадии погибают от ОПН и ее осложнений до 80 % больных, а в полиурической — 20 %. Формирование хронической почечной недостаточности после ОПН у больных с инфекционной патологией не характерно, за исключением септических форм инфекций, способных переходить в хроническое течение с развитием амилоидоза почек и т.д.
После ОПН при ГЛПС, лептоспирозе могут отмечаться длительные (до 1 года и даже более) астенические и мочевые синдромы в виде протеинурии, изогипостенурии (чаще при ГЛПС). Могут быть осложнения в виде пиелоциститов, пиелонефритов, вызванные присоединением вторичной микрофлоры и требующие соответствующего лечения.
Диагностика. Общеклинические методы исследования. Общий анализ крови. При большинстве инфекций его показатели с развитием олигоанурической стадии ОПН изменяются пропорционально ее тяжести —сначала возникает тромбоцитопения, затем — гипохром-ная анемия, пойкилоцитоз, анизоцитоз, нейтрофильный лейкоцитоз, лимфопения, увеличивается СОЭ, отмечается анэозинофилия. Эти изменения обусловлены азотемией. Нарастающий гиперлейкоцитоз, тромбоцитопения, лимфопения и анемия являются прогностически плохими факторами даже в полиурической стадии ОПН.
Общий анализ мочи. Зависит от инфекции, вызвавшей ОПН. Так, при лептоспирозе значительно преобладает эритроцитурия (в мочевом осадке определяются измененные и неизмененные эритроциты) над лейкоцитурией, цилиндрурией, характерно наличие клеток почечного эпителия при небольшой или умеренной протеинурии и отсутствии изогипостенурии, однако массивная, внезапная протеи-нурия для лептоспироза не характерна.
При ГЛПС в моче преобладает массивная, внезапно появляющаяся (с 3—5-го дня болезни), но кратковременная (3—5 дней) протеи-нурия («мочевой белковый пушечный выстрел») с развитием с начала полиурического периода выраженной и длительной изогипостенурии. Эритроцитурия небольшая, преобладает цилиндрурия (вое-ковидные и гиалиновые цилиндры с клетками почечного эпителия),
Для олигурической фазы ОПН при холере эритроцитурия, проте-инурия, лейкоцитурия не характерны, как и для большинства других инфекций, при которых ОПН развивается преимущественно по преренальному типу. При инфекциях, протекающих с закономерным поражением почек, исследование общего анализа мочи следует отнести к специфическим методам диагностики ОПН.
Биохимические показатели. На биохимические показатели, характеризующие функциональное состояние почек, существенно могут влиять патологические процессы, сопровождающиеся повреждени-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
547
ем других органов (например, при ВГ, лептоспирозе). Это следует учитывать при интерпретации полученных данных.
Коагулограмма. Характеризуется при ОПН, развивающейся на фоне ДВС-синдрома, фазностью (см. главу «ДВС-синдром»). В целом для олигурической стадии ОПН присущи гипокоагуляционные изменения свертывающей системы крови.
Показатели азотистого обмена. Уже в начальной стадии ОПН отмечается повышение уровня креатинина (> 110 мкмоль/л), затем мочевины (>8,4 ммоль/л), остаточного азота (>28,6 ммоль/л), аммиака (>58,5 ммоль/л) в плазме крови. Наиболее информативен уровень креатинина, который не зависит от характера питания больных, но его следует осторожно учитывать при инфекциях с массивным поражением мышц и ОПН. Уровень мочевины в крови особенно малоинформативен при инфекциях с повышенным катаболизмом белков тканей или при присоединении ОПН к печеночной недостаточности (например, при фульминантном ВГ). Может отмечаться небольшое повышение калия в плазме крови, снижаться содержание гидрокарбоната, но без снижения рН крови.
В олигурической стадии ОПН уровни мочевины и креатинина в плазме крови продолжают нарастать, являясь достаточно точными критериями тяжести ОПН, и служат для контроля за эффективностью лечения.
В олигурической фазе нарастает содержание креатинина, мочевины, остаточного азота, аммиака, калия, фосфатов, магния в плазме крови, снижаются уровни кальция, основного буфера, нарастает дефицит буферных оснований со снижением рН крови.
В анурической фазе показатели креатинина, мочевины, калия в плазме крови, дефицит буферных оснований и рН крови могут достигать критических величии (приведены ниже), которые требуют срочного проведения гемодиализа. Значительно нарастают уровни фосфатов, магния, органических кислот, развивается декомпенси-рованный метаболический ацидоз. Отмечается значительная гипо-кальциемия.
В первые дни полиурической стадии ОПН содержание мочевины и креатинина в плазме крови также может нарастать, иногда достигая критических цифр (>884 мкмоль/л креатинина и >36,4 ммоль/л мочевины), что требует экстренного проведения гемодиализа или ультрафильтрации крови. И лишь с 3—4-го дня эти показатели начинают снижаться. Одновременно может развиться значительная гипокалиемия и гораздо реже — гипонатриемия.
Восстановительная фаза характеризуется постепенным снижением содержания мочевины, остаточного азота, креатинина, аммиака в плазме крови, нормализацией содержания калия, натрия, хлора, кальция, фосфатов, магния, буферных оснований.
35*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
548
Для диагностики тяжести и стадии ОПН обязательным является определение содержания калия в сыворотке крови. При большинстве инфекций его нарастание (>5 ммоль/л) отмечается несколько позже, чем развитие азотемии, только в начале олигурической стадии ОПН, и регистрируется не при всех инфекциях (например, при инфекциях, осложненных дегидратационным шоком и ОПН, при ОПЭ на фоне фульминантного ВГ с присоединением ОПН он может существенно не повышаться). В полиурической стадии ОПН, наоборот, может развиться гипокалиемия, которая может явиться причиной гибели больного.
Содержание хлора в плазме крови, в отличие от уровня натрия в моче и крови, осмолярности плазмы крови и мочи, гораздо менее информативно в силу описанных выше причин, но его определение обязательно при инфекциях, при которых ОПН является следствием дегидратационного шока.
Содержание фосфатов, магния и кальция в сыворотке крови весьма информативно. Их определение является дополнительным методом диагностики ОПН и установления степени ее тяжести, стадии. Для ОПН и у инфекционных больных характерны гипокальциемия и гипермагниемия, гиперфосфатемия, появляющиеся в олигурической стадии (поэтому их определение не может быть методами ранней диагностики ОПН, в отличие от определения продуктов азотистого обмена, осмолярности, концентрации натрия в плазме крови и параллельно в моче) и исчезающие в полиурической стадии.
Важным методом лабораторной диагностики ОПН является также исследование КОС. Уже в начальной стадии ОПН отмечают уменьшение содержание гидрокарбонатного буфера (SB<15 ммоль/л), дефицит буферных оснований ( —BE > 3 ммоль/л), снижение общей буферной емкости крови, а в олигоурической стадии — и снижение рН крови, что характеризует декомпенсированный метаболический ацидоз, проходящий лишь в конце полиурической стадии. Его степень отражает тяжесть течения ОПН и имеет прогностическое значение. При тяжелой ОПН основные параметры КОС должны определяться не менее 2 раз в сутки для своевременной консервативной коррекции или для своевременного перевода на гемодиализ или ультрафильтрацию. Так же не реже 2 раз в сутки при тяжелой форме ОПН определяют и содержание в плазме крови калия, натрия, мочевины, креатинина, осмолярность плазмы, гематокрит, ЦВД, тогда как при нетяжелых формах ОПН обычно достаточно контролировать эти же показатели 1 раз в сутки.
Основные показатели, которые следует контролировать при ОПН, и их динамика при различных стадиях ОПН представлены в табл. 37.
Дополнительную помощь в оценке тяжести ОПН и ее стадии мо-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
549
Таблица 37. Изменения основных лабораторных показателей крови у больных при различных стадиях ОПН
|
|
Направленность изменений |
|||
|
|
лабораторных |
показателей |
||
Лабораторные по- |
Нормальные |
при различных стадиях ОПН |
|||
|
|
|
|
||
казатели плазмы крови |
значения |
Начальной (инициальной) |
Олиго- ануричес- кой |
Поли-уричес-кой (начало) |
Восстановительной |
Мочевина |
2,5—8,3 ммоль/л |
f |
tt |
ttt |
4 |
Остаточный |
7,14—21,4 ммоль/л |
f |
tt |
ttt |
4 |
азот |
|
|
|
|
|
Креатинин |
М:44—120 мкмоль/л Ж:44—100 мкмоль/л |
t |
tt |
ttt |
4 |
Клиренс эндо- |
М: 0,107—0,139 |
4 |
44 |
t |
N |
генного креа- |
ммоль/мин |
|
|
|
|
тинина (плаз- |
Ж: 0,087—0,107 |
|
|
|
|
ма и моча) |
ммоль/мин |
|
|
|
|
Мочевая кис- |
М:125—464 |
t |
tt |
tt |
4 |
лота |
ммоль/ мин Ж:119—381 ммоль/мин |
|
|
|
|
Азот аммиака |
11—32 мкмоль/л |
t |
tt |
ttt |
4 |
Альбумин |
35—50 г/л |
N или t* |
4 |
t |
N |
Калий |
3,5—5,5 ммоль/л |
N или 4* |
tt |
4 |
44 |
Кальций |
2,1—2,6 ммоль/л |
N или 4* |
44 |
t |
N |
Фосфаты |
0,8—1,2 ммоль/л |
NhahT |
tt |
4 |
N |
Магний |
0,75— 1,25 ммоль/л |
N или 4* |
tt |
4 |
N |
рН (венозная) |
7,26—7,36 |
N или 4* |
44 |
4 |
t |
Осмолярность |
295—310 мосм/л |
t* |
tt - |
t |
4 |
Буферная ем- |
-2,5— +2,5 |
4* |
44 |
4 |
t |
кость (BE) |
ммоль/л |
|
|
|
|
* Изменения показателей при преренальной ОПН вследствие дегидра-тационного шока.
жет оказать сопоставление одноименных лабораторных показателей, определяемых одномоментно в крови и моче (табл 38).
Табл. 38 достаточно полно демонстрирует трудности ранней диагностики ОПН в предолигоанурическои стадии, а также трудности дифференциации преренальной (гемодинамическои функциональной) азотемии и начальной стадии ОПН, иллюстрирует необход'и-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
550
Таблица 38. Сравнительные результаты биохимических показателей крови и мочи, а также микроскопии мочи при разных типах олигурии
Показатель |
Норма |
Его значение при |
|
преренальной адаптивной олигурии |
начальной стадии преренальной ОПН |
||
Осадок мочи |
Обычный |
Обычный или |
Коричневые зер- |
|
|
содержащий зернистые и гиали- |
нистые цилиндры, обломки клеток |
|
|
новые цилиндры |
почечного эпителия, измененные эритроциты |
Мочевина: соотно- |
До 100:1 |
> 100: 1 |
>20: 1 |
шение концентра- |
|
|
|
ций моча/ плазма |
|
|
|
Осмолярность: соотношение моча/ |
До 1,5:1 |
>2,5: 1 |
>1,8: 1 |
плазма |
|
|
|
Осмолярность |
До 400— |
> 500 мосм/л |
< 400 мосм/л |
мочи |
500 мосм/л |
|
|
Креатинин: |
От 20—40 |
>40 |
<20 |
соотношение кон- |
|
|
|
центраций моча/плазма |
|
|
|
Содержание натрия в моче |
20— 40 ммоль/л |
<20 ммоль/л |
> 40 ммоль/л |
Концентрация натрия в моче/ |
1—1,5 |
<1 |
2 |
концентрация на- |
|
|
|
трия в плазме, раз- |
|
|
|
деленные на соот- |
|
|
|
ношение концент- |
|
|
|
раций креатинина в моче/ сыворотке крови, х 100 |
|
|
|
мость комплексной лабораторной диагностики с последующей математической обработкой материала, которая в современных лабораторных полианализаторах проводится автоматически с дальнейшим компьютерным анализом полученных данных.
Биохимические исследования крови и мочи на содержание в них
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 551
креатинина, мочевины, натрия, на их осмолярность следует проводить как можно раньше, при первом подозрении на ОПН, обязательно параллельно.
Параллельное определение концентрации мочевины и особенно креатинина в моче позволяет вычислить их клиренс и провести своевременную дифференциацию преренальной (гемодинамичес-кой) азотемии и начальной стадии почечной недостаточности (т.е. «почки при шоке» от «шоковой» почки). Более точно это можно сделать, одновременно определив осмолярность сыворотки крови и мочи, а также содержание натрия в сыворотке крови и моче.
Инструментальные методы диагностики. Важнейший и простейший из них, но абсолютно обязательный для больных ОПН в любой ее стадии — ЭКГ. На ЭКГ определяются изменения, характерные для гипокалиемии (брадикардия, отклонение электрической оси сердца влево, остроконечные зубцы Т, расширение желудочковых комплексов, увеличение интервала Р—R и снижение амплитуды зубцов Р) и гипоксии миокарда, она отражает тяжесть течения ОПН, если сердечная мышца не поражается при самой инфекции (как, например, при дифтерии).
Рентгенография органов брюшной и грудной полостей при ОПН позволяет своевременно выявить плевральный выпот, экссудатив-ный плеврит, асцит, парез кишечника, кишечную непроходимость, прободение уремических язв.
С этой же целью больным с ОПН обязательно выполняют УЗИ органов брюшной полости, почек, сердца. УЗИ позволяет провести дифференциацию с постренальной ОПН, обусловленной обструкцией мочевых путей камнями, опухолью. Допплерография при УЗИ почек дает дополнительную информацию о кровенаполнении мозгового и коркового вещества почек, венозном оттоке и артериальном притоке, что позволяет косвенно судить о преобладании пререналь-ных и ренальных причин ОПН. В стадии олигоанурии при УЗИ может выявляться увеличение почек, связанное с их отеком. При этом полостные системы почек мочи не содержат. Поэтому данный метод следует считать специфическим у инфекционных больных с ОПН.
Радиоизотопная ренография должна быть отнесена к специфическим, специальным дополнительным методам диагностики ОПН у инфекционных больных. Этот метод позволяет получить информацию о клубочковой фильтрации, секреторной и экскреторной функции почек, что может быть использовано при подозрении на обструкцию мочевых путей, а также при дифференциации преренальной и ре-нальной ОПН. Данный метод гораздо менее опасен у инфекционных больных, чем внутривенная урография, проведение которой с целью исключения обструкции мочевых путей в 4 раза повышает риск развития ОПН при использовании большинства рентгенконтрастных
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
552
препаратов. При инфекциях с высокой частотой поражения почек, при снижении почечного кровотока, у пожилых больных, страдающих сахарным диабетом или длительно получавших нестероидные противовоспалительные препараты, внутривенную урографию выполнять нельзя из-за высокого риска развития ОПН.
Критерии диагноза. Клинически диагноз ОПН устанавливается с учетом заболевания, на фоне которого она возникла, степени развития при этом заболевании наиболее вероятного механизма почечных нарушений. Обращать внимание следует на наличие у больного следующих изменений:
симптомов азотемии, проявляющейся неврологическими нарушениями, абдоминальными явлениями, геморрагическим синдромом;
симптомов нарушений водно-электролитного баланса с клеточной дегидратацией и внеклеточной гипергидратацией (жажда, сухость во рту, отеки);
симптомов электролитных нарушений (в первую очередь признаков гиперкалиемии);
снижение почасового диуреза (менее 35—45 мл/ч). Диагноз ОПН подтверждается изменением следующих
лабораторных показателей:
повышением продуктов азотистого обмена: креатинина, мочевины, азота мочевины и остаточного азота, аммиака;
наличием электролитных нарушений с повышением содержания калия, фосфатов, магния в сыворотке крови при снижении в ней содержания кальция;
наличием нарушений КОС со снижением буферной емкости крови и стандартного гидрокарбоната;
снижением осмолярности мочи менее 400 мосм/л при повышении концентрации натрия в моче более 40 ммоль/л;
соотношение концентраций креатинина в моче и в плазме крови менее 20.
Дополнительно диагноз ОПН подтверждается результатами радиоизотопной ренографии и ультразвуковой допплерографии.
Дифференциальный диагноз. Наиболее сложным считают дифференциальный диагноз ОПН в ее начальной, предолигурической стадии. При инфекционных болезнях его наиболее часто приходится проводить с функциональной азотемией преренального происхождения. Клиническая дифференциация этих состояний почти невозможна. Однако для адаптивной азотемии, в отличие от прере-нальной ОПН, не характерны:
зуд кожи;
сильная жажда и сухость во рту, особенно на фоне адекватной регидратационной терапии;
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
553
неврологические и абдоминальные проявления уремического синдрома;
геморрагический синдром;
сохранение креатинемии и азотемии, гиперкалиемии на фоне восстановления диуреза.
При быстром, своевременном восстановлении почечной гемодинамики при ИТШ или дегидратационном шоке явления азотемии при преренальной азотемии быстро исчезают («почка при шоке»), а при ОПН— сохраняются («шоковая почка»). Дополнительными, но более точными методами дифференциации этих состояний являются показатели, приведенные в табл. 38 (см). Из функциональных проб, позволяющих разграничивать адаптивную преренальную азотемию и начальную стадию ОПН, заслуживает внимания проба с медленным (8—12 капель в минуту внутривенно) введением раствора допамина (дофамина) —200 мг в 250 мл 5 % раствора глюкозы. При адаптивной азотемии такое введение увеличивает почасовой диурез (свыше 45 мл/ч) с одновременным уменьшением концентрации мочевины и креатинина в крови, что не наблюдают при ОПН. Однако в клинике инфекционных болезней данную пробу следует проводить лишь при ОПН ренального генеза, а также при преренальном типе ОПН, вызванной ИТШ или анафилактическим шоком, но не дегид-ратационным шоком. При последнем необходимо лишь внутривенное введение солевых растворов (см. соответствующий раздел).
Достаточно важную информацию дает и обычный анализ мочи. При начальной стадии ОПН в осадке мочи обнаруживают больше изменений (измененные эритроциты, восковидные, зернистые и гиалиновые цилиндры, измененные клетки почечного эпителия), чем при адаптивной преренальной азотемии. При последней относительная плотность мочи обычно остается нормальной, а при ОПН она снижается.
В олигурической стадии тяжелой ОПН с уремической комой дифференциальный диагноз следует проводить с печеночной комой, малярийной комой, мозговой комой (см. соответствующие разделы). Особую сложность представляет то, что всем перечисленным состояниям может сопутствовать и ОПН. Диагностика последней в таких случаях проводится на основании лабораторных исследований крови и мочи.
Лечение. При лечении больных с инфекционной патологией, у которых течение основного заболевания осложнилось развитием ОПН различного характера, необходимо соблюдать ряд общих правил:
при выборе лечебной тактики, особенно на ранних стадиях ОПН, для ликвидации возникших нарушений важное значение имеет четкий патогенетический подход;
необходимо стремиться в первую очередь устранить причи-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
554
ну развития ОПН, не забывая при этом о необходимости этио-тропной терапии основного заболевания;
этиотропные препараты не должны быть нефротоксичными (например, при развитии ОПН следует отменить аминоглико-зиды и сульфаниламиды);
при назначении этиотропных препаратов, выводящихся преимущественно почками (пенициллины, цефалоспорины), следует учитывать клиренс креатинина и другие показатели, позволяющие более точно дозировать антибиотик;
при назначении этиотропной терапии необходимо учитывать сроки развития ОПН при данной инфекции, период болезни (не показано введение противолептоспирозного иммуноглобулина при поступлении больного на 2-й неделе болезни и позже, зато оправдано сочетание ультрафильтрации с плазмафере-зом, учитывая преобладание иммунокомплексных поражений в этот период болезни);
ранее проводившаяся неотложная терапия должна быть изменена (с учетом появления ОПН) путем исключения нефроток-сических препаратов (например, аминокапроновой кислоты, производных поливинилпирролидона), а также препаратов, ухудшающих почечный кровоток (мезатон, адреналин) или вызывающих отек паренхимы почки (маннитол, сорбитол и другие осмодиуретики);
ограничение дозы кортикостероидов, если их назначали ранее для лечения ИТШ, анафилактического шока, так как они увеличивают катаболизм белков и азотемию, ухудшают почечный кровоток;
исключение энтерального поступления и ограничение парентерального введения белков (при тяжелой ОПН исключаются совсем);
назначение питания и питья, строго соответствующих показателям основного обмена (голод усиливает катаболизм белков и азотемию), суточного диуреза, ЦВД, гематокрита, КОС, электролитов крови, с обязательным учетом потерь с кишечным и желудочным содержимым при диарее и рвоте, с потом и выдыхаемым воздухом при гипертермии и одышке.
Больных с ОПН обязательно госпитализируют в отделения реанимации, где имеются аппараты для гемодиализа и (или) ультрафильтрации крови. В этих отделениях больные с ОПН инфекционного генеза должны находиться до окончания полиурическои стадии, Последнее положение нередко не соблюдается, что может являться причиной гибели в полиурическои стадии ОПН.
Оказание неотложной помощи на догоспитальном этапе при ОПН у больных с инфекционной патологией:
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
555
— провести все неотложные мероприятия, необходимые при дан ном инфекционном заболевании, так как ОПН при инфекциях чаще всего является «осложнением осложнений» -— ИТШ, де- гидратационного шока и т.д.;
-— до выведения из шока, послужившего причиной ОПН, транспортирование больных недопустимо;
— больному вводят внутривенно струйно 200 мл 2,4% раствора гидрокарбоната натрия (но при дегидратационном шоке — лишь солевые растворы типа «Квартасоль»), 10 мл 10 % раство ра кальция глюконата для устранения угрожающей жизни ги- перкалиемии, 10 мл 2,4 % раствора эуфиллина (но не при дегид ратационном шоке), т. е. даже простейшие неотложные меро приятия должны учитывать причину ОПН (подробнее см. соот ветствующие разделы);
-— одновременно проводят ингаляцию увлажненного кислорода (и интубацию при угрозе отека легких);
— при наличии рвоты промывают желудок через зонд ледяным (холодным) раствором с последующим введением антацидов для профилактики жеудочно-кишечного кровотечения (если рвота не обусловлена механизмами, связанными с основным заболеванием, и не является противопоказанием к промыва нию);
-— при наличии судорог, возбуждения вводят внутривенно медленно натрия оксибутират в обычной дозе (является антагонистом калия, антигипоксантом и поэтому считается препаратом выбора при купировании судорог при ОПН, за исключением дегидратационного шока, при котором судороги устраняют внутривенным введением только солевых растворов);
при недостаточном эффекте внутривенно дополнительно вводят 2—4 мл сибазона (реланиума, седуксена), избегают введения ренотоксичных барбитуратов, аминазина;
необходимо во многих случаях учитывать возможность смешанной патологии, поэтому оценивают целесообразность рекомендаций по отношению к основному заболеванию.
ОПН не является препятствием для транспортировки, если она не обусловлена шоковым состоянием.
Лечение ОПН в условиях стационара проводят с учетом ее стадии, тяжести и этиологии, возраста больных и характера сопутствующих заболеваний.
Лечение преренальной формы ОПН в инициальной (предолигури-ческой) стадии у инфекционных больных зависит от причины снижения почечного кровотока. Если ОПН развивается на фоне дегидратационного шока, то основным лечением будет внутривенная ре-гидратация солевыми растворами. При ОПН на фоне ИТШ также
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
556
проводят соответствующую терапию (см. соответствующие разделы). Никогда не следует до установления причины ОПН назначать форсированный диурез с применением салуретиков. У больных с ОПН по преренальному типу они вызывают дополнительные потери воды и ухудшают почечный кровоток, что усиливает прогрессирова-ние ОПН.
Наиболее эффективным является лечение, восстанавливающее почечную гемодинамику в течение 2—3 ч. Следует помнить, что улучшение функций почек иногда становится очевидным лишь спустя 24—36 ч после восстановления общей гемодинамики при ИТШ или дегидратационном шоке. Больным с преренальной формой ОПН на фоне ИТШ после проведения всех противошоковых мероприятий (см. соответствующий раздел) вводят внутривенно в течение 5— 10 мин осмодиуретики: маннитол в дозе 0,5—1,5 г/кг (введение мочевины противопоказано!). При этом обычно сначала вводят 100мл 25 % раствора маннитола, через 1—1,5 ч диурез должен увеличиться до 40—50 мл/ч. Тогда введение препарата продолжают с интервалом 6 ч, но не более 400 мл 25 % раствора в сутки. Если диурез не увеличивается, маннитол, как и другие осмодиуретики, больше не вводят, так как высока вероятность некроза канальцев (т. е. присоединения к преренальной ОПН ренальной). Маннитол в организме не метабо-лизируется, и если он не выводится с мочой, то накапливается в межклеточном пространстве, вызывая его гипергидратацию, что может вызвать отек не только почки, но и мозга, легких. В этой ситуации осмодиуретики могут увеличить отек паренхимы почки с последующим дополнительным сдавлением мочевых канальцев. Однако, в отличие от салуретиков, осмодиуретики увеличивают ОЦК, что оправдывает их осторожное применение для лечения ОПН на фоне ИТШ,
Больным проводят коррекцию ацидоза, гиперкалиемии, которые выявляются уже в инициальной фазе ОПН, отменяют нефротокси-ческие препараты (см. далее). Для предупреждения гиперкалиемии исключают лекарства, содержащие калий, внутрь назначают калий-связывающие ионообменные сорбенты.
Питание инфекционных больных с ОПН должно быть достаточно калорийным, что предотвращает распад эндогенных белков и усиление азотемии. При наличии показаний к парентеральному питанию (отсутствие сознания, неукротимая рвота, желудочно-кишечные кровотечения и т.д.) его проводят растворами аминокислот, глюкозы и, если позволяет состояние печени, эмульгированных жиров, В остальных случаях больным назначают диету, показанную при том инфекционном заболевании, которое осложнилось ОПН. Однако строго рассчитывают суточное количество жидкости, ограничивают употребление поваренной соли, продуктов, содержащих калий, и исключают поступление белков в кишечник. Особенностью ОПН
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 557
у инфекционных больных является значительная и быстро нарастающая азотемия вследствие повышенных катаболических процессов. Поэтому у больных должна быть небелковая достаточной энергетической ценности (2200—2600 ккал/сут, или 9196—10868 кДж/сут) диета. Питание и водный режим должны обеспечивать ежесуточную потерю массы тела больного в пределах 200—400 г. Большие потери свидетельствуют о чрезмерной дегидратации, а меньшие — о гипергидратации.
Лечение преренальной и ренальной форм ОПН в олигурической стадии. Первоочередные лечебные мероприятия:
ставят катетер в мочевой пузырь, который периодически промывают антисептиками, для измерения почасового диуреза (при исчезновении необходимости катетеризации катетер немедленно удаляют из-за высокой частоты восходящих уроин-фекций);
ставят подключичный катетер для внутривенных инфузий и контроля ЦВД;
обязателен постоянный назогастальный зонд для промывания желудка раствором натрия гидрокарбоната, предотвращения аспирации рвотных масс у больных с нарушенным сознанием;
дача увлажненного кислорода, при явлениях дыхательной недостаточности — интубация или трахеостомия (при дифтерии);
обязателен ЭКГ-контроль (в первую очередь для коррекции ги-перкалиемии).
Последующие мероприятия по оказанию неотложной помощи и лечению ОПН заключаются в коррекции выявленных нарушений в лабораторных показателях.
Наиболее опасной в олигоанурической фазе ОПН, развившейся по ренальному типу, является гипергидратация. Она сама по себе может усилить отек паренхимы почек, вызвать сдавление мочевых канальцев с усугублением тяжести ОПН. Поэтому применение ос-модиуретиков (маннитол) противопоказано из-за опасности увеличения интерстициального отека почки.
После восстановления водно-электролитного баланса и гемодинамики рекомендуют салуретики (250 мг фуросемида на 100 мл 5 % раствора глюкозы внутривенно капельно в течение 1 ч, следующие повторные введения до 1000 мг препарата в сутки, если почасовой диурез возрастает до 40—50 мл после первого введения). Если диурез остался менее 40 мл/ч, рекомендуют повторно ввести еще 500 мг фуросемида в 200 мл 5 % раствора глюкозы в течение 2 ч. Если диурез увеличивается, то препарат рекомендуют вводить в виде непрерывной инфузий (30—60 мг/ч) до общей суточной дозы фуросемида 2 г. Фуросемид нельзя назначать, если больной до этого получал амино-гликозиды!
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
558
Однако при ОПН, развившейся по преренальному типу, введение салуретиков обычно неэффективно и даже небезопасно. Следует учитывать, что при анурии фармакокинетика фуросемида (лазикса) меняется, так как в норме 80—90 % препарата выводится с мочой, а точкой приложения действия салуретиков является поврежденная почка. У больных с ОПН описаны такие побочные действия больших доз салуретиков:
усугубление нарушений водного и электролитного баланса;
сердечные аритмии;
ототоксичность;
нейтропения, тромбоцитопения;
нарушение деятельности пищеварительного тракта.
До полного восстановления гемодинамики при дегидратацион-ном, анафилактическом шоке, ИТШ введение салуретиков вообще недопустимо.
Поэтому в олигурической фазе ОПН основным лечебным мероприятием является поддержание оптимального водно-электролитного баланса, осмолярности плазмы крови. Для этого строго учитываются количество всех выделений больного; рвотных масс, мочи, выделений из кишечника. Количество вводимой парентерально и энте-рально жидкости в течение суток может превышать общее количество выделений на 400 мл при нормальной температуре тела. При ее повышении у лихорадящих больных можно добавлять по 500 мл на каждый 1 °С свыше 37 °С .
При внутривенном ведении жидкости строго учитывают ее суточный баланс для избежания гипергидратации. Надежным критерием является ежесуточное измерение массы тела. При этом положительной считают ежесуточную потерю массы на 400 г. Водный баланс больного следует оценивать каждые 12 ч — при помощи взвешивания и по карте баланса жидкости.
Необходим также контроль свертывающей системы крови с возможной антигеморрагической терапией (но без применения нефро-токсических препаратов!). Для борьбы с геморрагическим синдромом, помимо уже указанных мероприятий, внутривенно водят 5 мл 5 % раствора витамина С, 600 мг троксевазина (венорутона) — до 2400 мг/сут, каждые 2—3 ч внутривенно 2—4 мл натрия этамзила-та (дицинона), внутрь назначают ранитидин, антациды (но не маг-нийсодержащие) в обычной терапевтической дозировке для профилактики кишечных кровотечений. Внутривенно вводят ингибиторы протеолиза и фибринолиза— контрикал по 100 000 ME, гордоксдо 500 000 — 1 000 000 ME.
Обязательным является внутривенное введение 5 % раствора глюкозы (ее количество зависит от водного баланса) с инсулином (6— 10 ЕД) для устранения гиперкалиемии и парентерального питания,
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
559
предотвращения повышенного катаболизма белков в организме. Для устранения сохраняющейся гиперкалиемии, помимо 5 % раствора глюкозы с инсулином, рекомендуют внутривенно вводить 10 мл 10 % раствора кальция хлорида. При гиперкалиемии свыше 6,5 ммоль/л и невозможности срочно начать гемофильтрацию или гемодиализ введение кальция хлорида по 10 мл повторяют каждые 5 мин до общего количества 40 мл 10% раствора. Кроме этого, если сохраняются изменения на ЭКГ, свидетельствующие о гиперкалиемии, дополнительно внутривенно вводят 50 ммоль натрия гидрокарбоната (50 мл 8,4 % раствора). Следует отметить, что гипокалиемическим эффектом обладает и натрия оксибутират, который применяют для купирования судорог у больных с ОПН.
Ежедневно проводят промывание кишечника раствором натрия гидрокарбоната. Возможно назначение внутрь калийсвязывающих энтеросорбентов, однако их действие слишком медленное.
Для коррекции сохраняющегося ацидоза и дефицита буферных оснований внутривенно вводят от 250 до 500 мл 2,5 % раствора натрия гидрокарбоната. Количество вводимого раствора зависит от дефицита буферных оснований, которое уменьшают до 5 ммоль/л, но не далее, так как алкалоз более опасен. При невозможности из-за гипергидратации коррекции ацидоза введением щелочных растворов его устраняют проведением гемодиализа или гемофильтрации.
Для улучшения почечного кровотока и микроциркуляции, что особенно важно при преренальном типе ОПН на фоне ИТШ, анафилактического шока, внутривенно назначают допамин в дозе 1—2,5мкг/кг в минуту, его вводят не менее 24 ч (не прекращая) после стабилизации общей гемодинамики (так как почечный кровоток может восстанавливаться позже). Затем для улучшения почечного кровотока и микроциркуляции внутривенно капельно вводят 100—200 мг трентала (пентоксифиллина, агапурина) в 100 мл изотонического раствора натрия хлорида или 100 мл 5 % раствора глюкозы, введения повторяют до 3 раз в сутки в указанной дозе. Противопоказания к введению трентала: геморрагический синдром, нестабильная общая гемодинамика, ОПН вследствие дегидратаци-онного шока при неполном купировании его симптомов. После введения трентала рекомендуют внутривенное введение 300—600 мг троксевазина (для улучшения венозного оттока), а затем 40—80 мг фуросемида (но лишь после полного купирования признаков шока). Рациональность введения огромных доз (до 1 г) фуросемида в таких случаях вызывает не только сомнения, но и опасения. Более безопасным считают сочетанное внутривенное введение небольших доз до-памина (1мкг/кг в минуту) и фуросемида (по 100—200 мг) каждые 6 ч (не превышая суточную дозу 800 мг), если после первого введения почасовой диурез увеличился хотя бы до 40 мл.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
560
При неэффективности указанного лечения применяют экстракорпоральные методы детоксикации: перитонеальный диализ, гемодиализ, ультрафильтрацию крови. Гемосорбция и плазмаферез обычно малоэффективны. Однако при ОПН, развившейся на 2-й неделе лептоспироза, на фоне фульминантных форм вирусных гепатитов, плазмаферез может быть достаточно эффективным дополнением к ультрафильтрации крови.
Перитонеальный диализ имеет преимущества перед гемодиализом (но не перед современной ультрафильтрацией, плазмосорбци-ей) лишь у больных с выраженным геморрагическим синдромом.
В остальных случаях традиционно считается, что методом выбора является гемодиализ, имеющий следующие преимущества:
позволяет эффективно бороться со многими проявлениями ОПН (прежде всего, с ацидозом и гиперкалиемией);
удаление жидкости ликвидирует внеклеточную гипергидратацию и азотемию;
удаление азотистых шлаков разгружает почки, способствуя регенерации клеток мочевых канальцев;
гемодиализ можно (и нужно!) продолжать на фоне полиурии, что позволяет более тщательно устранять водно-электролитные нарушения.
Гемодиализ обычно рекомендуют при уровне клубочковои фильтрации ниже Юмл/мин и продолжают до ее повышения свыше 25 мл/мин. При невозможности измерить уровень клубочковои фильтрации гемодиализ проводят до полного восстановления нормального диуреза.
Однако следует учитывать, что гемодиализ у больных с ОПН с инфекционной патологией имеет ряд негативных для функции почек свойств:
при наличии преимущественно преренальной формы ОПН (для которой характерна потеря способности к ауторегуляции тонуса сосудов) гемодиализ даже может задерживать выход больных из состояния анурии;
отмечается повышенная чувствительность почечного кровотока к нервной регуляции, что сопровождается большими его колебаниями;
возможно поражение эндотелия почечных сосудов;
может задерживать восстановление функции почек при остром канальцевом некрозе (при лептоспирозе особенно!), что связано с еще большим снижением диуреза после начала гемодиализа, с возможными эпизодами снижения почечного кровотока и активацией системы комплемента.
Для уменьшения перечисленных негативных явлений предлагают проводить непрерывный гемодиализ с использованием биосовместимых мембран (не следует использовать купрофановые диализата-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 561
ры). При постоянном проведении гемодиализа или гемофильтрации, когда в единицу времени удаляется небольшое количество жидкости, отрицательные гемодинамические эффекты сглаживаются и легче переносятся больными почками.
Ультрафильтрация не только более безопасна, но и обладает рядом преимуществ перед гемодиализом:
возможен более эффективный и гибкий контроль за гидратацией, уровнем креатинина, электролитов крови, среднемолеку-лярных токсинов;
лучше переносимость удаления избытка натрия и воды;
меньше нагрузка на сердце (за счет нормализации сердечного выброса и снижения венозного возврата);
больше биосовместимость (за счет минимального контакта крови больного с диализной мембраной);
создаются лучшие условия для внутривенной инфузии лекарственных растворов;
отсутствуют осложнения, связанные с качеством диализирую-щей жидкости;
возможно удаление из крови токсических веществ с большей молекулярной массой.
Гемофильтрация может проводиться с артериовенозным или вено-венозным доступом. Последний обязателен при критической гипергидратации и нестабильной гемодинамике (гипотензия, падение сердечного выброса), да и технически он проще и доступнее. Получаемый при этом гемофильтрат содержит, кроме воды, мочевину, электролиты, среднемолекулярные вещества (токсины, медиаторы воспаления, цитокины, гормоны). Гемофильтрат частично или полностью замещают растворами Рингера и «Дисоль», которые лучше вводить параллельно в венозное русло. При этом концентрация мочевины в ультрафильтрате равна концентрации ее в сыворотке крови. Объем гемофильтрата может достигать 30 л и больше, однако в большинстве случаев он значительно меньше и зависит от уровня гипергидратации организма (в среднем 3—6 л). Это достаточно дорогая процедура, которая требует большого количества стерильных растворов.
Гемофильтрация у инфекционных больных с ОПН показана прежде всего в случаях, сопровождающихся массивным гемолизом (малярия — falciparum, гемоглобинурийная лихорадка) или рабдоми-олизом (тяжелый столбняк, лептоспироз), когда в кровяное русло попадает большое количество белков, которые не удаляются через мембрану обычного диализатора.
Абсолютными клиническими показаниями для срочного проведения гемодиализа или ультрафильтрации крови, перитонеального диализа у инфекционных больных с ОПН являются:
— наличие симптомов или угроза отека мозга;
36 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
562
угроза или признаки отека легких;
нарушение сознания, судорожный синдром;
анурия свыше 4 сут (существует мнение, что при лептоспирозе консервативное лечение следует проводить при анурии не более 2 сут).
При наличии перечисленных состояний к экстракорпоральным методам детоксикации приступают немедленно после госпитализации. Биохимическими критериями необходимости проведению гемодиализа или ультрафильтрации крови являются:
—уровень креатинина в плазме крови выше критического значения (0,884 мкмоль/л) или суточный прирост его более 0,2 мкмоль/л; —уровень мочевины в крови выше 36,8 ммоль/л или суточный прирост ее концентрации в плазме крови более 8,4 ммоль/л;
концентрация калия в плазме крови выше 6—6,5 ммоль/л или суточный прирост его в плазме крови более 0,5 ммоль/л;
рН крови ниже 7,24;
BE менее — 12 ммоль/л.
Помимо указанных, существуют и другие биохимические показатели (содержание аммиака, кальция, магния, фосфатов в плазме крови; о них говорилось выше), которыми также руководствуются для определения показаний к экстракорпоральным методам детоксикации, однако обычно достаточно использовать приведенные выше критерии.
Лечение ОПН на фоне малярийной комы требует отказа от применения глюкокортикоидов, гепарина. Особенности лечения ОПН при лептоспирозе, ГЛПС изложены в соответствующих разделах.
Лечение ОПН в полиурической стадиипе менее сложное. Оно заключается в строгой коррекции водного баланса (угроза дегидратации из-за полиурии!) и электролитного баланса (устранение угрозы гипокалиемии). Большой ошибкой является прекращение гемодиализа или ультрафильтрации у больных с начавшейся полиурией, поскольку азотемия и ее последствия могут нарастать в первые дни полиурической стадии. В этой стадии возможны также большие потери натрия, основного буфера с усилением ацидоза, большие потери белка, поэтому необходимо проводить соответствующую коррекцию. Гемодиализ или ультрафильтрацию прекращают лишь при восстановлении нормального содержания мочевины, креатинина, электролитов в плазме крови, при значительном улучшении основных показателей мочи.
Если гемодиализ в олигурической фазе ОПН не проводился, то потери калия при выраженной гипокалиемии корректируют внутривенным введением глюкозо-инсулино-калиевой смеси (3,7 г калия хлорида, 8 ЕД инсулина на 1000 мл 5 % раствора глюкозы) под контролем ЭКГ и содержания калия в плазме крови. Это способству-
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ 563
ет проникновению калия внутрь клетки с устранением дисбаланса внутриклеточной и внеклеточной жидкости.
Для коррекции гипонатриемии вводят внутривенно 3 % раствор натрия хлорида в расчетном количестве. Однако в этом обычно необходимости не бывает.
Чаще приходится устранять большие потери белка, вплоть до переливаний плазмы крови и сывороточного альбумина.
Нередко возникает тяжелая анемия, ее с трудом корригируют введением препаратов железа. Коррекция анемии проводится только при уровне гемоглобина ниже 100 г/л.
Для профилактики гнойно-септических осложнений назначают антибиотики, не обладающие нефротоксическим действием, если до этого само инфекционное заболевание не требовало антибактериальной терапии (например, ГЛПС).
В восстановительной стадии больных с ОПН долечивают в обычных профильных отделениях. Постельный режим необходимо соблюдать до:
нормализации АД и исчезновения отеков (если таковые были);
уменьшения протеинурии и эритроцитурии не менее чем в 10 раз по сравнению с исходным уровнем;
восстановления диуреза.
Длительность соблюдения постельного режима может определяться и тем инфекционным заболеванием, которое осложнилось ОПН. Необходимо помнить, что восстановительная фаза при ОПН инфекционного генеза может продолжаться до 3 и даже до 12 мес, обычно с полным восстановлением функции почек. Поэтому большая часть лечения в этой стадии проводится амбулаторно.
Порядок выписки из стационара. Больных выписывают после прекращения полиурии, с учетом порядка выписки при конкретной нозологической форме. Диспансерное наблюдение проводят до 1 года. Формирование ХПН для инфекционных больных не характерно.
Профилактика. ОПН у инфекционных больных заключается в своевременном устранении причин, наиболее часто приводящих к ее развитию: быстрое оказание неотложной помощи и купирование проявлений ИТШ, гиповолемического и анафилактического шока, своевременное назначение антибиотиков прилептоспирозе, исключение нефротоксических препаратов при инфекциях, возбудители (или их токсины) которых обладают нефротропностью. У инфекционных больных с дегидратационным шоком, ИТШ устранение артериальной гипотензии в течение 35—40 мин после ее развития в большинстве случаев предотвращает ОПН по преренальному типу.
36*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
564
Острая печеночная
недостаточность.
Фульминантный гепатит
Фульминантный гепатит — быстро прогрессирующий, угрожающий жизни вариант течения вирусного гепатита у лиц с ранее интактной печенью, обусловленный быстрым развитием тяжелой острой недостаточности всех функций печени вследствие ее массивного некроза, сопровождающийся развитием тяжелой энцефалопатии, геморрагического синдрома, токсической дистрофии и нарушения функции других паренхиматозных органов.
Лат. — hepatitis fulminans.
Англ. — fulminant hepatitis.
Значительное распространение острых и хронических гепатитов, особенно вирусных с парентеральным механизмом заражения, отравлений гепатотоксичными ядами, тяжелых медикаментозных гепатитов сделало чрезвычайно актуальной проблему острой и хронической печеночной недостаточности, ее диагностики и лечения. Она чрезвычайно сложна и многогранна.
По механизму развития различают Звида печеночной недостаточности, клинические проявления и патогенез которых во многом схожи:
печеночно-клеточная;
портокавальная;
смешанная.
Проявления портокавальной и смешанной печеночной недостаточности возникают при циррозе печени с высоким давлением в воротной вене и при наличии спонтанных или созданных оперативным путем портокавальных анастомозов. Эти 2 вида печеночной недостаточности обычно хронические, в то время как печеночно-клеточная может быть острой и хронической.
Острая печеночно-клеточная недостаточность может развиваться при многих острых и хронических патологических процессах различной этиологии, протекающих с поражением печени. Для клиницистов-инфекционистов наиболее актуальной остается острая печеночная недостаточность, развивающаяся при тяжелом течении вирусных гепатитов (ВГ). Самым неблагоприятным вариантом ее течения является фульминантный гепатит.
История и терминология. Желтухи, протекающие с тяжелыми психическими расстройствами, были известны еще во II в. до н. э.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
565
В 1842 г. С. Rokitansky впервые ввел понятие «острая желтая атрофия печени», описывая ее как самостоятельную нозологическую форму неизвестной этиологии.
В формировании научных представлений об «острой желтой атрофии печени» особое значение имели работы СП. Боткина (1888), который установил ее связь с инфекционным заболеванием — катаральной желтухой и рассматривал как «наивысшую степень тех изменений», которые наблюдаются при данной болезни.
В 1924 г. С. Herxheimer предложил заменить этот термин на «ге-патодистрофия» на том основании, что в печени погибших не было атрофии, а наблюдалась жировая или белковая дистрофия клеток органа. Однако это название, как и предложенные «гепатаргия», «токсическая дистрофия печени», тоже были дискутабельными, не отражая всей многогранности патологического процесса. В 50-е годы XX в. Н. Popper, H. Scheffner предложили использовать морфологический термин «массивный некроз печени».
Широко использовались такие клинические термины, как «печеночная кома», «острая дистрофия печени», «печеночная недостаточность с энцефалопатией», «острая печеночная недостаточность», «острая печеночная энцефалопатия», «фульминантная печеночная недостаточность».
Впервые термин «фульминантный» был использован J. Lucke и J.Mallory (1946) для обозначения молниеносных форм «эпидемического гепатита, завершающегося смертью больных в первые 10 дней болезни». Однако разные авторы этот срок ограничивали различными периодами — 3—8 нед и более от начала заболевания. В дальнейшем в большинстве случаев фульминантную печеночную недостаточность (ФПН) описывали как полиэтиологический клинический синдром, характеризующийся острым началом, прогрессирующей желтухой, уменьшением размеров печени, появлением энцефалопатии, печеночного запаха и возможным развитием комы.
Позже развитие острой печеночной недостаточности при ВГ стали рассматривать как особый, крайне тяжелый и быстротечный вариант этого заболевания— фульминантный гепатит (ФГ). И если острая печеночная недостаточность может развиваться при многих острых и хронических заболеваниях печени, то фульминантная печеночная недостаточность развивается только при острых поражениях печени, а фульминантные гепатиты — только при вирусных гепатитах.
Основные этиологические факторы острой печеночно-клеточной недостаточности:
острые вирусные гепатиты;
другие вирусные инфекции (желтая лихорадка, гепатиты, вызванные вирусами группы герпеса — вирусом простого герпе-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
566
са, цитомегаловирусом, вирусом Эпштейна—Барр, варицелла-зостер);
генерализованные формы риккетсиозов, микоплазмозов, смешанных грибковых инфекций;
острый сепсис при абсцессе печени, гнойном холангите;
отравления грибами (бледная поганка, гелиотроп, крестовик);
отравления гепатотропными ядами (хлоруглероды, алкоголь, фосфор и т.д.);
отравления лекарственными препаратами (передозировка парацетамола, тетрациклинов, аминазина, кетоконазола, ко-три-моксазола, сульфонамидов, туберкулостатиков, препаратов мужских половых гормонов, повторный фторотановый наркоз);
расстройства неизвестного происхождения: острый жировой гепатоз беременных (синдром Шихана), синдром Рея (при гриппе, энтеровирусной инфекции, связанный с приемом ацетилсалициловой кислоты), болезнь Вильсона;
острые нарушения кровообращения в печени;
тяжелое течение гемобластозов, лимфогранулематоза, обширные метастазы злокачественных опухолей в печень, состояние после химиотерапии по поводу онкопатологии.
Актуальность. Наиболее часто острая печеночная недостаточность возникает при ВГ, распространение которых приняло характер пандемии (см. том 1). В Украине ежегодно регистрируется до 10 тыс. случаев вирусных гепатитов, причем в последние годы отмечается стабильный рост заболеваемости. Наиболее частой причиной ФГ являются вирусы гепатитов В и D. Такая ситуация складывается в США, Франции, Германии. Частота развития ФГ при HBV-ин-фекции составляет около 1 %. Считается, что большое значение для их развития имеют мутантные штаммы вируса. В Японии подобные штаммы были выделены у 65—85 % больных фульминантными формами ГВ. Однако далеко не всегда удается это подтвердить, даже при использовании современных биомолекулярных технологий. Во многих других регионах мира подобная зависимость не прослеживается. Считается, что на ФГВ приходится до 35—70 % всех фульминант-ных вирусных гепатитов.
При HDV-инфекции ФГ развивается приблизительно в 5 % случаев, причем при коинфекции несколько реже, чем при суперинфекции, однако все же чаще, чем при изолированной HBV-инфекции, — в среднем в 2 % случаев. Летальность при суперинфекции достигает 20 %, при коинфекции она даже несколько ниже, чем при «чистом» ВГВ. В странах Западной Европы высокая частота HDV-инфекции с тяжелым течением наблюдается среди наркоманов.
Данные о связи HCV-инфекции с развитием ФГ весьма противо-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 567
речивы. Выявление РНК HCV при ФГ колеблется от 0 до 12% в США и странах Европы и до 43—59 % в Азии (прежде всего на Тайване и в Японии), однако во многих случаях она выявлялась одновременно с другими вирусами гепатитов. И все же большинство исследователей считают, что ФГ развивается при HCV-инфекции не так уж и часто. Пока неясна роль HGV-инфекции в развитии ФГ. По некоторым данным, до 20 % ФГ связано с вирусными гепатитами (кроме А и В), а также с токсическими гепатитами у наркоманов.
HAV-инфекция вызывает развитие ФГ значительно реже. В США уровень летальности от вирусного гепатита А составляет менее 0,01 %, однако среди лиц старше 50 лет смертность составляет уже 27 на 1000 человек, а ее пик приходится на возрастную группу старше 65 лет — 40 на 1000. Ежегодно в США от ФГА умирают около 100 человек, причем более 70 % старше 49 лет. Эти данные свидетельствуют, что ФГ преобладают у неиммунных пожилых пациентов. ФГ возникают чаще также в микстах гепатитов А + В или А + С у пациентов различных возрастных групп.
HEV-инфекция, к сожалению, встречается и в нашей стране (регистрируются как эпидемические вспышки, так и спорадические случаи). Тяжелое течение у беременных выявлялось в 28 % случаев с высокой летальностью, особенно в поздние сроки, в эндемичных районах — до 20—40 %, тогда как среди других категорий пациентов — единичные случаи. Наиболее опасен последний триместр беременности: если в I триместре летальность при ВГЕ, по данным некоторых специалистов, составляла 1,5 %, во II — 8,5 %, то в III — 21 % и более. Возможность фульминантного течения сохраняется и в ранний послеродовой период, прежде всего на 1-й неделе.
В последние годы все чаще встречаются фульминантные формы при микст-гепатитах, причем в самых разнообразных количественных и качественных комбинациях. Однако во многих случаях при ФГ не удается подтвердить вирусную этиологию болезни. Так, в Великобритании более 50% случаев ФГ остаются нерасшифрованными. Схожа ситуация и в некоторых других странах. Вместе с тем, описываются случаи ФГ, вызванного вирусами Эпштейна—Барр, ветряной оспы у пациентов без сопутствующего иммунодефицита. ФГ могут вызвать также вирусы герпеса 1, 2, 6-го типов. У детей возможно развитие ФГ, вызванного, кроме вируса гепатита А, вирусами Эпштейна—Барр, простого герпеса, цитомегаловирусом. Эти же вирусы приобрели особое значение вследствие развития ФГ у лиц с пересаженной печенью в условиях интенсивной иммуносупрессии. Допускается, что и иные, еще не идентифицированные вирусы ни А—Е могут вызвать развитие ФГ.
Классификация. В современной клинической практике выделяют особый вариант течения ВГ, который принято обозначать как «фуль-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
568
минантный гепатит». Такой диагноз устанавливают при острых, угрожающих жизни состояниях с прогрессирующей энцефалопатией, обусловленной массивным некрозом печени вследствие ее вирусного поражения, который развился в сроки до 8 нед после появления первых симптомов болезни у пациентов с ранее интактной печенью.
Это основные общепринятые признаки ФГ. Детали терминологии, построение классификаций достаточно противоречивы и не являются общепринятыми. Поданным одних авторов, субфульминант-ное течение отличается от фульминантного лишь более поздним развитием (примерно через 2 нед от появления желтухи), тогда как, по мнению других, субфульминантный вариант — это более постепенное, более длительное развитие ФПН. Иные считают целесообразным выделять следующие варианты течения ФПН:
сверхострое (1-я неделя желтухи);
острое (8—28 сут желтухи);
подострое (29 дней — 8 нед желтухи);
позднюю печеночную недостаточность (после 8 нед, но не позднее 24 нед от начала заболевания), не акцентируя внимание на скорости развития клинической симптоматики.
Отсутствие единых классификационных критериев ФГ препятствует адекватной оценке результатов консервативного и оперативного лечения в разных странах, более четкому определению критериев диагноза, показаний к пересадке печени.
Фульминантные варианты ВГ по клинической и морфологической характеристике существенно отличаются от острых. Фульминантная печеночная недостаточность, быстро нарастая, достигает большой степени выраженности. При этом от момента появления признаков печеночной недостаточности до финала проходит несколько суток (2—3), а иногда все заканчивается в пределах 24 ч.
Вместе с тем, даже при особо тяжелых формах скоротечность гепатита далеко не всегда достигает истинно молниеносной, возможен и так называемый субфульминантный вариант, при котором развитие ФПН длится не часы, но сутки и более. Однако и в этом случае темпы прогрессирования некроза печени существенно выше, чем при тяжелом течении обычной циклической формы ВГ.
ФПН может развиваться еще в конце преджелтушного — начале желтушного периода. Такое фульминантное течение считается ранним (1—2 нед желтушного периода). Но и субфульминантное течение может развиваться в начале желтушного периода. Если появлению клинических признаков массивного некроза печени более 2 нед предшествует обычное течение желтушного периода ВГ, то прогрес-сирование некроза печени может несколько растягиваться во времени, морфологически ему чаще соответствует субмассивный не-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
569
кроз печени; клинически чаще всего формируется позднее субфуль-минантное течение, хотя может возникать и позднее фульминантное
течение (рис. 33). При истинно фульминантном течении печеночная энцефалопатия (ПЭ) развивается буквально по часам, поэтому стадии практически не выделяются.
В клинической практике врачу приходится иметь дело с различными вариантами печеночной недостаточности:
истинные фульминантные гепатиты, которые возникают при ранее интактной печени и бурно прогрессируют;
печеночная недостаточность при гепатитах-микст, когда к уже имеющейся патологии печени (вирусной, токсической и т.д.) присоединяется по типу суперинфекции возбудитель ВГ. При этом тоже возможно быстрое прогрессирование патологического процесса, но механизмы его будут отличаться от истинных фульминантных гепатитов, учитывая особенности фоновой патологии. В этих случаях иногда приходится говорить о хронической печеночной недостаточности в стадии декомпенсации.
Факторы, способствующие развитию фульминантного течения
ВГ.
одновременное заражение несколькими гепатотропными вирусами. В таком случае существенно повышается возможность фульминантного течения. Преимущественно с такими ситуа-
ФГ
Фульминантное (сверхострое)течение
Позднее фульминантное
Раннее фульминантное
|
Субфульминантное течение |
|
||||
|
' |
' |
|
' |
' |
|
Раннее фульминантное |
|
Позднее фульминантное |
||||
Стадии ПЭ* Прекома 1 Стадия 0 (латентная)
Стадия 1 Стадия 2 Стадия 3 Стадия 4
Прекома 2 Кома 1 Кома 2
Рис. 33
Классификационная схема фульминантных гепатитов.
*В схеме приведено классическое и современное деление этапов развития ФГ
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
570
циями связано развитие этих форм при гепатитах А, С, коин-фекции при HDV-инфекции. Лишь при ВГВ фульминантное течение не зависит от наличия суперинфекции;
заражение мутантными формами вируса HBV-инфекции;
сопутствующие хронические заболевания печени утяжеляют течение при всех гепатитах;
беременность (особенно при ВГЕ, в меньшей степени — при ВГВ);
иммуногенетические факторы, так, например, наличие у больных генетически детерминированного гипериммунного ответа особенно важно для HBV-инфекции. Чрезмерный иммунный ответ кодируется антигенами В8, А1-В8 по системе HLA. Чаще фульминантное течение ВГВ отмечается у женщин, чем у мужчин, у людей со склонностью к аллергическим реакциям, у лиц с группой крови А(В);
дополнительные воздействия, которые существенно отягощают течение основного заболевания (тяжелая физическая нагрузка, тяжелая психическая травма, острое токсическое поражение печени, наркомания), особенно в преджелтушный и начальный период желтухи.
Прежде чем рассмотреть патогенез этого состояния, необходимо коротко напомнить о роли печени в организме человека, акцентируя внимание на моментах, особенно важных для понимания патогенеза (более подробно изложено в главе «Вирусные гепатиты», см. том 1) или обоснования лечебной тактики при этом состоянии.
Печень — центральный орган метаболизма. Она регулирует водно-солевой и энергетический баланс (вырабатывает до 15 % общего количества макроэргов), КОС, систему свертывания крови, теплообмен и детоксикацию. Промежуточный обмен углеводов, белков, аминокислот и липидов, синтез белков и липопротеидов плазмы крови, конъюгация билирубина и образование желчи, метаболизм лекарств и гормонов — это перечень только некоторых из основных функций этого органа.
Печень не только синтезирует плазменные белки и прежде всего альбумин, но также катаболизирует и накапливает белки. Ежедневно она образует приблизительно 10 г альбумина. При необходимости печень может выделить количество белков, достаточное для восстановления 1 л плазмы крови.
Активнейшее участие печень принимает в обмене жиров и глюкозы. Нарушение функции печени, гипоксия приводят к накоплению молочной кислоты, которая благоприятствует развитию метаболического ацидоза, а в больших количествах оказывает токсическое действие. Другой продукт окисления глюкозы — пировиноградная
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙГЕПАТИТ
кислота — связывает в единое целое метаболизм глюкозы, белков и жирных кислот.
Дезинтоксикационная функция печени основана на ферментативных процессах: синтезе мочевины из аммиака, окислении, восстановлении, гидролизе и конъюгации. Этими путями обезвреживаются многие вещества, причем конечные продукты не всегда-теряют свою токсичность после пребывания в печени, но они превращаются в более растворимые формы и выводятся с желчью и мочой. Для значительного подавления синтеза мочевины и повышения уровня аминокислот в сыворотке крови необходимо удалить по крайней мере 85 % печени. Большинство лекарственных препаратов разрушается в печени путем гидролиза.
Непосредственно в печени синтезируются почти все прокоагу-лянты, наиважнейшие факторы противосвертывающей системы — антитромбин III и антиплазмины. В ней же происходит деградация активированных коагуляционных факторов и фибринолитических ферментов.
При поражении печени (особенно диффузном, что происходит при ВГ) нарушаются все эти функции, хотя степень нарушений каждой из них не происходит абсолютно параллельно, а зависит от множества факторов.
Патогенез фульминантного течения ВГ, несмотря на интенсивное исследование этой проблемы, до конца не изучен. Это касается вопросов причин развития ФГ, многих механизмов повреждения гепатоцитов и вторичных изменений в органах при развивающейся ПЭ. И если ранее интенсивно исследовались причины и механизмы энцефалопатии при циррозах печени, то лишь значительный рост заболеваемости ВГ вызвал необходимость изучения проблемы механизмов развития ПН при фульминантных ВГ.
В результате изучения ПЭ было выдвинуто много теорий (аммиачная, аминокислотная и т.д.) и ни одна из них, по сути, не была в дальнейшем отброшена. Происходило постепенное их объединение, уточнение конкретных механизмов взаимодействия различных повреждающих факторов.
В настоящее время наиболее полно отражает представление о патогенезе ПЭ гипотеза («нейроглии»), согласно которой эндогенные нейротоксины и аминокислотный дисбаланс, возникающие в результате печеночно-клеточной недостаточности и/или портосис-темного шунтирования крови, приводят к отеку и функциональным нарушениям астроглии. Последние изменяют проницаемость ГЭБ, активность ионных каналов, нарушают процесс нейротрансмиссии и обеспечения нейронов макроэргами. Эти изменения и проявляются клиническими симптомами ПЭ. Но если при циррозах печени це-ребротоксические вещества имеют в основном «кишечное» проис-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
572
хождение, то при ФГ — в первую очередь эндогенный (деструктивный) характер. Истинное понимание механизмов развития симптоматики при ФГ и даже понятия «церебротоксические вещества» их влияния на ЦНС и другие органы и системы еще впереди.
Следует также понимать, что при ФГ отмечается системная недостаточность печени, всех ее функций, которая в дальнейшем приводит к недостаточности других паренхиматозных органов и мозга. Ее появление возможно при вовлечении в процесс значительной части функционирующей паренхимы печени. Развитие тех или иных нарушений функции печени при различных вариантах течения ВГ (хо-лестаз, например) нельзя отождествлять с острой печеночной недостаточностью.
Поражение гепатоцитов. Механизм поражения гепатоцитов отличается при различных вирусных гепатитах. Об этом подробно описано в соответствующей главе (том 1). Вместе с тем, при ФГ имеются данные о возможности развития двух типов патологического процесса:
гипериммунного;
иммунотолерантного (репликативного).
Первый вариант наблюдается в случаев фульминантной HBV-ин-фекции, второй тип встречается достаточно редко, поэтому изучен мало, как и особенности его лечения.
Важное значение при ФГ имеет не только обширность поражения, но и подавление механизмов регенерации гепатоцитов, которое и определяет бурный, нарастающий в объеме, быстро прогрессирующий во времени некроз печени (в обычных ситуациях происходит быстрое восстанавление структуры органа). При фульминантном течении ВГ появляются цитотоксические агенты, которые, с одной стороны, поддерживают активный аутолиз гепатоцитов, с другой — подавляют процессы регенерации печени. Такие ингибиторы образуются уже при минимальном объеме некроза печени, возможно именно они определяют дальнейшее прогрессирование этого процесса. В условиях нарастающего воздействия ингибиторов даже введение фактора роста печени не усиливало ее регенерацию. Быстрое массивное поражение функционирующих гепатоцитов приводит к нарушению всех видов обмена в печени.
Нарушение белкового обмена, обмена гормонов. В результате повреждения гепатоцитов развивается нарушение белкового синтеза, которое приводит к гипопротеинемии (гипоальбуминемии), снижению онкотического давления, появлению интерстициальных отеков, асцита, иногда — полисерозита. Ускоряет появление отеков и асцита повышение уровня альдостерона в результате нарушения его обезвреживания в печени и накопления в крови. Это в свою очередь приводит к задержке натрия и, следовательно, воды, блокированию действия салуретиков.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 573
Отек печени, развитие ДВС-синдрома сопровождаются нарушениями микроциркуляции в органе, развитием гистотоксической гипоксии, усугублением нарушения обмена веществ, прежде всего нарушением образования трикарбоновых кислот, обеспечивающих процессы биологического окисления и образование макроэргов. Гипопротеинемия увеличивает венозное шунтирование в легких, нарушает альвеолярно-капиллярную диффузию кислорода вследствие интерстициальных отеков, что вызывает нарастание гипоксии всех органов и систем, в том числе и печени. Гемическая гипоксия усиливает гистотоксическую гипоксию, углубляет нарушения обмена веществ.
Нарушение КОС, Высокая концентрация аммиака (нарушается образование мочевины) раздражает дыхательный центр и усиливает одышку, возникающую компенсаторно вследствие гемической гипоксии. Гипервентиляция приводит к гипокапнии, респираторному алкалозу, который нередко сочетается с метаболическим алкалозом (следствие гипокалиемии). Создается парадоксальная ситуация: системный смешанный алкалоз и метаболический ацидоз в печени. Алкалоз может усубляться длительной аспирацией желудочного содержимого или бесконтрольным введением оснований, а сам он в свою очередь ухудшает диссоциацию оксигемоглобина, снижает уровень мозгового кровотока и периферическую тканевую перфузию, в результате чего усиливается гипоксия мозга, стимулируется анаэробное окисление глюкозы, нарастает метаболический ацидоз в нейронах и, как его следствие, возникают явления отека мозга.
Нарушение углеводного обмена в печени приводит к уменьшению запасов гликогена, поэтому она не в состоянии обеспечить основной обмен во всех органах и системах. В такой ситуации следствием острой печеночной недостаточности является резкое уменьшение образования макроэргов, повышение проницаемости, отек и дезинтеграция биологических мембран гепатоцитов. «Взрыв лизосом» сопровождается выходом в цитоплазму активных гидролитических ферментов и последующим аутолизом и некрозом клеток.
Нарушение белкового синтеза в печени вызывает значительное снижение продукции факторов свертывания крови и противосвер-тывающей системы крови, что создает предпосылки для появления кровотечений и быстрого прогрессирования ДВС-синдрома. Кроме того, возможно образование структурно неполноценного фибриногена (содержит избыток остатков сиаловой кислоты), что приводит к нарушению полимеризации фибрин-мономера. Нарушение обезвреживания активированных факторов свертывания крови и фибри-нолитических ферментов, которые активируются при лизисе гепатоцитов, также способствует развитию ДВС-синдрома.
Одним из основных нейротоксинов организма является аммиак.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
574
В организме постоянно поддерживается равновесие между его образованием и обезвреживанием. Основными органами, в которых образуется аммиак, являются: толстая кишка (в ней он образуется в результате гидролиза белка и мочевины кишечной микрофлорой), мышцы (при физической нагрузке пропорционально ее тяжести), почки (продукция аммиака существенно повышается при гипокали-емии), тонкая кишка (при распаде глутамина — основного источника энергии клеток слизистой оболочки). До 50% аммиака образуется при расщеплении белков в печени.
Аммиак обезвреживается двумя основными механизмами: путем синтеза мочевины в печени (орнитиновый цикл в перипортальных гепатоцитах) и при образовании глутамина. Следствием нарушения образования мочевины из аммиака, обезвреживания меркаптанов, нарушения обмена аминокислот с накоплением тирозина, фени-лаланина, триптофана является развитие энцефалопатии. Высокая концентрация аммиака, необходимая для функционирования глут-аминового цикла, поддерживается постоянным притоком из воротной вены и значительной активностью глутаминсинтетазы в этих же клетках. Синтез глутамина происходит также в мышцах и астроци-тах головного мозга. В печени глутамин синтезируется в небольшой популяции перивенозных гепатоцитов (около 5—10 % от числа всех клеток паренхимы). Синтез глутамина происходит в них при небольших концентрациях аммиака. Образование глутамина в других органах служит прежде всего для транспорта аммиака в нетоксичной форме. Гипераммониемия связана со снижением синтеза в печени мочевины и глутамина. Аммиак в неионизированной форме легко проникает через ГЭБ в головной мозг. Избыток глутамина в итоге приводит к уменьшению транспорта Н+ и снижению синтеза АТФ. Аммиак также непосредственно влияет на проницаемость ГЭБ, стимулируя транспорт ароматических аминокислот в головной мозг. В результате этого усиливается синтез ложных нейротрансмиттеров и серотонина. Повышенные концентрации аммиака снижают также плотность постсинаптических серотониновых рецепторов и увеличивают их аффинность.
К группе эндогенных нейротоксинов относятся также меркаптаны, коротко- и среднецепочечные жирные кислоты, фенолы.
Меркаптаны являются продуктами бактериального гидролиза се-русодержащих аминокислот (метионин, цистеин, цистин) в толстой кишке. В норме они обезвреживаются печенью. При ФПН в крови повышается концентрация меркаптанов, именно они являются причиной foetor hepaticus (печеночный запах). Механизм действия меркаптанов связывают с торможением Na+, К + -АТФазы в мембранах нервных клеток и увеличением транспорта ароматических аминокислот в головной мозг.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 575
Коротко- и среднецепочечные жирные кислоты образуются из пищевых жиров под воздействием бактерий кишечника, в условиях печеночно-клеточной недостаточности — в результате неполного распада жирных кислот. Механизм их нейротоксичности связывают также с торможением нейронной Na+, К + -АТФ-азы, угнетением синтеза мочевины в печени, что способствует гипераммониемии. Возможно, что они вытесняют триптофан из связи с альбумином, увеличивая таким образом поток триптофана в головной мозг.
Фенолы (дериваты тирозина и фенилаланина) также образуются в кишечнике под воздействием бактерий. В эксперименте на животных высокие концентрации фенолов вызывали развитие печеночной комы. Однако считается, что в развитии ПЭ у людей они, по-видимому, самостоятельного значения не имеют.
Наряду с эндогенными нейротоксинами, другой важной причиной функциональных нарушений астроглии является аминокислотный баланс, приводящий к синтезу ложных неиромедиаторов (фальшмедиаторов).
Аминокислотный дисбаланс характеризуется увеличением уровня ароматических аминокислот фенилаланина, тирозина, триптофана и снижением концентрации валина, лейцина, изолейцина. Коэффициент Фишера (валин + лейцин + изолейцин/фенилаланин + тирозин), в норме равный 3—4,5, снижается при ПЭ до 1 и ниже. Все эти аминокислоты конкурируют за одни и те же транспортные системы, поэтому повышение концентрации в крови последних приводит к их значительному поступлению в головной мозг. Но ферментные системы мозга не в состоянии обеспечить обычный метаболический путь повышенному потоку ароматических аминокислот. Фенилаланин в высоких концентрациях тормозит тирозин-3-монооксиге-назу — фермент, необходимый для синтеза допамина. Следствием этого является синтез так называемых ложных нейротрансмиттеров (Р-фенилэтаноламин и октопамин), структурно подобных, но существенно менее активных веществ, чем норадреналин и допамин.
Одним из важных факторов считается активация в ЦНС рецепторов для ингибирующих нейротрансмиттеров — у-аминобутировой кислоты и бензодиазепинов под воздействием соединений эндогенного происхождения. Большое значение в регуляции сна и поведения имеет содержание серотонина и его 5-НТ-1-рецепторов в ЦНС. Увеличение концентрации триптофана в крови и головном мозге приводит к усилению синтеза серотонина.
При ФГ снижается активность трансаминазы у-аминомасляной кислоты (ГАМК) в печени — основного фермента реакции обезвреживания тормозного медиатора ГАМК, что приводит к накоплению последнего. ГАМК, образованная в кишечнике бактериальной микрофлорой, проникает в ЦНС, где и проявляет свой угнетающий
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
576
эффект. В обычных условиях ГЭБ непроницаем для ГАМК, но вследствие отека астроглии барьерная функция значительно нарушается. ГАМК-эргические рецепторы могут активироваться эндогенно образованными и экзогенно поступившими бензодиазепинами, что объясняет развитие и усиление симптомов ПЭ при применении се-дативных препаратов.
Характерно, что не установлена жесткая связь между концентрациями каждого в отдельности из перечисленных эндогенных нейро-токсинов или аминокислот и степенью тяжести течения ПЭ. В эксперименте показан синергический эффект относительно нейротокси-ческого действия солей аммония, метантиола и октановой кислоты, октопамина и триптофана (предшественника серотонина) в возникновении ПЭ.
Таким образом, ПЭ является результатом комплексного воздействия и взаимного усиления нескольких факторов: эндогенных ней-ротоксинов, среди которых ведущее значение имеет аммиак, аминокислотного дисбаланса и изменения функции нейротрансмиттеров и их рецепторов— это один из вариантов метаболической энцефалопатии.
В итоге необходимо еще раз отметить, что патогенез фульминант-ного варианта ВГ значительно более сложный и многогранный: статус основной биохимической лаборатории человеческого организма и нарушение всех функций печени приводят к значительно более сложным комплексным нарушениям гомеостаза, которые еще предстоит выяснить.
Причинами смерти при ФГ являются фатальный отек мозга с вклинением ствола мозга, некробиоз ткани печени с последующими грубыми дистрофическими изменениями всех органов и систем и развитием их недостаточности (рис. 34).
При фульминантном течении чаще всего массивный некроз распространяется почти на всю печеночную дольку, сохраняется лишь небольшая часть клеток по ее периферии. Печень быстро уменьшается в размерах. При субфульминантном варианте (начальные стадии ПЭ) некроз затрагивает лишь центр долек, сохраняются непораженные зоны, процесс уменьшения размеров печени несколько длительнее. При фульминантном ВГВ изменения в дольке могут ограничиваться мостовидным некрозом без признаков его слияния. Однако эти изменения часто распределены в паренхиме печени неравномерно.
Клиническая картина. Клинические проявления фульминантно-го и субфульминантного течения ВГ очень близки. Основная разница заключается в темпе прогрессирования морфологических и клинических проявлений. Дм* фульминантного течения характерно раннее и быстрое появление признаков некроза печени в полном
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫИ ГЕПАТИТ
577
Массивный цитолиз гепатоцитов
Нарушение
функций
печени
ДВС-синдром
Дезинтоксикационной, инактивации гормонов
Белково-синтетической
 Накопление
аммиака, других токсичных продуктов,
гормонов
Накопление
аммиака, других токсичных продуктов,
гормонов
Синтез фальш-медиаторов
Гипопротеи-немия
Падение синтеза факторов свертывания крови
Гипоксия тканей
Дистрофия паренхиматозных органов
Кровотечения, микротромбозы
Полиорганная недостаточность
Рис. 34
Патогенез развития полиорганной недостаточности при фульминантных гепатитах
-17 — 2-3077
578-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
объеме, короткая (несколько часов) фаза прекомы и быстрый переход в кому. В такой ситуации практически отсутствуют этапы развития процесса с характерными клинико-лабораторными признаками. Морфологически этому варианту соответствует массивный некроз печени; иногда макроскопические изменения даже не успевают развиться и изменения в виде полной дезинтеграции клеточных мембран выявляются только микроскопически. При субфульминантном течении более постепенное (сутки и более) нарастание клинических признаков острой печеночной недостаточности. Именно при таком варианте течения возможно разделение на клинические стадии. Морфологически ему чаще соответствует субмассивный некроз печени. Фульминантное течение ВГ встречается значительно реже, чем субфульминантное.
Клиническая картина ФГ состоит из симптомов поражения печени, вторичного поражения мозга и других органов и систем.
Симптомы поражения ЦНС являются одними из наиболее ярких при развитии ФГ, их выраженность и определенная этапность развития во многом отражают глубину поражения печени. Острая печеночная недостаточность может прогрессировать чрезвычайно бурно, явления энцефалопатии быстро переходят в кому, если не блокируются этиологические и патогенетические факторы, способствующие ее возникновению и развитию.
Клинические проявления ПЭ складываются из нарушений психики, нервно-мышечных расстройств и изменений ЭЭГ. Традиционно различают 4 стадии ПЭ при ФГ (табл. 39).
Таблица 39. Стадии развития острой печеночной энцефалопатии
Стадия
Клинические проявления
ПрекомаI
Прекома II
Кома I (начальная, неглубокая)
Кома II (глубокая)
Эмоциональная неустойчивость (эйфория, сменяющаяся апатией), адинамия, обмороки, заторможенность, головокружение, нарушение ритма сна, провалы памяти, ощущения проваливания, акцентуация личности, нарушения сложных движений
Спутанное сознание, тремор, психомоторное возбуждение или сонливость, «хлопающий» тремор, смазанная речь, нарушение счета, отсутствие чувства времени, амнезия, изменение личности, ярость
Бессознательное состояние с сохранением реакции на сильные раздражители, непроизвольные мочеиспускание и дефекация, патологические рефлексы, судороги
Арефлексия, полная потеря реакции на раздражители
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ, ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
579
В стадии прекомы I появляются изменяющиеся нарушения поведения, эмоциональная неустойчивость, чувство тревоги, апатия, тоска и эйфория. Иногда нарушаются ориентировка, формула сна (сонливость днем и бессонница ночью), замедляется мышление. Психический статус таких пациентов приобретает новые черты: сильные личности становятся слабодушными, слезливыми, слабохарактерные вдруг становятся упрямыми. Иногда развивается агрессивность с негативизмом, но ориентация и критика сохранены. Характерны адинамия, некоторая заторможенность, отмечаются тяжелые сновидения, обмороки, головокружения, «мушки» перед глазами, шум в ушах, иногда — икота, зевота, повышенная потливость, начальные нарушения речи, письма. ЭЭГ в большинстве случаев в пределах нормы. Иногда уже в этот период появляется «хлопающий» тремор, что помогает в диагностике данного осложнения.
Диагностика ранней стадии наиболее сложна, особенно при раннем фульминантном течении ВГ. В период первых встреч с больным, когда характерологические особенности его еще не изучены, очень сложно отличить обычную акцентуированность личности больного от начальных признаков прекомы. Иногда окончательно оценить значимость таких признаков удается только после выведения пациента из тяжелого состояния и обретения им обычного психологического статуса. В оценке неадекватности следует обязательно учитывать ситуативную норму, сложившуюся в данном коллективе, стационаре, палате и т.д.
В прекоме II прогрессируют психические и неврологические нарушения. Больные совершают бессмысленные поступки, периодически возникает психомоторное возбуждение, во время которого они пытаются бежать, становятся агрессивными, а иногда и просто опасными по отношению к медицинскому персоналу и соседям по палате. Появляются неопрятность, атаксия, дизартрия, стереотипные движения, «хлопающий» тремор пальцев рук (астериксис), грубо нарушается почерк. Рефлексы повышаются. Развивается оглушенность, сознание часто спутанное. Больной не ориентируется во времени, ситуации, не в состоянии адекватно оценить свое поведение. Реакция на болевые раздражители слабой и умеренной силы сохранена. Иногда уже в этой стадии появляются менингеальный синдром, очаговая неврологическая симптоматика при отсутствии грубых психических изменений, что требует с целью дифференциальной диагностики с менингитом проведения люмбальной пункции. На ЭЭГ часто отмечается неравномерность а-ритма по частоте, негрубые, но устойчивые 9- и Л-волны. Оценка по шкале Глазго составляет 13 баллов.
В стадии комы I уже выявляется комплекс общемозговых, пирамидных и экстрапирамидных расстройств. Сознание отсутству-
37*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
580
ет, как и реакция на окрик, периодически может возникать психомоторное возбуждение. Появляются недержание мочи, нарушение зрачковых рефлексов, тризм, фибриллярные подергивания и судороги мышц; лицо маскообразное, может усугубиться менингеальныи синдром, рефлексы становятся высокими, появляются патологические знаки—симптомы Бабинского, Оппенгейма, выраженный тремор. Сохранена только реакция на сильные раздражители (боль, холод, тепло). Зрачки широкие, почти не реагируют на свет, «плавающие» глазные яблоки. Возможен клонус стоп. На ЭЭГ выявляются грубые изменения: преобладает 0- и Л-активность, практически исчезают а- и (3-волны. Оценка по шкале Глазго 9—12 баллов (см.).
В стадии комы II (глубокая кома) нарастают явления отека-набухания головного мозга. Сознание отсутствует, исчезает реакция и на сильные раздражители (боль, холод, тепло), может быть грубый менингеальныи синдром, более многочисленными становятся патологические рефлексы — Бабинского, Гордона, Жуковского, Оппенгейма, могут появиться субкортикальные рефлексы — хоботковый, хватательный, глазодвигательные нарушения. Исчезает корнеальный рефлекс. Усиление глубины комы сопровождается снижением АД, учащением дыхания и появлением его патологических типов — Куссмауля, Чейна—Стокса, изредка — генерализованными судорожными припадками. Отмечается одутловатость лица, синюшная гиперемия, общие отеки. На ЭЭГ преобладают гиперсинхронные Л-волны, кривая постепенно приближается к изолинии. По шкале Глазго — меньше 8 баллов.
Для более объективной оценки степени угнетения сознания и выраженности явлений энцефалопатии может использоваться интегральная шкала Глазго и дополнение к ней — Питтсбургская шкала оценки состояния ствола мозга для больных с комой нетравматического происхождения. Последняя определяет рефлекторную деятельность ствола мозга (табл. 40).
Чем меньше сумма баллов, тем больше глубина угнетения мозга. Общая сумма баллов на уровне 7 и ниже свидетельствует о смерти мозга.
В последнее десятилетие широко применяется и иная классификация стадий ПЭ у больных с острыми и хроническими заболеваниями печени (в соответствии с классификацией, принятой Международной ассоциацией по изучению болезней печени — Брайтон, Великобритания, 1992). Не так давно в ней были сделаны дополнения (введена стадия 0), которые направлены на выявление скрытой (латентной) печеночной энцефалопатии. Несмотря на отсутствие явной клинической симптоматики, ее наличие сопряжено с нарушением способности к точным движениям, ослаблением ре-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
581
акции и внимания. С целью объективизации психоневрологических изменений при ПЭ 0—2-й стадий могут быть использованы различные психометрические тесты, позволяющие выявить латентную ПЭ. Наибольшее распространение получили тест связи чисел и тест линии. Простота использования и оценки при незначительных материальных затратах позволяет широко их применять в клинической практике. На основании этих тестов можно заподозрить наличие прекомы I при субфульминантном течении ВГ на самых ранних этапах развития (табл. 40).
Таблица 40. Критерии классификации печеночной энцефалопатии West-Haven в модификации Conn (1994)
Степень тяжести |
Клиническая симптоматика |
Психометрические тесты |
0 (латент.) 1 2 3 4 |
Отсутствует, возможны ошибки при выполнении обычной работы Незначительное нарушение сознания, эйфория или боязливость, снижение внимания, ослабление способности к счету, нарушение почерка Сонливость, апатия, незначительная дезориентация в месте или во времени, изменение личности, неадекватное поведение, ослабление способности к счету (вычитание), астериксис, дизартрия, примитивные рефлексы (хоботковый, сосательный) Сонливость до сопора, реакция на словесные раздражители резко ослаблена или отсутствует, выраженная дезориентация, гиперрефлексия, патологические рефлексы Гордона, Жуковского, миоклонии, одышка Кома (отсутствие реакции на словесные и болевые раздражители) |
Выполнение нарушено Выполение нарушено Выполнение нарушено Выполнение невозможно Выполнение невозможно |
Патоморфологическим субстратом ПЭ является отек головного мозга. У умерших в глубокой коме признаки отека мозга выявлялись в 50—80 % случаев. Пусковыми моментами его являются все виды гипоксии, нарушения микроциркуляции в мозге. Когда мы говорим об отеке мозга при ФГ, то имеется в виду прежде всего отек мозжечка и ствола мозга, так как эта стадия является критической.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
582
Появляющиеся на ЭЭГ медленные 0- и А-волны свидетельствуют о прогрессирующей гипоксии мозга.
Клиническая диагностика отека мозга затруднена тем, что развивается уже на фоне бессознательного состояния. Особенно она сложна у лиц, злоупотребляющих алкоголем (алкогольный делирий на фоне вирусного или алкогольного гепатита).
Критерием и одной из причин развития отека мозга является повышение внутричерепного давления, в результате чего ограничивается кровоснабжение жизненно важных структур мозга. Контролируют уровень внутричерепного давления при помощи специальных чрездуральных датчиков. Критическим считается внутричерепное давление выше 30 мм рт. ст. В такой ситуации создается реальная угроза вклинения ствола мозга в большое затылочное отверстие и мгновенной смерти.
Каждая стадия ПЭ соответствует определенному уровню острой печеночной недостаточности, хотя четкие клиншсо-лабораторные критерии отсутствуют. Вместе с тем, необходимо отметить, что при наличии определенных сопутствующих заболеваний со стороны ЦНС такое соответствие исчезает. Это характерно для лиц, употребляющих наркотики, когда имеется хроническая токсическая энцефалопатия, значительно усугубляющаяся уже при умеренном нарушении функции печени. У подобных пациентов могут отсутствовать некоторые другие симптомы при развитии фульминантного течения и, наоборот, могут постоянно отмечаться симптомы, характерные для нее при отсутствии последней (например, тахикардия, бессонница).
Кроме симптомов, характеризующих поражение ЦНС, при ФГ появляется множество других. Причем возникновение многих из них также совершенно не связано с определенной стадией печеночной энцефалопатии, они развиваются во времени, становясь все более явными. Вместе с тем, часто появление именно этих симптомов и синдромов свидетельствует об угрозе развития ФГ еще до развития симптомов энцефалопатии. Особенно важны они у наркоманов, алкоголиков, улиц с посттравматической энцефалопатией, с другой органической патологией ЦНС. Это так называемые симптомы-предвестники ФГ. Часть из них неспецифична, однако при исключении других возможных причин их развития следует думать о ФГ. Нужно помнить, что эти симптомы не появляются сразу, в комплексе; более того, часть из них может вообще отсутствовать. Наиболее полно они себя проявляют на стадии комы, когда диагноз уже не вызывает сомнения, но и эффективность лечебных мероприятий существенно снижается. Выживаемость больных со 2-й стадией ПЭ при ФГ составляет от 65 до 70 %, тогда как с 4-й стадией — менее 20 %.
Таким образом, учитывая полисистемность поражений, харак-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
583
терную для ФГ, следует помнить, что любые изменения, симптомы и синдромы, не типичные для обычного циклического течения ВГ, особенно при их сочетании, не должны оставаться без внимания, так как могут свидетельствовать о надвигающейся или даже уже наступившей катастрофе. Наиболее яркие из них следующие.
Появление постоянной тошноты, неукротимой рвоты, анорексии, отвращения к пище, извращения вкуса и запаха. Умеренная тошнота и рвота могут быть и при обычном циклическом течении гепатита и связаны в основном с явлениями панкреатита и/или интоксикацией. Однако они появляются эпизодически, обычно в начале желтушного периода, нередко в сочетании с другими симптомами панкреатита. И только при угрозе развития ФГ тошнота становится упорной, а рвота неукротимой, не приносящей^облегчения. У пациентов появляется отвращение к пище, извращение вкуса и запаха, иногда только один вид пищи может вызвать приступ тошноты и рвоту.
Изменение пальпаторных свойств и размеров печени. Для острой фазы циклического течения ВГхарактерно более или менее выраженное увеличение печени, в этот период она должна быть плотной или плотно-эластичной, чувствительной при пальпации. Нормализация ее пальпаторных свойств происходит лишь после мочевого (холе-мического) криза. В случае фульминантного течения она становится мягкой, уменьшается в размерах, несмотря на стабильную или увеличивающуюся желтуху. Определение в такой ситуации лишь нижней границы печени часто малоинформативно, так как существует много причин, из-за которых печень может подниматься (вздутие живота) или опускаться, не изменяя своих размеров. Поэтому необходимо обязательно определять перкуторно вертикальный размер печени по Курлову. По мере прогрессирования ФГ постепенно изменяются свойства печени: она становится мягкой, невозможна ее пальпация, перкуторная величина уменьшается, вплоть до полного исчезновения печеночной тупости в терминальной стадии.
Боль в правом подреберье. Для циклического течения ОВГ характерна тяжесть в правом подреберье. Боль может появляться в случае присоединения дискинезий желчевыводящих путей, панкреатита, причем чаще всего она связана с приемом пищи. Появление острой, часто сильной боли в правом подреберье, иногда настолько интенсивной, что она симулирует острый холецистит или приступ мочекаменной болезни, характерно для манифестации ФПН, значительно чаще — при раннем ФГ. Боль не связана с приемом пищи, на ее интенсивность не влияют спазмолитики, она без видимой причины может усиливаться или ослабевать. При пальпации печени отмечается более или менее выраженная ее болезненность, иногда пальпация затруднена из-за защитного напряжения мышц. Боль связана с бурным развитием некрозов и кровоизлияний в областях печени, при-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
584
легающих к капсуле, по мере прогрессирования процесса она слабеет и исчезает. Появление интенсивной боли в правом подреберье всегда свидетельствует о быстром прогрессировании процесса.
Геморрагический синдром — один из важнейших критериев тяжести течения ВГ, свидетельствующий о тяжелом нарушении функции печени, прежде всего белковосинтетической, синтеза факторов свертывания крови. Проявления самые разнообразные — от кожных геморрагических высыпаний до носовых, маточных, желудочно-кишечных кровотечений, появления гематом и кровотечений в местах инъекций. На начальном этапе это могут быть кровоизлияния на плечах после измерения АД, в местах инъекций; гематомы, геморрагическая сыпь на коже, слизистых оболочках. Прямая связь со стадиями печеночной энцефалопатии при этом отсутствует, хотя желудочно-кишечные и маточные кровотечения развиваются обычно на поздних стадиях ФГ. Наиболее уязвимой категорией больных являются женщины, так как иногда появление менструального кровотечения становится фатальным даже при успешном купировании других проявлений ФГ. Поэтому врач должен обязательно соотносить время появления менструального кровотечения с этапом течения ВГ (период разгара, увеличения желтухи и интоксикации) в целях постоянного контроля и при необходимости — принятия неотложных мероприятий.
Весьма грозные кровотечения — это желудочно-кишечные. Среди возможных причин их развития основными являются образование так называемых стрессовых язв в желудке или двенадцатиперстной кишке, апластическая анемия как осложнение HCV-инфекции, действие глюкокортикоидов.
Чрезвычайно важно установить ведущую причину кровотечения— соотношение двух процессов, которые всегда имеются при ФГ:
падение синтеза прокоагулянтов;
развитие ДВС-синдрома.
Клинические данные в такой ситуации помогают мало, они свидетельствуют лишь о серьезности проблемы. ДВС-синдром развивается при ФГ очень часто. Падение синтеза факторов свертывания крови может быть причиной кровотечения только при критическом (меньше 20% протромбина) снижении их уровня. Большинство кли-нико-лабораторных показателей при преобладании любого из этих двух процессов будут одинаковы.
Для распознавания ведущей роли ДВС-синдрома основными критериями служат:
— выраженная тромбоцитопения (количество тромбоцитов ме нее 100х109/л); тогда как при падении синтеза факторов свер тывания вследствие некроза печени не бывает такого суще ственного снижения уровня тромбоцитов;
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
585
выраженная гипофибриногенемия (уровень 1,5 г/л и ниже); при преобладании падения синтеза прокоагулянтов подобный уровень фибриногена наблюдается в основном при глубоком поражении печени — показатель близкого финала;
высокий уровень продуктов деградации фибриногена — резко положительные этаноловый, (3-нафтоловый тесты, фибриноген В; преобладание падения синтеза факторов свертывания крови не сопровождается значительным повышением этих тестов;
высокий уровень фибринолитической активности при ДВС-синдроме; умеренное повышение фибринолитической активности при преобладании критического падения синтеза факторов свертывания печени.
Причиной кровотечений на ранних этапах развития ФГ является прежде всего ДВС-синдром, лишь на поздних обе причины практически равнозначны.
У взрослого здорового человека потеря до 15 % объема крови не требует инфузионной терапии. При ФГ развивается гипоальбумине-мия, умеренно выраженная гемолитическая анемия, которые существенно ухудшают переносимость даже умеренных кровотечений и усиливают без того нарастающую гипоксию. Гипопротеинемия приводит к патологическому перераспределению жидкости, последняя и становится причиной дополнительной гиповолемии. У больных в стадиях комы I—II при переходе в терминальное состояние ОЦК уменьшается в 1,6 раза. Несмотря на относительную гидремию, кровотечение не способствует существенному переходу жидкости в сосудистое русло.
Тахикардия. Для циклического течения ОВГ характерна бради-кардия, причем чем выше билирубинемия, тем сильнее она выражена. Учащение пульса должно насторожить врача, так как истинная тахикардия появляется уже на этапе, когда есть и другие признаки ФГ. Учащение пульса при отсутствии каких-либо других причин должно трактоваться как один из признаков ФГ. Одной из причин появления тахикардии является гиперкатехоламинемия. В дальнейшем тахикардия поддерживается многими факторами, в том числе и вследствие развития токсической дистрофии миокарда, гипоксии.
Повышение температуры тела. Этот симптом также свидетельствует о бурном прогрессировании процесса. С появлением желтухи при циклическом течении любого ОВГ температура тела нормализуется, даже если она была повышенной в продромальный период (исключение — ОВГО). Иногда может отмечаться субфебрильная температура в желтушный период вследствие аллергического компонента (ОВГВ), сопутствующих заболеваний (хронический холецистит, холангит и т.д.). Появление высокой температуры тела (38 °С
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
586
и выше) без иной причины, особенно в сочетании с болью в правом подреберье, свидетельствует о вероятности развития ФГ. Причиной лихорадки являются также массивные некрозы печени, интенсивный «цитокиновыи взрыв». По мере прогрессирования процесса или вследствие успешного лечения температура тела снижается до субфебрильной или нормализуется. Вторая волна лихорадки связана уже с развитием осложнений — активизацией имеющихся очагов хронической инфекции, присоединением бактериальной инфекции.
Появление печеночного запаха — грозный симптом, свидетельствующий о тяжелом нарушении дезинтоксикационной функции печени. Обусловлен он нарушением обезвреживания и повышением концентрации в крови меркаптанов, являющихся продуктами бактериального гидролиза серусодержащих аминокислот (метионин, цис-теин) в толстой кишке. Наличие печеночного запаха до начала лечебного комплекса свидетельствует о необходимости немедленной очистки кишечника, появление его во время лечения ФГ сигнализирует о явной недостаточности и/или неэффективности проводимых мероприятий по подавлению кишечной микрофлоры.
Острая почечная недостаточность развивается при ФГ чаще уже в разгар заболевания. Изменения со стороны почек выявляют у половины больных с симптомами ФГ, однако стадия анурии настает обычно в терминальной фазе заболевания. Поражение почек может манифестировать почти одновременно с поражением печени в основном при наличии их сопутствующей хронической патологии, иногда отмечается при истинно фульминантном течении. Имеется 2 основных механизма последовательного развития почечной недостаточности при ФГ:
функциональная почечная недостаточность (вазоконстрикция вследствие гиповолемии, уменьшение почечного кровотока);
острый канальцевый некроз почек (различные метаболиты, билирубин, желчные кислоты являются повреждающими факторами канальцевого аппарата; развивающаяся в период гипо-перфузии олигурия способствует задержке токсических метаболитов в крови, удлиняет период их токсического воздействия на почки).
Кроме того, острый канальцевый некроз могут вызвать и антибиотики (гентамицин и другие аминогликозиды, цефалоспорины I поколения), рентгенконтрастные препараты, особенно у лиц с сопутствующим сахарным диабетом, парацетамол. Нефротоксичность их усиливается в условиях выраженной токсинемии. Острый интер-стициальный нефрит в таких условиях с развитием ОПН могут вызвать пенициллины, цефалоспорины, бактрим, рифампицин, нестероидные противовоспалительные препараты.
Клиническая картина острой почечной недостаточности не от-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
587
личается от таковой при других тяжелых состояниях. Для своевременного распознавания ОПН следует почасово учитывать диурез. Количество мочи меньше 35—45 мл/ч соответствует олигурии, менее 15—20 мл/ч— олигоанурии. Уже в начальной стадии обращает на себя внимание низкая концентрация Na+ в моче (меньше 5 ммоль/л) при достаточно высокой ее осмолярности, в фазе олигурии относительная плотность снижена до 1003—1010. Если больной в этот период в сознании (что бывает не так уж часто), то он жалуется на жажду, голос теряет звучность. Характерно быстрое увеличение массы тела за счет развития отеков (они имеют двойное происхождение — ги-попротеинемия и ОПН). Значительно нарастает интоксикация, так как организм лишается последней основной системы детоксикации. На этом этапе часто развивается отек мозга, легких. Анурия при ФГ крайне трудно поддается лечению, устранение отека мозга становится практически невозможным.
Если на ранних стадиях развития ОПН может быть связана в основном с гиповолемией (рвота, отвращение к пище и жидкости), то в дальнейшем, особенно на фоне лечения, она уже носит смешанный характер (ренальный и преренальный), причем гиповолемия преренальной компоненты ОПН связана в основном с гипоальбу-минемией.
Лабораторная диагностика уремии на фоне поздних этапов ФГ существенно затруднена. Уровень мочевины в основном зависит от функции печени, уровень остаточного азота — от степени метаболических расстройств. Поэтому наиболее доступным и достоверным критерием почечной недостаточности для клинициста является уровень креатинина и частично — уровень К* не только в плазме крови, но и в эритроцитах, а также показатели КОС. Информативным показателем является и содержание натрия в моче, ее относительная плотность: при преренальной ОПН оно менее 10 ммоль/л, а относительная плотность высокая (1020 и больше), при ренальной ОПН — 25 ммоль/л и более, а также изогипостенурия.
Важными для прогноза, течения и исходов являются сроки появления первых клинических признаков ФГ Если они возникают в первую неделю желтушного периода, это предвещает чрезвычайную скоротечность процесса, соответствует понятию сверхострой печеночной недостаточности, массивному некрозу печени, быстрому развитию отека мозга. Для раннего фульминантного или суб-фульминантного варианта HBV-инфекции характерны укороченный продромальный период (2—4 дня) с возможным повышением температуры тела свыше 38 °С (что делает его похожим на ВГА), но сопровождающийся тяжелыми симптомами интоксикации и даже симптомами прекомы — тахикардией, болью в правом подреберье, анорексией, выраженной общей слабостью, бессонницей, голово-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
588
кружением, ощущением проваливания. Последнее совершенно не характерно для преджелтушного периода ВГА. Врача не должно смущать и почти полное отсутствие желтухи — существенное повышение уровня билирубина может и не развиться даже в стационаре. В такой ситуации чрезвычайно неблагоприятным является именно раннее фульминантное течение — пребывание в домашних условиях и поступление в стационар уже на этапе бурного прогрессирова-ния ФГ и развития комы делает дальнейший прогноз чрезвычайно серьезным.
Определенные этиологические варианты ФГ могут иметь некоторые особенности клинического течения и/или маркерной диагностики. Клиническая картина, приведенная выше, характерна в основном для острого ВГВ как наиболее частой причины фульминантного течения. Отсутствие данных об особенностях клинического течения некоторых ВГ часто связано с редкостью развития, с одной стороны, и недавней раздельной их регистрацией — с другой.
Особенности течения ФГС. Данные о роли HCV-инфекции в развитии ФГ остаются противоречивыми, о чем уже было сказано выше. Все же считают, что она вызывает менее тяжелое, обычно суб-фульминантное течение, более длительное во времени, чем ФГВ. Считается, что риск ФГС повышается при сочетанной инфекции HBV + HCV у пожилых и у пациентов с иммунодефицитом на фоне иммуносупрессивной терапии.
Редкость развития, частое сочетание с другими гепатитами, относительно недавнее начало регистрации не позволяют оценить значение HCV-инфекции в развитии ФГ и выявить особенности течения.
Особенности течения ФГЕ. ВГЕ у беременных часто приобретает истинно фульминантное течение с быстрым развитием массивного некроза печени.
Клинические особенности:
быстро уменьшается печеночная тупость;
быстро появляется печеночный запах;
прекома быстро переходит в кому;
закономерно развивается тяжелый ДВС-синдром и вследствие этого — различные кровотечения, в том числе и маточное;
раннее поражение почек с быстрым развитием ОПН;
ранний массивный гемолиз с развитием гемоглобинурии и прогрессирующей острой почечной недостаточности;
самопроизвольное прерывание беременности (выкидыш, преждевременные роды), сопровождающееся значительным ухудшением состояния;
— часто отмечается гибель даже доношенного ребенка. Вместе с тем, имеются данные о ФГЕ и у других категорий боль ных в случае наличия сопутствующего заболевания печени.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 58д
Особенности ФГА. Тяжесть клинических проявлений ВГА возрастает с увеличением возраста больных. Хотя наибольшая заболеваемость регистрируется среди лиц 5—14-летнего возраста, пик смертности приходится на возраст старше 65 лет. Соответственно смертность в возрасте 5—14 лет от ФГА составляет 7 на 10 000 и до 400 на 10 000 в возрастной группе старше 65 лет. (Серонегативность у лиц старше 60 лет в Великобритании составляла 10,5 %, а в США — 26,4 % у лиц старше 50 лет. Таким образом, именно ФГА является особенно опасным для людей пожилого возраста). Вместе с тем, особенности клинического течения и исход ФГА зависят от преморбидного фона и тяжести сопутствующих заболеваний.
Особенности течения и диагностики ФВГИ. Уникальный вирус, размножение и накопление которого возможно лишь при наличии HBV-инфекции (HBsAg). Клинические проявления ФВГО в основном те же, что и при ФВГВ. Однако чаще развивается субфульминантное течение с более постепенным субмассивным некрозом печени, хотя, по другим данным, — фульминантное. Появлению субфульминант-ного варианта предшествует фаза острого гепатита с обычным течением, четко выявляется фаза прекомы, которая сохраняется на протяжении 2—4 дней, часто появляется выраженный геморрагический синдром. В диагностике ФВГО необходимо учитывать, что лихорадка в желтушный период, боль в правом подреберье характерны и для обычного течения заболевания.
Показателем активного HDV-гепатита является обнаружение HDV РНК (ПЦР) или HDAg (ИФА) в сыворотке крови или в ткани печени при пункционной биопсии. При фульминантном течении эти маркеры могут отсутствовать, хотя, по другим данным, для него характерно именно длительное сохранение HDV-Ag в сыворотке крови. Активно реплицирующийся вирус D обычно подавляет репликацию HBV, при этом может наблюдаться временное исчезновение HBsAg и появление анти-HBs.
У части больных с острой HDV-суперинфекцией выявляются также анти-HCV. HCV может временно подавлять репликацию как HBV, так и HDV.
Особенности течения ФГулиц, употребляющих наркотики. У этой категории больных выявление фульминантного течения ВГ наиболее сложно. Симптомы токсической энцефалопатии препятствуют раннему выявлению признаков печеночной энцефалопатии, точно также они затрудняют оценку состояния больного при обратном развитии ФПН. Наличие таких симптомов, как тахикардия, бессонница ночью, сонливость днем, характерных для ФГ, является обычным для этой категории лиц, а уменьшение размеров печени может отсутствовать при длительном употреблении наркотиков и в связи с наличием хронического токсического гепатита. Особенно сложной
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
590
является дифференциальная диагностика при наличии синдрома отмены. Поэтому основными критериями ФГ становятся лабораторные показатели. Кроме того, у подавляющего большинства больных с ФГ, которые систематически употребляли наркотики, отмечались микст-гепатиты в различных количественных и качественных комбинациях, наиболее часто— В + С. В таких ситуациях нельзя останавливаться в диагностическом поиске при выявлении маркеров одного гепатита, так как прогноз, лечение и исходы у них значительно более серьезные, чем у остальных категорий больных.
Некоторые особенности физиологии организма у лиц пожилого возраста. У людей пожилого и старческого возраста ФГ возникает достаточно редко. Вместе с тем, его развитие происходит совершенно в иных условиях, так как имеются значительные фоновые изменения.
При старении на 20 % уменьшается мышечная масса, на 10—20 % увеличивается количество жира, на 10—15 % (после 75 лет — на 18— 20 %) уменьшается содержание воды, масса и емкость паренхиматозных органов. Уменьшается количество гепатоцитов и их размеры. Снижается их функциональная активность — алкилирования, ацетилирования, но не изменяется активность холинэстеразы, щелочной фосфатазы, замедляется период выведения и метаболизм лекарственных веществ. У таких пациентов существенно падает содержание белка в плазме крови и печени, усиливается гликогенолиз, усиленно накапливается молочная кислота. В желудке и кишечнике ухудшается и замедляется всасывание питательных веществ, лечебных препаратов. Ухудшение системной микроциркуляции замедляет абсорбцию лекарственных препаратов при внутримышечном и внутривенном введении.
У людей пожилого и старческого возраста значительно снижается выделительная функция почек вследствие снижения более чем в 2 раза почечного кровотока (42 %), к глубокой старости более чем в 3 раза сокращается азотвыделительная функция почек. Вместе с тем, уровень креатинина остается в пределах нормы. Поэтому при развитии ФПН возможно значительно более быстрое присоединение острой почечной недостаточности.
Возрастные изменения сердечно-сосудистой системы и органов дыхания, особенно при наличии ХИБС и гипертонической болезни II—III стадий, универсального атеросклероза и сахарного диабета, значительно усиливают гипоксию печени и гипоксическое повреждение гепатоцитов. У таких пациентов прогрессирование ФГ может значительно ускоряться, течение часто нетипичное. Все это необходимо учитывать при назначении лечения, которое осуществляется по принятым нами принципам.
Осложнения ФГ. Присоединение (активация) вторичной бактериальной и грибковой микрофлоры. У больных с ФГ значительно сни-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
жается сопротивляемость организма, дополнительное подавление защитных механизмов оказывает лечение (ГКС, полипрагмазия), парентеральное питание, голодание. Снижается как системный, так и местный иммунитет. Это облегчает присоединение экзогенной или активацию эндогенной инфекции. Считается, что у 90 % больных в стадии комы I—II развиваются инфекционные осложнения, причем иногда уже к 3-м суткам пребывания в стационаре. Часто возникающие осложнения со стороны легких, почек, ЛОР-органов распознаются поздно. Этому способствует позднее появление или отсутствие явных специфических симптомов, неполноценный мониторинг пациента. Типичные проявления сепсиса (лихорадка, лейкоцитоз) могут или отсутствовать, или их причиной будет ФГ. Наиболее часто развивается стафилококковая и грамотрицательная суперинфекция. Нужно заметить, что бактериальные и кандидозные осложнения чаще возникают при субфульминантном варианте, чем при фульминантном.
Чаще всего развивается пневмония, усиливающая прогрессировать гипоксии и отека мозга, провоцируя развитие отека легких. В процессе развития ФПН может произойти аспирация желудочного содержимого или крови (аспирационная пневмония), возникнуть ателектазы, застойная пневмония, респираторный дистресс-синдром взрослых, последний практически не поддается лечению. Рентгенологически часто выявляются изменения, характерные для указанных состояний или диффузное усиление сосудистого рисунка.
Может развиваться сепсис, чему способствует наличие открытых ворот для экзогенной инфекции — длительная катетеризация вены, мочевого пузыря. Транслокация бактерий возможна из кишечника с развитием флегмоны кишечника и сепсиса. Развитие флегмоны кишечника является абсолютно смертельным осложнением, которое иногда сводит на нет все успехи в лечении фульминантной печеночной недостаточности.
На фоне массивной, длительной терапии или полипрагмазии с применением антибиотиков, глюкокортикостероидов, при использовании инструментария, повреждающего целость кожи и слизистых оболочек (катетеры, дыхательные трубки и т.п.) возможно развитие генерализованного кандидоза и даже кандидозного сепсиса (примерно у */з больных). Кандидоз рассматривается как аутоинфекция — источником инфекции является сам больной. Поэтому при возможности необходимо выяснить анамнестические данные о наличии грибковой патологии в прошлом для своевременного выявления активации кандидозного процесса. Часто грибковая инфекция остается нераспознанной на уровне очаговой и даже генерализованной инфекции, что представляет угрозу для жизни больного.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
592
Острый геморрагический панкреатит и панкреонекроз иногда выявляют у больных, которые умирают от ФГ. Причиной их развития являются кровоизлияния в ткань железы, окружающие ткани, вирусы, лечение глюкокортикостероидами. Распознать эти осложнения крайне трудно, так как часто больной находится уже в коматозном состоянии. Поэтому необхо'дим постоянный контроль за уровнем амилазы в крови, активность которой повышается у xh больных. Это осложнение может быть причиной смерти.
ФГ сопровождаются постепенным развитием системной артериальной гипотензии. Причиной ее является низкое периферическое сопротивление (падение сосудистого тонуса). При этом развивается компенсаторное повышение сердечного выброса. Падение тонуса сосудов и повышение сердечного выброса коррелируют со степенью поражения печени. Причины гипотензии не совсем ясны, возможно, имеет значение мощный медиатор-спазмолитик — оксид азота. При длительном течении ФГ (5—6 сут и более) возможно падение сердечного выброса вследствие развития токсической дистрофии миокарда.
Методы исследования. Лабораторные показатели часто становятся определяющими, особенно на ранних этапах развития процесса, когда могут отсутствовать четкие клинические признаки развития ФГ.
Лейкоцитоз в крови. Для циклического течения острого вирусного гепатита характерны развитие умеренной лейкопении или нор-моцитоз. Появление даже небольшого лейкоцитоза может быть симптомом ФГ. В большинстве случаев постепенного развития ПЭ лейкоцитоз появляется достаточно поздно, уже на фоне развернутого комплекса симптомов. Вместе с тем, при более бурном течении лейкоцитоз как показатель некробиотического процесса может появляться достаточно рано. Появление лейкоцитоза без каких-либо других симптомов фульминантного течения требует также немедленного исключения присоединения или активации бактериальных поражений.
Снижение уровня альбуминов (общего белка) в крови. Снижение синтеза белков крови, большинство из которых образуется в печени, характерно для ФГ. Это основная причина гипопротеинемии, которая развивается в этой ситуации. В дальнейшем усугубление гипопротеинемии происходит дополнительно за счет кровотечений, повышенного катаболизма белков, длительного сохранения безбелковой диеты. Снижение уровня общего белка в крови при ФГ происходит в первую очередь за счет альбумина, факторов свертывания крови, что приводит к падению уровня общего белка, повышения относительного содержания глобулиновой фракции. Поэтому пользование тестом «общий белок» вполне допустимо. Критическим, сви-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 5д3
детельствующим о глубоком поражении синтетической функции печени и возможности развития ФГ является уровень общего белка в плазме крови ниже 60 г/л. Обычно снижение общего белка ниже допустимого уровня происходит уже на фоне имеющихся клинических симптомов, поэтому особого диагностического значения не имеет. Его уровень и динамика изменений имеют важное значение для выработки тактики лечения. Раннее снижение уровня общего белка происходит у лиц с недостаточным общим питанием.
Высокоинформативным показателем, отражающим уровень некрозов в печени, считают снижение уровня Gc-белка, который связан с витамином D. Рекомендуется определять его уровень с первого дня пребывания в стационаре.
Снижение уровня мочевины в плазме крови. Мочевина синтезируется в печени, поэтому ее уровень во многом связан с возможностями дезинтоксикационной функции печени. При обычном смешанном питании в печени образуется до 32—34 г мочевины в сутки, из них 15 % выводится с мочой. Этот тест более тонко отражает нарушение процессов в печени, чем тест «остаточный азот плазмы», так как не включает в свой состав веществ, не связанных с функцией печени (креатинин, аммиак, некоторые другие). Критическим, свидетельствующим о возможном развитии ФГ является уровень мочевины ниже 3—2,5 ммоль/л. Вместе с тем, на ее содержание в крови влияют и некоторые другие факторы:
наличие почечной недостаточности (поэтому необходимо обязательное параллельное определение уровня креатинина);
особенности питания (при растительной диете ее образуется меньше, при белковой — больше);
усиление эндогенного катаболизма белков (при недостаточном питании) сопровождается увеличением синтеза мочевины.
Наш опыт свидетельствует, что уровень мочевины в крови — достаточно эффективный тест как для прогноза развития фульминант-ного течения, так и для выхода из этого состояния. Во многих случаях снижение (повышение) уровня мочевины появляется не менее чем на 12 ч раньше, чем такой важный критерий, как протромбино-вый индекс. Вместе с тем, некоторые авторы считают, что ФГ редко сопровождается снижением уровня мочевины в крови.
Протромбиновый индекс (протромбиновый показатель) и другие факторы свертывания крови. Все факторы свертывания крови синтезируются в печени, причем интенсивность синтеза достаточно велика, поэтому при тяжелых нарушениях функции печени снижение их уровня в крови определяется достаточно быстро. Это касается в первую очередь протромбина, проакцеллерина и проконвертина. Несколько особняком стоит фибриноген. Некоторое количество его синтезируется в легких, поэтому снижение уровня ниже нормы при
38 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
594
ФГ происходит на поздних этапах и/или при развитии ДВС-синдро-ма. Мы остановимся на наиболее часто определяемом факторе — протромбине. Снижение уровня протромбина происходит уже на ранних этапах, часто еще до появления симптомов энцефалопатии. Критическим считается уровень протромбинового индекса ниже 60 %. Даже при отсутствии каких-либо других признаков фульминан-тного течения уменьшение его ниже 60 % требует активизации кли-нико-лабораторного наблюдения и применения необходимого комплекса терапии. Период полужизни протромбина составляет 72—96 ч, а количество превышает необходимый уровень в 2—3 раза.
Ранее других при ФПН реагирует проакцеллерин (фактор V). Снижение его считается наиболее ранним и точным критерием развивающейся печеночной недостаточности. Уменьшение его на 50 % (по данным других центров, — на 25 %) считается даже показанием для трансплантации печени, так как в этих условиях эффективность консервативной терапии значительно снижается. Период полужизни проакцеллерина составляет 12—15 ч, уровень его в крови превышает необходимый в 8—10 раз.
Для ФГ характерно значительное снижение проконвертина (фактор VII) до 40 % и ниже, причем информативность и чувствительность этого показателя считается существенно выше, чем протромбина и проакцеллерина, так как период полужизни составляет только 2—6 ч. При развитии ФПН уровень проконвертина может меняться в течение суток, равно как и протромбина.
При определении диагностической значимости полученных результатов необходимо четко знать, что исследует лаборатория: уровень протромбина или так называемый протромбиновый комплекс, в состав которого входят проакцеллерин и проконвертин. Ясно, что изменения со стороны протромбинового комплекса будут выявляться раньше, чем чистого протромбина, учитывая длительность периода полужизни.
Фибриноген. Период его полужизни составляет 100 ч, а избыток превышает необходимое количество в 3—6 раз, поэтому для ранней диагностики ФПН особого значения не имеет. Показатели его уровня чаще используют для диагностики ДВС-синдрома. Выраженная гипофибриногенемия развивается обычно в конечной фазе ФПН.
Изменение соотношения фракций билирубина. Речь идет не об уровне билирубина. ФПН может начинаться даже при общем билирубине ниже 100 мкмоль/л, более важным является соотношение прямой и непрямой фракций. Для циклического течения ОВГ характерно значительное преобладание прямого билирубина над непрямым. Увеличение в динамике уровня билирубина больше за счет непрямого свидетельствует о глубоких нарушениях функции печени (гепато-цитов) и возможном прогрессировании, вплоть до развития ФГ.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
595
Изменение активности ферментов. АлАТ, АсАТ. Это высокочувствительные показатели цитолиза, маркеры активности патологического процесса, наиболее ранние критерии диагноза острого гепатита, для которых характерно некоторое преобладание уровня АлАТ над АсАТ. Это нашло отображение в так называемом коэффициенте де Ритиса: АсАТ/АлАТ « 1—0,7. Более значительное повышение уровня АсАТ по сравнению с АлАТ при ОВГ (коэффициент де Ритиса больше единицы) является неблагоприятным признаком, свидетельствующим о тяжелом повреждении печени и возможности развития ФПН.
Толкование их абсолютного уровня повышения во многом зависит от методики определения (см. «Вирусные гепатиты», том 1). При исследовании колориметрическим методом повышение активности этих ферментов в разведенной сыворотке крови более 50 ммоль/л {55—70 ммоль/л и выше) свидетельствует о массивном цитолизе и возможности развития ФГ.
При определении активности трансаминаз кинетическим методом их уровень выше 5000 ЕД/мл (иногда — до 10 000—15 000 ЕД/мл и выше) также свидетельствует о тяжелом течении и возможном развитии ФПН.
Определение активности трансаминаз в динамике при развившемся ФГ также имеет определенное прогностическое значение. Значительное падение активности трансаминаз при сохранении или нарастании клинических симптомов является грозным прогностическим признаком, свидетельствующем о полном «выгорании» ге-патоцитов.
Значительное повышение активности трансаминаз с существенным преобладанием АсАТ в период печеночной комы связано с тяжелым поражением не только печени, но и миокарда и также свидетельствует о близком летальном исходе.
Некоторое повышение активности трансаминаз может отмечаться при выходе из состояния фульминантной недостаточности и снижения активности медикаментозного лечения, но это можно считать нормальной реакцией.
Креатинфосфокиназа и некоторые другие показатели. В последнее время обратили внимание на «парапеченочные» ферменты, повышение уровня которых отмечается вследствие вторичного токсического поражения других органов и систем. Одним из таких является креатинфосфокиназа (КФК). При обычном циклическом течении ВГ уровень КФК не превышает допустимых значений. Для ФПН при ВГ характерны снижение сократительной способности миокарда, тахикардия на фоне нарастающей гипотензии, значительное повышение уровня КФК (от 250 до 3000 МЕ/л и больше). Это свидетельствует о грубых нарушениях функции мембран кардиомиоцитов.
38*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
596
При развитии ФГ почти у всех пациентов значительно снижается активность холинэстеразы, особенно при субфульминантном варианте развития ВГ, уменьшается уровень холестерина.
Маркерный профиль гипериммунного варианта ФВГВ. Для ОВГВ с циклическим течением характерно исчезновение HBsAg в начале желтушного периода, анти-HBs появляются уже в период поздней реконвалесценции. Чуть позже исчезает HBeAg, но сразу же регистрируются анти-НВе. При гипериммунном варианте ФГВ отмечается более быстрое исчезновение HBsAg, HBeAg и сразу же появляются анти-HBs IgM и анти-НВе IgM, что и соответствует гипериммунному ответу. В 15—21 % случаев фульминантного варианта ОВГВ HBsAg радиоимунным методом вообще не выявляется. Выживаемость больных с отсутствием HBsAg в сыворотке, согласно результатам некоторых исследователей, существенно выше, чем у больных с наличием HBsAg. Вместе с тем, такие данные не являются абсолютными. У большей части больных с ФГ HBV ДНК в сыворотке крови с помощью ПЦР не определяется, что позволяет предположить отсутствие репликации вируса; подтверждением этому служит относительно низкая частота рецидивов ВГВ после трансплантации печени по поводу фульминантного гепатита В.
Инструментальные методы. Биопсия печени. При ФГ для определения прогноза и необходимости пересадки печени производится биопсия печени путем введения специальной иглы «Trucut» через яремную вену в печеночную вену (трансъюгулярная биопсия). Обнаружение субмассивных некрозов, захватывающих более 50 % печеночной ткани, является показанием для пересадки печени. Вместе с тем, неравномерность поражения различных участков печени может затруднять прогностическую оценку. На поздних стадиях ФГ биопсию желательно не выполнять.
Электроэнцефалография. ЭЭГ используется для оценки клинического состояния и определения прогноза заболевания. Прогрес-сирование характеризуется повышением амплитуды волн, уменьшением их частоты. По мере прогрессирования процесса появляются трехфазные волны, частота изменяется незначительно, однако существенно уменьшается амплитуда волн, в дальнейшем — полное отсутствие мозговой активности.
Критерии диагноза. ФГ распознают при наличии совокупности клинических симптомов и лабораторных показателей, которые отражают состояние синтетической функции печени. Наиболее важными среди них являются:
появление психических расстройств, развитие комы при вирусном гепатите;
печеночный запах изо рта;
неукротимая рвота, отвращение к пище, извращение вкуса;
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
597
размягчение печени и уменьшение ее размеров на фоне прогрессирующей желтухи;
геморрагический синдром в виде кровоизлияний, петехиаль-ной сыпи, различной локализации кровотечений;
появление тахикардии при отсутствии других видимых причин;
появление лихорадки, сильной боли в правом подреберье без видимых других возможных причин;
снижение синтеза альбумина, проакцеллерина, протромбина, проконвертина, мочевины;
появление лейкоцитоза в крови без видимых других возможных причин.
Наличие уже 2—3 симптомов, характерных для энцефалопатии, и/или общеклинических проявлений, а также соответствующих лабораторных данных должно трактоваться как угроза развития ФГ.
Дифференциальная диагностика. Перечисленные вначале состояния, при которых может развиться острая печеночная недостаточность, требуют разграничения, так как во многих случаях могут быть определенные особенности лечения, которые существенно влияют на исход заболевания.
Вместе с тем, многие из этих заболеваний встречаются крайне редко, частота развития ФПН незначительна, выделение особенностей затруднено. Поэтому в основном остановимся на более распространенной патологии, но предварительно оговорим один из показателей, оценка которого при всех указанных ниже состояниях вызывает иногда у практического врача затруднение — выделение HBsAg. HBsAg является маркером лишь инфицирования организма HBV-инфекцией, но совершенно не свидетельствует о наличии у пациента острого и тем более ФГВ, ведь в мире регистрируется сотни миллионов носителей этого вируса. Поэтому необходимо уточнение всего маркерного профиля.
Отравления грибами. Прежде всего — это отравления бледной поганкой и строчками.
Бледная поганка содержит мощные яды фаллоидин, фаллоин и аманитин, которые не разрушаются при термической обработке и высушивании. Они поражают митохондрии гепатоцитов, кардиоми-оцитов, клеток почек, вызывая нарушение функции этих органов. Фаллоидин подавляет полимеризацию актина и вызывает холестаз, аманитин подавляет синтез белка, ингибируя РНК. Общим является развитие тяжелого гепатита, анемии, отека мозга и в дальнейшем ОПН.
Признаки отравления бледной поганкой развиваются через 6— 40 ч после употребления грибов в пищу. Особенности клинических проявлений:
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
598
заболевание дебютирует синдромом гастроэнтерита — появляются сильная боль в животе, частая рвота, профузный водянистый стул с примесью слизи, иногда — кровавый, при нормальной температуре тела; часто развивается обезвоживание с явлениями дегидратационного шока;
боль в животе может быть схваткообразной или коликоподоб-ной, часто бывает выраженная изжога; иногда боль обостряется изжогой;
гипертермия появляется обычно на фоне выраженного обезвоживания;
промывание желудка и кишечника, купирование обезвоживания на короткое время улучшают состояние, наступает период зловещего благополучия;
спустя 2—5 дней развивается картина острой печеночной недостаточности, которая дебютирует тошнотой и рвотой, с быстрым развитием печеночной комы и геморрагического синдрома;
рано присоединяется острая почечная недостаточность;
— смерть может настать от паралича дыхательного центра. Особенности отравления строчками. Строчки содержат гальвел-
ловую кислоту, которая обладает гемолитическим и гепатотоксичес-ким действием. Она хорошо растворяется в горячей воде, поэтому тщательное промывание и проваривание делает эти грибы съедобными. Признаки отравления развиваются через 6—25 ч после употребления недостаточно обработанных грибов. Характерны развитие желтухи, ОПН, повышение активности трансаминаз, отек мозга. Отличия от ФГ:
в дебюте характерны явления гастроэнтерита, боль в животе;
возможны судороги;
желтуха появляется быстро, сопровождается повышением температуры тела (острый гемолиз), носит смешанный характер — гемолитический и паренхиматозный;
развивается острая почечная недостаточность;
в крови отмечается анемия, повышение билирубина за счет прямого и непрямого;
часто развивается кома смешанного происхождения;
смерть настает на 3-й—4-е сутки от острой сердечной недостаточности, отека мозга;
отсутствуют маркеры вирусных гепатитов (наличие HBsAg не исключает возможность отравления).
Отравления суррогатами алкоголя. Наиболее сложная проблема. Часто отсутствуют соответствующие анамнестические данные, так как больные скрывают прием суррогатов не только от врача, но и от родственников. Под суррогатами понимается громадное количество
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 5QQ
токсических для печени веществ, которые могут находиться в алкогольных напитках кустарного производства. Для них характерно:
отсутствие продромального периода, характерного для ВГ;
быстро появляется острая почечная недостаточность;
гипербилирубинемия часто смешанная при высокой активности трансаминаз, поздно снижается протромбиновый индекс.
Острый алкогольный гепатит. Сложной является и дифференциальная диагностика с острым алкогольным гепатитом, так как может скрываться систематическое употребление алкоголя или наличие запоев. Желтуха может сочетаться с явлениями энцефалопатии, симулируя клинику ФГ. Поэтому важными для диагностики становятся внешние признаки хронического алкоголизма (облик, поведенческие, неврологические, висцеральные изменения), характерные для этого заболевания.
Острый алкогольный гепатит отличают:
преимущественное развитие его у лиц молодого и среднего возраста после тяжелого запоя при длительном (более 10 лет) злоупотреблении алкоголем;
в дебюте — внезапное появление болевого и диспепсического синдромов (тошнота, рвота, диарея) и лишь затем развитие желтухи;
боль в правом подреберье или надчревье бывает достаточно сильная, диффузная, может имитировать острый живот;
лихорадка на фоне желтухи длительностью до 2 нед, у трети больных температура повышается до 40 °С;
значительно увеличенная и уплотненная печень;
кожные телеангиэктазии, ладонная эритема, астериксис (порхающий тремор кистей рук);
полинейропатии, контрактура Дюпюитрена;
в крови — даже гиперлейкоцитоз с нейтрофилезом, иногда до лейкемоидной реакции, значительно увеличение СОЭ (до 40— 50 мм/ч), анемия; активность трансаминаз повышена умеренно, АсАТ значительно больше АлАТ, существенно повышена активность глутаматдегидрогеназы и у-глутамилтрансферазы, тимоловая проба в норме;
часто выраженная гипогликемия;
длительность течения.
Синдром Вернике—Корсакова, алкогольный делирий на фоне вирусного гепатита. Крайне сложна дифференциальная диагностика состояний при наличии у пациента острого вирусного гепатита и сопутствующих заболеваний, связанных с алкоголизмом. Синдром Гайе—Вернике—Корсакова развивается при хроническом алкоголизме и проявляется симптомами энцефалопатии
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
600
(амнезия, грубая дезориентация, апатия), полинейропатией, тахикардией, гипотензией. На фоне острого вирусного гепатита может сложиться впечатление о развитии ФГ. Точно также достаточно сложна дифференциальная диагностика острого вирусного гепатита в сочетании с алкогольным делирием (см. табл. 41).
Таблица 41. Дифференциальная диагностика ФГ и сочетания ОВГ + синдром Вернике—Корсакова и ОВГ+алкогольный делирий
Признак |
ФГ |
ОВГ + синдром Вернике—Корсакова |
ОВГ + алкогольный делирий |
Типичный |
Астериксис |
Нистагм |
Галлюцинации |
симптом |
|
|
|
Анамнез |
Нет разре- |
Алкоголизм+ |
Абстиненция |
|
шающих |
недостаточность |
после длительного |
|
факторов |
питания |
запоя |
Дезориенти- |
Появляется |
Часто с самого на- |
Выраженная |
ровка в месте и |
во 2-й стадии |
чала |
|
времени |
ПЭ |
|
|
Поведение |
Спокойное, в |
Спокойное, апа- |
Очень беспокой- |
|
конце 2—3-й стадии агрессивное |
тичное |
ное, агрессивное |
Галлюцинации |
Очень редко |
Нет |
Ярчайшие |
Страх |
Во 2—3-й |
Нет |
Достаточно выра- |
|
стадиях, умеренный |
|
женный |
Движения |
Замедленные |
Некоординиро- |
Сильное двига- |
|
|
ванные, особенно |
тельное беспо- |
|
|
при ходьбе |
койство |
Тремор |
Астериксис |
Нет |
Мелко- и средне-размашистый тремор |
Речь |
Замедлена, смазана |
Не изменена |
Быстрая |
Глазные симп- |
Нет |
Нистагм, парез |
Нет |
томы |
|
взора |
|
Судороги |
Редко, в терминальной стадии |
Нет |
Выраженные |
Рвота |
Часто |
Нет |
Иногда |
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 601
Продолжение табл. 41
Признак |
ФГ |
ОВГ + синдром Вернике—Корсакова |
ОВГ + алкогольный делирий |
Очаговые |
Чаще в тер- |
Часто |
Могут, при выра- |
симптомы |
минальной стадии |
|
женном отеке |
Бессонница |
Часто, нарушение формулы сна |
Иногда |
Всегда |
Повышение |
Иногда, феб- |
Не характерно |
Повышается вне- |
температуры |
рильная |
|
запно, фебрильная |
тела |
|
|
|
Тахикардия |
Часто |
Всегда |
Всегда |
Лейкоцитоз в |
Часто |
Нет |
Иногда |
крови |
|
|
|
Снижение |
Всегда |
Нет |
Нет |
уровня факто- |
|
|
|
ров свертыва- |
|
|
|
ния крови |
|
|
|
Отравление гепатотоксическими веществами. В данном разделе рассмотрим лишь некоторые острые отравления гепатотоксическими веществами, которые могут имитировать клинические проявления ФВГ.
Отравление четыреххлористым углеродом от ФГ отличают:
инкубационный период (колеблется от нескольких часов до нескольких дней);
остро появляющиеся симптомы поражения ЦНС (головокружение, сонливость, спутанность сознания, расстройства зрения, иногда судороги, кома) в сочетании с головной болью, тошнотой, рвотой, диареей, лихорадкой в течение 2—3 дней;
желудочно-кишечное кровотечение (при заглатывании яда);
наличие периода мнимого благополучия в течение нескольких дней;
появление желтухи происходит одновременно с присоединением тяжелого поражения почек с анурией;
— гипертрансфераземия, но АсАТ значительно превышает АлАТ. Отравление дихлорэтаном вызывает развитие тяжелой острой
печеночной недостаточности, что может симулировать ранний ФВГ. Особенности этого отравления, отличающие его от ФВГ:
— инкубационный период практически отсутствует, развивается
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
602
клиника алкогольного опьянения, тошнота, рвота, боль в над-чревье, иногда понос;
одышка, цианоз, желтуха, олигоанурия появляются почти одновременно;
нарушения зрения, жужжание в ушах, гиперемия лица, шеи, цианоз губ;
поражаются печень, почки, миокард и в меньшей степени — ЦНС;
активность трансаминаз высокая, АсАТ превышает АлАТ;
смерть может настать от отека легких, острой печеночно-по-чечной недостаточности, отека мозга.
Отравление парацетамолом. Значительное распространение парацетамола — анальгетика и жаропонижающего, широкое применение его в педиатрической практике делает актуальной возможность отравления им. У взрослых некрозы в печени развиваются после приема 7,5—10 г препарата, но реальную дозу трудно оценить, так как быстро развивается рвота, а данные анамнеза обычно ненадежны. Алкоголь, индуцируя ферменты, усиливает гепатотоксич-ность парацетамола, поэтому у больных алкоголизмом повреждение печени может развиться при ежедневном приеме лишь 4—8 г препарата и даже меньше (при наличии сопутствующего заболевания печени). Полярный метаболит парацетамола связывается в печени с глутатионом. Истощение запасов глутатиона приводит к тому, что этот метаболит арилирует макромолекулы, необходимые для жизнедеятельности гепатоцитов, вызывая их некроз. Сердечно-легочная и почечная недостаточность, наблюдающиеся особенно у людей пожилого возраста, повышают риск поражения печени даже после приема умеренных доз парацетамола. Следует помнить, что парацетамол часто используется с целью суицида. Развивается фульминан-тная печеночная недостаточность, которая может походить на раннее фульминантное течение ВГ, т.к. быстро развивается желтуха, кома с бурным прогрессированием процесса.
Отличительные особенности отравления парацетамолом:
инкубационный период несколько часов;
вначале появляются тошнота, частая рвота; сознание не нарушается;
через 2 сут настает мнимое улучшение, но спустя 1—2 сут — ухудшение — желтуха, боль в правом подреберье;
состояние быстро ухудшается при тяжелом отравлении — до развития комы (острые некрозы печени);
значительная гипогликемия;
поражение миокарда, часто острый канальцевый некроз почек с развитием ОПН;
тяжесть состояния можно оценить по номограммам, учитыва-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 603
ющим концентрацию парацетамола и срок после приема препарата;
— эффективным антидотом являются N-ацетилцистеин и метио- нин (в первые 10 ч после отравления), в дальнейшем их эффек тивность резко падает, через сутки практически отсутствует.
Лептоспироз (желтушная форма). Развитие острой печеночной недостаточности крайне тяжелой степени при лептоспирозе возникает редко, в основном на фоне хронического гепатита с исходом в цирроз печени, когда происходит декомпенсация последнего. Однако и тяжелое течение иктерогеморрагического лептоспироза может напоминать начальные этапы ФГ. Лептоспироз чаще необходимо дифференцировать с ФГА или ранним ФГВ. Общим является развитие желтухи, ДВС-синдрома и геморрагического синдрома, ОПН, возможно — комы.
Основные отличительные особенности лептоспироза:
острое начало;
отсутствие симптомов энцефалопатии независимо от уровня билирубина, но возможно развитие гнойного лептоспирозного менингоэнцефалита (именно с этим может быть связано нарушение сознания);
наличие выраженных миалгий;
печеночная и почечная недостаточность появляются раньше, чем желтуха и признаки поражения печени;
шафрановый оттенок желтухи;
сохранение размеров печени;
гипербилирубинемия смешанная;
низкая активность трансаминаз, часто АсАТ >АлАТ;
нормальный уровень факторов свертывания крови;
выявление в крови антител к лептоспирам, отсутствие анти-HAV IgM и маркеров острой HBV-инфекции.
Малярия. Тяжелую малярию с развитием желтухи и отека мозга (комы) может вызвать только Plasmodium falciparum, такая малярия в Украине бывает лишь завозной.
Особенности тропической малярии в отличие от ФГ:
анамнез (пребывание в странах, эндемичных для тропической малярии);
«преджелтушный» период сопровождается высокой, до 39— 41 "С лихорадкой, которая имеет постоянный характер (при первичных приступах) или приобретает характерный вид с типичными приступами (озноб -» жар —» пот);
желтуха появляется на фоне лихорадки, в основном умеренная, имеет своеобразный лимонный оттенок;
печень увеличена значительно, плотная;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
604
быстрое развитие почечной недостаточности за счет нарушений микроциркуляции;
геморрагический синдром не характерен;
в крови — быстро нарастающая анемия за счет гемолиза, билирубин повышен в основном за счет непрямого, активность трансаминаз низкая или нормальная;
нормальный или незначительно снижен уровень факторов свертывания крови;
в крови в большом количестве выявляется Plasmodium falciparum — возбудитель тропической малярии.
Желтая лихорадка. Развитие заболевания может напоминать ФГА, ФГО, ФГЕ — начальный «продром» с последующим развитием печеночной недостаточности.
Основные отличия от ФГ следующие:
соответствующий эпидемиологический анамнез: пребывание в стране, эндемичной по желтой лихорадке (Южная Америка, тропическая Африка);
острое начало с лихорадки, выраженной боли в пояснице, конечностях;
лихорадка двухволновая, с коротким периодом апирексии;
гиперемия лица, шеи, верхней части туловища, конъюнктив, склер, одутловатость лица, петехиальная сыпь;
желтуха развивается на 4-й день, сочетается с поражением почек;
вторая волна лихорадки сопровождается исчезновением гиперемии лица, нарастанием брадикардии, почечно-печеночной недостаточности, появлением тяжелого геморрагического синдрома;
повышение активности трансаминаз умеренное, АсАТ значительно выше АлАТ, смешанная гипербилирубинемия.
Синдром Шихана (острый жировой гепатоз беременных). Это сравнительно нечастое, но крайне грозное заболевание, возникающее в поздние сроки беременности, сопровождающееся поражением печени. Относят к так называемым митохондриальным ци-топатиям (как и синдром Рея). Дифференциальная диагностика с тяжелыми формами вирусных гепатитов, ФГ крайне сложна. Дифференциальный диагноз производится в первую очередь с ФГВ, а также ФГЕ (табл. 42).
Синдром Рея (Рейе). Это осложнение возникает при гриппе, ветряной оспе, энтеровируснои инфекции, некоторых других острых вирусных инфекциях, особенно в период эпидемий, вследствие приема салицилатов (аспирина) в острой фазе болезни, причем риск развития дозозависим. К другим возможным экзогенным факторам
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУАЬМИНАНТНЫИ ГЕПАТИТ 605
Таблица 42. Клинико-лабораторные особенности ФГВ, ФГЕ и острого жирового гепатоза беременных (ОЖГБ)
Признак |
ОЖГБ |
ФГВ |
ФГЕ |
Появле- |
На всем протя- |
На всем протяже- |
Только в III тримес- |
ние бо- |
жении беремен- |
нии беременности, |
тре беременности. |
лезни по |
ности |
но чаще в III три- |
Связано с развитием |
отноше- |
|
местре и даже в |
и прекращением бере- |
нию к |
|
ранний послеродо- |
менности |
беремен- |
|
вой период |
|
ности |
|
|
|
Началь- |
Продромальный |
Продром короткий, |
Продром длитель- |
ные |
период до 2 нед: |
меньше недели, |
ный (до нескольких |
прояв- |
может быть суб- |
иногда вообще от- |
недель, начинается в |
ления бо- |
фебрилитет, |
сутствует, преоб- |
28—30 нед) с непосто- |
лезни |
сыпь, характер- |
ладают диспепти- |
янными симптомами |
|
ны диспептичес- |
ческий, интоксика- |
интоксикации: изжо- |
|
кий, интоксика- |
ционный синдро- |
га, тошнота, изредка |
|
ционный, артрал- |
мы. Иногда диарея, |
рвота, усиливающая- |
|
гический синд- |
полиартралгия, |
ся слабость, зуд кожи |
|
ромы |
лихорадка |
|
Изжога |
Выражена слабо, |
Иногда |
Обязательный при- |
|
симптом необя- |
|
знак, значительно и |
|
зательный |
|
своеобразно выражен |
Желтуха |
Выражена обыч- |
Выражена обычно |
Нарастает буквально |
|
но значительно |
значительно |
по часам, достаточно интенсивная |
Размеры |
Вначале увели- |
При развитии |
В разгар уменьшается |
печени и |
чена, плотная, |
ФГ — становится |
|
свойства |
при развитии |
мягкой, уменьша- |
|
|
ФГ — уменьшается, становится мягкой |
ется |
|
Селезенка |
Чаще увеличена |
Чаще увеличена |
Не увеличена |
Гемор- |
В основе — ДВС- |
Выступает на пер- |
В основе — ДВС-син- |
рагичес- |
синдром (часто) |
вый план за счет |
дром |
кий синд- |
|
присоединения |
|
ром |
|
ДВС-синдрома. |
|
|
Лабор |
опорные показатели |
|
Общий |
Чаще нейтро- |
Те же изменения |
Нейтрофильный лей- |
анализ |
фильный лейко- |
|
коцитоз |
крови |
цитоз, реже — нормоцитоз |
|
|
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 606
Продолжение табл. 42
Признак |
ОЖГБ |
ФГВ |
ФГЕ |
Били- |
Разной степени |
Те же изменения |
Повышение быстрое, |
рубин |
повышение |
|
умеренное |
АлАТ, |
Тысячи ед/л, де- |
Те же изменения |
Нормальный уровень |
АсАТ |
сятки ммоль/л в |
|
или умеренное повы- |
|
разведенной сы- |
|
шение (меньше 1000 |
|
воротке крови |
|
ед/л, до 10 ммоль/л в разведенной сыворотке крови) |
Глюкоза |
Гипогликемия |
Те же изменения |
Часто гипогликемия |
крови |
|
|
|
Общий |
Уменьшается в |
Может не снижать- |
Значительно повыша- |
белок |
соответствии со |
ся за счет ранне- |
ется |
крови |
стадией ФГ |
го присоединения ОПН |
|
Мочевина |
Снижается, яв- |
Может не снижать- |
Повышается |
|
ляется маркером |
ся за счет ранне- |
|
|
прогрессирова- |
го присоединения |
|
|
ния |
ОПН |
|
Креати- |
В норме, повыша- |
В норме, повыша- |
Значительно повыша- |
нин |
ется при ОПН |
ется с присоединением ОПН. |
ется. |
Коагуло- |
Снижение уров- |
Снижение уровня |
Признаки развития |
грамма |
ня факторов |
факторов сверты- |
ДВС-синдрома |
|
свертывания |
вания крови чаще |
|
|
крови за счет па- |
смешанного харак- |
|
|
дения синтеза, или смешанного характера(присоединение ДВС-синдрома) |
тера |
|
Гемолиз |
Не характерен |
Характерен |
Не характерен |
Маркеры |
См. соответству- |
См. соответствую- |
Отсутствуют или |
|
ющий раздел |
щий раздел |
только НвэАд |
Течение |
Развитие ФГ ча- |
См. начало. |
Всегда бурное разви- |
болезни |
ще во 2-й полови- |
Развитие бурное, |
тие процесса с пора- |
|
не беременности |
быстрое, с быст- |
жением печени, по- |
|
|
рым присоедине- |
чек, отек мозга, тя- |
|
|
нием поражения |
желый ДВС-синдром |
|
|
почек, гемолиза, |
с массивными наруж- |
|
|
ДВС-синдрома, |
ными и внутренними |
|
|
кровотечений |
кровотечениями в течение 1—2 сут |
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
607
Продолжение табл. 42
Признак |
ОЖГБ |
ФГВ |
ФГЕ |
Акушер- |
Умеренное повы- |
Беременность и |
Частые явления позд- |
ские осо- |
шение частоты |
ВГЕ взаимно отяго- |
него токсикоза в III |
бенности |
акушерских ос- |
щают течение бе- |
триместре беремен- |
|
ложнений и экс- |
ременности и ге- |
ности. В основном у |
|
трагенитальных |
патита (II—III три- |
первородящих, а так- |
|
заболеваний |
местры) |
же при беременности двойней и плодом мужского пола |
Течение |
Возможно недо- |
Часто преждевре- |
Часто преждевремен- |
беремен- |
нашивание соот- |
менное прерыва- |
ные роды с кровотече- |
ности |
ветственно тя- |
ние беременности. |
нием, особенно в пос- |
Течение |
жести и стадии |
Начало родовой де- |
леродовой и ранний |
родов |
ФГ |
ятельности может |
послеродовой перио- |
|
|
значительно ухуд- |
ды, повышенная пе- |
|
|
шить течение гепа- |
ринатальная гибель |
|
|
тита и исход |
детей |
Течение |
Повышенная |
Повышает смерт- |
Высокая заболевае- |
после |
заболеваемость |
ность родильниц, |
мость родильниц |
родораз- |
родильниц, воз- |
часть детей погиба- |
|
решения |
можно ухудше- |
ют в анте-, интра- |
|
|
ние течения ВГВ, опасность позднего послеродового кровотечения |
натальный период |
|
Новорож- |
Риск заражения |
Из детей, родив- |
Высокая заболевае- |
денные |
ВГВ, повышенная |
шихся живыми, |
мость |
|
заболеваемость |
половина погибает в течение первого месяца жизни |
|
относят афлатоксин, множественные укусы шершней, инсектициды. Ранее регистрировался среди детей и подростков, в последнее время — среди взрослых и людей пожилого возраста. Синдром Рея представляет собой своеобразный вариант острого жирового гепато-за с развитием тяжелой печеночной недостаточности. Обнаружено избирательное поражение митохондрий гепатоцитов с нарушением митохондриального этапа превращения аммиака в мочевину — блокада орнитиновой транскарбамилазы и карбамоилфосфатсинтета-зы. При заболевании печеночная недостаточность сопровождается развитием энцефалопатии. Вместе с тем, истинная причина разви-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
608
тия неизвестна, некоторые педиатры считают, что в основе лежит неизвестное нарушение обмена веществ.
Особенности синдрома Рея, отличающие его от ФГ:
наличие респираторного синдрома, клиники основного заболевания в «продроме»;
развивается через 3—7 дней после респираторного синдрома;
имеются данные о приеме аспирина, других салицилатов;
неукротимая рвота, прогрессирующие неврологические расстройства;
выраженная гипогликемия (почти у половины больных);
умеренное повышение активности трансаминаз;
незначительная выраженность или отсутствие желтухи;
смерть в тяжелых случаях настает через 4—10 ч после появления симптомов вследствие отека мозга.
Лечение ФПН и пограничных тяжелых форм вирусных гепатитов. Лечение тяжелых форм вирусных гепатитов, ФГ — чрезвычайно сложная проблема. Несмотря на значительные успехи и прогресс знаний в гепатологии, уровень решения проблемы лечения подобных форм вирусных гепатитов остается практически неизменным на протяжении последних 30—40 лет. Отсутствуют действенные этиотропные препараты, которые могли бы помочь остановить этот лавинообразно нарастающий патологический процесс. В последнее десятилетие получил определенное распространение новый метод лечения — пересадка печени. Однако в основном трансплантацию производят при наличии тяжелых хронических заболеваний печени. Применение этого метода при фульминантном течении вирусного гепатита сопряжено со многими техническими, организационными, медицинскими проблемами, которые не позволяют пока широко внедрять данный метод. Поэтому консервативная терапия была и остается основной в лечении фульминантного течения ОВГ. Применяемые методы консервативного лечения не стали панацеей, эффективность многих препаратов (преднизолон, например) не доказана. Вместе с тем, эффективность комплекса мероприятий не оценивалась, а отдельные методы не получили распространения. Часто наблюдается острая печеночная недостаточность у больных с наличием микст-поражения печени, когда одно из заболеваний хроническое. В таких случаях острую печеночную недостаточность уже нельзя оценивать как ФГ. Однако на раннем этапе развития хронического процесса, когда морфологическая перестройка выражена мало, лечебная тактика остается такой же, как и при ФГ.
Успех в лечении ФВГ прямо зависит от сроков его проведения. Более глубокие стадии ФПН сопровождаются развитием многих нарушений, которые усиливают полиорганную недостаточность, требуют дополнительной медикаментозной коррекции, что значитель-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
609
но ухудшает прогноз. Для достижения успеха в лечении ФПН необходимо выполнение ряда условий:
лечение необходимо начинать немедленно, при появлении первых клинических или лабораторных признаков развития ФГ, в любое время суток. Потеря даже нескольких часов в ожидании появления новых симптомов или уточнения лабораторных показателей может оказаться фатальной;
необходимые мероприятия должны выполняться в комплексе, быстро;
дозы лечебных препаратов должны быть достаточными, лечение малыми дозами малоэффективно. Точно также не следует назначать слишком большие дозы, учитывая возможность развития побочного действия, нарушения метаболизма и выведения из организма препарата, а также экономическую целесообразность;
при лечении ФГ следует помнить о вреде полипрагмазии;
обязательный контроль не менее 2 раз в сутки основных показателей гомеостаза, которые отображают степень нарушения функции печени и других органов, контроль баланса жидкости;
лечение должно производиться в условиях инфекционной реанимации или общереанимационного отделения под непосредственным контролем инфекциониста. В крайнем случае можно лечить в условиях палаты интенсивной терапии при наличии отдельного поста медицинской сестры, при этом желательна организация круглосуточного врачебного наблюдения с участием врача-реаниматолога, так как ситуация может меняться очень быстро и требовать немедленной коррекции лечения.
Неотложная помощь при ФПН В случае, если подозрение на развитие ФВГ возникает уже при первичном обращении к врачу, больного следует немедленно госпитализировать непосредственно в отделение реанимации, палату интенсивной терапии инфекционного отделения. Для проведения квалифицированного лечения должны быть немедленно вызваны инфекционист и реаниматолог. Если ФВГ выявлен у больного, находящегося на лечении в неинфекционном стационаре, вопрос о целесообразности перевода его в специализированную инфекционную реанимацию должен решаться индивидуально с учетом лечебных возможностей отделения, где находится больной, и состояния самого больного. Перевод крайне нежелателен, если больной в состоянии комы или у него имеется выраженный геморрагический синдром. Длительная транспортировка противопоказана, она приведет к ухудшению состояния пациента. В такой ситуации необходимо организовать лечение по месту пребывания больного под контролем инфекциониста.
Прежде чем перейти непосредственно к лечению, следует ука-
39 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 610
зать, что изложенные ниже принципы применимы прежде всего для лечения фульминантного или субфульминантного вариантов ВГВ,
который встречается наиболее часто.
При наличии признаков ФГ необходимо немедленно провести катетеризацию крупной вены, так как большинство препаратов должно вводиться внутривенно, к тому же часто вследствие развития геморрагического синдрома каждая внутримышечная или подкожная инъекция вызывает кровотечение из места введения или образование гематомы. Венепункция может быстро осложниться флебитом, возможно выпадение иглы из вены, недостаточна бывает скорость введения препаратов, необходимо обеспечить длительную неподвижность больного во время внутривенного введения, что не всегда возможно. Можно катетеризировать крупную подкожную вену, лучше всего — подключичную, так как появится возможность контролировать ЦВД. В крайнем случае можно сделать венесекцию. Обязательны катетеризация мочевого пузыря (для тщательного учета диуреза), ежедневное промывание его и катетера раствором фу-рацилина. Если больной в коме, то вводится назогастральныи зонд для осуществления энтерального питания. Перед кормлением или введением таблетированных препаратов необходимо промывать желудок, удалять застойное содержимое, если оно имеется.
Весь комплекс лечебных мероприятий следует разделить на:
обязательные;
необходимые при развитии определенных осложнений.
Обязательные мероприятия, своевременно выполненные в полном объеме, в большинстве случаев положительно влияют на общее течение ФГ, предупреждая во многих случаях развитие осложнений и позволяя избежать полипрагмазии, к которой часто прибегает врач уже на самом раннем этапе оказания помощи больному. В отдельных случаях она, к сожалению, бывает неизбежна, но все же нужно по мере возможностей стремиться сократить прием медикаментов, учитывая то, что полипрагмазия не благоприятствует купированию явлений острой печеночной недостаточности.
Обязательные мероприятия. Режим строгий постельный. Охрана от дополнительных энергетических затрат с целью уменьшения образования аммиака в мышцах.
Диета должна быть легкоусвояемой, при необходимости — жидкой, не содержать животных белков. Первые 1—2 сут может быть вообще безбелковой. Общая суточная энергетическая ценность с учетом внутривенно вводимых препаратов — не менее 8360— 10 450 кДж (2000—2500 ккал). Таким больным категорически противопоказано голодание. Запас углеводов в организме составляет всего около 700 г, поэтому при голодании, ГКС-терапии, терминальном
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
состоянии быстро истощается запас гликогена, активируется утилизация эндогенных белков и нарастают явления аутоинтоксикации.
Тяжелобольные находятся в состоянии стресса, когда значительно возрастают энергетические потребности организма, резко усиливается катаболизм и гиперметаболизм. Во время голодания организм получает макроэрги из собственных запасов жира и гликогена, а также функциональных внутриклеточных белков. Нарушение функции печени при ФГ приводит к нарушению обмена глюкозы, жирных кислот, усилению катаболизма белков, значительному усилению аммиачной интоксикации, развитию метаболического ацидоза. Кроме того, полный покой кишечника вызывает атрофию его слизистой оболочки, дегенеративные изменения возникают уже через несколько дней покоя. Они прогрессируют, даже несмотря на полноценное парентеральное питание. Следует помнить, что именно энтеральное питание способствует сохранению защитного барьера, отделяющего микроорганизмы кишечника от системной циркуляции, препятствуя, таким образом, транслокации бактерий в кишечную стенку. Поэтому если больной без сознания, то ему налаживают энтеральное питание через назогастральный зонд.
Энтеральное питание через назогастральный зонд должно быть дробным, частым, общий объем не должен превышать 1,5 л, так как основной недостаток этого способа — возможность регургитации и аспирации жидкости в легкие. Наиболее частым осложнением эн-терального питания является диарея (10—20 %), связанная с гипер-осмолярностью питательного раствора. Нужно исключать любые гипертонические препараты, добавляемые к пищевым смесям (в том числе и 40 % глюкозу). Желательно добавлять пектины, которые задерживают опорожнение желудка, помогают более эффективно снижать осмотическую концентрацию пищевой смеси. Лучше всего в этом качестве использовать неочищенный яблочный сок (до 100 мл в сутки) или каопектат (30 мл 2—3 раза в день).
Тонкокишечное кормление (зонд вводится в двенадцатиперстную кишку) менее эффективно, так как устраняется трофический эффект желудочного кормления, нет убедительных доказательств, что оно снижает риск аспирационной пневмонии, кроме того, увеличивается вероятность возникновения диареи, да и технически это более сложная процедура.
Гиперосмолярная диарея не является противопоказанием для эн-терального зондового питания. Нужно лишь изменить тактику питания (уменьшить осмолярность питательной смеси, ее объем, увеличить частоту приема пищи, исключить антациды и т.д.). После выхода из состояния острой печеночной недостаточности необходим поэтапный переход на диету №5а, затем №5.
При комбинированном питании парентерально можно вводить
39*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
612
аминокислотные смеси, но не содержащие незаменимые аминокислоты (метионин, триптофан, фенилаланин, тирозин). Это гепасте-рилА, гепаферил А, нутрамин К, аминостерил N-Hepa, гепата-мин, отечественный глютаргин. В состав большинства из них входят L-аргинин, L-глутаминовая, яблочная кислоты, имеющие важное значение в обезвреживании аммиака, синтезе мочевины. Их действие усиливается L-орнитином и L-аспарагиновой кислотой. Противопоказанием для их применения является развитие почечной недостаточности.
Ежедневно необходима сифонная клизма щелочной реакции для уменьшения экзогенной интоксикации. Небольшое количество гидрокарбоната будет также благоприятствовать коррекции внутрипе-ченочного метаболического ацидоза. Необходимо также помнить, что применение щелочного раствора для обычной очистительной клизмы будет увеличивать всасывание токсических веществ из кишечника и усиливать тем самым интоксикацию и энцефалопатию.
Плазмаферез является важнейшим методом лечения, который выполняет сразу несколько задач:
снижение вирусной и антигенной нагрузки (удаляются вместе с плазмой одновременно вирусные антигены, ЦИКи, антитела к вирусным антигенам, аутоантитела); снижение концентрации иммуноглобулинов в плазме приводит к уменьшению активности инфекционно-аллергического и аутоиммунного воспаления в печени;
дезинтоксикационная (удаление всего спектра токсических веществ, незаменимых аминокислот, продуктов метаболизма клеток, местных гормонов, пептидов, многих других биологически активных веществ — медиаторов альтерации и воспаления) ; удаление плазмы ведет к освобождению клеток от адсорбированных на их поверхности токсических и других продуктов, повышает их функциональную активность;
предупреждение развития и лечение ДВС-синдрома, который всегда имеется при ФГ.
Плазмаферез оказывает быстрое воздействие на активность патологического процесса. Выполнение его возможно двумя способами:
дискретный, или прерывистый (при помощи центрифуги типа ОС-б);
непрерывный (на фракционаторах типа ПФ-0,5).
Первый метод более прост, дешев и доступен для массового применения, однако требует больше времени, а также дозозависим (объем его связан также и с емкостью флакона), второй— значительно более дорогой (стоимость аппаратуры, фракционаторов), несколько сложнее в техническом применении, но требует существен-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ 613
но меньше времени, значительно легче дозируется объем экскреции плазмы.
Определенным недостатком обоих способов является удаление альбуминов, что требует при необходимости коррекции уровня белка крови. При нормальном уровне общего белка плазмы крови (больше 60 г/л) производится 2—3 сеанса плазмафереза. При определенном сгущении крови возможно проведение дилюции кристал-лоидными растворами в количестве 5—7 мл/кг. В первый сеанс экс-фузируют до 30—35 % ОЦП, этот объем замещают кристаллоидны-ми растворами. Если до первого сеанса уровень общего белка крови составлял меньше 60 г/л, то замещение плазмы должно быть комбинированным (лучше всего замороженная плазма + кристаллоидные растворы в соотношении 1:1). Во второй и третий сеансы объем экс-фузии должен составлять около 25 % ОЦП, замещение — комбинированное. Сеансы плазмафереза повторяются через 24 ч. Следует также отметить, что низкий уровень протромбина (30 % и ниже) и других факторов свертывания крови не является противопоказанием для проведения плазмафереза в необходимом объеме. Однако в этой ситуации уже во время первого сеанса замещение может быть комбинированным, так как обычно имеется и гипоальбуминемия.
Дискретный плазмаферез осуществляется при помощи сдвоенных пластиковых мешков-гемаконов (что удобнее и безопаснее) или стандартных 500 мл флаконов с раствором глюгицира. При его проведении крайне редко развиваются побочные реакции, при применении фракционаторов побочные эффекты возникают существенно чаще — по некоторым данным, — до 15 %, однако развиваются они в основном при больших объемах эксфузии плазмы (30—40 мл/кг). Обычно побочное действие возникает в конце процедуры или через 30—40 мин после нее, оно проявляется парестезиями, похолоданием конечностей, одышкой, снижением АД. Происхождение таких реакций связано с гипокальциемией вследствие введения большого объема цитратного раствора, быстрым уменьшением ОЦК и гемоди-намическими сдвигами, обусловленными эмоциональной напряженностью, охлаждением растворов до комнатной температуры.
При гипокальциемии вводят 10—15 мл 10 % раствора кальция глю-коната, согревают больного. В случаях умеренной гипотензии можно ограничиться введением кристаллоидных растворов. Если АД ниже 80/40 мм рт. ст., следует остановить процедуру и ввести ГКС. В случае развития гипотонической реакции следует ее устранить и продолжить плазмоферез лишь после стабилизации гемодинамики с более низкой скоростью, в заместительных растворах увеличить долю белковых препаратов.
Не рекомендуется проведение плазмафереза при выраженной анемии (уровень НЬ ниже 80 г/л), гемолитических анемиях любого
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
614
происхождения независимо от степени их выраженности, сердечнососудистых заболеваниях в стадии декомпенсации, язвенной болезни желудка и двенадцатиперстной кишки при отсутствии рубцевания, хотя последние противопоказания относительны.
Определенная осторожность нужна при наличии у больного тяжелой сопутствующей патологии сердечно-сосудистой системы в фазе декомпенсации. В такой ситуации возможность проведения плазмафереза решается совместно с кардиологом. Решение данной проблемы упрощается при наличии аппарата для плазмафереза непрерывного типа. Его применение позволяет уменьшить скорость отбора крови, увеличить время проведения сеанса, что существенно уменьшает нагрузку на сердечно-сосудистую систему. При недостаточности кровообращения предварительная дилюция не проводится, более того, при необходимости и возможности может быть одновременно проведена гемофильтрация.
Более эффективны плазмацитоферез и криоплазмацитоферез, однако их применение ограничивается высокой стоимостью аппаратуры и фракционаторов.
Другие методы экстракорпоральной детоксикации (гемосорбция, гемофильтрация, гемодиализ, их варианты) не являются альтернативой плазмаферезу и в обязательный комплекс мероприятий не входят. При применении современных так называемых делигандизиру-ющих сорбентов не решаются все проблемы, устраняемые плазма-ферезом. Кроме того, сохраняются проблемы противопоказаний, дороговизны, технических сложностей гемосорбции при развитии ДВС-синдрома.
Глюкокортикостероиды (ГКС). Почти полустолетний опыт использования ГКС при ФГ, несмотря на периоды восторженного и, наоборот, отрицательного отношения к ним, показал их определенную эффективность. Именно в последние десятилетия наметилось уравновешенное отношение к применению ГКС при ФГ. Невзирая на то, что, по справедливому мнению многих авторов, ГКС не стали поворотным моментом в лечении тяжелых форм ВГ, так как существенно не влияли на исход заболевания, применение их показано при ФГ. Да и вряд ли вообще какой-либо метод лечения ФГ является панацеей. При этом заболевании положительного эффекта можно ожидать лишь от комплекса мероприятий.
Все противопоказания для назначения ГКС (язвенная болезнь, психические заболевания, туберкулез, сахарный диабет, сердечнососудистая недостаточность, гипертоническая болезнь и др.) при ФГ весьма условны. Вместе с тем, сложно решается проблема целесообразности применения ГКС у больных с ФГ и желудочно-кишечными кровотечениями. Одни авторы эту проблему обходят стороной, другие — ратуют за категорическую отмену ГКС при малейшем
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙГЕПАТИТ
615
подозрении на кровотечение из эрозий или язв желудка, двенадцатиперстной кишки. При экстремальных состояниях, к которым относится и ФГ, такое противопоказание можно рассматривать как относительное. Мы считаем, что противопоказанием для применения ГКС при ФГ может быть только массивное кровотечение, угрожающее развитием геморрагического шока. Длительность парентеральной ГКС-терапии при ФГ ограничивается в большинстве случаев 5— 7—10 днями, поэтому вряд ли возможно их существенное влияние на кровотечения.
ГКС могут быть эффективными при лечении больных с ФГ, учитывая такие их особенности:
мощное противовоспалительное действие (стабилизация мембран лизосом с блокадой выделения медиаторов альтерации и воспаления — гистамина, серотонина, кининов, других проте-аз), уменьшение проницаемости мембран клеток, подавление активности гиалуронидазы, снижение уровня экссудации;
достаточно мощное и быстрое иммунодепрессивное действие — подавление антителообразования, в том числе противовирусных и аутоантител, трансформации лимфоцитов, фагоцитоза; вместе с тем, они не влияют на пролиферацию стволовых клеток;
стимуляция синтеза белка и гликогена в гепатоцитах, повышение уровня альбумина в плазме крови.
При лечении ФГ предпочтение отдается преднизолону, так как у него наименее выражен минералокортикоидный эффект. Среднесуточная доза составляет 3—5 мг/кг при дробном (каждые 3—4 ч) внутривенном введении через равные промежутки времени. Нужно учитывать быструю элиминацию препарата. Внутривенное введение может комбинироваться с внутримышечным при отсутствии нарушений микроциркуляции, влияющих на эффективность всасывания. Купирование явлений острой печеночной недостаточности должно служить основанием для быстрого уменьшения дозы ГКС с последующей их отменой, причем отсутствие снижения при этом уровня билирубина не должно смущать: критериями эффективности ГКС-терапии являются только симптомы ФГ.
Применение больших доз ГКС нежелательно, так как эффективность их при этом не возрастает, а вероятность развития осложнений существенно увеличивается.
Осложнения ГКС-mepanuu. С учетом небольшой длительности лечения глюкокортикостероидами в некоторых случаях возможно развитие таких преходящих осложнений, как:
гипертензия;
стероидный диабет;
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 616
кандидоз (впрочем, его причиной часто является и полипрагма-зия);
активизация хронических очагов инфекции;
— желудочно-кишечное кровотечение. Противопоказанием для применения ГКС является развитие так
называемого иммунотолерантного варианта ФВГВ, протекающего с продолжающейся репликацией вируса. В этой ситуации ГКС могут способствовать дальнейшему прогрессированию инфекционного процесса.
Ингибиторы протеаз. Нарушения микроциркуляции, закономерное развитие ДВС-синдрома, значительная активация протеолити-ческих ферментов (лизосомальных гидролаз, протеиназ крови) являются основанием для применения ингибиторов протеаз — контрикала или его аналогов (гордокс, трасилол). Ингибиторы протеаз инактивируют протеолитические ферменты, кинины (каллидин, брадикинин), предупреждают высвобождение биологически активных пептидов-(кининов), тормозят развитие тканевого отека путем непосредственной стабилизации проницаемости капилляров. Кроме того, ингибиторы протеаз являются наиболее важным элементом лечения при развитии ДВС-синдрома. Доза контрикала в условиях такого «ферментативного взрыва» должна быть достаточной — до 1000—2000 МЕ/кг в сутки. Инфузии ингибиторов протеаз продолжают на протяжении 3—4 дней (до стабилизации состояния). Параллельно может внутривенно вводиться пентоксифиллин в дозе 100—200 мг в сутки.
Дезинтоксикационная терапия с форсированием диуреза — одно из важнейших направлений лечения ФГ. Она должна проводиться с учетом состояния КОС, водного баланса, содержания электролитов. Обязательным компонентом терапии является 5—10 % раствор глюкозы, он выполняет такие основные функции:
коррекция гипогликемии, которая иногда развивается при ФГ в связи с нарушением глюнеогенеза;
является донатором глюкуроновой кислоты, которая связывает токсины с образованием нетоксичных соединений;
подавление катаболизма белков, уменьшение вследствие этого явлений специфической интоксикации, приводящей к энцефалопатии.
Суточная доза глюкозы с учетом энтеральных поступлений должна составлять до 5 г/кг.
Форсирование диуреза производится салуретиками в обычных терапевтических дозах, но обязательно с первого дня одновременно назначают антагонисты альдостерона. При ФГ происходит накопление альдостерона, который задерживает натрий и воду и, таким образом, блокирует действие салуретиков. Поэтому важно именно
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПА ТИТ
617
одновременное (действие антагонистов альдостерона развивается через 24—48 ч) применение спиронолактона (верошпирона, аль-дактона) в дозе до 150—200 мгвсуткиисалуретиков. Одновременное назначение этих средств позволит уменьшить вероятность возникновения труднокорригируемой гипернатриемии (уровень натрия в плазме крови выше 160 ммоль/л) и задержки жидкости. Коррекцию гипокалиемии, которая часто возникает при ФГ, лучше проводить растворами калия хлорида с глюкозо-инсулиновой смесью. К сожалению, антагонисты альдостерона существуют только в таблети-рованном виде, поэтому их следует вводить через назогастральный зонд. Необходимо помнить об определенном токсическом действии салуретиков на печень, поэтому доза препарата должна быть минимально необходимой.
Чрезвычайно важной проблемой является коррекция электролитного баланса. Для контроля обычно определяют уровень электролитов в плазме крови. Однако нормальный уровень не должен вводить в заблуждение клинициста. При активном выходе калия из клеток концентрация его в плазме становится нормальной, повышенной или пониженной в зависимости от стадии процесса. Точно так же низкая концентрация натрия в плазме крови может быть не только при изотонической дегидратации, но и при активном переходе натрия в клеточный сектор взамен теряемого калия при гипок-сических состояниях (синдром больных клеток), имеющихся при ФПН. Поэтому для определения тактики коррекции электролитов и необходимости введения конкретных растворов важно исследование концентрации калия и натрия не только в плазме, но и в лизате эритроцитов, суточной экскреции этих катионов с мочой. В норме за сутки с мочой выделяется 1,5—3,5 г калия и 3—6 г натрия. Возмещать потери калия необходимо уже в первые сутки лечения, так как его запас в организме составляет всего 150—200 г. Значительное снижение экскреции натрия (1,2 г) свидетельствует о наличии патологического обмена электролитов на клеточном уровне, что присуще любой гипоксии. Введение растворов, содержащих натрий, в таких условиях будет способствовать накоплению воды в тканях, развитию и прогрессированию отека мозга, легких. Определение уровня калия в эритроцитах имеет и прогностическое значение. При концентрации ниже 70 ммоль/л прогноз становится неблагоприятным, так как при потере калия последний замещается натрием и ионами водорода. Такая клетка теряет способность восстанавливать продукцию макроэргов. Однако нарушение баланса электролитов в эритроцитах начинается на поздних стадиях патологических процессов, потому что они (как другие высокодифференцированные клетки — мозга, печени, сердца) при гипоксии теряют свой калий значительно позже других, менее дифференцированных клеток. Поэтому для определе-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
618
ния баланса электролитов лучше ориентироваться на суточную экскрецию электролитов с мочой. Уровень в эритроцитах необходимо определять для оценки степени развившихся изменений, их восстановления в процессе лечения. Осторожно должна осуществляться коррекция Са2+, так как последний усиливает вазоконстрикцию. Весьма целесообразно введение Мд2+ в виде сульфата магния.
Необходим строжайший контроль за балансом воды в организме больного: учет вводимой за сутки жидкости — внутривенно, через зонд и выводимой из организма — с мочой, калом, в виде патологических потерь (застой в желудке, рвота), а также в виде неощутимых потерь через кожу, легкие. В норме неощутимые потери колеблются от 800 до 1000 мл в сутки. При повышении температуры тела на 1 °С свыше 37 °С они возрастают на 500 мл. При проведении ИВЛ респираторами с недостаточным увлажнением вдыхаемой газовой смеси потери через легкие могут значительно возрастать и составлять до 1000 мл. Особенно велики потери через кожу и легкие в жаркое время года. Поэтому при составлении водного режима для больного, который не может полноценно питаться, эти возможные потери жидкости должны быть учтены. Нельзя допускать резких перепадов в сторону как положительного, так и отрицательного баланса жидкости. Чрезмерная дегидратация приведет к углублению нарушений микроциркуляции и усилению гипоксии, гипергидратация — к усилению отеков и угрозе развития отека легких. Нужно стремиться к нулевому балансу. Общий объем вводимой жидкости должен составлять 40—50 мл/кг в сутки при нормально функционирующих почках.
Антибактериальная терапия должна быть направлена на предупреждение развития/лечение бактериальных осложнений при ФГ. Частота их возникновения может достигать 80 %. Именно они часто становятся причиной безуспешного лечения ФПН. Чаще всего поражаются легкие и мочевыводящие пути. По некоторым данным, у трети больных с ФПН развивается спонтанный бактериальный перитонит. При назначении антибиотиков обязательно учитывается гепатотоксичность и нефротоксичность препарата, метаболизм, пути выведения из организма. В связи с этим не рекомендуется применение цефалоспоринов I—III поколений, карбопенемов, макроли-дов, тетрациклинов.
Возможны 3 основных варианта развития бактериальных осложнений:
активация имеющихся хронических очагов бактериальной инфекции;
присоединение экзогенной бактериальной инфекции;
активация и транслокация кишечной микрофлоры с развитием флегмоны кишечника, сепсиса, перитонита.
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
619
При наличии хронических очагов инфекции (обструктивный бронхит, пиелонефрит) системную антибактериальную терапию назначают с первого дня: ципрофлоксацин (или иные фторхинолоны), рифаксимин, полусинтетические пенициллины, метронидазол, ами-ногликозиды II—III поколения в обычных терапевтических дозах на весь период интенсивной терапии с применением ГКС. Это же лечение будет служить профилактикой присоединения экзогенной, активации эндогенной микрофлоры. Однако назначение фторхиноло-нов требует известной осторожности, так как они несколько повышают активность трансаминаз.
При отсутствии хронических очагов инфекции антибактериальную терапию можно не назначать, если ликвидация критического состояния возможна в течение 2—3 сут. Если пациента невозможно вывести из критического состояния в течение этого срока, антибактериальную терапию можно проводить энтерально с учетом возможности активации и транслокации кишечной микрофлоры. Назначают препараты, подавляющие кишечную микрофлору и плохо всасывающиеся в кишечнике, — ампициллин (3—4 г/сут), амок-сициллин (2 г/сут), рифаксимин, канамицина сульфат. Особенность последнего в том, что он практически не всасывается из кишечника.
Энтерально введенные антибиотики угнетают гнилостные и бродильные процессы в кишечнике, препятствуя образованию аммиака, фенолов, индола и многих других токсичных метаболитов, имеющих большое значение в развитии печеночной энцефалопатии.
При отсутствии возможности применить антибиотики, подавляющие кишечную микрофлору, можно назначить лактулозу (нормазе, дуфалак, порталак, лактофальк, иволак). Она практически не всасывается из кишечника, в толстой кишке стимулирует размножение анаэробных лактобацилл, под влиянием бактерий в толстой кишке разлагается до жирных кислот, которые снижают местную рН. Кислая среда является неблагоприятной для бактероидов, которые считаются основными продуцентами аммиака. Следствием этого является угнетение аммиак- и фенолобразования и уменьшение абсорбции этих веществ. Продуктом ферментации лактулозы является также молочная и пировиноградная кислоты. Последние увеличивают осмотическое давление в толстой кишке, вызывая слабительный эффект. За счет осмотического действия почти в 2 раза увеличивается объем стула и существенно уменьшается время транзита по кишечнику. Считается, что действие лактулозы сопоставимо с эффектом сифонных клизм. Применяется лактулоза по 15—30 мл в виде сиропа 3—4 раза в день на протяжении всего острого периода.
Лечебная тактика при фульминантном варианте ВГЪ практически не отличается от таковой при ФГВ. Однако в этом случае не показа-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
620
но применение ГКС. Изучение эффективности действия различных противовирусных препаратов проводилось на ограниченном контингенте, полученные результаты весьма противоречивы. Поэтому их внедрение в практику требует уточнения и проверки временем.
Тактика лечения при микст-гепатитах неоднозначна. Прежде всего имеются в виду микст-гепатиты В + С, А + В. Лечение ФГ А + В ничем не отличается от такового при ФГВ. При фульминантном варианте вирусного гепатита В + С часто оказываются неэффективны плазмаферез и глюкокортикостероиды. Вместе с тем, лечение микст-гепатитов наиболее сложно, а эффект непредсказуем, так как часто одновременно у пациента имеются гепатиты с разнонаправленным патогенезом (прямое цитотоксическое действие вируса и иммуноопосредованное) и различной степенью активности каждого из них. Поэтому терапия должна проводиться осторожно, с возможным изменением основного вектора лечения. Лечение фульминант-ных микст-гепатитов — самая большая терапевтическая проблема, не разработанная ни на теоретическом, ни на лабораторном, ни, тем более, на клиническом уровне.
При ФГ могут возникать многочисленные дополнительные симптомы и синдромы, обусловленные столь характерными для них полиорганными нарушениями. Они могут становиться непосредственной причиной смерти, что требует своевременного выявления таких нарушений и срочной их коррекции. Но именно при ликвидации этих нарушений чаще всего возникает угроза полипрагмазии.
Отек-набухание головного мозга выявляется у 60—80 % умерших от печеночной комы. Пусковым фактором развития отека мозга является его гипоксия, на фоне которой прогрессирует повышение внутричерепного давления. Именно уровень внутричерепного давления —важнейший показатель эффективности противоотечной терапии. Более того, отсутствие тенденции к его снижению на фоне адекватного лечения в III—IV стадии энцефалопатии при ФГ является показанием к немедленной пересадке печени.
Существенное значение в лечении отека-набухания головного мозга имеет ограничение энергозатрат, что создает условия для уменьшения потребностей мозга в кислороде и улучшает переносимость гипоксии (см. лечение психомоторного возбуждения).
Больному важно приподнять верхнюю часть туловища на 20— 30° — это благоприятствует снижению внутричерепного давления. Следует обратить внимание, что более высокий подъем может повысить внутричерепное давление. Медикаментозное лечение отека головного мозга включает препараты, улучшающие микроциркуляцию, комбинацию осмодиуретиков с салуретиками в обычных дозах под контролем уровня электролитов (гипокалиемия способствует развитию метаболического алкалоза, углублению комы). Маннитол
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
назначают из расчета 1 г/кг (суммарная доза 100 г в виде 20 % раствора внутривенно струйно), фуросемид — 0,5—1 мг/кг.
Стойкая гипокалиемия является главным проявлением гипо-магниемии, причины их возникновения во многом одинаковы. Гипомагниемию могут вызвать салуретики, осмодиуретики, амино-гликозиды. Без Мд2+ нарушается работа калий-натриевого насоса, накапливающего К+ внутри клетки. Поэтому показано 1—2 раза в сутки ежедневно внутривенно капельно вводить 10 мл 25 % раствора магния сульфата. Если в этот день производился плазмаферез, то дозу увеличивают до 25—30 мл. Вводить его лучше в составе глюкозо-калий-инсулиновой смеси.
ГКС в таком случае предпочтительно назначать в виде 2 препаратов — дексаметазона, (лучше проникает через гематоэнцефаличес-кий барьер) в дозе 0,3—0,4 мг/кг и преднизолона — остальная часть дозы. Высокоэффективной считается краниоцеребральная гипотермия, которая уменьшает внутричерепную гипертензию и улучшает внутримозговой кровоток.
Эффективна в ликвидации практически всех видов гипоксии гипербарическая оксигенация (ГБО). Достаточно благоприятные результаты обеспечивает ГБО в стадии прекомы.
Рекомендуют применение 40 % раствора глюкозы по 100 мл 3—4 раза в сутки внутривенно капельно. С одной стороны, это часть парентерального питания, с другой — высокая концентрация повышает проникновение глюкозы через ГЭБ, что улучшает питание мозга.
В случае нарастания явлений гипоксии у больного в состоянии комы, даже при отсутствии нарушений внешнего дыхания, показан перевод на ИВЛ в режиме небольшой гипервентиляции кислородо-воз-душной смесью в соотношении 1:1. Критериями целесообразности перевода больного на ИВЛ в целях предупреждения развития отека мозга, является РаС02 ниже 48 мм рт. ст., Ра02 ниже 75 мм рт. ст. По мнению некоторых авторов, об ИВЛ необходимо думать уже во 2-й стадии ПЭ и вполне обоснованно применять в 3-й стадии. Именно Ра02 является показателем эффективности газообмена в легких. Важным при этом является контроль внутричерепного давления. Повышение его выше 25—30 мм рт. ст. рассматривается как критическое, потому что при этом резко ограничивается кровоснабжение мозга, прежде всего жизненно важных структур, увеличиваются гипоксия, отек мозга, мозжечка, возникает угроза развития вклинения ствола мозга в большое затылочное отверстие, что часто является непосредственной причиной смерти.
Купирование приступов психомоторного возбуждения является важным элементом лечения развивающегося отека головного мозга. Направлено оно на уменьшение энергозатрат. Выбор препаратов незначительный. Морфин, барбитураты, большинство нейролептиков
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
622
или углубляют кому, или являются гепатотоксичными. Предпочтение отдается естественному медиатору ЦНС — у-оксимасляной кислоте (натрия оксибутирату), имеющей достаточно большую терапевтическую широту и существенно (до 20 %) снижающей потребность мозга в кислороде — препарат вводят внутривенно капельно. Может применяться флумаземил — антагонист бензодиазепиновых рецепторов, вызывающий кратковременное, но вполне определенное улучшение приблизительно у 70 % больных. Возможно сочетанное введение натрия оксибутирата с сибазоном, препаратов со взаимно-потенцирующим действием, но доза последнего должна быть ограничена в связи с определенной гепатотоксичностью (2—4 мл в сутки). Учитывая, что сибазон преципитирует в растворах для внутривенного введения, адсорбируется на стенках трубок, его нужно вводить в трубку буквально рядом с веной. Период полужизни препарата в сыворотке крови 24 ч, поэтому возможна кумуляция.
При развитии желудочно-кишечного кровотечения, во-первых, необходимо выяснить причину его возникновения (эрозивно-язвен-ное, язвенное) и уровень поражения (желудок, двенадцатиперстная кишка и т.д.), что позволит определиться с возможностью местного влияния на причину кровотечения, во-вторых, —с основной причиной расстройства гемостаза (резкое падение синтеза прокоагу-лянтов или ДВС-синдром). Вероятность развития кровотечения существенно повышается при наличии ОПН. Кровотечения при ОПН связаны прежде всего с нарушениями в сосудисто-тромбоцитарном звене, существенное значение имеет и анемия (нарушается транспорт тромбоцитов к месту повреждения сосудистой стенки).
В большинстве случаев развиваются оба процесса (см. выше, патогенез), но с определенным преобладанием одного из них. Особое значение имеет промывание желудка при развитии желудочных кровотечений. Этой процедурой удается избежать всасывания белков распадающейся крови: из 500 мл крови высвобождается до 120 г белка. При выявлении в желудке или двенадцатиперстной кишке кровоточащих дефектов слизистой оболочки, которые невозможно коагулировать, показано промывание желудка ледяной водой с добавлением адреналина, аминокапроновой кислоты или трансамчи, можно вводить памбу. Возможны прием гемофобина (раствор пектинов с добавлением кальция хлорида) по 1 столовой или десертной ложке 1 —3 раза в день, а также местная гипотермия (холод на живот, мороженое внутрь).
Для профилактики повторных кровотечений применяют негепа-тотоксичные блокаторы Н2-гистаминовых рецепторов (с учетом их гепатотоксичности), антациды (алмагель), препараты висмута.
Учитывая нарушения и в тромбоцитарном звене гемостаза, целесообразно использование натрия этамзилата (дицинона) до 8—12 мл
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
в сутки, аскорбиновой кислоты. Во всех случаях применяют препараты кальция, викасол в обычных терапевтических дозах. Тактика остановки кровотечений несколько отличается в зависимости от ведущего патогенетического механизма, спровоцировавшего возникновение этого осложнения:
при преобладании ДВС-синдрома назначается терапия по классической схеме (см. соответствующую главу), элементы которой уже описаны среди обязательных мероприятий, предусмотренных при лечении ФГ. Дополнительно необходимо проводить заместительное лечение, лучше всего криопреципита-том плазмы или замороженной плазмой, которые содержат не только весь комплекс факторов свертывания крови, но и проти-восвертывающей системы, имеющей существенное значение в профилактике развития и лечении ДВС-синдрома. Скорость введения не более 20 мл/мин. При массивной кровопотере показано введение альбумина. Однако его можно назначать лишь в дополнение к замороженной плазме и/или криопреципитату, так как, являясь мощным сорбентом токсинов, он будет усиливать токсическую нагрузку на печень. Применение гепарина в такой ситуации является весьма рискованным. Введение плаз-мозамещающих препаратов должно быть весьма ограниченным. Препараты поливинилпирролидона (гемодез, неогемодез) не решают проблему детоксикации организма даже частично, но их побочное действие, которое всегда сказывается в будущем, делает эти средства малоприемлемыми. На фоне преобладания ДВС-синдрома возможно введение 200—400 мл реополи-глюкина, но не более 1—2 раз. Полиглюкин по своим побочным действиям мало отличается от препаратов поливинилпирролидона. В последние годы появились новые трансфузионные средства — перфторан, препараты гидроксиэтилкрахмала. Однако эффективность и последствия применения первого еще требуют изучения, применение второго возможно при отсутствии почечной недостаточности;
при преобладании падения синтеза факторов свертывания крови проводится активная заместительная терапия препаратами нативной и замороженной плазмы. В случае падения уровня эритроцитов и гемоглобина до критических значений возможно и вливание одногруппной свежей (не более 2—3 сут после забора) крови, эритроцитарной массы, а лучше всего — отмытых эритроцитов, которые, кроме всего прочего, обладают существенным детоксицирующим действием. Применение более «старой» крови малоэффективно, так как эритроциты во многом утрачивают свои функциональные возможности: они имеют в значительной степени обедненный углеводный пул, в
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
624
несколько раз снижается содержание в них АТФ. В результате этого происходит активное связывание кислорода, но нарушается процесс отсоединения кислорода в тканях (так называемое смещение кривой диссоциации оксигемоглобина влево). Создается иллюзия кислородтранспортного благополучия, когда смешанная венозная кровь имеет высокое насыщение кислородом. Однако нарушается процесс естественной десатура-ции и усиливается тканевая гипоксия.
Препараты кальция должны назначаться в обычной дозе; нужно помнить об их вазоконстрикторном действии. Применение изолированного препарата фибриногена мало эффективно, его можно назначать при невозможности введения плазмы. Викасол применяется в обычной терапевтической дозе, но необходимо учитывать, что эффект его, во-первых, зависит от функционального состояния печени, во-вторых, развивается не ранее чем спустя сутки.
При других видах кровотечения медикаментозная терапия остается такой же, могут меняться лишь принципы местного воздействия в зависимости от локализации процесса.
Важной является профилактика повторных желудочно-кишечных кровотечений (прием антацидов, блокаторов Н2-рецепторов).
Развитие острой почечной недостаточности при ФГ всегда делает прогноз крайне неблагоприятным, так как нарушается последняя эффективная система детоксикации организма. Чаще всего почечная недостаточность возникает в финальной фазе ФГ, ее появление свидетельствует о тяжелых дистрофических изменениях в паренхиматозных органах, в том числе и в почках. При истинно фульминант-ном течении ВГ ОПН может развиваться чрезвычайно быстро, почти одновременно с печеночной.
Появление даже олигурической фазы ОПН резко ограничивает возможности дезинтоксикационного лечения, коррекции электролитов и КОС. Объем парентерально вводимой жидкости ограничивается 500 мл растворов в сутки плюс дополнительное количество, соответствующее перспирационным, дренажным, диуретическим потерям. При этом следует учитывать, что в условиях повышенного катаболизма в организме продуцируется еще 400—500 мл воды.
Лечение олигурии повышенными дозами салуретиков не показано из-за гепатотоксичности последних и недостаточной эффективности. Применение других калийсберегающих диуретиков (леспе-нефрил, леспенефлан) возможно в случае отсутствия антагонистов альдостерона.
Возможно введение маннитола в дозе 25 г (25 % или 30 % раствор); через 1 — 1,5 ч после его введения диурез должен составлять около 50 мл/ч. При отсутствии эффекта вводят такую же дозу маннитола повторно, результат ожидается на протяжении 2 ч. Доза маннитола
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
625
не должна превышать 50—60 г, так как в организме он не метаболи-зируется. Аккумулируясь во внеклеточном пространстве, он накапливается, что приводит к повышению осмотического давления.
При тяжелых дистрофических изменениях в миокарде, при сердечной недостаточности введение маннитола противопоказано, так как он значительно повышает осмолярность и объем циркулирующей плазмы.
Можно применить инфузию малых доз дофамина — 1—5 мкг/кг в минуту в течение 12 ч, если предварительное лечение салуретиками и антагонистами альдостерона оказалось безрезультатным. Такие дозы дофамина не дают побочных реакций (рвота, тахикардия, аритмия), но увеличивают почечный кровоток.
При отсутствии эффекта от консервативного лечения возможно проведение гемофильтрации. Применение в этой ситуации гемодиализа малореально, так как для этого требуется значительная системная гепаринизация, что может спровоцировать тяжелое кровотечение. В последнее время для проведения гемодиализа стали использовать фраксипарин с последующей дезактивацией протамин сульфатом. Эффективнее применение гемофильтрации, даже при наличии признаков сердечной недостаточности, что позволяет увеличивать объемы дезинтоксикационной терапии, удалять избыток жидкости из организма. Показанием для проведения гемофильтрации является прогрессирующая гиперкалиемия при олигоанурии или анурии и отсутствии эффекта от консервативного лечения, а также признаки гипергидратации.
При гемофильтрации используют синтетические мембраны с высокой гидравлической проницаемостью. Не требуя сложного оборудования, она обеспечивает дифференцированный подход к лечению в зависимости от ведущего синдрома ОПН и обладает рядом преимуществ перед гемодиализом:
более эффективный и гибкий контроль за гидратацией, уровнем креатинина, электролитов в крови, среднемолекулярных токсинов;
лучшая переносимость удаления избытка натрия и воды;
меньшая нагрузка на сердце (за счет нормализации сердечного выброса и снижения венозного возврата);
более высокая биосовместимость (за счет минимального контакта крови больного с диализной мембраной);
хорошие условия для внутривенной инфузии лекарственных растворов;
отсутствуют осложнения, связанные с качеством диализирую-щей жидкости.
Следует помнить, что уровень мочевины не является критерием оценки состояния функции почек.
40 — 2-3077
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
626
Гемофильтрация может проводиться с артериовенозным или вено-венозным доступом. Последний обязателен при критической гипергидратации и нестабильной гемодинамике (гипотензия, падение сердечного выброса), да и технически он проще и доступнее. Получаемый при этом ультрафильтрат содержит, кроме воды, мочевину, электролиты, среднемолекулярные вещества (токсины, медиаторы воспаления, цитокины, гормоны). Ультрафильтрат частично или полностью замещают растворами Рингера, «Дисоль», которые лучше вводить параллельно в венозное русло. При этом концентрация мочевины в ультрафильтрате равна концентрации в сыворотке крови. Объем ультрафильтрата может достигать 30 л и больше, однако в большинстве случаев он значительно меньше и зависит от уровня гипергидратации организма. Это достаточно дорогая процедура, требующая большого количества стерильных растворов.
Однако и гемофильтрация не в состоянии заменить нормальный диурез. Реальной положительной динамики можно ожидать лишь в случае улучшения функционального состояния печени, что существенно уменьшит токсическое воздействие на почечную паренхиму. Тогда возможен переход олигоанурической стадии ОПН в полиури-ческую, которая лучше поддается коррекции.
В случае положительного эффекта от проводимой терапии, особенно салуретиками, даже в сочетании с антагонистами альдосте-рона, необходимы тщательный контроль и коррекция электролитов не только в плазме крови, но и в эритроцитах (внутриклеточно), так как гипокалиемия и возникающий вследствие этого метаболический алкалоз способствуют проникновению внутрь клетки (в том числе и нервной) аммиака, усилению токсического поражения ЦНС.
Стабилизация процесса, которая проявляется прекращением дальнейшего прогрессирования ФГ, позволяет несколько сократить базисное лечение (прежде всего за счет сокращения лекарственной терапии осложнений) и расширить патогенетическую и симптоматическую терапию.
Другие методы лечения. Некоторые методы лечения и препараты, которые традиционно применяются при лечении ФГ, имеют либо историческое значение, либо малоэффективны, либо, будучи достаточно эффективными симптоматическими средствами, не влияют существенно на механизм развития патологического процесса и исход заболевания.
Историческое значение в лечении ФГ имеют заменные переливания крови (наиболее эффективным было заменное переливание свежей гепаринизированной крови), перфузия гетеропечени (свиной), неэффективным — использование липоевой кислоты, липамида, ко-карбоксилазы, АТФ, рибоксина, эссенциале, малоэффективным бы-
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
627
ло применение цитохрома С, малоэффективным и с большим количеством побочных реакций и осложнений — гемосорбции.
Введение рекомбинантного сс-интерферона неэффективно или даже может привести к ухудшению.
Достаточно эффективным оказалось использование искусственной печени в лечении энцефалопатии, отека мозга, коагулопатий. При этом плазму крови или кровь пропускают через сеть тонких, проницаемых капиллярных трубок (но непроницаемых для иммуноглобулинов), помещенных в камеру, содержащую культуру гепа-тоцитов человека или животных. Однако пока неясно, можно ли при ее помощи добиться восстановления собственной печени или она останется паллиативным методом, позволяющим выиграть время для трансплантации печени. Скорее всего, — последнее. Что касается трансплантации гепатоцитов, то эта проблема пока еще нерешаема.
Трансплантация печени считается наиболее перспективным методом лечения ФПН на современном этапе развития гепатологии. Вместе с тем, ее проводят в основном при хронических заболеваниях печени. Необходимо более четко определить критерии пересадки печени в случае развития ФГ. Ведь исходы консервативного лечения ФГ существенно разнятся в зависимости от скорости прогресси-рования и этапа, с которого начато полноценное лечение. Истинно фульминантное течение, при котором пересадка печени на самом деле является успешной альтернативой, далеко не всегда позволяет своевременно и успешно подготовить пациента к серьезному оперативному вмешательству и произвести пересадку печени, так как совместимую донорскую печень удается получить в лучшем случае лишь через 2 сут. Часть больных умирают в ожидании трансплантации, послеоперационная летальность при ФПН колеблется в чрезвычайно широких пределах — от 10 до 60 %, что свидетельствует об отсутствии единых подходов к трансплантации, разной степени тяжести больных. Минимальная смертность у пациентов, оперированных по поводу хронических заболеваний печени в плановом порядке, максимальная — при ФПН (от 50 до 90 %). Остаются чрезвычайно высокими частота и количество послеоперационных осложнений, 20—25 % пациентов требуется ретрансплантация печени, у 38 % в период с 4-го по 6-й месяц после операции развиваются компрессионные переломы позвонков вследствие так называемой печеночной остеодистрофии. По мнению многих специалистов, трансплантация печени — сложнейший метод лечения, который не начинается с операции и не заканчивается ею. Все это существенно сказывается на качестве жизни. Да и стоимость оперативного лечения и дальнейшего выхаживания пациентов, иммуносупрессивного лечения также высока. Далеко не всем трансплантация показана и возможно ее выполнение. Даже при более благоприятных вариантах течения ФГ,
40*
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
628
пре- и послеоперационная летальность, осложнения в посттрансплантационный период и 5-летняя выживаемость пациентов не позволяют пересадке печени быть полностью альтернативным методом лечения ФПН при острых В Г на данном этапе развития гепатологии. Это требует дальнейшего совершенствования консервативного лечения, разработки более четких критериев трансплантации, совершенствования системы преемственности консервативного и оперативного лечения.
Некоторые особенности лечения лиц пожилого и старческого возраста с ФГ. У лиц пожилого и старческого возраста в 1,5—2,5 раза повышается риск развития лекарственной болезни по сравнению с 30—40-летними. Уменьшение альбуминов в плазме крови, с которыми связываются лекарственные вещества, повышает концентрацию несвязанного препарата, свободного для диффузии в ткани организма. Это приводит к тому, что организм пожилых людей значительно более восприимчив к эффектам лекарственной терапии, к развитию кумуляции и лекарственной интоксикации, особенно при использовании нескольких препаратов. В связи со снижением массы и емкости паренхиматозных органов, а также соотношения мышцы—жир— вода дозу лекарств нельзя рассчитывать на основании общей массы тела больного. У тучных увеличивается депо лекарственных веществ в жировой ткани, что способствует их кумулятивному и токсическому действию даже при относительной передозировке препарата. В связи с ухудшением почечного кровотока даже малые дозы адреналина будут уменьшать эффективный почечный плазмоток на 50—60 %. Поэтому при назначении препаратов, которые выделяются почками в неизмененном виде или в виде активных метаболитов (большие дозы пенициллинов, цефалоспоринов, аминогликозиды, дигоксин), необходимо оценить доступными способом функциональную способность почек.
Имеются определенные особенности проведения плазмафереза у таких пациентов. Производится эксфузия не более 25 % ОЦП, замещение проводится комбинированное или белковыми препаратами.
Очень важным моментом, определяющим необходимость строгой индивидуальной тактики в лечении таких больных, является изменение метаболизма ряда препаратов, чувствительности к ним тканей, процессов выведения их из организма, взаимоотношений медикаментов в организме и т.д. Это в значительной степени объясняет происхождение неадекватных реакций на лекарственные препараты у людей пожилого возраста. Вот почему у таких пациентов увеличение дозы вводимого препарата не всегда дает положительный эффект и относительно легко вызывает противоположные по характеру реакции (сердечные гликозиды, нитроглицерин, симпатомиме-тики и др.).
ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. ФУЛЬМИНАНТНЫЙ ГЕПАТИТ
62д
Крайне осторожно необходимо назначать препараты со схожим эффектом действия. При применении двух препаратов одновременно, вещество, обладающее большим сродством к белкам, вытесняет из связи с ним часть другого вещества и делает ее биологически активной. Поэтому назначение даже обычных доз препарата может привести к передозировке, токсическому воздействию. Эта опасность значительно увеличивается при использовании нескольких препаратов, в такой ситуации часто возникают неожиданные, нередко нежелательные и опасные реакции.
Снижение функциональной активности гепатоцитов вследствие возрастной инволюции и патологического процесса дополнительно приводит к существенному изменению печеночного метаболизма. Результат взаимодействия между лекарственными веществами-индукторами может существенно отличаться и оказаться весьма неожиданным, даже при применении препаратов в меньших дозах.
Существенно уменьшается диапазон функциональной активности почек в условиях выраженной интоксикации, в том числе и медикаментозной. Могут возникать нежелательные реакции вследствие взаимодействия метаболитов и лекарственных веществ на этапе замедленной почечной экскреции у пожилых пациентов. При этом могут удлиняться время действия препарата на организм и возникать лекарственная интоксикация, которая, даже незначительно выраженная, дает нежелательные реакции.
Для старческого возраста характерно латентное, малосимптом-ное, затяжное течение реакций взаимодействия лекарственных веществ, которые оказывали неблагоприятное влияние на общее состояние больных.
Все это необходимо помнить при лечении ФГ у пациентов пожилого возраста. Полипрагмазия у таких больных еще более катастрофична, чем у больных молодого и среднего возраста.
Профилактика. Своевременное выявление и наблюдение за тяжелыми больными с ОВГ, учет факторов риска и применение более рациональной терапевтической тактики. Выявление факторов, которые бы достоверно прогнозировали дальнейшее течение ВГ. Эффективным является широкое использование вакцинации против ВГВ, ВГА лиц из групп риска по развитию ФПН.
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
630
Острая надпочечниковая недостаточность
Острая надпочечниковая недостаточность — патологический процесс, формирующийся в результате выраженного, внезапно наступившего несоответствия уровня гормонов коры надпочечников их потребностям в организме и проявляющийся значительным срывом гемодинамики, сдвигами водно-электролитного баланса и глубоким нарушением тканевой перфузии.
Синонимы: острая гипофункция коры надпочечников, острая депрессия коры надпочечников.
Лат. — insufficieceae glandulae suprarenales acutae.
Англ. — acute over kidney glandules failure.
Необходимо заметить, что подобные вышеназванному изменения в организме могут резко развиться в результате декомпенсации по различным причинам уже существовавшей хронической надпочеч-никовой недостаточности. По своим проявлениям и последствиям такой патологический процесс может быть сравним с острой недостаточностью надпочечников и будет наряду с ней рассмотрен ниже.
Работы Т. Addison положили начало изучению проблемы над-почечниковой недостаточности. В 1849 г. автор описал первичную хроническую недостаточность надпочечников (болезнь Аддисона) и обострение ее в виде адреналового криза. В начале XX в. исследования R. Waterhouse и С. Friderichsen случаев молниеносной формы менингококцемии позволили установить причину такого катастрофического течения этой формы менингококковой инфекции — инфаркт надпочечников в результате кровоизлияния в них. Таким образом, в XX в. был описан новый вариант течения острой надпочечниковой недостаточности, получивший название «синдром Уотерхауса—Фридериксена». Дальнейшие наблюдения позволили установить, что подобное повреждение надпочечников возможно не только при менингококцемии, но и при некоторых других инфекционных болезнях, протекающих с выраженным геморрагическим синдромом и кровоизлияниями в ткань внутренних органов, в том числе надпочечники (сыпной тиф, дифтерия и др.).
Острая надпочечниковая недостаточность в структуре заболеваний, подлежащих лечению в реанимационных отделениях, колеблется в пределах 0,3—4,2 %. Однако при отдельных нозологических формах в качестве осложнения вероятность развития синдрома Уотерхауса—Фридериксена разная: при менингококцемии — в 10—
ОСТРАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ 631
20 % случаев, при эпидемическом сыпном тифе —в 3—6 %, при сепсисе — в 2,5—4,7 %.
Причины развития надпочечниковой недостаточности могут быть самые различные (инфекции, стрессы, токсические факторы, опухоли и т. д.), а протекать нарушения функции этого органа могут как острый или хронический процесс.
Возникновение острой надпочечниковой недостаточности возможно и из-за кровоизлияний в кору надпочечников различной степени обширности при ДВС-синдроме, развившемся на фоне не только инфекционных болезней, а и, например, при патологическом течении беременности (токсикозы, отслойка плаценты), проведении длительной антикоагулянтной терапии (инфаркт миокарда, тромбофлебит глубоких вен голени, операции на сердце).
Классическим вариантом хронической недостаточности функции надпочечников является аддисонова болезнь — первичное поражение надпочечников в результате идиопатического аутоиммунного процесса, туберкулеза, грибковых поражений, сифилиса, амилои-доза, саркоидоза, двусторонних опухолевых метастазов. Скорость прогрессирования такого процесса и степень его выраженности разные.
Иногда течение аддисоновой болезни настолько сглажено, что длительное время поражение бывает нераспознанным и впервые выявляется только в случае развития острой недостаточности надпочечников — адреналового (аддисонова) криза. Спровоцировать такую декомпенсацию аддисоновой болезни нередко могут хирургическое вмешательство, сепсис, различные тяжелые инфекционные болезни, в связи с чем именно инфекционисту приходится встречаться с подобными случаями. Иногда хроническая надпочечнико-вая недостаточность может быть вторичной в результате дефицита адренокортикотропного гормона (АКТГ) в организме, как это бывает при пангипопитуитаризме. В данном случае также возможно развитие кризов.
Необходимость продолжительной терапии глюкокортикостерои-дами (ГКС) возникает при системных заболеваниях соединительной ткани, выраженных аллергозах, гормонозависимой форме бронхиальной астмы, пузырчатке. Даже такое небольшое количество пред-низолона, как 10 мг в день в течение 3 нед, уже может вызвать депрессию надпочечников длительностью до 1 года. Долговременный же прием ГКС в дальнейшем приводит к аплазии надпочечниковых желез с формированием вторичной хронической надпочечниковой недостаточности, проявления которой купируются лишь постоянным приемом ГКС. Стресс может усилить скрытую надпочечнико-вую недостаточность у этой категории пациентов. А отмена ГКС, которую иногда осуществляет сам больной по различным причинам
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
632
(плохое самочувствие, косметические изменения, вызванные этими препаратами, неправильная оценка результатов лечения, боязнь развития осложнений при присоединении интеркуррентных болезней, в том числе и инфекционного характера), или быстрая замена одного ГКС другим может закончиться развитием острой фатальной надпочечниковой недостаточности.
В результате еще не выясненных до конца причин у некоторых людей вырабатывается малое количество гормонов корой надпочечников, хотя в самом органе не выявляют органических изменений. У подобных индивидуумов при стрессе, в том числе развившемся на фоне инфекционного процесса, усиливается расходование ГКС, а при продолжении действия инициирующей причины может довольно быстро наступить истощение резерва коры надпочечников, что сопровождается появлением их недостаточности. Подобное состояние может развиться у этой категории людей в разгар самых различных инфекций — гриппа, пневмонии, сальмонеллезов, малярии и некоторых других.
Однако при таком варианте недостаточности надпочечников после прекращения влияния стресс-факторов запас гормонов восстанавливается сравнительно быстро без признаков хронической надпочечниковой недостаточности в дальнейшем.
Но существуют инфекционные заболевания, при которых возникает реальная опасность развития более серьезного варианта недостаточности надпочечников — синдрома Уотерхауса—Фридерик-сена.
В основе его лежит геморрагическая деструкция ткани железы из-за внутрикапсулярного кровоизлияния в надпочечники обычно в сочетании с тромбозом надпочечниковых вен. Возникновение такой, нередко молниеносно развивающейся надпочечниковой недостаточности возможно при менингококцемии, эпидемическом сыпном тифе, дифтерии, тяжелых формах сальмонеллезов, чуме, сепсисе различной этиологии и некоторых других инфекционных заболеваниях. И хотя в генезе этого синдрома кроме нарушений, связанных с глобальным дефицитом гормонов надпочечников, играют большую роль и другие факторы (запуск ДВС-синдрома, ИТШ, действие различных токсических веществ, в том числе присущих возбудителю), именно надпочечниковой недостаточности придают наибольшее значение в формировании подобного осложнения.
. Одной из причин развития острой надпочечниковой недостаточности может быть двусторонняя резекция надпочечников или даже односторонняя в случае опухоли (функция оставшегося надпочечника угнетается опухолевой гиперсекрецией).
Встречаемость отдельных причин развития острой надпочечниковой недостаточности в практике инфекциониста неодинакова — ча-
ОСТРАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ 633
ще всего возникают синдром Уотерхауса—Фридериксена, стрессовая недостаточность при различных инфекционных болезнях у лиц с малым функциональным резервом коры надпочечников, адренало-вый криз и синдром отмены длительной кортикостероидной терапии у больных с атрофией надпочечников.
Острую надпочечниковую недостаточность часто относят к шо-кам, выделяя особую его форму— шок вследствие эндокринной недостаточности (см. главу «Шоки»), Те острейшие нарушения, которые характеризуют это состояние, сравнимы с развивающимися при других видах шоков патологическими процессами и клиническими проявлениями.
Классификация. Общепринятой систематизации острой надпо-чечниковой недостаточности не существует. Нередко выделяют:
первичную острую надпочечниковую недостаточность (сюда относят синдром Уотерхауса—Фридериксена, надпочечниковую недостаточность, возникающую на почве кровоизлияний, в результате хирургического удаления надпочечников, стрессовую недостаточность у лиц с ограниченным функциональным резервом коры надпочечников);
острую декомпенсацию хронической надпочечниковой недостаточности (адреналовый криз при аддисоновой болезни и синдром отмены длительной терапии ГКС).
Наиболее подходящей для целей практического здравоохранения считается классификация G. Williams, R. Dluhy (1987), согласно которой выделяют острую надпочечниковую недостаточность по типу:
синдрома Уотерхауса—Фридериксена;
кровоизлияний в надпочечники различного происхождения, но не связанных с бактериемией или септицемией;
адреналового криза;
синдрома отмены длительной кортикостероидной терапии.
В данную классификацию не включена как отдельная форма острая надпочечниковая недостаточность, развивающаяся в ответ на стресс у лиц с ограниченным функциональным резервом коры надпочечников из-за кратковременности и в целом доброкачественности течения подобных случаев.
Примерная формулировка диагноза. Поскольку острая надпочечниковая недостаточность обычно осложняет течение основного заболевания, то в диагнозе на первом месте указывают нозологическую форму:
Менингококцемия, молниеносная форма, синдром Уотерхауса— Фридериксена.
Грипп, тяжелое течение, аддисонова болезнь, адреналовый криз.
Патогенез. Основными гормонами коры надпочечников являются
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
634
кортизол (гидрокортизон), относящийся к ГКС, минералокортикоиды (кортикостерон и альдостерон) и андрогены. У взрослых за сутки секретируется примерно 20 мг кортизола, 2 мг кортикостерона и 0,2 мг альдостерона. Кора надпочечников в норме также продуцирует большое количество андрогенов, однако свои физиологические эффекты они оказывают лишь после превращения в тестостерон и его производные. Поскольку в результате острой надпочечниковой недостаточности быстро возникают нарушения со стороны жизненно важных органов, то чаще всего в этой ситуации срывы андро-генной гормональной составляющей просто не успевают развиться. Несомненно, что в случае развития ее на фоне хронической гипофункции надпочечников обнаруживаются те или иные отклонения в обмене андрогенов. Иногда именно факт нарушений андрогенного обмена помогает заподозрить существовавшую ранее хроническую надпочечниковую недостаточность.
Большое значение для поддержания естественной жизнедеятельности организма имеют глюкокортикостероиды. Деление стероидов, вырабатываемых надпочечниками, на ГКС и минералокортикоиды достаточно произвольно, поскольку большинство естественных ГКС обладает некоторыми свойствами минералокортикоидов и наоборот. Описательный термин «глюкокортикостероиды» применяют к тем стероидам надпочечников, которые преимущественно влияют на межуточный обмен. Их физиологическое действие на него включает регуляцию метаболизма белков, углеводов, липидов и нуклеиновых кислот. Под действием ГКС:
осуществляется метаболизация белков, которая носит в основном катаболитическую направленность и характеризуется ускоренным распадом белков и повышением экскреции азота;
увеличивается содержание гликогена в печени и осуществляется печеночный синтез глюкозы;
индуцируется гипераминоацидемия, вызывающая стимуляцию секреции глюкагона, что также способствует образованию глюкозы;
в клетках большинства тканей угнетается образование нуклеиновых кислот, но в печени синтез РНК возрастает;
регулируется мобилизация жирных кислот, повышается активирующее действие жиромобилизующих гормонов, особенно ка-техоламинов и гипофизарных пептидов, на клеточную липазу;
осуществляется защита организма от стресса, реализуются противовоспалительные свойства, которые связаны с сохранением реактивности сосудов на уровне микроциркуляторного русла по отношению к содержащимся в крови вазоконстрик-тивным факторам; таким образом, реализуется противодействие повышению проницаемости капилляров при воспалении;
ОСТРАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ 635
угнетается продукция интерлейкина-2 макрофагами, укрепляются мембраны клеток, что тоже является составляющими их противовоспалительного механизма действия ГКС;
поддерживается нормальный объем внеклеточной воды и тормозится ее поступление в клетку за счет частичного воздействия на механизмы распределения и экскреции воды в организме;
осуществляется часть процесса регуляции реабсорбции натрия в почечных канальцах и выведения калия с мочой вследствие слабых минералокортикоидных свойств, присущих в первую очередь кортизолу;
в крови увеличивается количество полиморфноядерных лейкоцитов, уменьшается содержание эозинофилов, массы лимфо-идной ткани.
Необходимо заметить, что в случае острого первичного снижения выработки ГКС корой надпочечников хотя и возникают нарушения всех этих функций, свойственные дефициту ГКС, но их клиническое значение и последствия разные. На первый план выступают именно те влияния, вызывающие быстрое развитие каскада катастрофических процессов в организме, в результате бурного прогрессирования которых более опосредованные последствия дефицита ГКС могут и не успеть проявиться. В случае же развития острого дефицита ГКС на фоне хронической депрессии надпочечников (аддисонов криз, резкая отмена ГКС при хронической патологии) налицо будут все признаки последствий такого процесса.
Минералокортикоиды, среди которых основное значение имеет альдостерон, выполняют в организме функцию главных регуляторов объема внеклеточной жидкости и обмена калия. Объем жидкости регулируется за счет прямого действия на транспорт натрия в почечных канальцах. Минералокортикоиды влияют преимущественно на дистальные извитые канальцы, вызывая снижение экскреции натрия и увеличивая выведение калия. В результате этого ионы натрия и вслед за ними вода переносятся из эпителия канальцев в капиллярную кровь почек. Альдостерон и другие минералокортикоиды также действуют на эпителий протоков слюнных, потовых желез и желез пищеварительного тракта, всюду вызывая реабсорбцию натрия, воды и экскрецию калия.
На фоне перечисленных выше причин надпочечники значительно уменьшают секрецию ГКС, альдостерона и других минералокорти-коидов. Возникает несоответствие уровня гормонов надпочечников их фактической потребности, что приводит к развитию ряда патологических процессов. Конечно, не все звенья патологического каскада в патогенезе острой надпочечниковой недостаточности изучены до конца, не все процессы полностью прояснены.
Вследствие снижения секреции ГКС в первую очередь умень-
КРИТИЧЕСКИЕ СОСТОЯНИЯ В КЛИНИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 636
шается вазоконстрикторное действие катехоламинов, для которых кортикостероиды являются активирующим фактором. Снижение АД и уменьшение венозного возврата к сердцу в итоге стимулирует секрецию альдостерона, но в данной ситуации это становится невозможным, так как отсутствует субстрат воздействия. Такое недостаточное образование альдостерона приводит к повышенному выведению из организма натрия, хлора и воды с мочой в результате невозможности концентрировать ее, а также с потом и слюной, что в итоге обусловливает быстрое развитие тяжелой гипертонической дегидратации (см. «Дегидратационный шок») с прогрессирующим уменьшением ОЦК, появление сердечной недостаточности. Вследствие этого еще больше нарастает уже запущенная дефицитом ГКС гипо-тензия. Она значительно усугубляет каскад патологических реакций, приводит к выраженному нарушению тканевой перфузии и недостаточности клеток (см. «Дегидратационный шок» — Патогенез). Особенностью развития острой надпочечниковой недостаточности является быстрое формирование ОПН, азотемии.
Одновременно снижается выделение калия с мочой, возрастает его концентрация в крови, вызывающая появление нарушений сердечной проводимости, усиливающей сердечную недостаточность. Формируется внутриклеточная дегидратация, связанная с нарушением функционирования натрий-калиевого насоса. Развивающийся выраженный дисбаланс основных электролитов приводит к появлению нарушений нервно-мышечной передачи, лежащих в основе характерной для острой надпочечниковой недостаточности тотальной миастении.
В результате исчезновения стимулирующего действия ГКС истощается депо гликогена, снижается скорость гликогенолиза в печени, замедляется образование глюкозы из аминокислот, что приводит к острой гипогликемии. Вместе с этим в формировании гипогликемии большую роль отводят обусловленному дефицитом ГКС повышению чувствительности к инсулину.
Вследствие дефицита ГКС увеличивается проницаемость капилляров, что проявляется развитием кровоизлияний различной степени выраженности.
С наибольшей степенью развертывания подобные нарушения выявляются при синдроме Уотерхауса—Фридериксена. Примерная схема патогенеза острой надпочечниковой недостаточности в этой ситуации приведена на рис. 35.
Степень повреждения коры надпочечников патологическим процессом обусловливает быстроту развертывания проявлений надпочечниковой недостаточности и ее выраженность. Даже при сохранении целости не более 10% ее клеток возможен благоприятный
ОСТРАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ
637
Менингококковая инфекция, сыпной тиф, чума, дифтерия, сепсис (действие факторов агрессии возбудителя, запуск ДВС-синдрома)
Кровоизлияние в надпочечники, тромбоз надпочечниковых вен
I секреции ГКС
секреции минералокортикоидов
