
- •140101.65 – Тепловые электрические станции
- •140104.65 – Промышленная теплоэнергетика
- •140100.65 – Теплоэнергетика
- •1. Информация о дисциплине «техническая термодинамика»
- •1.1. Предисловие
- •1.2. Содержание дисциплины и виды учебной работы
- •1.2.1. Содержание дисциплины по гос
- •1.2.2. Объем дисциплины и виды учебной работы
- •1.2.3. Перечень видов практических занятий
- •Раздел 1. Основные законы
- •1.2. Первый закон термодинамики
- •1.3. Второй закон термодинамики
- •Раздел 2. Реальные газы. Водяной пар (40 часов)
- •2.1.Свойства и фазовые переходы
- •Реальных газов
- •2.2. Характеристики и процессы водяного пара
- •2.3. Влажный воздух
- •2.4. Термодинамика газового потока. Истечение газов через сопло
- •Раздел 3.Компрессоры.
- •3.2. Циклы двигателей внутреннего сгорания (двс)
- •3.3. Циклы газотурбинных установок (гту)
- •Раздел 4. Циклы паротурбиннных
- •4.2. Циклы пту с промежуточным перегревом и регенеративным отбором пара
- •4.3. Циклы парогазовой и атомной установок
- •Раздел 5. Циклы холодильных и теплонасосных
- •Раздел 6. Элементы химической термодинамики
- •6.2. Уравнение максимальной работы химической рекции
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины
- •2.2.2. Тематический план дисциплины для студентов заочной формы обучения
- •Техническая термодинамика
- •Раздел 1.
- •Основные законы термодинамики
- •Раздел 2.
- •Реальные
- •Водяной пар
- •Раздел 3.
- •Компрессоры.
- •Циклы тепловых двигателей
- •Раздел 4.
- •Циклы паротурбинных установок
- •Раздел 5.
- •Циклы холодильных и теплонасосных установок
- •Раздел 6.
- •Элементы химической термодинамики
- •2.4. Временной график изучения дисциплины
- •2.5. Практический блок
- •2.5.1. Практические занятия
- •2.5.1.1. Практические занятия (очно – заочная форма обучения)
- •2.5.1.2. Практические занятия (заочная форма обучения)
- •2.5.2. Лабораторный практикум
- •2.5.2.1. Лабораторные работы (очно – заочная форма обучения)
- •2.5.2.2. Лабораторные работы (заочная форма обучения)
- •2.6. Рейтинговая система по дисциплине «Техническая термодинамика»
- •3.Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект лекций по дисциплине «техническая термодинамика» Введение
- •Раздел 1. Основные законы термодинамики
- •1.1. Термодинамика идеального газа
- •Основные понятия и определения термодинамики.
- •1.1.1. Законы идеального газа
- •1.1.2. Уравнение состояния
- •Теплоемкость
- •Последнюю формулу еще можно представить в виде
- •Смеси идеальных газов
- •Вопросы для самопроверки
- •1.2. Первый закон термодинамики
- •Обратимые равновесные процессы в идеальных газах
- •Разделив уравнение (б) на уравнение (а), найдем
- •Изопараметрические процессы
- •IV. Адиабатный процесс
- •V. Политропные процессы
- •Вопросы для самопроверки
- •1.3. Второй закон термодинамики
- •1.3.1. Круговые процессы
- •1.3.2. Прямой цикл Карно
- •1.3.3. Обратный цикл Карно
- •1.3.4. Второй закон термодинамики
- •1.3.5. Эксергетический метод исследования
- •1.3.6. Эксергия неподвижного рабочего тела
- •1.3.7. Эксергия потока рабочего тела
- •1.3.8. Эксергия потока теплоты
- •Вопросы для самопроверки
- •Раздел 2. Реальные газы. Водяной пар
- •2.1. Свойства и фазовые переходы реальных газов
- •2.1.1. Реальные газы и их свойства
- •Критические параметры некоторых веществ
- •2.1.2. Условия равновесия при фазовом переходе
- •2.1.3. Термические и калорические свойства реальных газов
- •Вопросы для самопроверки
- •2.2. Характеристики и процессы водяного пара
- •2.2.1. Водяной пар и основные процессы водяного пара
- •Испарение - процесс образования пара, происходящий с поверхности жидкости при любой температуре.
- •2.2.2. Изопараметрические процессы изменения состояния водяного пара в pv -, Ts - и hs - диаграммах
- •Вопросы для самопроверки
- •2.3. Влажный воздух
- •2.3.1. Свойства влажного воздуха
- •2.3.2. Теплоёмкость и энтальпия влажного воздуха
- •Вопросы для самопроверки
- •2.4. Термодинамика газового потока. Истечение газов через сопло
- •2.4.1. Термодинамика газового потока
- •Замена переменных приводит уравнение к виду
- •2.4.2. Термодинамика потока в каналах переменного сечения
- •2.4.3. Истечение газов через сужающиеся сопла (конфузоры)
- •Вопросы для самопроверки
- •2.4.4. Истечение газа с учетом трения
- •2.4.5. Истечение водяного пара
- •2.5. Расчет процессов дросселирования
- •2.5.1. Уравнение процесса дросселирования
- •Вопросы для самопроверки
- •Раздел 3. Компрессоры. Циклы тепловых двигателей
- •3.1. Виды компрессоров и процессы в компрессоре
- •3.1.1. Назначение и типы компрессоров
- •3.1.2. Многоступенчатое сжатие
- •3.1.3. Мощность привода идеального компрессора и коэффициенты полезного действия (кпд)
- •Вопросы для самопроверки
- •3.2. Циклы двигателей внутреннего сгорания (двс)
- •3.2.1. Циклы поршневых двигателей внутреннего сгорания (двс)
- •Цикл Oтто
- •Цикл Дизеля
- •Цикл Тринклера
- •3.3. Циклы газотурбинных установок (гту)
- •3.3.1. Принципиальная схема и цикл гту с изобарным подводом теплоты
- •3.3.3. Регенерация теплоты в цикле гту. Многоступенчатое сжатие в компрессоре и ступенчатый подвод теплоты
- •Вопросы для самопроверки
- •3.4. Циклы реактивных двигателей
- •И турбореактивного двигателей
- •Вопросы для самопроверки
- •Раздел 4. Циклы паротурбинных установок (пту)
- •4.1. Идеальный и действительный циклы пту
- •4.1.1. Идеальный цикл Ренкина
- •4.1.2. Цикл Ренкина на сухом насыщенном и перегретом паре
- •Следовательно, полезная работа цикла Ренкина равна
- •Термический кпд цикла Ренкина
- •Введем понятие относительного эффективного кпд
- •Далее введем относительный электрический кпд
- •Тогда расход пара на турбину можно выразить в виде
- •Тогда кпд всей пту определится произведением
- •Вопросы для самопроверки
- •4.2. Циклы пту с промежуточным перегревом и регенеративным отбором пара
- •Выражение для термического кпд основного (без промежуточного перегрева) цикла Ренкина:
- •Регенеративный цикл паротурбинных установок
- •Вопросы для самопроверки
- •4.3. Циклы парогазовой и атомной установок
- •4.3.1. Циклы парогазовых установок
- •4.3.2. Схема и цикл атомной теплоэнергетической установки
- •Вопросы для самопроверки
- •4.4. Циклы и устройства прямого преобразования теплоты в электроэнергию
- •4.4.1. Циклы установок с магнитогидродинамическим генератором (мгд-генератор)
- •4.4.2. Термодинамические и термоэлектронные преобразователи
- •Вопросы для самопроверки
- •Раздел 5. Циклы холодильных и теплонасосных установок
- •5.1. Циклы воздушной и парокомпрессорной холодильных установок
- •5.1.1. Циклы холодильных установок
- •5.1.2. Цикл воздушной холодильной установки
- •5.1.3. Цикл парокомпрессионной холодильной установки
- •5.1.4. Абсорбционная холодильная установка
- •Вопросы для самопроверки
- •5.2. Передача теплоты тепловым насосом и тепловой трубой
- •5.2.1. Тепловой насос
- •5.2.2. Передача теплоты тепловыми трубами
- •Вопросы для самопроверки
- •Раздел 6. Элементы химической термодинамики
- •6.1. Законы термодинамики в термохимии
- •6.1.1. Основные понятия химической термодинамики
- •6.1.2. Тепловой эффект химической реакции
- •6.1.3. Зависимость теплоты реакции от температуры
- •6.1.4. Химическое равновесие
- •Основные определения
- •Константа химического равновесия
- •Химические константы I и условные химические константы j
- •6.1.5. Диссоциация
- •Вопросы для самопроверки
- •6.2. Уравнение максимальной работы химической реакции
- •6.2.1. Химическое сродство. Мера химического сродства
- •Вопросы для самопроверки
- •Глоссарий (словарь терминов)
- •Охрана труда и техника безопасности при проведении лабораторных работ
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольные работы
- •Контрольная работа 1
- •Контрольная работа 2
- •Контрольная работа 3
- •4.2. Методические указания к выполнению контрольных заданий и практических работ
- •Искомая мощность привода компрессора
- •4.3. Тренировочные и контрольные тесты
- •Вопрос 1. Выберите определение понятия «прямой цикл».
- •Вопрос 2. Как зависит холодильный коэффициент идеальной воздушной холодильной установки от степени повышения давления в компрессоре р2/р1?
- •Вопрос 4. Выберите наиболее полное определение понятия «идеальный газ».
- •4.4. Итоговый контроль. Вопросы для подготовки к экзамену
- •Приложение п.1. Теплофизические свойства сухого воздуха при нормальном атмосферном давлении
- •П.3. Средняя массовая теплоемкость газов при постоянном давлении, [4]
- •П.4. Средняя объемная теплоемкость газов при постоянном давлении,
- •П.5. Относительные молекулярные массы, плотности и объемы киломолей при нормальных условиях, критические температуры и критические давления некоторых газов
- •П.6. Энтальпия 1 м3 газов и влажного воздуха (кДж/м3)
- •П.7. Диаграмма h-s водяного пара
- •П.8. Насыщенный водяной пар (по давлениям)
6.2. Уравнение максимальной работы химической реакции
Химический потенциал. Уравнение максимальной работы химической реакции (уравнение Гиббса –Гельмгольца). Химическое сродство. Константа равновесия и максимальная работа реакции. Зависимость константы равновесия от давления и температуры. Тепловая температура Нернста. Стандартные значения термодинамических функций веществ.
По теме не предусмотрены практические занятия, лабораторные и контрольные работы.
После изучения теоретического материалы следует ответить на вопросы для самопроверки по этой теме. Ответы можно найти в учебниках [1,3].
6.2.1. Химическое сродство. Мера химического сродства
Причиной реакции является химическое сродство реагирующих веществ, т.е. сила их стремления к соединению.
За
меру химического сродства принимается
максимальная работа реакции, величина
которой для реакции
![]() может быть определена по следующим
уравнениям:
может быть определена по следующим
уравнениям:
При v, Т = const

 .
(6.16)
.
(6.16)
При р, Т = const

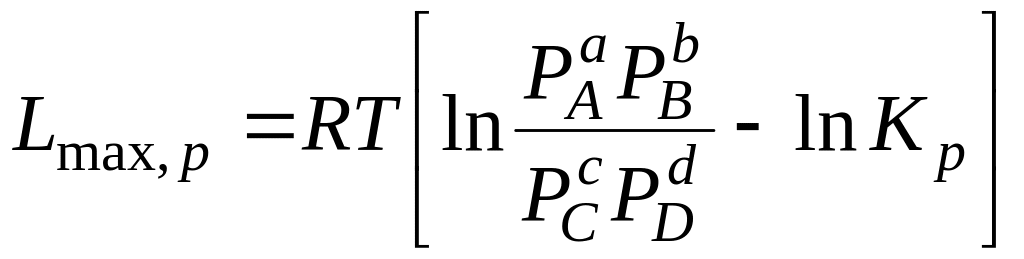 ,
(6.17)
,
(6.17)
где С –начальные концентрации; Р –начальные парциальные давления соответствующих газов.
Эти
уравнения позволяют решить вопросы о
возможности осуществления реакции при
заданных условиях и о направлении
реакции. Для этого следует сравнить
значение
 ,
вычисленное по заданным начальным
концентрациям веществ, со значением
константы равновесия Кс,
взятым из таблиц для рассматриваемой
реакции при заданных условиях.
,
вычисленное по заданным начальным
концентрациям веществ, со значением
константы равновесия Кс,
взятым из таблиц для рассматриваемой
реакции при заданных условиях.
Если >Kc, т.е. Lmax > 0, то при заданных условиях возможна прямая реакция превращения веществ А и В, в вещества С и D.
Если <Kc, т.е. Lmax < 0, то при заданных условиях невозможна прямая реакция соединения веществ А и В, а возможна только обратная реакция –распада веществ С и D на вещества А и В. Если Lmax = 0, то это означает, что при заданных условиях невозможны ни прямая, ни обратная реакции, так как при этих условиях система находится в химическом равновесии.
Ввиду того, что максимальная работа одной и той же реакции при одной и той же температуре есть величина переменная, зависящая от начальных концентраций веществ, для оценки химического сродства максимальные работы различных реакций берутся при начальных концентрациях всех веществ, равных единице. При этом
![]()
![]() ,
,
![]() .
.
![]() (6.18)
(6.18)
Последнее уравнение может быть применено для вычисления уменьшения свободной энергии и термодинамического потенциала, так как
![]() ;
;
![]() ;
;
при этом
![]()
![]() =
=![]()
![]()
![]() =
=![]() .
.
Закон Нернста (тепловая теорема). Согласно закону Нернста вблизи абсолютного нуля в реакциях, протекающих в конденсированных системах, равны максимальные работы и тепловые эффекты:
![]() ,
,
а также
![]() .
(6.19)
.
(6.19)
По закону Нернста постоянная интегрирования в уравнениях константы равновесия и максимальной работы для конденсированных систем равна нулю.
Следствие тепловой теоремы:
1. При абсолютном нуле теплоемкость сi конденсированных тел равна нулю:
![]() .
.
Опытные данные позволяют предположить, что при абсолютном нуле не только алгебраическая сумма теплоемкостей, но и теплоемкость каждого тела в отдельности равна нулю.
2. При абсолютном нуле энтропия конденсированных тел равна нулю:
![]() .
.
