
- •140101.65 – Тепловые электрические станции
- •140104.65 – Промышленная теплоэнергетика
- •140100.65 – Теплоэнергетика
- •1. Информация о дисциплине «техническая термодинамика»
- •1.1. Предисловие
- •1.2. Содержание дисциплины и виды учебной работы
- •1.2.1. Содержание дисциплины по гос
- •1.2.2. Объем дисциплины и виды учебной работы
- •1.2.3. Перечень видов практических занятий
- •Раздел 1. Основные законы
- •1.2. Первый закон термодинамики
- •1.3. Второй закон термодинамики
- •Раздел 2. Реальные газы. Водяной пар (40 часов)
- •2.1.Свойства и фазовые переходы
- •Реальных газов
- •2.2. Характеристики и процессы водяного пара
- •2.3. Влажный воздух
- •2.4. Термодинамика газового потока. Истечение газов через сопло
- •Раздел 3.Компрессоры.
- •3.2. Циклы двигателей внутреннего сгорания (двс)
- •3.3. Циклы газотурбинных установок (гту)
- •Раздел 4. Циклы паротурбиннных
- •4.2. Циклы пту с промежуточным перегревом и регенеративным отбором пара
- •4.3. Циклы парогазовой и атомной установок
- •Раздел 5. Циклы холодильных и теплонасосных
- •Раздел 6. Элементы химической термодинамики
- •6.2. Уравнение максимальной работы химической рекции
- •Заключение
- •2.2. Тематический план дисциплины
- •2.2.1. Тематический план дисциплины
- •2.2.2. Тематический план дисциплины для студентов заочной формы обучения
- •Техническая термодинамика
- •Раздел 1.
- •Основные законы термодинамики
- •Раздел 2.
- •Реальные
- •Водяной пар
- •Раздел 3.
- •Компрессоры.
- •Циклы тепловых двигателей
- •Раздел 4.
- •Циклы паротурбинных установок
- •Раздел 5.
- •Циклы холодильных и теплонасосных установок
- •Раздел 6.
- •Элементы химической термодинамики
- •2.4. Временной график изучения дисциплины
- •2.5. Практический блок
- •2.5.1. Практические занятия
- •2.5.1.1. Практические занятия (очно – заочная форма обучения)
- •2.5.1.2. Практические занятия (заочная форма обучения)
- •2.5.2. Лабораторный практикум
- •2.5.2.1. Лабораторные работы (очно – заочная форма обучения)
- •2.5.2.2. Лабораторные работы (заочная форма обучения)
- •2.6. Рейтинговая система по дисциплине «Техническая термодинамика»
- •3.Информационные ресурсы дисциплины
- •3.1. Библиографический список
- •3.2. Опорный конспект лекций по дисциплине «техническая термодинамика» Введение
- •Раздел 1. Основные законы термодинамики
- •1.1. Термодинамика идеального газа
- •Основные понятия и определения термодинамики.
- •1.1.1. Законы идеального газа
- •1.1.2. Уравнение состояния
- •Теплоемкость
- •Последнюю формулу еще можно представить в виде
- •Смеси идеальных газов
- •Вопросы для самопроверки
- •1.2. Первый закон термодинамики
- •Обратимые равновесные процессы в идеальных газах
- •Разделив уравнение (б) на уравнение (а), найдем
- •Изопараметрические процессы
- •IV. Адиабатный процесс
- •V. Политропные процессы
- •Вопросы для самопроверки
- •1.3. Второй закон термодинамики
- •1.3.1. Круговые процессы
- •1.3.2. Прямой цикл Карно
- •1.3.3. Обратный цикл Карно
- •1.3.4. Второй закон термодинамики
- •1.3.5. Эксергетический метод исследования
- •1.3.6. Эксергия неподвижного рабочего тела
- •1.3.7. Эксергия потока рабочего тела
- •1.3.8. Эксергия потока теплоты
- •Вопросы для самопроверки
- •Раздел 2. Реальные газы. Водяной пар
- •2.1. Свойства и фазовые переходы реальных газов
- •2.1.1. Реальные газы и их свойства
- •Критические параметры некоторых веществ
- •2.1.2. Условия равновесия при фазовом переходе
- •2.1.3. Термические и калорические свойства реальных газов
- •Вопросы для самопроверки
- •2.2. Характеристики и процессы водяного пара
- •2.2.1. Водяной пар и основные процессы водяного пара
- •Испарение - процесс образования пара, происходящий с поверхности жидкости при любой температуре.
- •2.2.2. Изопараметрические процессы изменения состояния водяного пара в pv -, Ts - и hs - диаграммах
- •Вопросы для самопроверки
- •2.3. Влажный воздух
- •2.3.1. Свойства влажного воздуха
- •2.3.2. Теплоёмкость и энтальпия влажного воздуха
- •Вопросы для самопроверки
- •2.4. Термодинамика газового потока. Истечение газов через сопло
- •2.4.1. Термодинамика газового потока
- •Замена переменных приводит уравнение к виду
- •2.4.2. Термодинамика потока в каналах переменного сечения
- •2.4.3. Истечение газов через сужающиеся сопла (конфузоры)
- •Вопросы для самопроверки
- •2.4.4. Истечение газа с учетом трения
- •2.4.5. Истечение водяного пара
- •2.5. Расчет процессов дросселирования
- •2.5.1. Уравнение процесса дросселирования
- •Вопросы для самопроверки
- •Раздел 3. Компрессоры. Циклы тепловых двигателей
- •3.1. Виды компрессоров и процессы в компрессоре
- •3.1.1. Назначение и типы компрессоров
- •3.1.2. Многоступенчатое сжатие
- •3.1.3. Мощность привода идеального компрессора и коэффициенты полезного действия (кпд)
- •Вопросы для самопроверки
- •3.2. Циклы двигателей внутреннего сгорания (двс)
- •3.2.1. Циклы поршневых двигателей внутреннего сгорания (двс)
- •Цикл Oтто
- •Цикл Дизеля
- •Цикл Тринклера
- •3.3. Циклы газотурбинных установок (гту)
- •3.3.1. Принципиальная схема и цикл гту с изобарным подводом теплоты
- •3.3.3. Регенерация теплоты в цикле гту. Многоступенчатое сжатие в компрессоре и ступенчатый подвод теплоты
- •Вопросы для самопроверки
- •3.4. Циклы реактивных двигателей
- •И турбореактивного двигателей
- •Вопросы для самопроверки
- •Раздел 4. Циклы паротурбинных установок (пту)
- •4.1. Идеальный и действительный циклы пту
- •4.1.1. Идеальный цикл Ренкина
- •4.1.2. Цикл Ренкина на сухом насыщенном и перегретом паре
- •Следовательно, полезная работа цикла Ренкина равна
- •Термический кпд цикла Ренкина
- •Введем понятие относительного эффективного кпд
- •Далее введем относительный электрический кпд
- •Тогда расход пара на турбину можно выразить в виде
- •Тогда кпд всей пту определится произведением
- •Вопросы для самопроверки
- •4.2. Циклы пту с промежуточным перегревом и регенеративным отбором пара
- •Выражение для термического кпд основного (без промежуточного перегрева) цикла Ренкина:
- •Регенеративный цикл паротурбинных установок
- •Вопросы для самопроверки
- •4.3. Циклы парогазовой и атомной установок
- •4.3.1. Циклы парогазовых установок
- •4.3.2. Схема и цикл атомной теплоэнергетической установки
- •Вопросы для самопроверки
- •4.4. Циклы и устройства прямого преобразования теплоты в электроэнергию
- •4.4.1. Циклы установок с магнитогидродинамическим генератором (мгд-генератор)
- •4.4.2. Термодинамические и термоэлектронные преобразователи
- •Вопросы для самопроверки
- •Раздел 5. Циклы холодильных и теплонасосных установок
- •5.1. Циклы воздушной и парокомпрессорной холодильных установок
- •5.1.1. Циклы холодильных установок
- •5.1.2. Цикл воздушной холодильной установки
- •5.1.3. Цикл парокомпрессионной холодильной установки
- •5.1.4. Абсорбционная холодильная установка
- •Вопросы для самопроверки
- •5.2. Передача теплоты тепловым насосом и тепловой трубой
- •5.2.1. Тепловой насос
- •5.2.2. Передача теплоты тепловыми трубами
- •Вопросы для самопроверки
- •Раздел 6. Элементы химической термодинамики
- •6.1. Законы термодинамики в термохимии
- •6.1.1. Основные понятия химической термодинамики
- •6.1.2. Тепловой эффект химической реакции
- •6.1.3. Зависимость теплоты реакции от температуры
- •6.1.4. Химическое равновесие
- •Основные определения
- •Константа химического равновесия
- •Химические константы I и условные химические константы j
- •6.1.5. Диссоциация
- •Вопросы для самопроверки
- •6.2. Уравнение максимальной работы химической реакции
- •6.2.1. Химическое сродство. Мера химического сродства
- •Вопросы для самопроверки
- •Глоссарий (словарь терминов)
- •Охрана труда и техника безопасности при проведении лабораторных работ
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •4. Содержание отчета
- •3. Экспериментальная установка и методика опыта
- •Обработка результатов опыта
- •4. Содержание отчета
- •4. Блок контроля освоения дисциплины
- •4.1. Задания на контрольные работы
- •Контрольная работа 1
- •Контрольная работа 2
- •Контрольная работа 3
- •4.2. Методические указания к выполнению контрольных заданий и практических работ
- •Искомая мощность привода компрессора
- •4.3. Тренировочные и контрольные тесты
- •Вопрос 1. Выберите определение понятия «прямой цикл».
- •Вопрос 2. Как зависит холодильный коэффициент идеальной воздушной холодильной установки от степени повышения давления в компрессоре р2/р1?
- •Вопрос 4. Выберите наиболее полное определение понятия «идеальный газ».
- •4.4. Итоговый контроль. Вопросы для подготовки к экзамену
- •Приложение п.1. Теплофизические свойства сухого воздуха при нормальном атмосферном давлении
- •П.3. Средняя массовая теплоемкость газов при постоянном давлении, [4]
- •П.4. Средняя объемная теплоемкость газов при постоянном давлении,
- •П.5. Относительные молекулярные массы, плотности и объемы киломолей при нормальных условиях, критические температуры и критические давления некоторых газов
- •П.6. Энтальпия 1 м3 газов и влажного воздуха (кДж/м3)
- •П.7. Диаграмма h-s водяного пара
- •П.8. Насыщенный водяной пар (по давлениям)
1.1.1. Законы идеального газа
При теоретическом изучении термодинамического состояния идеального газа используется ряд физических законов:
1. Закон Бойля-Мариотта – произведение абсолютного давления газа на его удельный объем, при T=const, есть величина постоянная (рv=const).
Таким образом, для двух последовательных состояний газа согласно этому закону, имеем:
![]() const
const
![]() const
const
2.
Закон Гей-Люссака – отношение удельного
объема газа, при р=const,
к абсолютной температуре есть величина
постоянная (![]() =const).
=const).
Тогда для двух последовательных состояний газа имеем:
![]() const,
const,
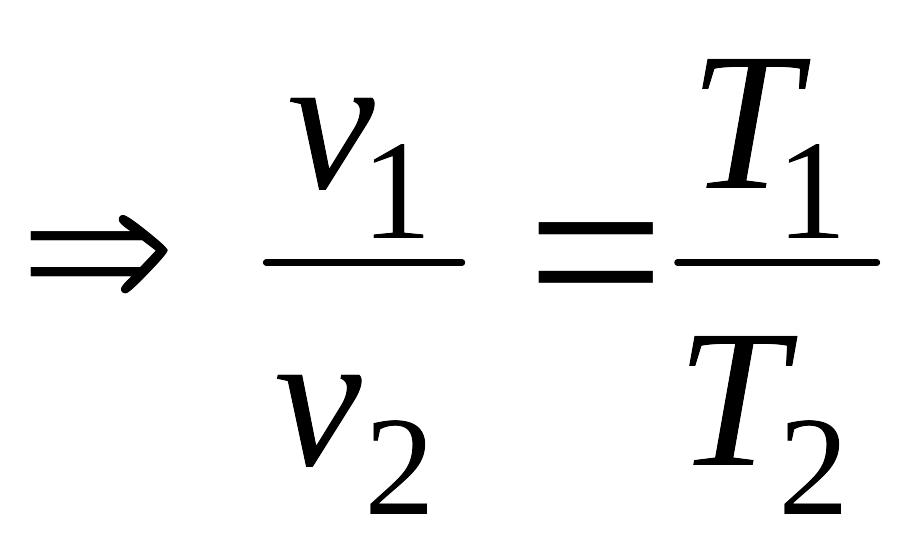 ,
,
![]() .
.
3.
Закон Шарля - при v=const
отношение температуры к давлению есть
величина постоянная (![]() const).
Для двух последовательных состояний
имеем:
const).
Для двух последовательных состояний
имеем:
![]() .
.![]()
4. Закон Авогадро – при одинаковых давлениях и температурах в равных объемах различных идеальных газов содержится одинаковое число молекул, что то же самое при одинаковых давлениях и температурах один моль различных газов занимает одинаковый объем. При нормальных физических условиях по закону Авогадро объем одного киломоля идеального газа составляет Vм=22,4м3.
1.1.2. Уравнение состояния
Параметры состояния термодинамической системы связаны между собой зависимостью, которая называется уравнением состояния. Это уравнение устанавливает функциональную зависимость параметров состояния f(р,T,v)=0. С математической точки зрения функция f(р,T,v)=0 в трехмерном пространстве описывает конкретную поверхность, каждая точка на которой отображает равновесные состояния ТДС. Эта поверхность называется термодинамической поверхностью. Уравнение состояния позволяет символично выразить каждый из параметров через два других параметра, т.е.
![]() ;
;![]() ;
;![]() .
.
Следует отметить, что современная физика пока не располагает универсальным уравнением состояния для всех форм материальных тел. На сей день имеется ряд эмпирически установленных зависимостей для некоторых категорий материальных тел, описывающих их термодинамическое состояние.
Для идеального газа эта зависимость называется уравнением Клапейрона-Менделеева и имеет вид:
![]() ,
(1.3)
,
(1.3)
где
р
– давление, (Па); V
– объем газа, (м3);
m
– масса газа, (кг); R0=8314
(![]() )
- универсальная газовая постоянная,
)
- универсальная газовая постоянная,
![]() г
– мольная масса газа, (
г
– мольная масса газа, (![]() );
Т
– абсолютная температура, (К).
);
Т
– абсолютная температура, (К).
Путем
введения понятия удельного объема
![]() ,
то уравнение (1.3) можно написать в виде
,
то уравнение (1.3) можно написать в виде
![]() ,
(1.4)
,
(1.4)
где
![]() ,
(
,
(![]() ),-
удельная газовая постоянная, характеризует
физические свойства конкретного газа.
Для некоторых газов их свойства
представлены в табл. 1.1.
),-
удельная газовая постоянная, характеризует
физические свойства конкретного газа.
Для некоторых газов их свойства
представлены в табл. 1.1.
Таблица 1.1
Газ |
μ, кг/кмоль |
R, Дж/(кг К) |
ρ0, кг/м3 |
Водород Н2 |
2 |
4124 |
0,09 |
Гелий Не |
4 |
2077 |
0,18 |
Азот N2 |
28 |
297 |
1,25 |
Кислород О2 |
32 |
260 |
1,43 |
Воздух |
29,1 |
287 |
1,29 |
Углекислый газ СО2 |
44 |
190 |
1,81 |
Водяной пар Н2О |
18 |
462 |
0,71 |
Для реальных газов, в которых необходимо учитывать межмолекулярные силы взаимодействия и нельзя пренебрегать объемами молекул. Соответствующее уравнение состояния было предложено Ван-дер-Ваальсом, которое имеет вид
![]() ,
(1.5)
,
(1.5)
где а – учитывает силу взаимодействия молекул, b – представляет собой суммарный объем молекул.
