- •Министерство образования и науки российской федерации Российский государственный университет нефти и газа имени и.М. Губкина
- •Содержиние
- •Введение.
- •Оксид углерода(II) – со.
- •Оксид серы(IV) – so2
- •Сероводород – h2s.
- •Оксид азота (IV) – no2.
- •Содержание окиси азота в выхлопных выбросах мобильных дорожных источников:
- •Содержание окиси азота в выхлопных выбросах мобильных внедорожных источников:
- •Метан – ch4.
- •Хроническое действие метана:
- •Заключение.
- •Самоочищение атмосферы.
- •Источники.
Оксид серы(IV) – so2
(диоксид серы, сернистый газ, сернистый ангидрид).
Основные характеристики.
Сернистый газ – в нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 – один из основных компонентов вулканических газов.
Получение:
Сернистый газ – не природный продукт, он появляется в результате активной промышленной деятельности человека. 95% его мировых выбросов происходит над территорией Северного полушария, и особенно – над Восточной и Западной Европой. Что неудивительно: именно в этих странах принято активно использовать бурый уголь в производстве энергии.
Во время сгорания автомобильного и прочего топлива в воздухе оказывается большая концентрация оксидов азота, углеводородов, угарного газа и, конечно, диоксида серы. Все вместе они создают густой туман с голубоватой дымкой, чрезвычайно опасный для здоровья человека.
Однако не только в Европе, но и в Азии человек страдает от губительных серных паров. Практически полное отсутствие очистных сооружений при большом скоплении заводов приводит к тому, что в китайском Шанхае образуется плотная дымка: людям становится сложно дышать, и даже машины с включёнными фарами с трудом находят себе дорогу. Производственные предприятия Шанхая выбрасывают в воздух до 15 млн. тонн сернистого газа в год. И чем больше топлива человечество потребляет, тем больше ядовитых выбросов появляется в атмосфере: сегодня вес выделяемого SO2 уже составляет 174 млн. тонн в год. Доля сернистого газа среди всех серосодержащих промышленных выбросов составляет не менее 95%.
В атмосферу сернистый газ попадает в результате промышленной переработки серосодержащих веществ. Например, он выделяется во время производства целлюлозы и серной кислоты, стекла и ультрамарина, а также при обжиге руд с содержанием сернистых металлов, на нефтеперерабатывающих заводах и в травилках на металлозаводах. Когда в котельных сжигаются серосодержащие угли, побочным продуктом данного процесса также является SO2, активно загрязняющий атмосферу.
Попав в воздух, сернистый газ остаётся там сравнительно недолго: самое большее – три недели (в сухом и чистом воздухе), самое меньшее – несколько часов (во влажном воздухе с посторонними примесями вроде аммиака). Когда SO2 смешивается в воздухе с каплями влаги, происходят фотохимические, каталитические и другие реакции, в результате чего образуется вторичный загрязнитель – серная кислота Н2SО4. От этого опасность данного газа возрастает ещё больше, ведь капли кислоты могут преодолевать очень большие расстояния.
Наибольшую опасность сернистый ангидрид представляет в его взаимодействии с взвешенными частицами с образованиями солей серной кислоты, которые способны оседать в лёгких и вызывать серьёзные заболевания, вплоть до разрушения тканей.
Сжиженный сернистый газ также очень опасен, т.к. при утечке он быстро переходит в газообразное состояние и оседает у поверхности земли (особенно в подвалах, тоннелях и оврагах) в виде едкого холодного тумана. Над поверхностью воды двуокись серы превращается в удушливый ядовитый газ.
Способы получения:
Промышленный способ получения – сжигание серы или обжиг сульфидов, в основном – пирита:
![]()
В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
![]()
![]()
Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
![]()
Применение:
Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также в слабоалкогольных напитках (вина средней ценовой категории) в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады (зерновые склады). Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях.
При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и как следствие присутствия воды H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты
Химические свойства:
Относится к кислотным оксидам.
Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция
обратима):
![]()
Со щелочами образует сульфиты:
![]()
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные
свойства SO2, степень окисления серы в таких реакциях повышается:
![]()
![]()
![]()
Последняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2
(обесцвечивание фиолетового раствора). В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
![]()
Или для получения фосфорноватистой кислоты:
![]()
Действие сернистого газа на организм.
SO2 относится к разряду токсичных газов. При вдыхании сравнительно небольших его концентраций воспаляются верхние дыхательные пути, появляются кашель, насморк, першение в горле, голос становится хриплым. Симптомы дальнейшего отравления – глотание с болью, удушье, рвота, нарушения речи, иногда начинается острый отёк лёгких. При этом поражение лёгких происходит не сразу, а через 1-2 дня после попадания SO2 в дыхательные пути.
Если пары сернистого газа значительно превышают норму, у человека происходят гораздо более тяжёлые изменения в организме: бронхопневмония, глубокий бронхит, отёк гортани и лёгких. Пары серной кислоты при попадании в организм человека вызывают хронические бронхиты и конъюнктивиты.
Вышеназванные симптомы означают, что вдыхание диоксида серы в больших концентрациях сильно повышает риск заболеваний дыхательных путей, сопровождающихся кашлем, воспалением носоглотки, бронхитами, хрипотой и болью в горле. Особенно опасно наличие диоксида серы в воздухе для людей с заболеваниями органов дыхания. У астматиков он вызывает фатальные аллергические реакции. Помимо этого, пары диоксида серы способны разрушать витамин B1.
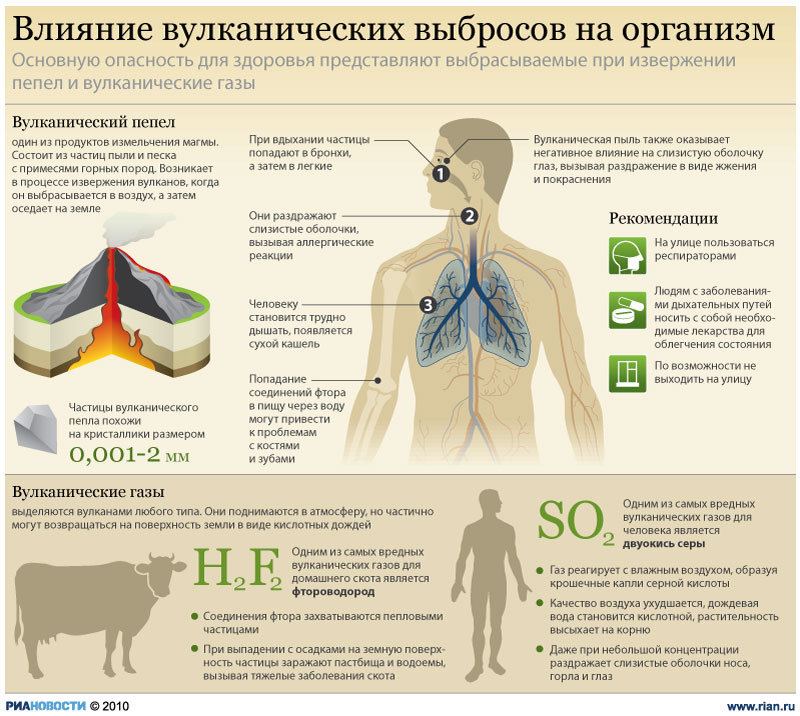
Ниже приведена схема влияния вулканических выбросов на организм человека, в состав которых входит сернистый газ.