- •Предмет и задачи биофизики. История развития биофизики. Разделы биофизики.
- •Особенности кинетики биологических процессов. Параметры и переменные. Влияние концентраций на скорость реакций. Понятие «узкого места».
- •Механизмы первичных реакций в организме при размене физической энергии на химическую (теория мишени, теория непрямого действия, теория цепных процессов).
- •Влияние температуры на скорость реакций в биологических системах.
- •Перекисное окисление липидов в мембранах. Биологические последствия пероксидации липидов.
- •Кинетика ферментативных реакций (уравнения Михаэлиса-Ментен).
- •Чувствительность различных биологических объектов к радиации. Действие ионизирующего облучения на живые системы.
- •Аллостерическое и конкурентное ингибирование ферментативных реакций. Субстратное торможение. Индукция и репрессия синтеза ферментов (по Жакобу и Моно).
- •Статистический характер организации биополимеров (на примере двумерной свободно сочлененной полимерной цепи).
- •Раздел III. Пространственная организация биополимеров
- •Глава VII. Пространственные конфигурации полимерных молекул (стр. 167 - 182)
- •§1. Статистический характер организации полимеров
- •Множественность стационарных состояний. Модели триггерного типа. Силовое и параметрическое переключение триггера. Гистерезисные явления.
- •Транспорт электролитов (электрохимический потенциал, электродиффузионное уравнение Нернста-Планка , гидратация ионов).
- •Классификация термодинамических систем. Первый закон термодинамики и его применимость в биологии. Закон Гесса.
- •Транспорт электролитов (ионное равновесие на границе мембрана-раствор, равновесие Доннана).
- •Второй закон термодинамики. Понятие градиента. Энтропия, свободная и связанная энергия.
- •Пространственная конформация биополимеров (стереоспецифичность аминокислот, первичная, вторичная, третичная, четверичная структура белка).
- •Вида ионизирующих излучений. Единицы измерения дозы ионизирующего излучения.
- •Изменение энтропии в открытых системах. Стационарные состояния и состояния термодинамического равновесия. Принцип Ле-Шателье.
- •Механно-химические процессы в полимерах.
- •Активный транспорт (участие атф-аз вм активном транспорте ионов через биологические мембраны).
- •Переносчики и каналы.
- •Устойчивость и неустойчивость стационарного состояния (на примере гидродинамической модели).
- •1. Кинетические уравнения Лотки (a.J. Lotka. Elements of Physical Biology, 1925)
- •2. Модель Вольтерра
- •(По к. Вилли, в. Детье, 1974)
- •Активный транспорт (электрогенный транспорт ионов – опыт Уссинга и ).
- •Понятие обобщенных сил и потоков. Соотношение взаимности Онзагера. Теорема Пригожина.
- •Простая и облегченная диффузия.
- •Кооперативные свойства макромолекул (механизм кооперативного связывания кислорода гемоглобином и миоглобином).
- •Потенциал покоя и его происхождение.
- •[Править]История открытия
- •[Править]Общие положения
- •[Править]Формирование потенциала покоя
- •Поверхностный заряд мембранных систем (происхождение дзета-потенциалов – представление Гельмгольца, Гуи, Штерна; определение дзета-потенциалов).
- •Состояние воды и гидрофобные взаимодействия.
- •Потенциал действия (изменение электропроводной мембраны, потоки ионов натрия и калия, схема функционирования натриевого канала при возбуждении). Распространение возбуждения.
- •Роль гидрофобных взаимодействий в формировании структуры белков. Переход спираль-клубок. Переход глобула-клубок.
- •Переход клубок—глобула
- •Транспорт неэлектролитов (проницаемость мембран для воды, роль коллоидно-осмотического давления плазмы в переносе воды).
- •Электропроводность биосистем (закономерности происхождения постоянного тока через биологические объекты; явления поляризации).
- •Сокращение мышцы (схема взаимодействия актина и миозина по а.Хаксли).
- •Электропроводность биосистем (закономерности происхождения переменного тока через биологические объекты; дисперсия электропроводности).
- •5. Живая ткань как проводник переменного электрического тока. Дисперсия
- •Химия и физика мышцы (схема взаимодействия актина с миозином по Хаксли, кривая зависимости скорости изотонического сокращения от величины нагрузки по Хиллу).
- •Структура биомембран: развитие представление о структуре, модельные мембранные системы.
- •Ковалентные и слабые связи.
- •21. Слабые связи.
- •Динамические модели биологических систем. Понятие фазовой плоскости. Фазовой портрет системы.
- •12. Понятие фазовой плоскости. Фазовый портрет системы.
- •Свободные радикалы. Методы изучения. Классификация свободных радикалов.
- •Классификация свободных радикалов, образующихся в нашем организме
- •Первичные радикалы (радикалы кислорода, окись азота, радикал коэнзима q). Первичные радикалы
- •Активные формы кислорода
- •Окись азота
- •Радикал коэнзима q
- •Клеточные системы антирадикальной защиты.
- •Динамика мембран. Фазовые переходы в липидном бислое.
- •Слабые взаимодействия (ион-ионное взаимодействие, диполь-дипольное взаимодействие, наведенные диполи, лондоновские или дисперсные силы).
- •Свойства
- •Слабый распад
- •Дисперсионное взаимодействие
- •Характеристика ковалентной связи.
Слабый распад
Процесс распада более массивной частицы на более легкие вследствие слабого взаимодействия называется слабым распадом. Типичным примером является бета-распад нейтрона.
Ион-дипольное Сольватация Ион-дипольное, то есть, когда ион взаимодействуетс нейтральной молекулой, имеющей постоянный дипольный момент.
Ион-ионное Ионная ассоциация Ион-ионное (монополь-монополь)
(Диполь-дипольное) (Агрегация растворителя) Диполь-дипольное, то есть взаимодействие между молекулами, имеющими постоянный дипольный момент.
Наведенные Диполи возникают только при внесении диэлектрика в электрическое поле. Под влиянием последнего в неполяр-ных молекулах диэлектрика происходит смещение зарядов1 их. Наведенные диполи возникают только при внесении диэлектрика в электрическое поле. Схема взаимодействия между.| Взаимное отталкивание электронов на / заполненных орбиталях. Такое отталкивание особенно велико, когда заполненные орбитали. При этом возникают мгновенные наведенные диполи, между которыми действуют силы взаимного притяжения. Схема возникновения наведенных дипольных моментов, приводящих к слабому ( вандерваальсовому взаимодействию.| Перекрывание ls-op - биталей двух атомов водорода в молекулярном ионе Н 2. При согласованном движении электронов у молекулы могут возникать наведенные диполи, и между этими диполями возникают так называемые индукционные силы притяжения.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
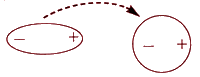
Энергия такого взаимодействия (энергия Лондона) дается соотношением:
EЛ = −2 μмгн2 γ2 / r6,
где μмгн - момент мгновенного диполя. Лондоновские силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами.
Характеристика ковалентной связи.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1D = 3,4·10-30 Кл·м).
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | μ | = l · q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. На характеристики связей влияет их кратность:
энергия связи увеличивается в ряду:
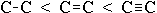 ;
;длина связи растет в обратном порядке:
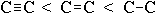 .
.