
- •Предмет и задачи биофизики. История развития биофизики. Разделы биофизики.
- •Особенности кинетики биологических процессов. Параметры и переменные. Влияние концентраций на скорость реакций. Понятие «узкого места».
- •Механизмы первичных реакций в организме при размене физической энергии на химическую (теория мишени, теория непрямого действия, теория цепных процессов).
- •Влияние температуры на скорость реакций в биологических системах.
- •Перекисное окисление липидов в мембранах. Биологические последствия пероксидации липидов.
- •Кинетика ферментативных реакций (уравнения Михаэлиса-Ментен).
- •Чувствительность различных биологических объектов к радиации. Действие ионизирующего облучения на живые системы.
- •Аллостерическое и конкурентное ингибирование ферментативных реакций. Субстратное торможение. Индукция и репрессия синтеза ферментов (по Жакобу и Моно).
- •Статистический характер организации биополимеров (на примере двумерной свободно сочлененной полимерной цепи).
- •Раздел III. Пространственная организация биополимеров
- •Глава VII. Пространственные конфигурации полимерных молекул (стр. 167 - 182)
- •§1. Статистический характер организации полимеров
- •Множественность стационарных состояний. Модели триггерного типа. Силовое и параметрическое переключение триггера. Гистерезисные явления.
- •Транспорт электролитов (электрохимический потенциал, электродиффузионное уравнение Нернста-Планка , гидратация ионов).
- •Классификация термодинамических систем. Первый закон термодинамики и его применимость в биологии. Закон Гесса.
- •Транспорт электролитов (ионное равновесие на границе мембрана-раствор, равновесие Доннана).
- •Второй закон термодинамики. Понятие градиента. Энтропия, свободная и связанная энергия.
- •Пространственная конформация биополимеров (стереоспецифичность аминокислот, первичная, вторичная, третичная, четверичная структура белка).
- •Вида ионизирующих излучений. Единицы измерения дозы ионизирующего излучения.
- •Изменение энтропии в открытых системах. Стационарные состояния и состояния термодинамического равновесия. Принцип Ле-Шателье.
- •Механно-химические процессы в полимерах.
- •Активный транспорт (участие атф-аз вм активном транспорте ионов через биологические мембраны).
- •Переносчики и каналы.
- •Устойчивость и неустойчивость стационарного состояния (на примере гидродинамической модели).
- •1. Кинетические уравнения Лотки (a.J. Lotka. Elements of Physical Biology, 1925)
- •2. Модель Вольтерра
- •(По к. Вилли, в. Детье, 1974)
- •Активный транспорт (электрогенный транспорт ионов – опыт Уссинга и ).
- •Понятие обобщенных сил и потоков. Соотношение взаимности Онзагера. Теорема Пригожина.
- •Простая и облегченная диффузия.
- •Кооперативные свойства макромолекул (механизм кооперативного связывания кислорода гемоглобином и миоглобином).
- •Потенциал покоя и его происхождение.
- •[Править]История открытия
- •[Править]Общие положения
- •[Править]Формирование потенциала покоя
- •Поверхностный заряд мембранных систем (происхождение дзета-потенциалов – представление Гельмгольца, Гуи, Штерна; определение дзета-потенциалов).
- •Состояние воды и гидрофобные взаимодействия.
- •Потенциал действия (изменение электропроводной мембраны, потоки ионов натрия и калия, схема функционирования натриевого канала при возбуждении). Распространение возбуждения.
- •Роль гидрофобных взаимодействий в формировании структуры белков. Переход спираль-клубок. Переход глобула-клубок.
- •Переход клубок—глобула
- •Транспорт неэлектролитов (проницаемость мембран для воды, роль коллоидно-осмотического давления плазмы в переносе воды).
- •Электропроводность биосистем (закономерности происхождения постоянного тока через биологические объекты; явления поляризации).
- •Сокращение мышцы (схема взаимодействия актина и миозина по а.Хаксли).
- •Электропроводность биосистем (закономерности происхождения переменного тока через биологические объекты; дисперсия электропроводности).
- •5. Живая ткань как проводник переменного электрического тока. Дисперсия
- •Химия и физика мышцы (схема взаимодействия актина с миозином по Хаксли, кривая зависимости скорости изотонического сокращения от величины нагрузки по Хиллу).
- •Структура биомембран: развитие представление о структуре, модельные мембранные системы.
- •Ковалентные и слабые связи.
- •21. Слабые связи.
- •Динамические модели биологических систем. Понятие фазовой плоскости. Фазовой портрет системы.
- •12. Понятие фазовой плоскости. Фазовый портрет системы.
- •Свободные радикалы. Методы изучения. Классификация свободных радикалов.
- •Классификация свободных радикалов, образующихся в нашем организме
- •Первичные радикалы (радикалы кислорода, окись азота, радикал коэнзима q). Первичные радикалы
- •Активные формы кислорода
- •Окись азота
- •Радикал коэнзима q
- •Клеточные системы антирадикальной защиты.
- •Динамика мембран. Фазовые переходы в липидном бислое.
- •Слабые взаимодействия (ион-ионное взаимодействие, диполь-дипольное взаимодействие, наведенные диполи, лондоновские или дисперсные силы).
- •Свойства
- •Слабый распад
- •Дисперсионное взаимодействие
- •Характеристика ковалентной связи.
Химия и физика мышцы (схема взаимодействия актина с миозином по Хаксли, кривая зависимости скорости изотонического сокращения от величины нагрузки по Хиллу).
Сократительные белки актин и миозин образуют в миофибриллах тонкие и толстые миофиламенты. Они располагаются параллельно друг другу внутри мышечной клетки, как показано на рис. 4.1–схеме крошечного участка мышечного волокна человека. На ней изображены также одна из митохондрий (саркосом), лежащая между миофибриллами, и часть системы поперечных и продольных трубочек (их функции рассмотрены в разд. 4.2). Миофибриллы представляют собой сократимые пучки «нитей» (филаментов) диаметром около 1 мкм. Перегородки, называемые Z–пластинками, разделяют их на несколько компартментов–саркомеров длиной примерно по 2,5 мкм.
Структура саркомеров схематически показана на рис. 4.1. С помощью светового микроскопа в них можно видеть регулярно чередующиеся поперечные светлые и темные полосы. Согласно теории Хаксли и Хансон [II], такая поперечная полосатость миофибрилл обусловлена особым взаиморасположением актиновых и миозиновых филаментов. Середину каждого саркомера занимают несколько тысяч «толстых» нитей миозина диаметром примерно по 10 нм. На обоих концах саркомера находятся около 2000 «тонких» (толщиной по 5 нм) нитей актина, прикрепленных к Z–пластинкам наподобие щетинок в щетке. Пучок лежащих в определенном порядке

Рис. 4.1. Схема участка волокна скелетной мышцы человека (по Garamvolgyi)

Рис. 4.2. А.Поперечнополосатая структура миофибрилл: слева расслабление, справа сокращение. Б. Организация миозиновых и актиновых нитей в расслабленном и сократившемся саркомере. Обратите внимание на аддитивный характер укорочения последовательно соединенных саркомеров [11]
миозиновых нитей длиной 1,6 мкм в середине саркомера выглядит в световом микроскопе темной полосой шириной 1,6 мкм; из–за свойства двойного лучепреломления в поляризованном свете (т. е. анизотропии) она называется А–диском. По обе стороны от А–диска находятся изотропные участки, содержащие только тонкие нити и поэтому выглядящие светлыми; эти так называемые I–диски тянутся до Z–пластинок. Именно в результате такого периодического чередования светлых и темных полос в бесчисленных саркомерах миофибриллы сердечной и скелетной мускулатуры выглядят поперечно–полосатыми.
В покоящейся мышце концы толстых и тонких филаментов обычно лишь слабо перекрываются на границе между А– и I–дисками. Эта зона перекрывания в А–диске выглядит в световом микроскопе гораздо темнее центральной Н–зоны, в которой нет актиновых нитей. На электронных микрофотографиях Н–зоны видна очень тонкая темная М–линия в середине саркомера–сеть опорных белков, по–видимому, удерживающих толстые нити в составе единого пучка.
Укорочение саркомеров. Мышца сокращается в результате укорочения множества последовательно соединенных саркомеров в миофибриллах. Сравнивая структуры саркомера в двух различных функциональных состояниях (рис. 4.2), можно видеть изменения поперечной исчерченности и взаиморасположения нитей во время сокращения: тонкие актиновые филаменты скользят вдоль толстых миозиновых, двигаясь между ними к середине их пучка и саркомера.
Рис. 4.2 иллюстрирует основное положение теории скользящих нитей–во время сокращения мышцы сами актиновые и миозиновые нити не укорачиваются. Это объясняет данные световой микроскопии: ширина А–диска (1,6 мкм) всегда остается постоянной, тогда как I–диски и Н–зоны при сокращении сужаются.
Длина нитей не меняется и при растяжении мышцы. Тонкие филаменты попросту вытягиваются из промежутков между толстыми нитями, так что степень перекрывания их пучков уменьшается.
Каким же образом осуществляется «разнонаправленное скольжение» актиновых нитей в двух половинах саркомера?
Работа поперечных мостиков. Миозиновые нити несут поперечные, отходящие биполярно, как показано на рис. 4.3, А, выступы длиной около 20 нм с головками примерно из 150 молекул миозина. Во время сокращения каждая головка(поперечный мостик) может связывать миозиновую нить с соседними актиновыми (рис. 4.3, А). Движение головок создает объединенное усилие, как бы «гребок», продвигающий актиновые нити к середине саркомера. Сама биполярная организация молекул миозина обеспечивает противоположную направленность (стрелки на рис. 4.3) скольжения актиновых нитей в левой и правой половинах саркомера.
В результате однократного движения поперечных мостиков вдоль актиновой нити саркомер укорачивается только на 2 х 10 нм, т.е. примерно на 1% своей длины. Однако при изотоническом сокращении мышцы лягушки саркомеры за десятую долю секунды укорачиваются на 0,4 мкм, т. е. на 20% длины. Для этого поперечные мостики должны совершить свои гребковые движения за указанный промежуток времени не один, а 20 раз. Только за
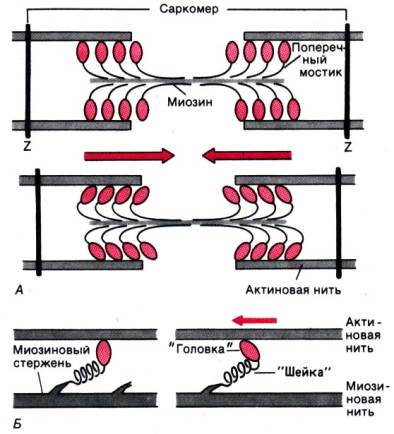
Рис. 4.3. Функция поперечных мостиков. А. Модель механизма сокращения: миозиновая нить с поперечными мостиками, прикрепленными к соседним актиновым нитям; вверху–до, внизу–после «гребка» мостиков (на самом деле они функционируют асинхронно) [2]. 5. Модель [10] механизма генерирования силы поперечными мостиками; слева– до, справа– после «гребка». Поперечные мостики химически соответствуют субфрагменту миозина–«тяжелому меромиозину», который состоит из субфрагментов I (головка) и II (шейка)
счет ритмичных отделений и повторных прикреплений миозиновых головок актиновая нить может подтягиваться к середине саркомера, подобно тому как группа людей тянет длинную веревку, перебирая ее руками. Благодаря суммации минимальных укорочений миофибрилл в последовательно расположенных саркомерах мышца лягушки длиной 2 см при изотоническом сокращении за 0,1 с поднимет маленький груз на высоту 0,4 см. Следовательно, когда принцип «вытягивания веревки» реализуется во множестве последовательных саркомеров, повторяющиеся молекулярные движения поперечных мостиков приводят к макроскопическому движению. При расслаблении мышцы миозиновые головки отделяются от актиновых нитей. Поскольку актиновые и миозиновые нити могут легко скользить друг относительно друга, сопротивление расслабленных мышц растяжению очень низкое. Их можно снова растянуть до исходной длины, приложив совсем небольшое усилие. Следовательно, удлинение мышцы во время расслабления носит пассивный характер. Только что описанные движения поперечных мостиков недавно были продемонстрированы на молекулярном уровне методом дифракции рентгеновских лучей (их малоугловое рассеивание сократившейся мышцей с временным разрешением порядка нескольких миллисекунд [14]).
Рассмотрим, к чему сводятся представления о механизме попеременного сокращения и расслабления мышц. В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий (рис. 20.8):
1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер (см. рис. 20.8, а);
2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90° (см. рис. 22.8, б);
3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера (см. рис. 20.8, в);
4) новая молекула АТФ связывается с комплексом миозин–F-актин (см. рис. 20.8, г);
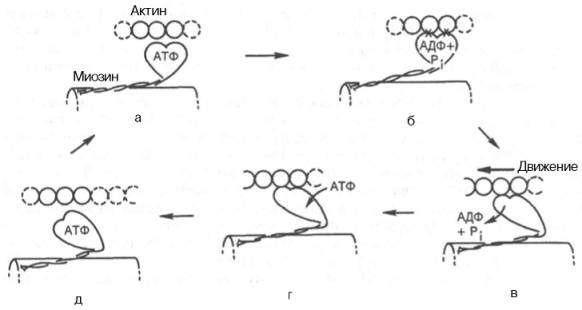
Рис. 20.8. Биохимический цикл мышечного сокращения. Объяснение в тексте.
5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом (см. рис. 20.8, д). Затем цикл возобновляется.
Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регулятор-ная роль принадлежит ионам Са2+. Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция . Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ.
По современным представлениям, в покоящейся мышце (в миофибрил-лах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур.
Связывание ионов Са2+ разветвленной сетью трубочек и цистерн сарко-плазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети . При этом наблюдается весьма своеобразная картина: скорость выкачивания ионов Са2+ из межфибриллярного пространства стимулируется этими же ионами. В целом такой механизм получил название «кальциевая помпа» по аналогии с хорошо известным в физиологии натриевым насосом.
Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионовСа2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость акто-миозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов Са2+ в саркоплазму.
Как отмечалось, «чувствительность» актомиозиновой системы к ионам Са2+ (т.е. потеря актомиозином способности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов Са2+ до 10–7 М) обусловлена присутствием в контрактильной системе (на нитях F-акти-на) белка тропонина, связанного с тропомиозином. В тропонин-тропомио-зиновом комплексе ионы Са2+ связываются именно с тропонином. В молекуле тропонина при этом происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиози-нового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Mg2+-АТФазы.
В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул. Итак, чем большее число мостиков прикреплено в данный момент к акти-новым нитям, тем больше сила мышечного сокращения.
Наконец, если возбуждение прекращается, содержание ионов Са2+ в саркоплазме снижается (кальциевая помпа), то циклы прикрепление–освобождение прекращаются, т.е. «головки» миозиновых нитей перестают прикрепляться к актиновым нитям. В присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если прекращается поступление АТФ (аноксия, отравление дыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики толстых (миозиновых) нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы.
