
- •Предмет и задачи биофизики. История развития биофизики. Разделы биофизики.
- •Особенности кинетики биологических процессов. Параметры и переменные. Влияние концентраций на скорость реакций. Понятие «узкого места».
- •Механизмы первичных реакций в организме при размене физической энергии на химическую (теория мишени, теория непрямого действия, теория цепных процессов).
- •Влияние температуры на скорость реакций в биологических системах.
- •Перекисное окисление липидов в мембранах. Биологические последствия пероксидации липидов.
- •Кинетика ферментативных реакций (уравнения Михаэлиса-Ментен).
- •Чувствительность различных биологических объектов к радиации. Действие ионизирующего облучения на живые системы.
- •Аллостерическое и конкурентное ингибирование ферментативных реакций. Субстратное торможение. Индукция и репрессия синтеза ферментов (по Жакобу и Моно).
- •Статистический характер организации биополимеров (на примере двумерной свободно сочлененной полимерной цепи).
- •Раздел III. Пространственная организация биополимеров
- •Глава VII. Пространственные конфигурации полимерных молекул (стр. 167 - 182)
- •§1. Статистический характер организации полимеров
- •Множественность стационарных состояний. Модели триггерного типа. Силовое и параметрическое переключение триггера. Гистерезисные явления.
- •Транспорт электролитов (электрохимический потенциал, электродиффузионное уравнение Нернста-Планка , гидратация ионов).
- •Классификация термодинамических систем. Первый закон термодинамики и его применимость в биологии. Закон Гесса.
- •Транспорт электролитов (ионное равновесие на границе мембрана-раствор, равновесие Доннана).
- •Второй закон термодинамики. Понятие градиента. Энтропия, свободная и связанная энергия.
- •Пространственная конформация биополимеров (стереоспецифичность аминокислот, первичная, вторичная, третичная, четверичная структура белка).
- •Вида ионизирующих излучений. Единицы измерения дозы ионизирующего излучения.
- •Изменение энтропии в открытых системах. Стационарные состояния и состояния термодинамического равновесия. Принцип Ле-Шателье.
- •Механно-химические процессы в полимерах.
- •Активный транспорт (участие атф-аз вм активном транспорте ионов через биологические мембраны).
- •Переносчики и каналы.
- •Устойчивость и неустойчивость стационарного состояния (на примере гидродинамической модели).
- •1. Кинетические уравнения Лотки (a.J. Lotka. Elements of Physical Biology, 1925)
- •2. Модель Вольтерра
- •(По к. Вилли, в. Детье, 1974)
- •Активный транспорт (электрогенный транспорт ионов – опыт Уссинга и ).
- •Понятие обобщенных сил и потоков. Соотношение взаимности Онзагера. Теорема Пригожина.
- •Простая и облегченная диффузия.
- •Кооперативные свойства макромолекул (механизм кооперативного связывания кислорода гемоглобином и миоглобином).
- •Потенциал покоя и его происхождение.
- •[Править]История открытия
- •[Править]Общие положения
- •[Править]Формирование потенциала покоя
- •Поверхностный заряд мембранных систем (происхождение дзета-потенциалов – представление Гельмгольца, Гуи, Штерна; определение дзета-потенциалов).
- •Состояние воды и гидрофобные взаимодействия.
- •Потенциал действия (изменение электропроводной мембраны, потоки ионов натрия и калия, схема функционирования натриевого канала при возбуждении). Распространение возбуждения.
- •Роль гидрофобных взаимодействий в формировании структуры белков. Переход спираль-клубок. Переход глобула-клубок.
- •Переход клубок—глобула
- •Транспорт неэлектролитов (проницаемость мембран для воды, роль коллоидно-осмотического давления плазмы в переносе воды).
- •Электропроводность биосистем (закономерности происхождения постоянного тока через биологические объекты; явления поляризации).
- •Сокращение мышцы (схема взаимодействия актина и миозина по а.Хаксли).
- •Электропроводность биосистем (закономерности происхождения переменного тока через биологические объекты; дисперсия электропроводности).
- •5. Живая ткань как проводник переменного электрического тока. Дисперсия
- •Химия и физика мышцы (схема взаимодействия актина с миозином по Хаксли, кривая зависимости скорости изотонического сокращения от величины нагрузки по Хиллу).
- •Структура биомембран: развитие представление о структуре, модельные мембранные системы.
- •Ковалентные и слабые связи.
- •21. Слабые связи.
- •Динамические модели биологических систем. Понятие фазовой плоскости. Фазовой портрет системы.
- •12. Понятие фазовой плоскости. Фазовый портрет системы.
- •Свободные радикалы. Методы изучения. Классификация свободных радикалов.
- •Классификация свободных радикалов, образующихся в нашем организме
- •Первичные радикалы (радикалы кислорода, окись азота, радикал коэнзима q). Первичные радикалы
- •Активные формы кислорода
- •Окись азота
- •Радикал коэнзима q
- •Клеточные системы антирадикальной защиты.
- •Динамика мембран. Фазовые переходы в липидном бислое.
- •Слабые взаимодействия (ион-ионное взаимодействие, диполь-дипольное взаимодействие, наведенные диполи, лондоновские или дисперсные силы).
- •Свойства
- •Слабый распад
- •Дисперсионное взаимодействие
- •Характеристика ковалентной связи.
Роль гидрофобных взаимодействий в формировании структуры белков. Переход спираль-клубок. Переход глобула-клубок.
Все аминокислотные остатки, входящие в состав полипептидной цепи условно разделяются на две группы:
-неполярные (гидрофобные)
-полярные (гидрофильные)
Степень гидрофобности остатка определяют по разности свободных энергий растворения аминокислоты в слабополярном растворителе и воде (обычно используют этиловый спирт).
Полученные таким образом величины разностей свободных энергий, приходящихся на белковую группу аминокислоты при переносе из спирта в воду, приведены в таблице:
Степень гидрофобности аминокислотных остатков |
|||||
Гидрофобные
|
Три |
Иле |
Тир |
Фен |
Про |
12.50 |
12.40 |
12.00 |
11.10 |
10.85 |
|
Гидрофобные F кДж/моль |
Лей |
Вал |
Лиз |
Гис |
Нет |
10.10 |
7.06 |
6.27 |
5.85 |
5.45 |
|
Гидрофильные F кДж/моль |
Ала |
Арг |
Цис |
Глу |
Асп |
3.05 |
3.05 |
2.71 |
2.50 |
2.26 |
|
Гидрофильные F кДж/моль |
Тре |
Сер |
Гли |
Асн |
Глн |
1.84 |
0.17 |
0.00 |
-0.04 |
-0.42 |
|
Названия остатков: глицил, аланил, валил, лейцил, изолейцил (иле), фенилаланил (фен), пролил, тритофонил (три), серил (сер), треонил (тре), метионил (мет), аспарагинил (асп), глутаминил (глн), цистинил, аспаргил, глутамил (глу), тирозил, гистидил (гис), лизил (лиз), аргинил (арг).
Гипотеза об определяющей роли гидрофобных взаимодействий была доказана в 1944 году. Идея состояла в том, что гибкая молекула белка в воде сворачивается в глобулу (поскольку полярные остатки белка стремятся к максимальному контакту с водным окружением, а неполярные - к минимальному контакту). Из геометрии известно, что минимальной поверхностью при заданном объеме обладает шар. Стремление неполярных остатков образовать внутри белковой части некое подобие шарообразной капли, а полярных - сосредоточиться на ее поверхности, и приводит к образованию компактного тела - глобулы с гидрофобным ядром и гидрофильной поверхностью.
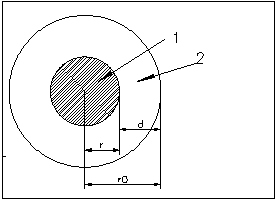
1 - гидрофобное ядро
2 - гидрофильная оболочка
В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных остатков к неполярным, можно предсказать форму глобулы. Для простоты будем считать, что все остатки имеют одинаковые объемы. Найдем отношение числа полярных остатков к неполярным, которое обозначим bs. Будем считать , что радиус глобулы r0, и глобула покрыта мономолекулярным слоем полярных остатков толщиной d (Фишер считал, что d~4-5A). При сделанных допущениях отношение числа полярных и неполярных остатков равно отношению объемов сферического слоя и центрального ядра:
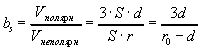
Следовательно, чем меньше r0, тем больше должна быть относительная гидрофильность белка. На рисунке приведена теоретическая кривая (кривая Фишера) значений параметра b от объема глобулы (V=4/3r03), а также экспериментальные значения.
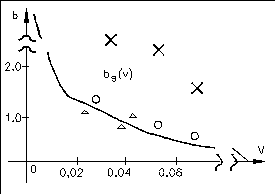
Глобула может быть сферической, строго говоря, лишь при b=bs (соответствует кривой Фишера на графике). Если b>bs, то есть число полярных остатков в белке больше, чем необходимо для того, чтобы покрыть гидрофобное ядро гидрофильным слоем, то глобула вытягивается в виде эллипсоида и имеет большую поверхность, чем в случае сферы.

b>>bsвозникают фибриллярные структуры ( обозначено x на графике)
b<bsгидрофильные остатки не полностью закрывают гидрофобное ядро и гидрофобное взаимодействие между такими открытыми участками приводит к агрегации белков и возникновению надмолекулярных структур (обозначено на графике).
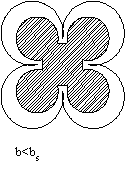
Таким образом, белки, для которых значения b лежат выше кривой Фишера, представляют собой эллипсоиды и фибриллы, значения лежат на кривой представляют собой глобулы. Под кривой располагаются белки, образующие надмолекулярную структуру. Формирование гидрофобного ядра в глобулярных белках имеет принципиальное значение для их функционирования. Белки при их огромной молекулярной массе обладают сравнительно компактной структурой прежде всего, благодаря гидрофобным взаимодействиям.
линейные молекулы (нуклеиновые кислоты, полипептиды), претерпевающие переход спираль — клубок, разбиваются на чередующиеся спиральные и клубкообразные участки (рис. 3).
Переход спираль — клубок в ДНК наблюдается при повышении температуры, добавлении в раствор кислоты или щёлочи, а также под влиянием других денатурирующих агентов. Этот переход в гомополинуклеотидах происходит при нагревании в интервале десятых долей °С, в фаговых и бактериальных ДНК — в интервале 3—5°С (рис. 3), в ДНК высших организмов — в интервале 10—15 °С. Чем выше гетерогенность ДНК, тем шире интервал перехода и меньше способность молекул ДНК к ренатурации. Переход спираль — клубок в различных видах РНК носит менее кооперативный характер (рис. 4) и происходит в более широком интервале температурных или других денатурирующих воздействий.
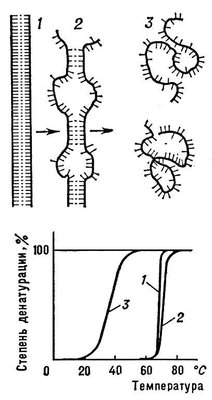 Рис.
3. Схема перехода спираль — клубок для
ДНК: 1 — нативное состояние (вместо
двойной спирали для простоты изображена
«верёвочная лестница»); 2 — состояние
ДНК в области перехода; 3 — денатурированное
состояние (однонитевые клубки).
Рис.
3. Схема перехода спираль — клубок для
ДНК: 1 — нативное состояние (вместо
двойной спирали для простоты изображена
«верёвочная лестница»); 2 — состояние
ДНК в области перехода; 3 — денатурированное
состояние (однонитевые клубки).
