
- •Лабораторная работа Определение точной концентрации раствора NaOh
- •Лабораторная работа Определение точной концентрации раствора NaOh
- •Лабораторная работа Определение кислотности молока
- •1. Результаты эксперимента занесите в таблицу
- •Лабораторная работа
- •Лабораторная работа Определение концентрации щелочи методом кондуктометрического титрования
- •Лабораторная работа Определение концентрации щелочи методом рН-метрического титрования
- •Лабораторная работа Определение концентрации кислоты методом рН-метрического титрования
Лабораторная работа Определение кислотности молока
О свежести молока судят по его кислотности, которую устанавливают титриметрическим методом и выражают в условных градусах Тернера (°Т). Градус Тернера – это объем 0,1 н. водного раствора NaOH, необходимый для нейтрализации 100 мл молока (измеряется в мл).
Кислотность свежего молока обусловлена содержанием в молоке белков, кислых солей, органических кислот и составляет 16÷18 °Т (это означает, что на нейтрализацию 100 мл молока потребовалось 16÷18 мл 0,1 н. NaOH); кислотность же меньше 16 °Т свидетельствует о заболевании животного или фальсифицировании молока (добавление соды, аммиака и др.). При хранении молока его кислотность возрастает, что связано с накоплением молочной кислоты в процессе жизнедеятельности молочнокислых бактерий.
Реактивы: раствор NaOH с точно известной концентрацией (Cэ = …. моль/л)
раствор индикатора фенолфталеина
Выполнение работы:
1. Запишите значение молярной концентрации эквивалента гидроксида натрия (данные возьмите у студентов, выполнявших лабораторную работу «Определение точной концентрации раствора NaOH»).
2. Отберите пипеткой 10 мл молока и перенесите в коническую колбу на 100 мл. Добавьте в эту колбу 20 мл дистиллированной воды и 2-3 капли раствора фенолфталеина. Круговым вращением колбы тщательно перемешайте содержимое колбы.
3. Заполните бюретку раствором щелочи. Установите уровень жидкости на нулевой отметке.
4. Титруйте содержимое колбы раствором щелочи при непрерывном перемешивании до появления розовой окраски, не исчезающей в течение 1 мин. Запишите объем щелочи, пошедший на титрование.
5. Выполните п. 2–4 несколько раз до получения трех сходящихся результатов (отличие в объеме щелочи не должно превышать 0,1 мл).
Оформление работы:
1. Результаты эксперимента занесите в таблицу
№ титрования |
V(молока), мл |
V(NaOH), мл |
(NaOH), мл |
Cэ(NaOH), моль/л |
Х, Т° |
1 |
10 |
|
|
|
|
2 |
|
||||
3 |
|
||||
… |
|
Рассчитайте кислотность молока Х по формуле
Х =
![]() ,
,
где Cэ(NaOH) – нормальная концентрация раствора NaOH, взятого для титрования (моль/л)
V(NaOH) – объем раствора NaOH, пошедший на титрования 10 мл молока (мл)
0,1 – нормальная концентрация раствора NaOH, которая, исходя из определения понятия «градус Тернера», необходима для титрования 10 мл молока (моль/л)
10 – коэффициент пересчета на 100 мл молока
2. По значению кислотности молока сделайте вывод о его свежести.
3. Вычислите массовую долю молочной кислоты в молоке по формуле
ω = Х·0,009,
где 0,009 – масса молочной кислоты в молоке с кислотностью 1 Т°.
Лабораторная работа

Лабораторная работа Определение концентрации щелочи методом кондуктометрического титрования
Реактивы: раствор соляной кислоты HCl (или серной кислоты H2SO4) с точно известной
концентрацией (Cэ = …. моль/л)
раствор гидроксида натрия NaOH (титрант)
Выполнение работы:
1. Запишите значение молярной концентрации эквивалента используемого для работы раствора кислоты.
2. В компьютере в папке Мои документы добавьте папку Э 9-41 или Э 9-42 (если таковая отсутствует)
3. Соберите установку (если она не собрана лаборантом):
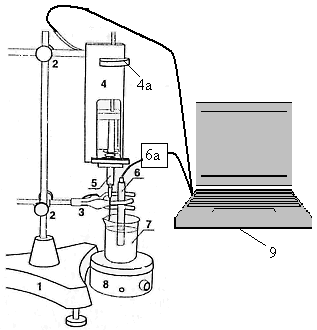
1 – штатив, 2 – муфты, 3 – лапка, 4 – датчик объема жидкого реагента, 4а – металлический диск, 5 – шприц,
6 и 6а – датчик электропроводности, 7 – химический стакан, 8 – магнитная мешалка, 9 – компьютер
Переключите датчик электропроводности (6а) на диапазон 0,5–5 мСм/см.
4. Отмерьте пипеткой 4 мл раствора кислоты с точно известной концентрацией, перенесите в химический стакан (7) и добавьте в него дистиллированной воды примерно до метки 80 мл (или 100 мл). Опустите в стакан магнит, покрытый тефлоновой оболочкой. Поставьте стакан на магнитную мешалку (8). Погрузите в раствор чистый (при необходимости промойте дистиллированной водой) датчик электропроводности (6).
5. В шприц (5) на 20 (или 10) мл наберите раствор гидроксида натрия, точную концентрацию которого необходимо определить. Доведите объем раствора в шприце до точной отметки 20 мл (или 10 мл) таким образом, чтобы в шприце не было пузырька воздуха. Вставьте шприц в датчик объема жидкого реагента (4). Подведите толкатель в датчике объема жидкого реагента путем вращения металлического диска (4а) к поршню шприца так, чтобы из иглы показалась капля раствора. Поместите закрепленный шприц в химический стакан таким образом, чтобы его игла располагалась над раствором кислоты и не касалась никаких предметов.
6. Включите магнитную мешалку, отрегулируйте вращение и положение магнита (чтобы не было выброса раствора из стакана, а также, чтобы магнит не соприкасался со стенками стакана и датчиком электропроводности).
7. На компьютере двумя щелчками левой кнопки мыши входят в программу L-химия-практикум. Затем также двумя щелчками левой кнопки мыши переходят на вкладки выбор работы → титрование → 1 параметр → выбирают интервал электропроводности 0,5–5 мСм/см → автоматическое определение объема титранта → настройка оборудования → сначала задают в мл объем шприца 20, затем в см длину шприца 63 (если использовали шприц на 10 мл, то соответственно вводите числа 10 и 49) → выход → проведение измерений → пуск (на экране монитора число в правом верхнем углу характеризует значение электропроводности раствора, а число в правом нижнем углу – объем титранта) → запоминаете нулевую точку нажатием кнопки выбор.
8. Вращением металлического диска на датчике объема жидкого реагента из шприца добавьте примерно 0,4÷0,5 мл раствора щелочи (смотрите на экран монитора в правом нижнем углу). Нажмите также двумя щелчками левой кнопки мыши на экранную кнопку выбор. Затем вновь введите примерно 0,4÷0,5 мл раствора щелочи и нажмите на экранную кнопку выбор. Данную операцию повторяйте до тех пор, пока не введете около 3,5 мл раствора щелочи. После этого проведите аналогичные манипуляции, но только добавляя по 0,05÷0,1 мл щелочи. И так до тех пор, пока значение электропроводности не будет устойчиво расти.
9. Остановите измерения нажатием экранной кнопки стоп (на графике появляется вертикальная желтая линия) → архив → задайте имя файла (свою фамилию и название лабораторной работы) и сохраните его в папке Э 9-41 или Э 9-42, находящейся в папке Мои документы → сохранить → выход (выйти из программы).
10. Повторите п.4–9 несколько раз до трех сходящихся результатов (одинаковый объем титранта в точке эквивалентности,– на графике соответствует точке перегиба).
Оформление работы:
1. Откройте сохраненный Вами файл и перепишите экспериментальные данные: первый столбец соответствует объему добавленного титранта, второй – электропроводности при этом объеме (или перенесите данные в программу Excel).
2. Постройте на миллиметровке (или с помощью Excel) график зависимости электропроводности от объема титранта.
3. По графику определите объем титранта, соответствующий точке эквивалентности (точка перегиба зависимости κ = f(Vтитранта)).
4. Запишите уравнение титриметрической реакции
5. Рассчитайте молярную концентрацию эквивалента гидроксида натрия по формуле
Сэ(NaOH)
=
![]()
.
