- •Диаграммы состояния и их значение при кристаллизации сплава в сварном соединении.
- •Фазовые превращения в стали при нагреве и охлаждении.
- •Влияние легирующих элементов на процессы, протекающие в сталях при сварке.
- •Термическая обработка сварных соединений.
- •Назначение и выбор вида термической обработки сварных конструкций.
- •Свариваемость сталей.
- •Особенности сварки сталей.
- •Изностойкий наплавленный металл.
- •Классификация сталей
Основы металловедения неразъемных соединений
Курс лекций.
6 семестр
Кафедра ОиТСП
Разработал: Семенова Ирина Петровна
Введение.
Основными процессами, определяющими формирование и свойства сварных соединений, являются металлургические и металловедческие процессы.
Кристаллическое строение сварного соединения, свойства образующихся в нем сплавов, которые определяют механические и эксплуатационные свойства самого соединения, полученного различными способами, объясняется законами металловедения.
Большинство способов сварки связаны с нагревом металлов в широком диапазоне температур и последующем охлаждении. В зоне сварного соединения протекают сложные структурные и фазовые изменения, которые определяют прочность, пластичность, вязкость, коррозионную стойкость соединения. Эти явления связаны с диффузионными закономерностями. Знание этих процессов необходимы для рационального построения технологии сварки и получения высоких свойств сварных соединений.
Особое место в обеспечении работоспособности сварных соединений занимает их термическая обработка, условия которой определяются с одной стороны составом свариваемых металлов, с другой стороны, условиями эксплуатации.
Из истории: Ломоносов – о металлах(которые коваться могут), Аносов Павел Петрович- 1797-1851г.- основоположник учения о стали,метааллургии стали,первый микроскоп, исследовние структуры и свойств стали, Обухов Павел Матвеевич-выпуск высококачественных сталей,Чернов Дмитрий-диаграммы состояния стали, роль термообработки, первая металлограф.лаборатория.
Физическое строение металлов:
Металлическая связь – связана со строением внешних оболочек атомов металлов. На внешней оболочки атома металла имеются только один или 2 электрона, поэтому их связь не очень сильная и они могут сравнительно легко отделяться от атома. Это приводит к тому, что эти электроны беспорядочно блуждают между положительными ионами, причем часть атомов может быть неионизирована.
При наложении внешней разности потенциалов создается упорядоченное движение электронов от – к +. Этим объясняется хорошая проводимость металлов.
Прочность связи электрона с атомом определяется энергией выхода электрона и потенциалом ионизации. Используя эти справочные данные можно судить о способности металлов к образованию сварного соединения при надлежащем контакте в результате установления электронного обмена и создания металлической связи.
Элемент Al Ti Fe
Потенциал ионизации, эВ 5,98 6,82 7,87
Энергия выхода электр., эВ 4,20 4,10 4,70
Помимо атомного строения при сварке плавлением или давлением большое значение имеет кристаллическое строение металлов, которое также определяет взаимодействие соединяемых металлов.
Кристаллическое строение металла – это закономерное и однотипное расположение атомов данного элемента, образующие кристаллическую решетку. У металлов рапространениы 3 типа решеток: ОЦК, ГЦК и ГПУ. (рис.1)
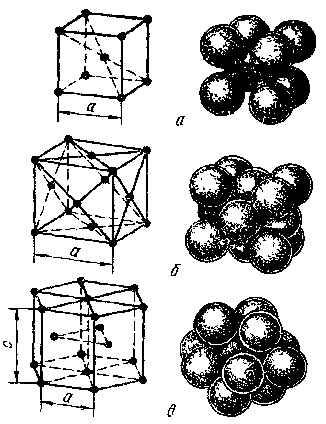
Рис. 1 Элементарные ячейки ОЦК (а), ГЦК (б) и ГП (в) решеток
У некоторых металлов характер решетки может меняться в зависимости от температуры. Это связано с изменением энергетического состояния атомов при нагреве и охлаждении. Такое свойство металла называется полиморфизм. Например, Fe : ОЦК ---ГЦК; Ti ГЦК ---ГПУ.
Для кристаллических решеток различных металлов характерно различное расстояние между атомами, которые образуют базовую геометрическую фигуру. Эти расстояния называют параметрами решетки.
При сварке разнородных металлов очень важно различия атомно-кристаллического строения соединяемых металлов. Это означает, что атомы одного металла способны энергетически благоприятно располагаться в решетке другого металла. Признаком такой близости являются параметры решетки и их соответствие.
Однако реальные металлы всегда имеют несовершенства кристаллической решетки (рис.2 и3):
Они определяют механические свойства металлов, их способность сопротивляться воздействию внешних сил. Они возникают в результате смещения или удаления атомов со своих мест в решетке: это вакансии, межузельные атомы, дислокации, границы зерен. Наиболее важным видом несовершенства являются дислокации, которые движутся под воздействием внешних сил. Дислокации, как и другие несовершенства кристаллического строения, появляются в процессе кристаллизации.
Кристаллизацией называется переход металла из жидкого состояния в твердое с образованием кристаллической структуры. Затвердевание происходит путем образования центров кристаллизации (зародышей) и их роста.
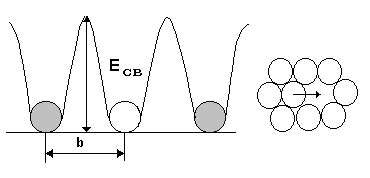
Рис.2 .Схема образования вакансии. Рис. 3. Схема образования дислокации при сдвиге
Плавление металла, сварочная ванна.
Металлы – кристалличенские вешества. Строго определенное расположение атомов обусловлено их энергетическим состоянием и соответственно минимумом свободной энергии атомом. Свободная энергия F системы определяется по формуле
F=U -T * S (1.1)
Свободная энергия любой системы атомов с повышением температуры уменьшается с определенной скоростью.
При повышении температуры энергетическое состояние металла приближается к энергетическому состоянию расплава. И при температуре То свободная энергия расплава ниже, чем у твердого металла. При этой температуре могут сосуществовать как жидкое, так и твердое состояние металла..

Рис.4 Зависимость свободной энергии от температуры для жидкой и кристаллической фазы.
Таким образом, чтобы достигнуть полностью жидкого состояния, необходимо перегреть на ∆Т (разница свободной энергии ∆ Fп). Металл казалось, теряет свое кристаллическое строение, однако, даже в жидком состоянии сохраняется определенный порядок расположения атомов. В структуре увеличивается количество вакансий. С дальнейшим повышением температуры в расплаве сохраняются группировки закономерно расположенных атомов. При некотором переохлаждении ниже То они станут естественными или самопроизвольными центрами кристаллизации. Таким образом, условия плавления влияют на процесс последующей кристаллизации и свойства сварного шва.
Влияние неметаллических включений и карбидов на кристаллизацию сплава.
Примеси в сплаве могут быть центрами несамопроизвольной кристаллизации.
На практике несамопроизвольную кристаллизацию используют для модификации – измельчения кристаллитов при затвердевании.
Однако модифицирующее действие сохраняется только в Ом случае, когда они не растворяются в сварочной ванне. Наибольший интерес в этом случае представляют собой тугоплавкие и труднорастворимые включения. Например карбиды. (см. таблицу 1)
Таблица 1 Температуры растворения карбидов различных элементов при нагреве стали в твердом состоянии.
Элемент, образующий карбид |
Fe |
Cr |
W |
V |
Температура растворения карбида, оС |
720 |
1100 |
1300 |
1200 |
При быстром нагреве, небольших степенях перегрева, малой продолжительности существования сварочной ванны наиболее тугоплавкие карбиды могут сохраниться.
В основном металле и в сварном шве могут находиться также нитриды.
Большое влияние на кристаллизацию могут оказать неметаллические включения, которые попадают из флюсов и электродных покрытий (CaO, MgO, SiO2) или могут быть продуктами раскисления ванны (SiO2, MnO, Al2O3,TiО2), частичками шлака ( 2FeO*Sio2, 2Mno*SiO2, MnS, FeS )и др. Температуры плавления неметаллических примесей приведены в таблице 2.
Таблица 2 Температуры плавления неметаллических примесей.
Соединение |
FeO |
MnO |
Cr2O3 |
SiO2 |
Al2O3 |
TiО2 |
ZrO2 |
Тпл., оС |
1360 |
1700 |
1960 |
1670 |
2050 |
2123 |
2900 |
Средняя температура сварочной ванны при дуговой сварке (ручная автоматическая под флюсом, в защитных газах) составляет 1600-1900оС:
-наиболее низкая- для дуговых в защитных газах,
- наиболее высокая – для автоматической сварки под флюсом. Температура в ванне под дугой доходит до 2300оС, однако продолжительность пребывания ванны при этой температуре крайне мала, что не обеспечивает растворения наиболее тугоплавких примесей.
Продолжительность существования сварочной ванны при различных видах и режимах сварки существенно различается. Для указанных выше видов она составляет не более 1-2 мин и может быть оценена по формуле: td=Ld/vcd
Где td- средняя продолжительность существования сварочной ванны; Ld-длина сварочной ванны; vcd-скорость сварки.
Исходя из сказанного, следует, что при больших степенях перегрева в сварочной ванне очень мало естественных центров кристаллизации.
Наличие искусственных центров кристаллизации будет зависеть от состава свариваемого материала и присадочной проволоки, условий сварки. Возникающие в сварочной ванне конвективные потоки под воздействием газодинамической и электромагнитной сил должны приводить к рассредоточению нерастворившихся тугоплавких частиц.
Закономерности кристаллизации и формирован
ия первичной структуры сварного шва.
Для того, чтобы начался процесс кристаллизации, необходимо отклонение от равновесной температуры То, т.е. переохлаждение ∆Т, при этом свободная энергия изменится на ∆ F . Повлиять на степень переохлаждение можно путем изменения скорости охлаждения металла, увеличение которой приводит к возрастанию ∆Т. (рис.5)
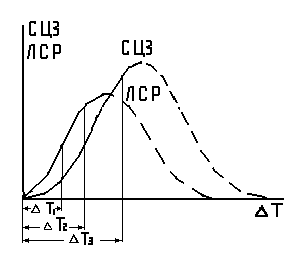
Рис. 5 Зависимость параметров кристаллизации от степени переохлаждения (∆Т): ЛСР – линейная скорость роста размера зародышей; СЦЗ – количество центров кристаллизации.
Роль степени переохлаждения при кристаллизации сводится к тому, что в жидком металле увеличивается устойчивость образований атомов, создающих зародыши при самопроизвольном процессе.
При этом способность зародыша быть центром кристаллизации является его размер R.
Только после достижения критического размера зародыш станет устойчивым и начнет расти, вызывая снижение свободной энергии. При этом критический размер зародыша уменьшается с увеличением степени переохлаждения, что приводит к созданию условий для образования большего числа зародышей (рис. 5).
Рассмотренные закономерности касаются естественных центров кристаллизации – зародышей образовавшихся из расплава. В расплаве сварочной ванны, как мы уже говорили, существуют искусственные центры- различные включения. Наиболее лучшими такого рода частицами служат вещества, кристаллическая решетка которых по типу и параметрам решетки близка к решетке кристаллизующегося металла. Поскольку искусственные центры уже существуют в жидком металле и на их образование не требуется дополнительных затрат энергии, для кристаллизации на них требуется меньшая степень переохлаждения.
Рассмотренные выше закономерности кристаллизации определяют характер строения сварных швов. Основными элементами являются кристаллиты (дендриты) (рис.6)
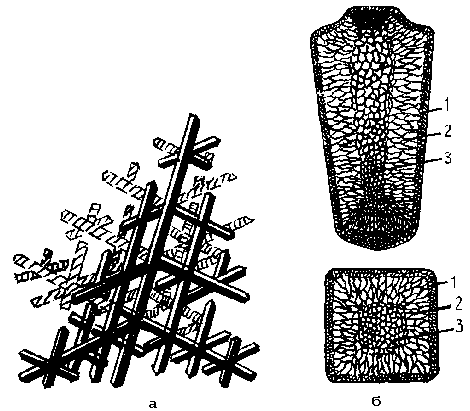
Рис. 6.Схема роста дендрита (а) и строения слитка: 1- зона мелких кристаллов, 2-зона столбчатых кристаллов, 3- зона равноосных кристаллов.
В реальных условиях металл кристаллизуется в ограниченном пространстве с холодными стенками. В этом случае рост основной оси дендрита будет расти перпендикулярно поверхности кристаллизации. Подрастающий ствол со временем сам становится элементом отвода тепла и от него в разных местах начинают расти ветви второго, третьего и т.д.порядка с определенной кристаллографической ориентацией. При столкновении твердых поверхностей постройка кристаллита завершается (рис.6). При наличии многих центров кристаллизации растет много дендритов, их поверхности сталкиваются, мешая дальнейшему росту. Форма кристаллов становится неправильной, а благодаря различной ориентации поликристаллический металл становится более однородным (изотропным).
Химическая однородность.
Одной из основных особенностей дендритного строения литого металла является неоднородность состава по сечению дендрита. Первые порции кристаллизующегося металла наиболее чистые (содержат меньше примесей). Оси дендритов значительно меньше загрязнены примесными атомами по сравнению с межосными пространствами. Такое различие в содержании примесей в металле осей дендритов и межосных участков называют дендритной ликвацией. Поскольку процесс перемещения атомов примеси диффузионный и связан со временем, степень дендритной ликвации зависит от скоростей кристаллизации и охлаждения. В большей степени к ликвации склонны углерод, сера. Фосфор, в меньшей – кремний, марганец, хром, молибден, вольфрам.
Особенности кристаллизации и кристаллического строения сварных швов при сварке плавлением.
На рис. 7 представлена схема мгновенного состояния сварочной ванны.
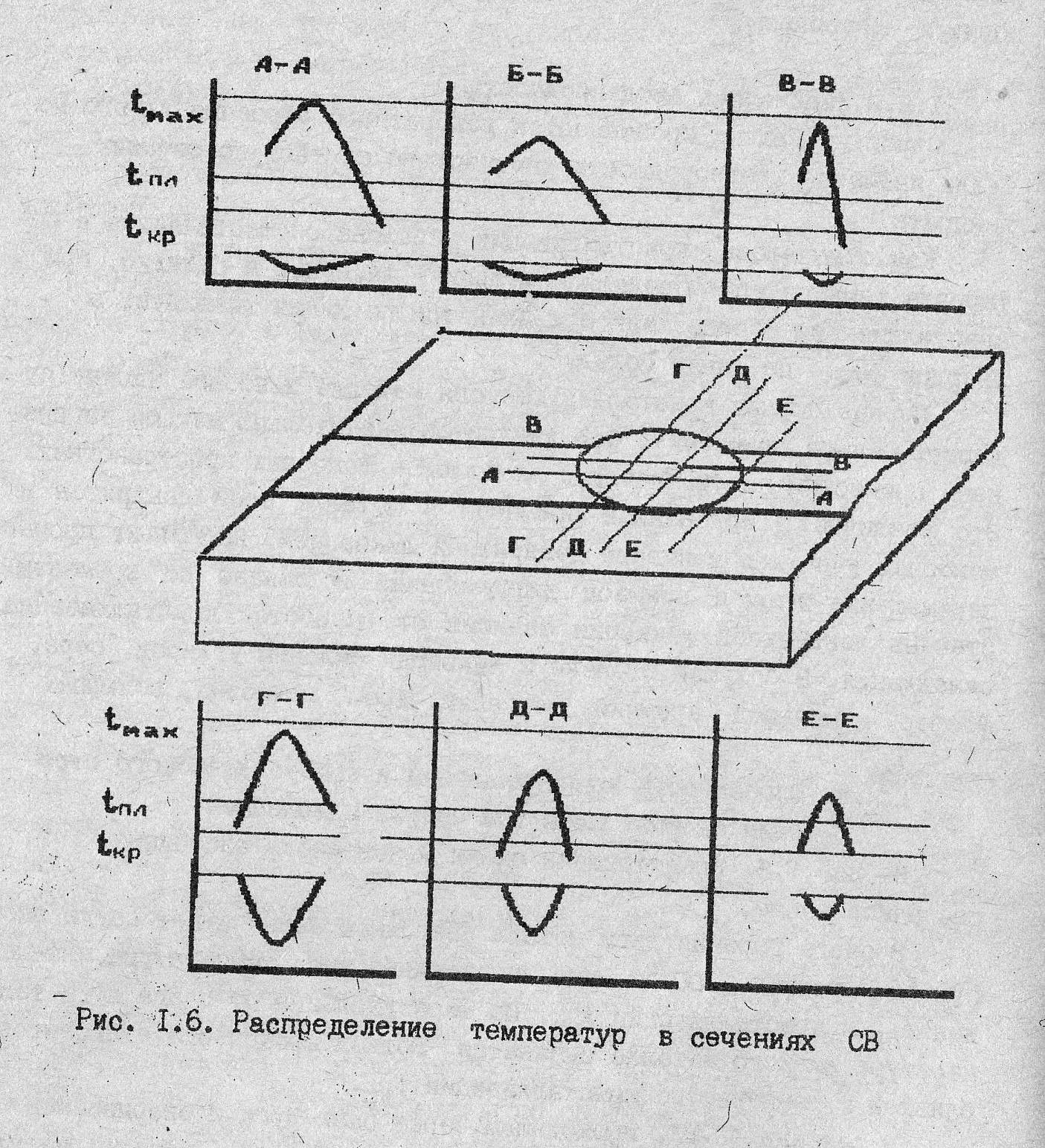
Рис. 7. Распределение температур в сечениях сварочной ванны.
В очаге горения дуги металл сварочной ванны имеет самую высокую температуру 2300 оС, что значительно выше температуры плавления tпл и кристаллизации tкр. По мере удаления от очага дуги температура жидкого металла снижается. Вблизи кромок она становится близкой к температуре кристаллизации tкр.
В сечение «Г-Г», проходящем через очаг дуги и свариваемые кромки, температура жидкого металла на границе с твёрдым металлом выше, чем в сечениях «Д-Д», «Е-Е», лежащих ближе к хвостовой части ванны. В соответствии с этим рост кристаллов на кромках в зоне максимальной температуры tmax. Если мгновенно прекратить сварку, то характер кристаллизации будет соответствовать схеме, изображённой на рис. 8.:
-рост кристаллов начинается с закристаллизовавшейся поверхности металла шва;
-кристаллы из хвостовой части вытягиваются вдоль оси шва, они имеют большую протяжность;
-размеры кристаллов, растущих с боковых поверхностей, и угол их наклона к оси шва зависят от толщины свариваемого материала, его теплофизических свойств, скорости и режима сварки и др.
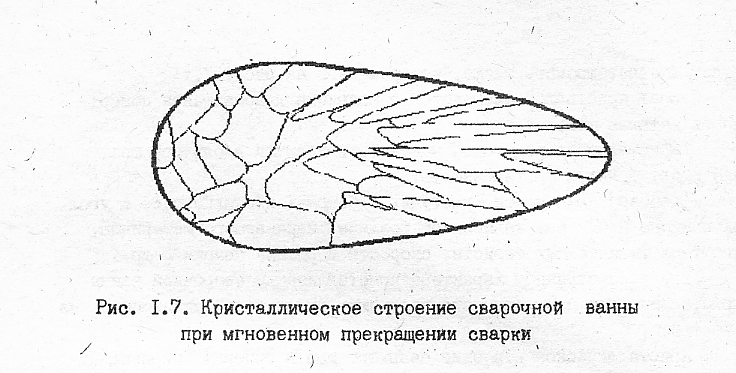
Рис. 8 Кристаллическое строение сварочной ванны при мгновенном прекращении сварки
При рассмотренном характере кристаллизации сварочной ванны кристаллическое строение сварного шва имеет вид, показанный на рис. 9.

Рис. 9. Кристаллическое строение сварочного шва в продольном сечении
Кристаллическое строение сварного шва в сечении, перпендикулярном его оси, может различаться в зависимости от условий сварки (рис. 10):
при сравнительно малой продолжительности существования сварочной ванны (малый объём ванны, повышенная скорость сварки) столбчатые кристаллы могут расти до встречи в области центральной линии шва (рис. 10.а);
при большой ванне и медленной её кристаллизации в центральной части шва образуется небольшая зона равновесных кристаллов, возникших в условиях естественной кристаллизации (рис. 10. б);
при сварке на охлаждаемой металлической подкладке (рис. 10.в) на ней кристаллизуется тонкой слой мелких разориентированных кристаллов, становящихся зародышами для растущих столбчатых кристаллов;
при многослойной сварке (рис. 10.г) кристаллы каждого предыдущего слоя становятся основной для кристаллизации последующих слоёв, но так как скорость охлаждения каждого слоя больше скорости охлаждения ванны в целом (при однослойной сварке), то кристаллическое строение слоёв более мелкозернистое и с менее выраженной ликвацией примесей.
Следует отметить также явление прерывистости кристаллизации и ликвации. Замечено, что рост кристаллов идёт не непрерывно, а с периодическими остановками, которые названы тепловым эффектом (выделением теплоты) при переходе их жидкого состояния в твёрдое. При таком прерывистом росте слоёв кристаллизации сначала застывает наиболее чистый металл, а затем металл с большим содержанием примесей.
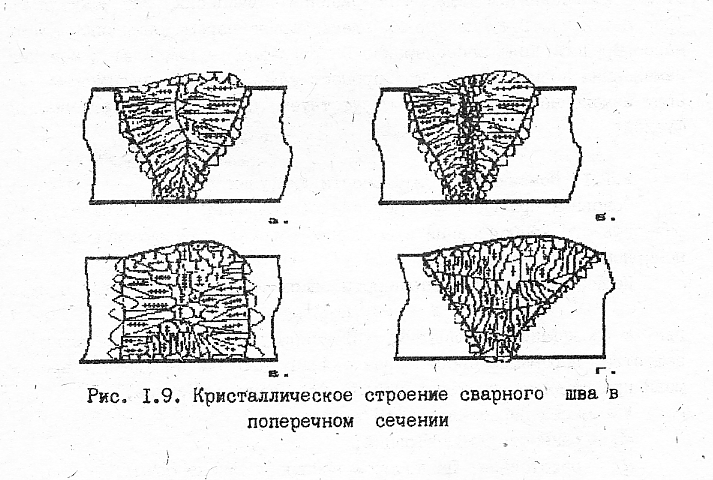
Рис. 10. Кристаллическое строение сварного шва в поперечном сечении
Диаграммы состояния и их значение при кристаллизации сплава в сварном соединении.
В промышленности чаще всего применяют не чистые металлы, а сплавы двух или нескольких элементов на основе какого-нибудь металла. Стали – это сплавы на основе железа, которые содержат углерод, марганец, кремний, никель, хром и другие элементы.
Путем термообработки можно в широких пределах изменять физические и механические свойства большей части металлических сплавов. При переходе жидкого однородного сплава в твердое состояние в нем могут происходить различные изменения, связанные с различными полиморфными превращениями, образованием твердых растворов различного состава. При этом растворение элементов друг в друге может быть неограниченно, частичное или вообще отсутствовать. Взаимодействие элементов происходит в зависимости от температуры. В ряде случаев составляющие сплава могут представлять между собой механические смеси, образовывать химические соединения. Важно, что каждая форма взаимодействия составляющих сплава по-своему влияет на свойства сплава и особенно его поведение при соединении сваркой, а после образования соединения – на механические свойства. Лучше всего свариваются материалы (элементы), дающие непрерывный ряд твердых растворов, хуже – дающие химические соединения и невзаимодействующие.
Диаграммы состояния представляют собой графическое изображение всех превращений, протекающих в сплавах в зависимости от температуры и концентрации компонентов. Превращения в сплавах при нагреве или охлаждении зависят от того, какие фазы при этом образуются. Так, однородная жидкость представляет собой однофазную систему, а жидкий сплав и находящиеся в нем кристаллы или механическая смесь кристаллов двух видов - двухфазную систему.
Различают четыре главных типа диаграмм состояния двойных сплавов: 1)механическая смесь; 2)твердый раствор с неограниченной растворимостью компонентов друг в друге; 3)твердый раствор с ограниченной растворимостью компонентов и 4) химическое соединение. Диаграммы состояния двойных сплавов строят в двух измерениях: по оси ординат откладывают температуру, а по оси абсцисс - концентрацию компонентов. Общее содержание двухкомпонентного сплава в любой точке абсциссы равно 100%, а крайние ординаты соответствуют чистым компонентам. Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре.
Диаграмма состояния системы с неограниченным растворением компонентов в твердом состоянии (1 тип). По этой диаграмме (рис.11) кристаллизуются сплавы, оба компонента которых неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
В отличие от чистых металлов, их сплавы кристаллизуются не при постоянной температуре, а в интервале температур и имеют разную температуру конца кристаллизации. Следовательно, состав фазы непрерывно изменяется. Верхняя кривая - линия ликвидус, а нижняя кривая - линия солидус. Выше ликвидуса сплав находится в однофазном жидком состоянии, а ниже линии солидуса - в однофазном твердом состоянии в виде твердого α -раствора. Между линиями ликвидус и солидус сплав находится в двухфазном состоянии (жидкая фаза и кристаллы твердого α -раствора).
Рассмотрим процесс кристаллизации сплава состава х-х. Cплав при температуре выше ta находится в жидком состоянии. При охлаждении сплава до температуры tб из жидкого сплава начинает выпадать кристалл твердого α-раствора. При температуре tб затвердевает последняя капля жидкого сплава. Линии, соединяющие составы фаз, находящиеся в равновесии, называют конодами.
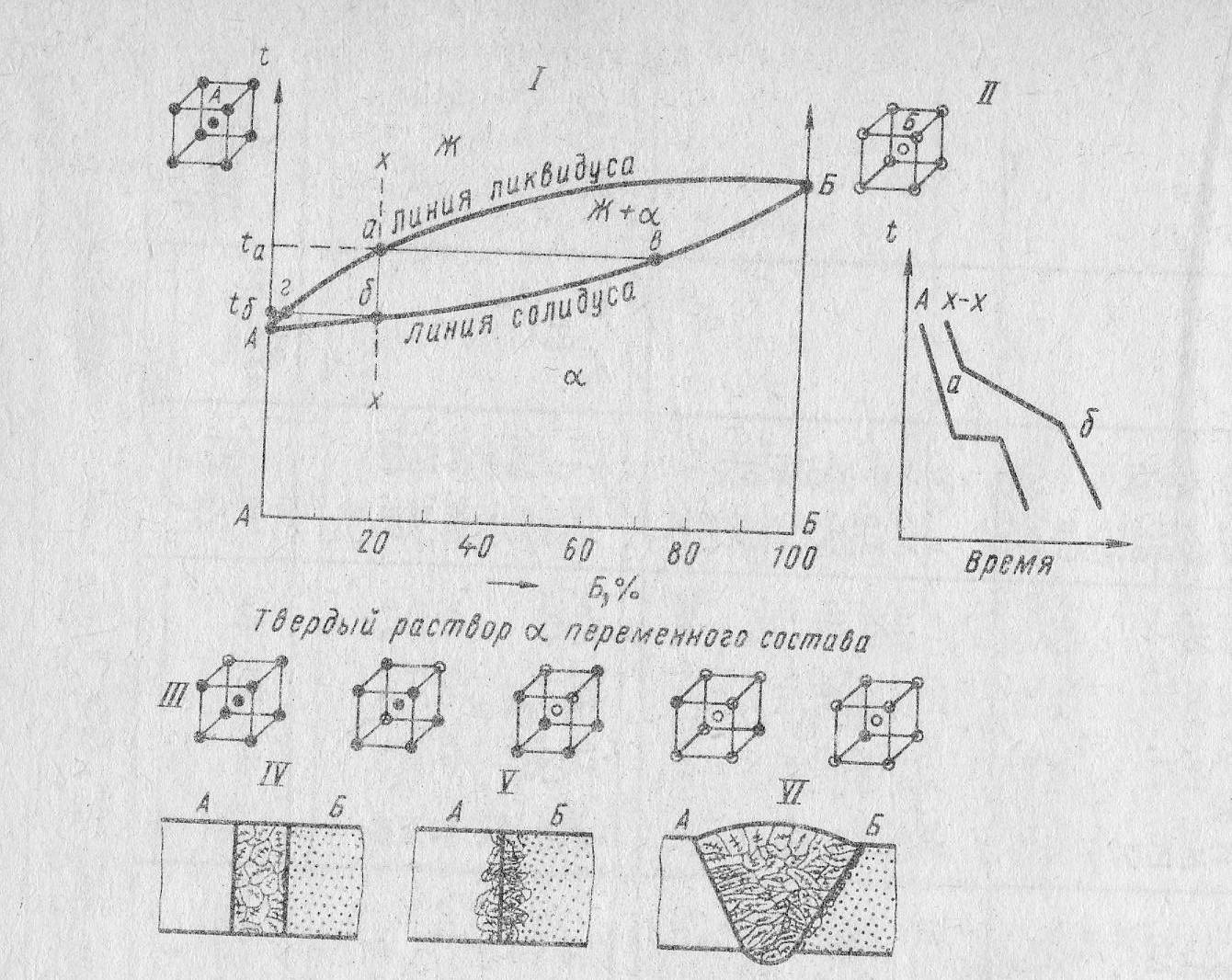
Рис. 11. Диаграмма состояния двухкомпонентной системы с полной растворимостью компонентов в твердом и жидком состояниях
Такого рода взаимодействие возможно для металлов с аналогичными типами кристаллических решеток и атомами близких размеров. Металлы, дающие сплавы такого типа должны соединяться различными видами сварки. После кристаллизации сварной шов представляет собой непрерывный ряд твердых растворов переменного состава.
Диаграмма состояния с полной нерастворимостью компонентов в твердом состоянии (2 тип).
По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, а в твердом - образуют механическую смесь.
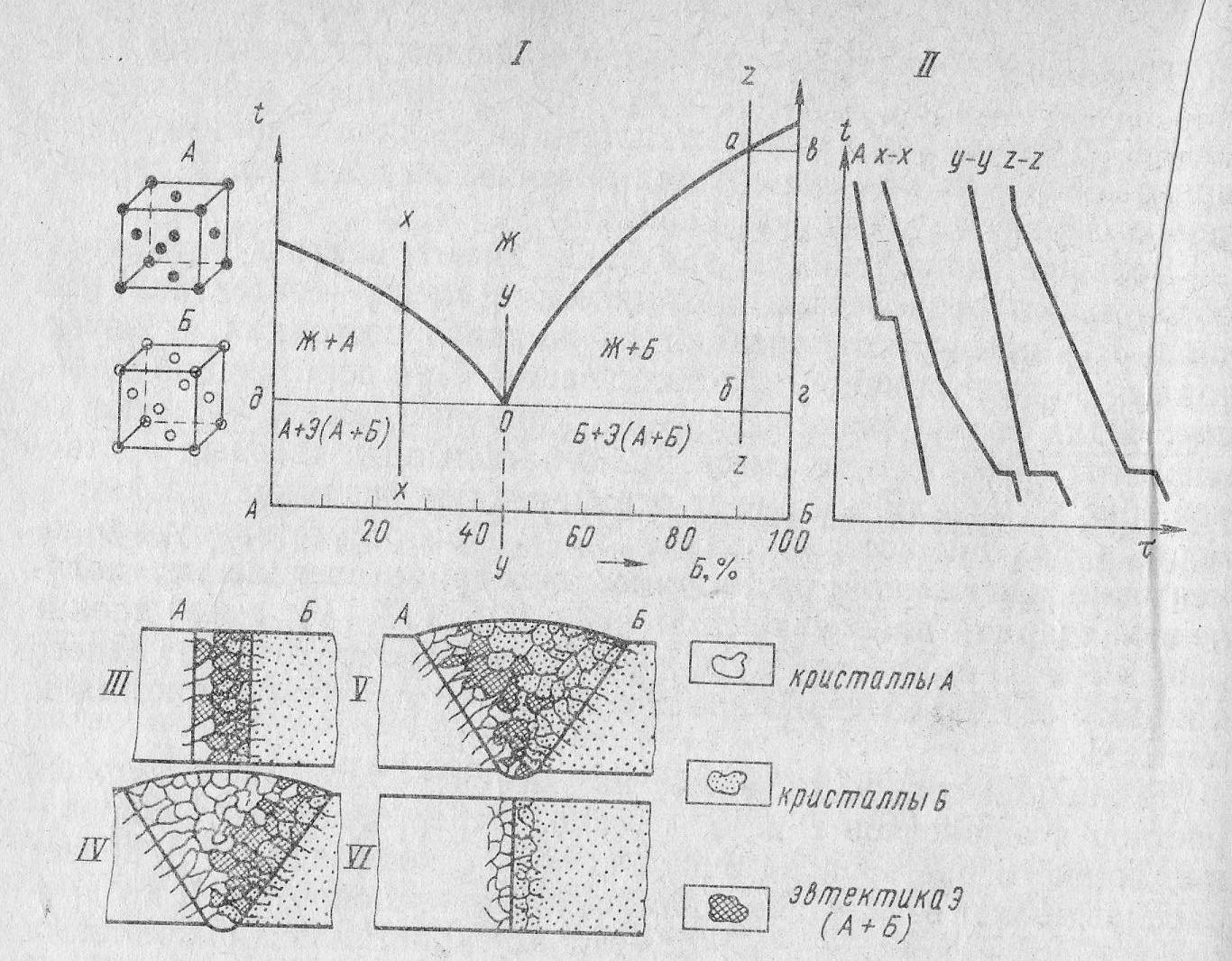
Рис. 12 Структурная диаграмма состояния сплавов с эвтектическим превращением.
Механическую смесь кристаллов двух видов, одновременно кристаллизующихся из жидкого сплава при постоянной температуре (точка д) эвтектикой. Сплавы, содержащие меньше 45% Б (точка у) называют доэвтектическими, а сплавы, содержащие больше 45% Б - заэвтектическими. В точке О кристаллизуется сплав эвтектической концентрации. Структура сплава состоит только из эвтектики.
При сварке плавлением микроструктура и фазовое состояние металла будут постепенно переходить от кристаллов одного металла с малым количеством эвтектики к кристаллам другого металла также с малым количеством эвтектики (рис. 12) Между этими зонами количество эвтектики будет постепенно увеличиваться, а где-то на промежуточном участке должна находится чисто эвтектическая зона. При данном типе диаграммы состояния свариваемых металлов хорошее сплавление металла шва с основными свариваемыми металлами обусловлено тем, что на кромках каждого металла надстраиваются зерна каждого металла. Для обеспечения работоспособности такого шва важно плавное изменение структуры и свойств в пределах сварного соединения.
Диаграмма состояния с полной растворимостью компонентов в жидком и ограниченной растворимостью в твердом состояниях (3 тип).
По этой диаграмме (рис. 13) кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, обладают ограниченной растворимостью в твердом состоянии и не образуют химических соединений.
Линия ликвидус аналогична предыдущей диаграмме и состоит из двух ветвей. Выше ликвидуса сплав находится в жидком состоянии. Линия солидус состоит из трех частей: левая и правая ветви и эвтектическая горизонталь. Ниже солидуса сплав находится в твердом состоянии. По левой ветви ликвидуса кристаллизуются твердый -раствор (Б в А), по правой - твердый -раствор (А в Б). Под левой ветвью солидуса существует область твердого -раствора, а под правой - твердого -раствора.
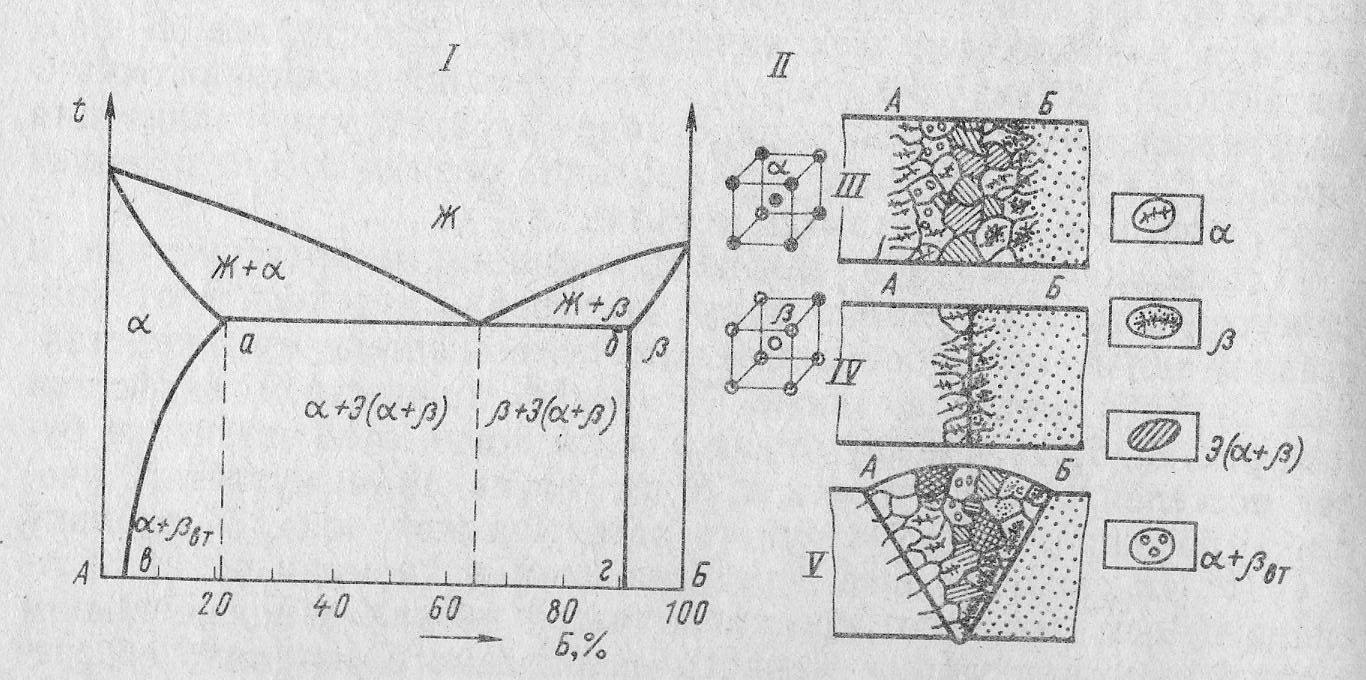
Рис. 13. Диаграмма состояния сплава с ограниченной растворимостью компонентов в твердом состоянии.
Для металлов, образующих эвтектические смеси, но имеющие взаимную ограниченную растворимость, механизм образования сварного соединения заметно изменяется. При сварке плавлением в сварочной ванне на кромках свариваемых металлов из жидкого расплава кристаллизуются не чистые металлы, а их твердые растворы. Эвтектическая смесь в такой системе состоит не из чистых металлов А и Б, а из ограниченных растворов.
Для металлов с таким типом диаграммы характерно также появление диффузионных зон на границе соединения. Образование диффузионных зон связано с тем, что в металл А проникает (диффундирует) некоторое количество атомов Б. Точно также в металл Б будет диффундировать некоторое количество атомов А.
Диаграмма состояния с образованием устойчивого химического соединения (4 тип).
По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, а при затвердевании образуют устойчивое химическое соединение.
Диаграмма состояния сплава А и Б приведена на рисунке 14. Линия СGHМ соответствует химическому соединению С и разделяет диаграмму состояния на две части. Если условно химическое соединение принять за отдельный компонент системы, то диаграмму состояния можно разделить на две диаграммы: А - С и С - Б Каждая из них представляет собой диаграмму состояния 2 типа. Возможны и другие случаи, например, когда одна часть диаграммы представляет диаграмму состояния 2 типа, а вторая - 3 типа и др.
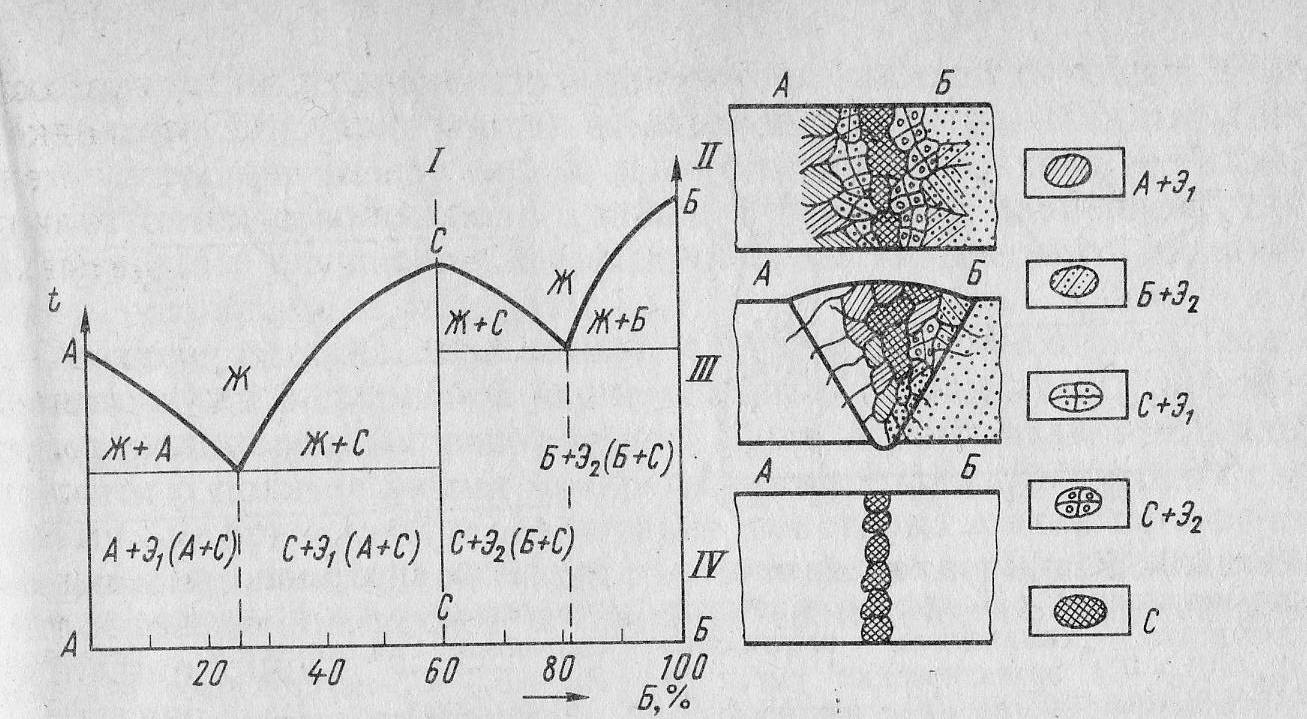
Рис. 14. Диаграмма состояния сплава с образованием химического соединения.
Химическое соединение, образующиеся из атомов А и Б, может иметь абсолютно другую кристаллическую решетку. Поэтому его свойства будут радикально отличаться от свойств металлов А и Б. Очень часто химические соединения двух мягких и вязких металлов оказываются твердыми и хрупкими (например, железа с алюминием). В этой связи особенно важно учитывать возможность образования химических соединений в сварных соединениях.
Для всех типов диаграмм состояния с образованием химического соединения характер строения металла шва очень схожий, с той лишь разницей, что у кромок в случае отсутствия взаимной растворимости будут находится кристаллы чистых металлов А и Б. А в случае ограниченных растворов – соответственно α-кристаллы (раствор С в А) и β-кристаллы (раствор С в Б). Вдали от кромок могут также появиться кристаллы А в С и Б в С.
Основное влияние на свойства сварного шва оказывает зона кристаллов химического соединения, подчас со свойствами, резко отличающимися от свойств близлежащих кристаллов. Такая неоднородность свойств может отрицательно сказаться на работоспособности сварного шва.
На практике часто приходится иметь дело со сваркой не только чистых металлов, но и сплавов. Рассмотрение диаграмм состояния при сплавлении трех и более компонентов более сложное. Однако в сварных соединениях сплавов также могут существовать твердые растворы нескольких компонентов, эвтектические или эвтектоидные смеси, химические соединения. Характер кристаллизации и изменение свойств при сварке сплавов близок характеру кристаллизации и изменения свойств чистых металлов.
Особенности диффузионных процессов при сварке.
Диффузия в металлах и сплавах – это элементарные процессы перемещения атомов кристаллического вещества на расстояние больше параметров кристаллической решетки.
Наиболее вероятный механизм диффузии связан с перемещением атомов по незанятым узловым положениям – вакансиям или междоузлиям (рис.15). В сумме такие элементарные перемещения определяют массоперенос. Если массоперенос направлений и приводит к местным изменениям концентрации, то перенос называют гетеродиффузией, а если изменение концентрации отсутствует, процесс называют самодиффузией.

а) б)
Рис. 15.Схема механизма перемещения атомов при диффузии по вакансиям (а) и по междоузлиям (б).
Очень большое значение процессы диффузии имеют при сварке. Например, при сварке плавлением, процессы диффузии влияют на степень химической и механической неоднородности металла шва и сварного соединения. Особенно большое значение процессы гетеродиффузии имеют для формирования сварных соединений разнородных сталей или сплавов, так как обычные закономерности диффузионного процесса осложняются специфическими условиями диффузии – реакционной диффузией и диффузией, вызванной влиянием состава на изменение термодинамической активности растворенного и диффузионной вещества.
Основные закономерности диффузии.
Основной параметр диффузии – скорость переноса массы перемещающегося элемента через единицу площади сечения за единицу времени. Основной причиной перемещения растворенного вещества служит разность его концентраций в соседних объемах и стремление к равномерному распределению.
Первый закон Фика характеризует массоперенос в зависимости от перепада концентрации растворенного вещества.
М= - D* dc/dx;
Где D= коэффициэнт диффузии характеризует количество вещества в граммах или молях, перемещающегося через единицу площади за единицу времени при градиенте концентрации (dc/dx ) равном единице; dc –разность концентраций; dx – расстояние, на котором возник градиент концентрации. Знак минус показывает, что диффузия идет в направлении уменьшения dc/dx.
Коэффициэнт диффузии – очень важный показатель данного процесса. При определенной температуре он зависит от природы растворителя и растворенного вещества. Особенно сильно он зависит от температуре:
D= Do e –Q/(RT) , где Do – предэкспоненциальный множитель (зависит от типа кристаллической решетки); Q – энергия активации (зависит от энергии связи диффундирующего атома в решетке растворителя); R- газовая постоянная; Т – температура.
По мере протекания процесса диффузии разность концентраций и соответственно градиент концентрации уменьшается. Изменение градиента dc/dx со временем τ описывается вторым законом Фика:
dc/dx = - D d2c / d2x или
c x, τ= co* [1 + (Ф x/2 √D* τ)],
Ф ( x/2 √D* τ) – функция Крампа, со –исходная концентрация.
Зная коэффициент диффузии D и продолжительность процесса τ пор выражению X ≈√ D* τ можно определить размер диффузионной зоны для данного элемента и растворителя.
Для формирования свойств сварных соединений сталей важнейшее значение имеет диффузионное перемещение углерода, водорода, серы, фосфора, железа, хрома, молибдена, алюминия и некоторых других. В процессе диффузии перемещение атомов внедрения и замещения происходит по-разному, характеризуется различными энергетическими параметрами и протекает с разной скоростью.
Небольшие по размеру атомы внедрения значительно отличаются от параметров решетки и размеров атомов растворителя, они слабее удерживаются в своих положениях, чем атомы замещения. Чем больше отличия атомов внедрения от растворителя, тем слабее он удерживается, соответственно меньше его энергия активации и больше скорость диффузии. (таблица 3).
Таблица 3. Энергия активации диффузии различных элементов, дающих растворы внедрения в α –железе.
элемент |
Атомный диаметр, нм |
Отличие от атомного диаметра железа, нм |
Энергия активации, Q ДЖ/моль. |
H |
0,56 |
2 |
15700 |
N |
1,42 |
1,14 |
76100 |
O |
1,54 |
1,02 |
84100 |
B |
1,78 |
0,76 |
88400 |
Для элементов, образующих растворы замещения, энергия активации зависит не только от соотношения размеров атомов и решетки, но и от возможности деформации (например сжатия) атома и др. (табл. 4)
Таблица 4. Энергия активации диффузии различных элементов, дающих растворы замещения в γ-железе.
Элемент |
S |
Al |
Mo |
Cu |
Mn |
Ni |
Fe |
Q, кДж/моль |
121 |
184 |
247 |
255 |
278 |
282 |
284 |
Энергия активации углерода и легирующих элементов в α-железе и γ-железе различна. Например, в α-железе энергия активации диффузии углерода меньше, а скорость диффузии больше. Для сварных соединений существенно, что на границах зерен диффузионные процессы идут активнее, так как на них большая концентрация дефектов кристаллического строения. Состояние границ зерен для сварного соединения более значимо, чем для основного металла, так как швы обладают более крупными литыми кристаллами и выросшего зерна в околошовной зоне.
Скорость диффузии какого-либо элемента в легированной стали зависит от характера и степени ее легирования, так как диффундирующий атом взаимодействует с решеткой растворителя, а легирующие элементы искажают ее, деформируют, изменяют энергетическое состояние.
Диффузионные процессы при сварке.
Рассмотренные закономерности относились к случаю перемещения растворенных атомов в однородном твердом растворе при наличии градиента их концентрации, т. е в твердом состоянии металлы А и Б неограниченно растворимы друг в друге (диаграмма неограниченной растворимости).
В какой-то начальный момент времени пребывания при определенной температуре диффузия атомов А и Б произойдет на небольшое расстояние, а распределение А в Б будет характеризоваться кривой 1., а Б в А - кривой 2.(см. рис. 16). По мере увеличения времени нахождения металла при данной температуре произойдет увеличение глубины взаимодиффузии, распределение концентраций А в Б и Б в А будет соответствовать кривым 1’ и 2’. Обе кривые симметричны, если скорость диффузии А в Б и Б в А примерно одинаковы. Реально такие скорости могут быть разными и симметричность кривых будет нарушена.
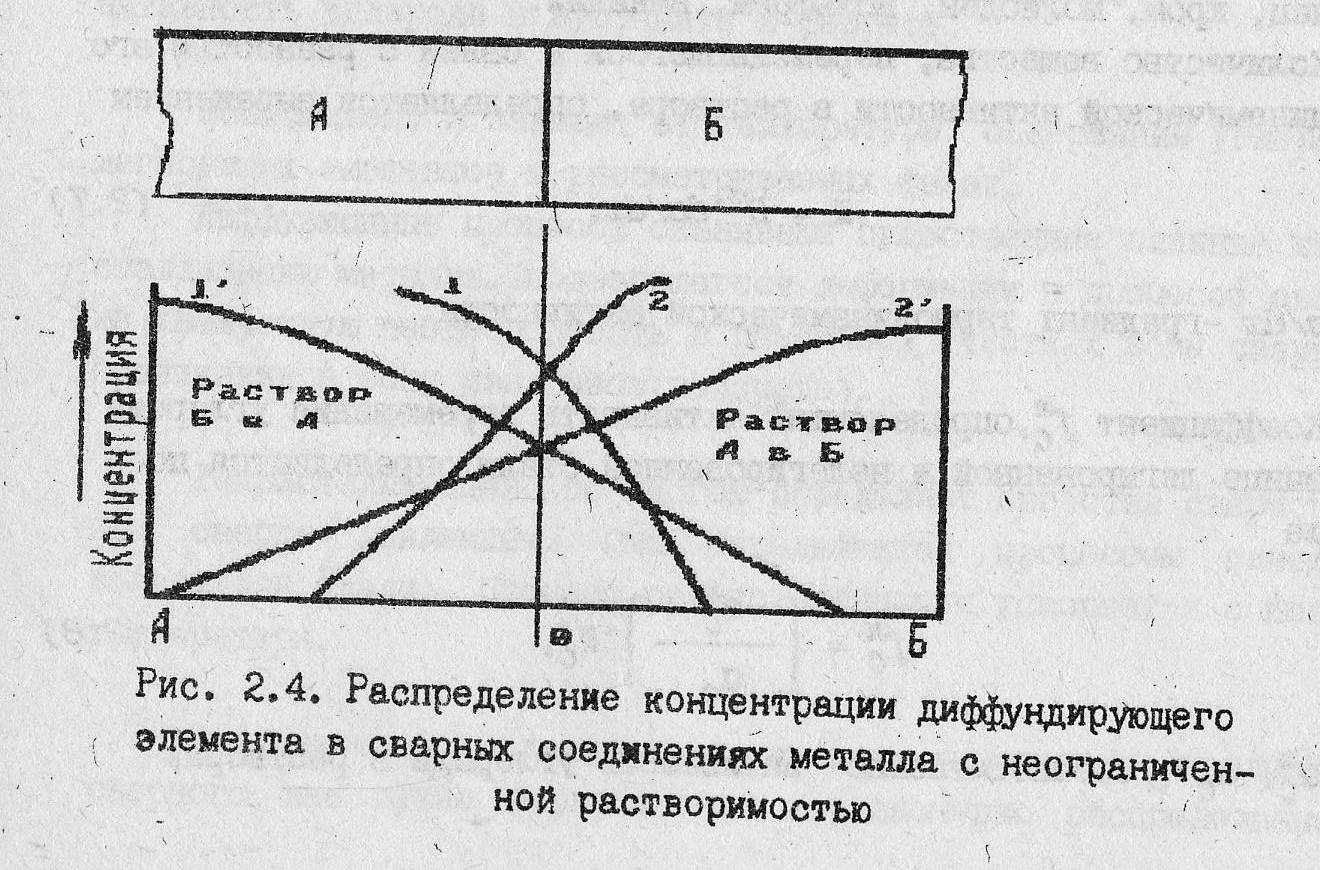
Рис. 16. Распределение концентрации диффундирующего элемента в сварных соединениях металла с неограниченной растворимостью.
Диффузию, сопровождающуюся фазовыми изменениями (в случае ограниченной растворимости , образования химических соединений, эвтектик или эвтектоидов) называют реактивной. Для этой диффузии характерно образование зон неизменной концентрации – зон химических соединений. В сварном соединении эти зоны не обязательно должны располагаться в плоскости контакта свариваемых материалов. Последующий нагрев при термообработке, приводящей к дальнейшему развитию диффузионных процессов, сместит положение этих зон.
Для сварных соединений характерен еще один вид диффузии, когда процесс перемещения в растворе какого-либо элемента происходит не в связи с разностью концентраций в растворе, а в связи с разницей его термодинамической активности: например, диффузия углерода на границе сварки легированной и нелегированной стали или разнолегированных сталей. При исследовании такой диффузии и вызываемой ею неоднородности состава и строения сварного соединения было замечено, что независимо от содержания в свариваемых сталях углерода направление его перемещения определяется степенью легированности сталей. Перемещение углерода при этом может происходить даже из стали с меньшей его концентрацией. Было также замечено, что кремний является элементом, «выталкивающим» углерод, а хром, молибден и ванадий «притягивающими» его.
Оценивая влияние диффузионных процессов на строение и свойства сварных соединений, следует иметь в виду их влияние на процессы рекристаллизации металла. Ускорить процесс рекристаллизации способны не только повышение температуры, но и степень деформации. Сама рекристаллизация в момент ее протекания ускоряет диффузионную подвижность атомов. Кроме этого на закономерности протекания диффузии влияет деформация, которая также ускоряет движение атомов, следовательно, диффузию. Это происходит за счет увеличения плотности дефектов кристаллического строения.
Структурные и фазовые превращения в сталях при нагреве и охлаждении.
Диаграмма «Железо-углерод».
Диаграмма железо- углерод, имеющая техническое применение, включает содержание углерода от 0 до 6,67% (Рис.17). Содержание углерода 6,67% соответствует 100%-ной доле химического соединения Fe3C, называемого цементитом. Таким образом, диаграмма железо- углерод представляет часть диаграммы между чистым компонентом А (Fe) и соединением В (Fe3C). Сплошные линии соответствуют метастабильной системе Fe- Fe3C, пунктирные линии изображают стабильную систему Fe - C. В области до 4,3% С различия граничных фазовых линий между метастабильной и стабильной системами незначительны. Однако при длительном температурном воздействии и при более высоком содержании углерода цементит имеет склонность к распаду на железо и графит. Графит и цементит могут, как часто наблюдается у чугуна, появляться рядом друг с другом.
Диаграмма Fe-Fe3C является характерным примером сложной системы, содержащей три превращения:
1. Перитектическое превращение с перитектической точкой при 0,16%С и 1493оС (точка J), в результате чего из расплава и первично выделенного d-твердого раствора (ОЦК) образуется g -твердый раствор (ГЦК) по реакции: Ж + γ.
2. Эвтектическая реакция между расплавом, g-твердым раствором и Fe3C при 4,3% С и 1147оС по реакции Ж γ+Fe3C (точка С).. Эвтектическая горизонталь простирается от 2,14 до 6,67% С, соответственно от 31 до 100% Fe3C. Это означает, что при содержании С<2,14% из расплава выделяется гомогенный g-твердый раствор, максимальная растворимость С от 2,14% при 1147оС уменьшается до 0,8% при 723оС. С максимальной растворимостью углерода в g-твердом растворе при 2% связываются границы для стали (<2,14%) и чугуна (>2,14%).
3. Эвтектоидное превращение g - твердого раствора (аустенит) в a + Fe3C при 0,8%С и 723оС по реакции γ α + Fe3C (точка S).
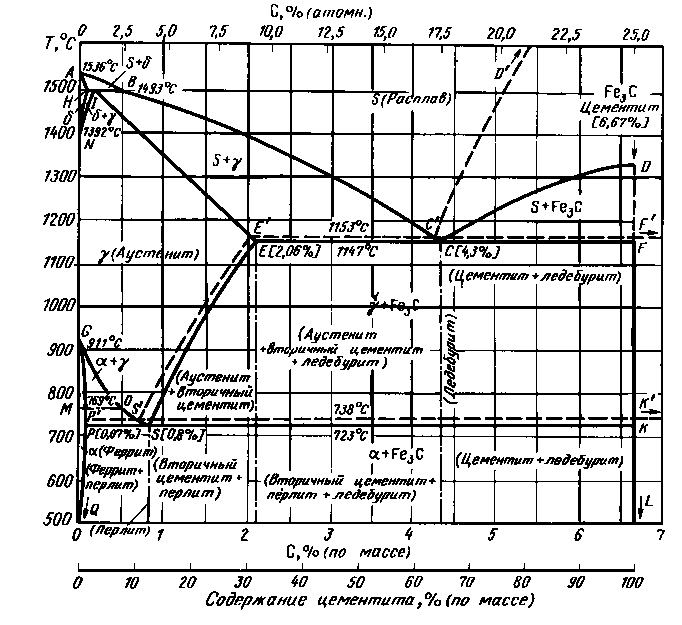
Рис.17. Диаграмма состояния железо-углерод
При содержании С>2,14% наряду с первично выделенным g - твердым раствором остаточный расплав превращается в эвтектику γ + Fe3C, которая при 4,3%С образуется как чистая эвтектика и называется также ледебуритом.
На диаграмме Fe- Fe3C левее точки Е’ находятся стали, правее - чугуны. Как видно из диаграммы, стали не испытывают эвтектического превращения. При температурах ниже 723оС все стали (в отожженном состоянии) состоят из двух фаз - феррита и цементита. Феррит- это твердый раствор углерода в α-Fe с ОЦК решеткой. Максимальная растворимость углерода в α -Fe составляет около 0,025% (точка Р) Цементит - это карбид железа Fe3C, содержащий 6,7%С.
Микроструктура сталей
По микроструктуре в отожженном состоянии различают:
а) техническое железо, не испытывающее эвтектоидное превращение (до 0,025%С);
б) доэвтектоидные стали (от 0,025 до 0,8%С);
в) эвтектоидные стали (0,8 %С);
г) заэвтектоидные стали (от 0,8 до 2,14%С).
В отожженном техническом железе (Рис. 18) микроструктура состоит либо только из равноосных зерен феррита (до 0,006%С), либо из равноосных зерен феррита с пограничными выделениями третичного цементита. Третичный цементит образуется по границам зерен феррита вследствие уменьшения растворимости углерода в феррите при понижении температуры, и образует разорванную сетку, т.к. количество его невелико.
В отожженных доэвтектоидных сталях две структурные составляющие: избыточный феррит, образующийся в результате полиморфного превращения γα, и эвтектоид - перлит, который возникает при эвтектоидном превращении γ α + Fe3C. Избыточный феррит при большом его количестве выделяется в виде равноосных зерен (рис.19), при малом количестве - в виде сетки по границам зерен аустенита (рис.20).
Перлит имеет характерное пластинчатое строение и состоит из отдельных зерен - колоний (рис. 21). Количественное соотношение феррита и цементита в перлите не зависит от химического состава стали.
В отожженных заэвтектоидных сталях структурные составляющие - перлит и цементит вторичный. Последний выделяется из аустенита перед эвтектоидной реакцией из-за уменьшения растворимости углерода при понижении температуры. Вторичный цементит выделяется по границам зерен аустенита, образуя сетку (рис. 22), заполненную колониями перлита, которые образуются из аустенита при эвтектоидном превращении.
Таким образом, по микроструктуре можно качественно отличить стали с разным содержанием углерода. В таблице 5 приведены данные о фазовых и структурных составляющих сталей.
Таблица 5 - Фазовое состояние и микроструктура отожженных углеродистых сталей
Техническое название сплава |
% С (по массе) |
Фазы при 20оС |
Структурные составляющие при 20оС |
Техническое железо |
0 - 0,006 0,006-0,025 |
a , Fe3C |
Феррит (Ф) Ф+ЦIII |
Доэвтектоидная сталь |
0,025 - 0,8 |
a , Fe3C |
Перлит+ФИЗБ |
Эвтектоидная сталь |
0,8 |
a , Fe3C |
Перлит |
Заэвтектоидная сталь |
0,8 - 2,14 |
a , Fe3C |
Перлит + ЦII |
Фазы углеродистой стали сильно отличаются механическими свойствами: феррит мягок и пластичен, цементит тверд и хрупок. Ясно, что механические свойства стали зависят от свойств фаз, однако существенное влияние оказывает и микроструктура. Свойства отдельных фаз и перлита можно сравнить в таблице 6. Эвтектоидные и заэвтектоидные стали со структурой перлита или перлита с вторичным цементитом обладают повышенной твердостью. Если же сталь подвергнуть специальному отжигу (сфероидизирующий отжиг), выделения вторичного цементита и цементит эвтектоида принимают глобулярную форму (см. рис. 23), а твердость снижается.
Рисунок 18 - Схема микроструктуры технического железа: феррит и третичный цементит по границам зерен |
Рисунок 19 - Схема микроструктуры доэвтектоидной стали: зерна избыточного феррита и перлит |
Рисунок 20 - Схема микроструктуры перлита |
Рисунок 21 - Схема микроструктуры доэвтектоидной стали: сетка избыточного феррита и перлит |
Рисунок 22 - Схема микроструктуры заэвтектоидной стали: сетка вторичного цементита и перлит |
Рисунок 23 - Схема микроструктуры заэвтектоидной стали: феррит и зернистый цементит |
Таблица 6 - Механические свойства структурных составляющих в углеродистых сталях
Структура (фаза) |
Механические свойства |
||
|
Твердость НВ, МПа |
В, МПа |
,% |
Феррит Цементит Перлит Феррит и зернистый цементит (0,8%С) |
80– 90 7500 - 8200 190 - 230 1600 – 1900 |
190 - 250 30 830 - 900 650 - 700 |
40-50 <1 9-12 18-25 |
Строение зоны термического влияния (ЗТВ).
Рассмотрим схему зоны термического влияния в сварных соединениях в соответствии с диаграммой состояния и максимальной температурой нагрева, достигаемой в отдельных точках. Протяженность отдельных участков возрастает с уменьшением градиента распределения максимальных температур нагрева.
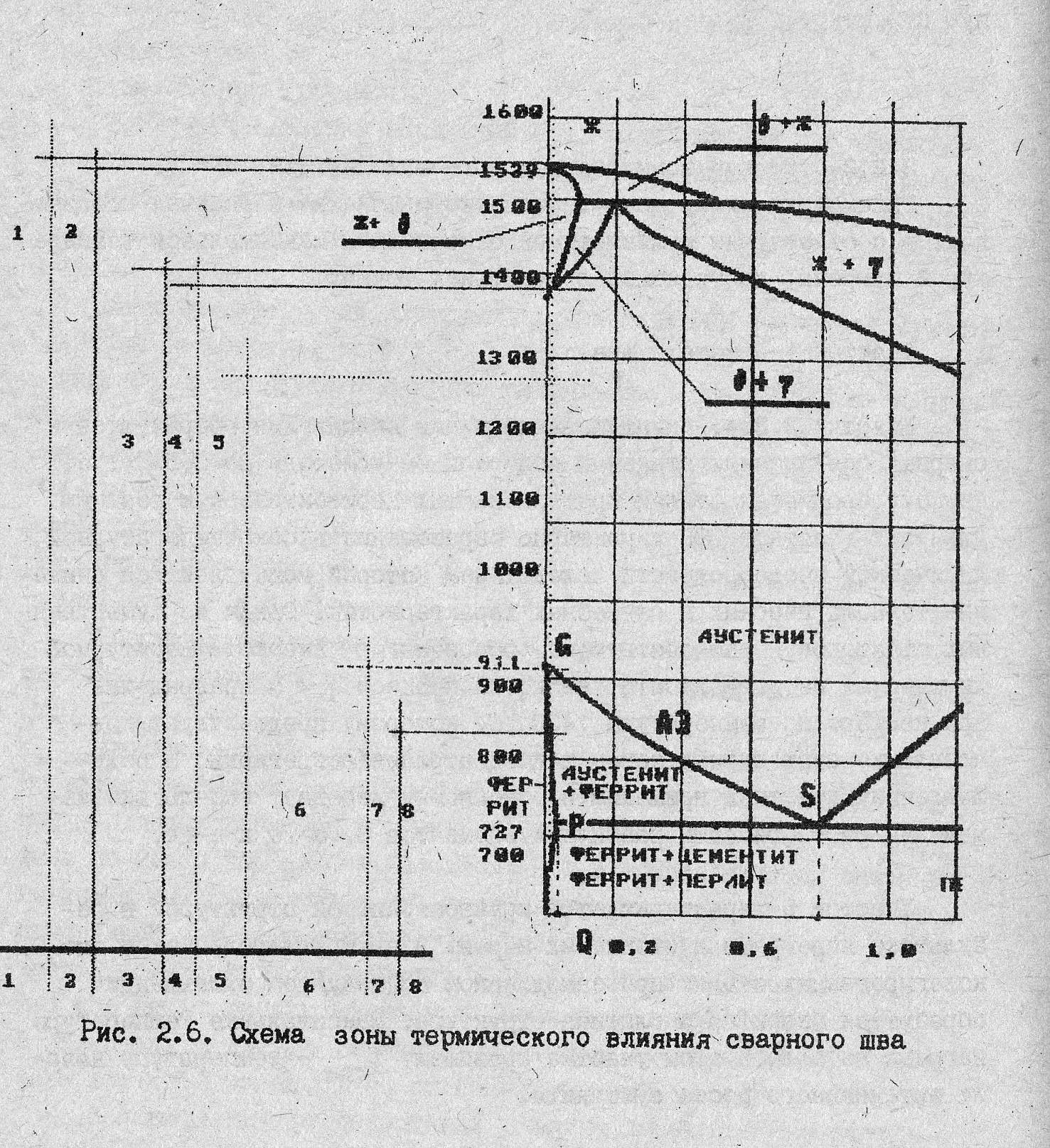
Рис.24. Схема зоны термического влияния в сварном соединении.
Участок 1 – металл шва
Участки 2, 3, 4, прилежащие к линии сплавления, образуются в сварных соединениях сталей, претерпевающих перитектическую реакцию, что характерно для низкоуглеродистых сталей с содержанием углерода до 0,5%. Для данных участков характерно образование высокотемпературной химической неоднородности, следствием которой может служить снижение технологических и служебных свойств сварных соединений. Одним из существенных факторов, способствующим высокотемпературной химической неоднородностит, является процесс превращении α→ δ при нагреве до 1400оС.
Участок 5. характеризуется крупнозернистой структурой в результате перегрева аустенитных зерен. В низкоуглеродистых и низколегированных сталях при замедленной последующем охлаждении образуется перлитно-ферритная структура пластинчатого типа.
Участок 6. участок нормализации с температурой нагрева в интервале Т рекрист – Ас3 . Для этого участка характерна относительно мелкозернистая структура аустенита с повышенной неоднородностью по содержанию углерода и легирующих элементов.
Участок 7. Участок неполной рекристаллизации с максимальной температурой нагрева в интервале Ас3-Ас1, структура стали – аустенитно-ферритная с наличием карбидов. Аустенит характеризуется наибольшей неоднородностью по углероду и элементам замещения. При умеренных скоростях охлаждения из межкритического интервала температур более углеродистая част аустенита превращается по мартенситному механизму, а менее углеродистая – по диффузионному.
Участок 8 – участок отпуска, в котором металл нагревается до температуры Ас1 600оС. Здесь наиболее активно происходят процессы разделения феррита и цементита, коагуляции карбидов.
Следует отметить, что во всех участках ЗТВ процессы структурно-фазовых превращений, и, следовательно, формирования механических свойств сварного соединения в значительной степени зависят от параметров термических циклов сварки и термообработки, химического состава и исходного структурного состояния сталей.