
Адсорбция на границе газ-жидкость
Р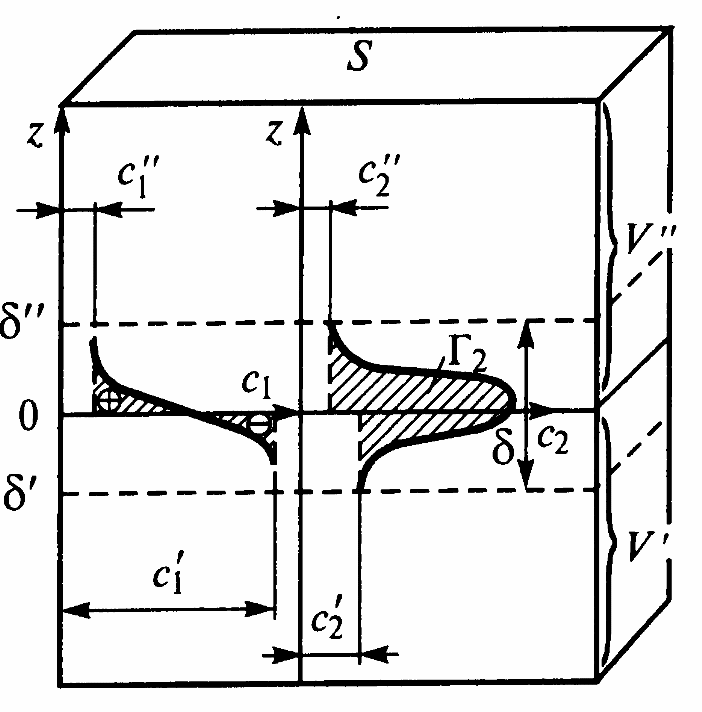 ассмотрим
адсорбцию на границе газ – жидкость,
пусть это будет раствор гексилового
спирта в воде и воздух. Тогда зависимость
концентрации спирта при переходе границы
раздела схематично изображена на
рисунке. Здесь с1’ и с2’
– концентрации воды и спирта в жидкой
фазе, с1’’ и c2’’
– в газовой фазе.
ассмотрим
адсорбцию на границе газ – жидкость,
пусть это будет раствор гексилового
спирта в воде и воздух. Тогда зависимость
концентрации спирта при переходе границы
раздела схематично изображена на
рисунке. Здесь с1’ и с2’
– концентрации воды и спирта в жидкой
фазе, с1’’ и c2’’
– в газовой фазе.
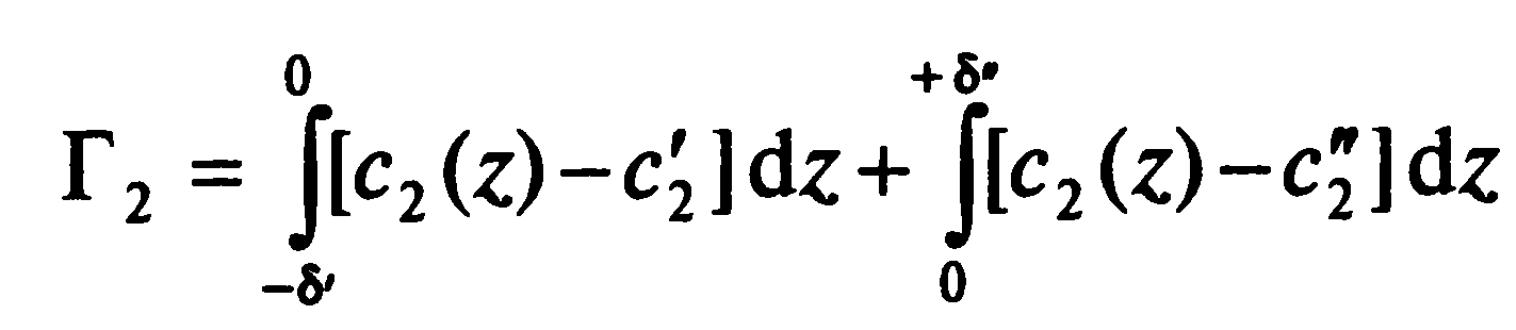
Аналогично можно выразить и адсорбцию первого компонента. Тогда адсорбция отрицательна в области, примыкающей к жидкости, и положительна в области, примыкающей к пару. Таким образом, величина адсорбции зависит от положения поверхности раздела, а поверхность, где Г1=0 называется эквимолекулярной поверхностью для 1-го компонента.
Р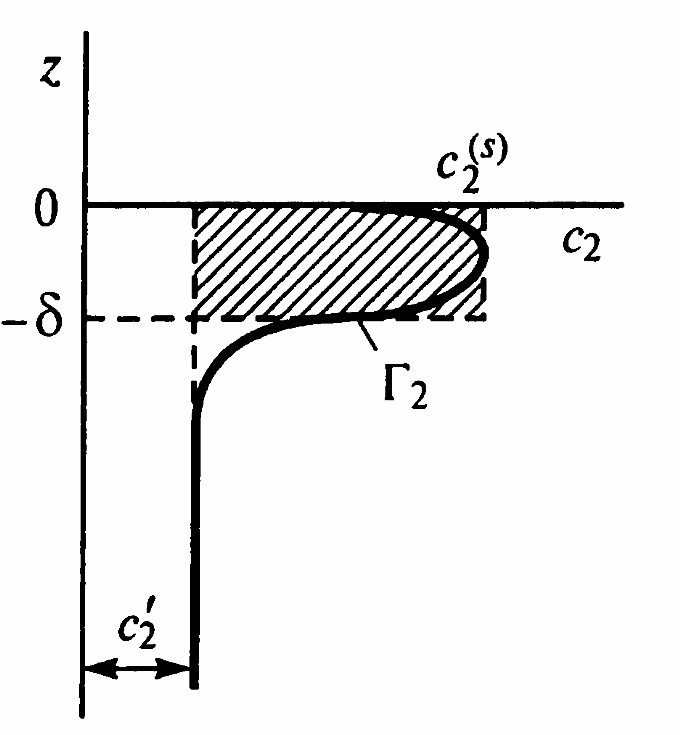 ассмотрим
подробнее адсорбцию второго компонента,
примем, что он практически нелетуч.
ассмотрим
подробнее адсорбцию второго компонента,
примем, что он практически нелетуч.
Можно сказать, что
для этого случая
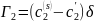 я
я
При ярко выраженной
способности к адсорбции
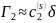
В этих уравнениях с2(s) – средняя концентрация в поверхностном слое.
Адсорбция пав на границах раздела фаз
Поверхностное натяжение водных растворов, в зависимости от природы растворённого вещества, может быть как выше, так и ниже поверхностного натяжения воды. Вещества, снижающие поверхностное натяжение воды, называются поверхностно-активными (ПАВ). ПАВ - органические вещества с дифильным строением молекул, т.е. состоящие из двух частей: гидрофильной (полярной) и гидрофобной (неполярная углеводородная цепь).
Способность вещества изменять поверхностное натяжение раствора характеризуется поверхностной активностью:
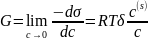
Адсорбцией называется процесс самопроизвольного концентрирования растворённого вещества в поверхностном слое. Универсальным термодинамическим соотношением, описывающим адсорбцию, является уравнение Гиббса:
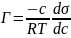
Зависимость поверхностного натяжения от концентрации (изотерма поверхностного натяжения) в широком интервале концентраций описывается уравнением Шишковского:
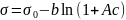
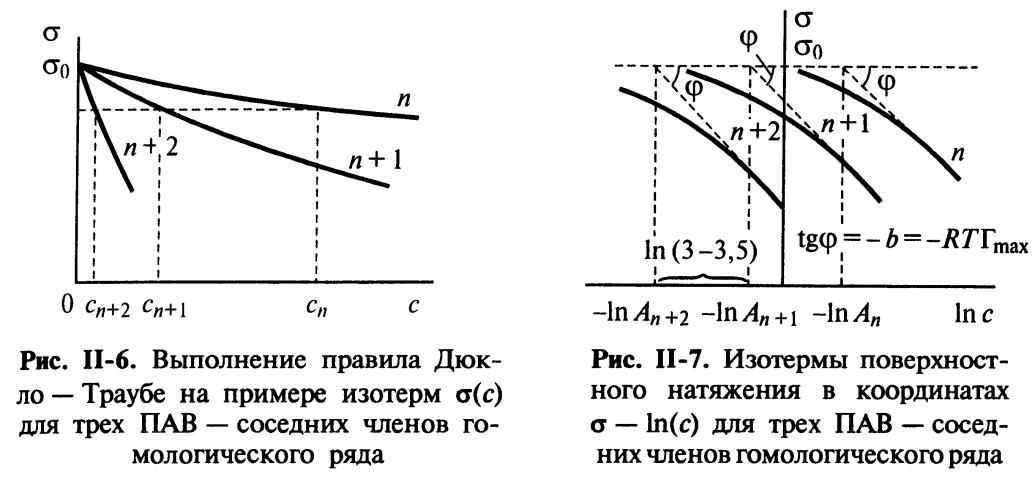
где b и A – константы, характеризующие ПАВ, причем b является константой для всего гомологического ряда, а A - константа, характерная для данного вещества и возрастающая примерно в три раза при удлинении углеводородного радикала молекулы ПАВ на одну СН2 группу.
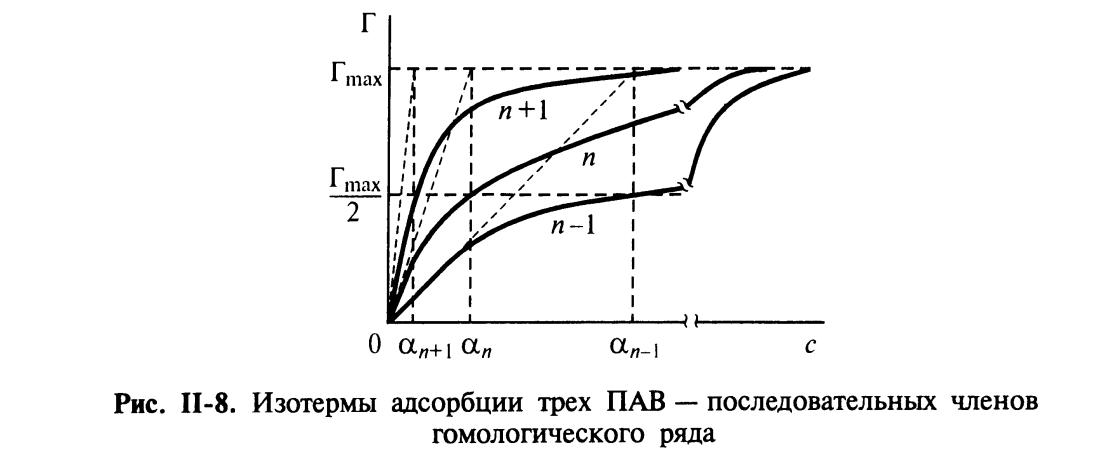
Подобная закономерность была выведена до этого Дюкло и Траубэ, и получила название правило Дюкло-Траубэ.
Снижение поверхностного натяжения обусловлено адсорбцией ПАВ на поверхности раздела раствор/воздух.
Совместное решение уравнений приводит к уравнению:
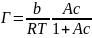
которое
при
условии
 превращается в известное уравнение
Ленгмюра:
превращается в известное уравнение
Ленгмюра:
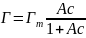
, где Гm – адсорбция в предельно заполненном слое.
При
малых концентрациях данное уравнение
линейно
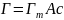
Постоянство b
дало основание предположению о том, что
молекулы ориентируются в граничном
слое перпендикулярно. Тогда адсорбция
определяется поперечным сечением
молекулы s1:
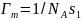
Т.к. начальный участок изотермы адсорбции Ленгмюра линеен, то можно записать
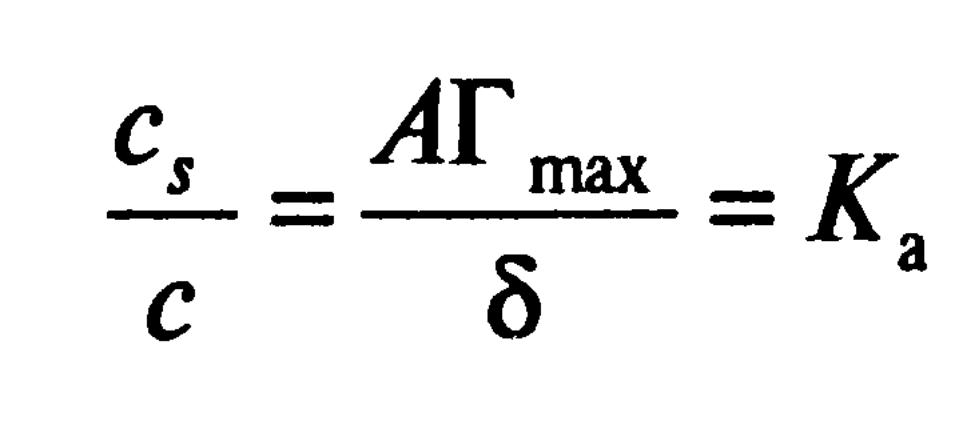
Т.е. к равновесию можно применить закон Генри, поэтому этот участок изотермы называется областью Генри. Следовательно, можно использовать приближение идеальных растворов и тогда для равновесия объемных и поверхностного растворов:
![]()
![]()
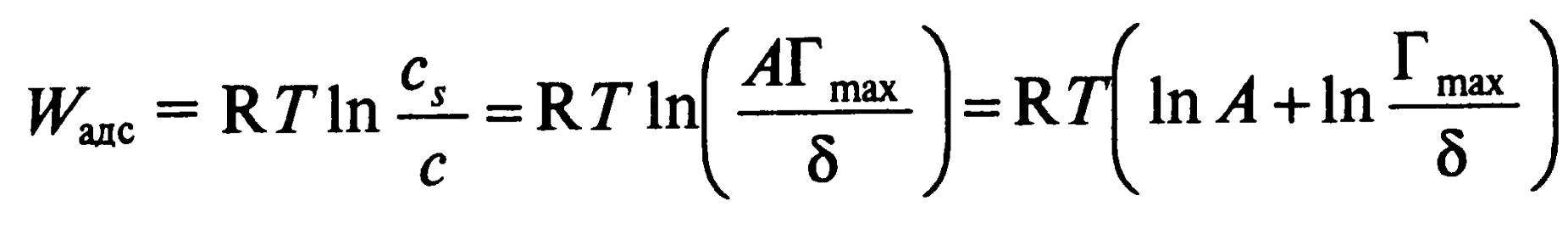
Отсюда, из-за постоянства Гmax и δ для правила Дюкло-Траубэ:
![]()
Здесь n – число СН2-групп, φ1 – инкремент работы адсорбции, равный для этого правила 3 кДж/моль, φ0 – величина, характеризующая изменение энергии взаимодействия полярной группы ПАВ с молекулами воды при выходе на поверхность.
Адсорбционную активность можно связать с работой адсорбции так:
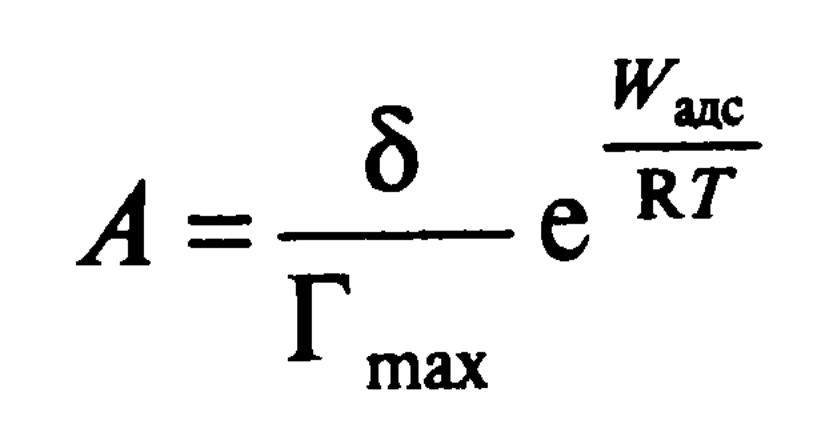
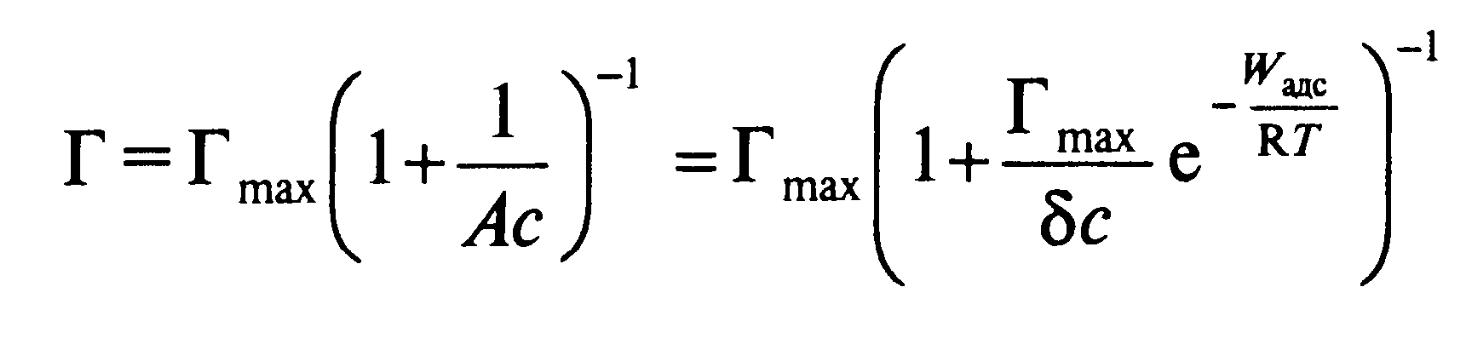
Выразим зависимость двумерного давления от адсорбции (уравнение Ван-Лаара):
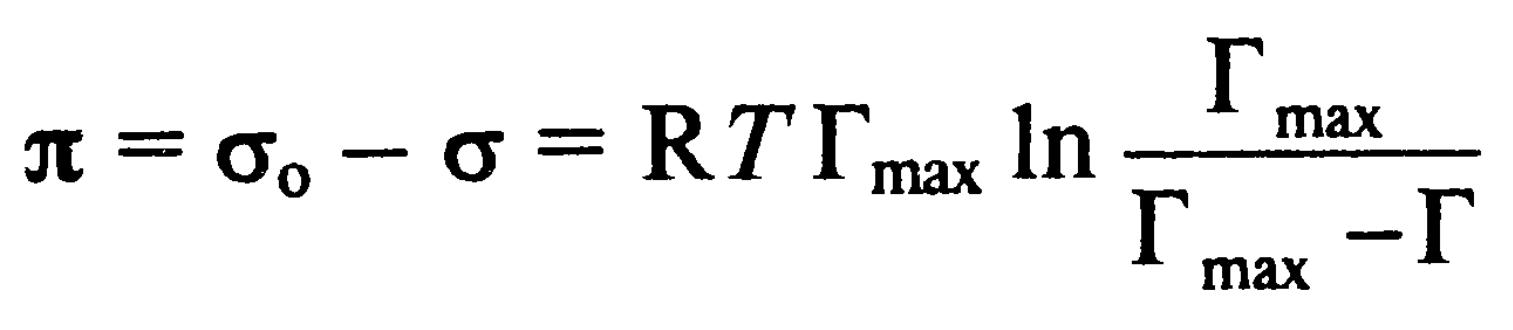
При низких концентрациях:
![]()
