
- •Вопрос 1 Сырье для производства синтетического аммиака. Способы получения водорода и азота
- •Двухступенчатая организация конверсии природного газа.
- •Вопрос 2 Паровая конверсия природного газа: реакции и равновесие процесса.
- •Вопрос 3 Паровая конверсия природного газа: катализаторы.
- •Паровая конверсия природного газа: кинетика.
- •Параметры первой ступени конверсии природного газа.
- •Оборудование конверсии природного газа 1 ступени. Многорядная трубчатая печь.
- •Вопрос 4 Методика расчета материального баланса радиантной зоны трубчатой печи
- •Вопрос 5 Методика расчета теплового баланса радиантной зоны трубчатой печи
- •Вопрос 6 Двухступенчатая организация процесса конверсии природного газа.
- •Особенности второй ступени конверсии.
- •Реакции и равновесие процесса
- •Вопрос 7 Паровоздушная конверсия метана: кинетика, катализаторы и параметры процесса.
- •Вопрос 8 Оборудование стадии паровоздушной конверсии природного газа
- •9. 10. Двухступенчатая организация конверсии монооксида углерода. Конверсия монооксида углерода: реакции и равновесие процесса.
- •Методика расчета материального баланса процесса конверсии со.
- •Методика расчета теплового баланса конвертора со .
- •Очистка конвертированного газа от диоксида углерода. Требования, предъявляемые к хемосорбенту и массообменной аппаратуре.
- •Моноэтаноламиновая очистка: реакции, равновесие, кинетика и параметры процесса.
- •15. Оборудование стадии очистки конвертированного газа от диоксида углерода и регенерации раствора
- •Технологическая схема мэа-очистки.
- •Очистка конвертерного газа от со2 по методу «карсол».
- •18.Физико-химические свойства nн3.Требования к качеству nн3.Синтез nн3 :реакция,равновесие процесса
- •Требования к качеству продукционного nн3 по гост 6221 – 90.
- •19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
- •20. Оборудование стадии синтеза nн3.Технологические особенности производств
- •23.Производство нак. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения hno3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
- •25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
- •27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
- •28. Оборудование стадии абсорбции нитрозных газов.
- •30.Методика расчета материального баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •31. Методика расчета теплового баланса первой тарелки абсорбционной колонны в производстве азотной кислоты.
- •33. Сырье и требования к качеству продукционного карбамида. Физико-химические свойства карбамида. Синтез карбамида: реакции и равновесие процесса.
- •34. Синтез карбамида: кинетика и параметры процесса. Диаграмма состояния системы.
- •35. Оборудование стадии синтеза карбамида. Расходные коэффициенты на 1 т карбамида. Технологические особенности производства карбамида.
- •36. Технологические схемы получения карбамида.
- •Вопрсо№39: Методика расчета материального баланса аппарата итн
- •Способы получения элементарной серы. Добыча серы. Требования к качеству серы.
- •Сырье для производства h2so4. Серный колчедан и др. Сернистые соединения металлов, газы цветной металлургии, сульфаты Ca, k, Fe.
- •Газы цветной металлургии
- •Физико-химические основы процесса горения серы. Печи для сжигания жидкой серы. Утилизация теплоты горения серы.
- •Методика расчета материального баланса циклонной печи.
- •Методика расчета теплового баланса циклонной печи.
- •47. Равновесие и кинетика процесса окисления диоксида серы
- •48. Катализаторы для окисления диоксида серы. Контактные аппараты для окисления диоксида серы.
- •49. Методика расчета материального баланса контактного аппарата
- •50. Методика расчета теплового баланса контактного аппарата
- •51.Равновесие и кинетика процесса абсорбции триоксида серы.
- •Аппаратурное оформление стадии абсорбции. Моногидратный абсорбер. Олеумный абсорбер, сушильная башня.
- •53.Методика расчета материального баланса моногидратного абсорбера.
- •55. Технологическая схема печного отделения.
- •56. Технологическая схема контактно-компрессорного отделения.
- •57. Технологическая схема сушильно-абсорбционного отделения.
- •58.Способы производства и применение фосфорной кислоты. Сырье и требования к качеству продукционной фосфорной кислоты. Стадии технологического процесса.
- •Разложение апатитового концентрата смесью серной и фосфорной кислот
- •Фильтрация фосфополугидрата на вакуумных фильтрах, гидроудаление
- •Упаривание (концентрирование) фосфорной кислоты
- •Абсорбция газов
- •59.Химизм процесса взаимодействия фосфатов с кислотами. Кинетика процесса разложения фосфатов.
- •Скорость процесса разложения фосфатов (Кинетика)
- •60.Кристаллизация сульфата кальция и условия образования крупнокристаллического осадка.
- •61.Режимы экстракции фосфорной кислоты. Оборудование для экстракции фосфорной кислоты.
- •62.Выделение и улавливание фтора при получении и переработке эфк. Оборудование стадии.
- •63.Методика расчета материального баланса отделения экстракции в производстве дигидратной эфк.
- •64.Методика расчета теплового баланса отделения экстракции в производстве дигидратной эфк.
- •65. Производство сложных удобрений на основе эфк. Свойства фосфатов аммония. Физико-химические особенности производства аммофоса и фосфатов аммония.
- •Физико-химические особенности н а рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС. Взаимодействие эфк с nh3 происходит по реак-ям (1)-(3).
- •66 Вопрос. Основное оборудование стадий нейтрализации, гранулирования и сушки при получении фосфатов аммония: струйный реактор, саи, аг, сб, бгс.
- •68. Производство диаммонийфосфата, особенности технологии. Требования на даф
- •1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
- •8. Дать полную характеристику колонне синтеза, как реактору для получения карбамида. Материал колонны синтеза.
- •9. Основные стадии процесса окисления аммиака до оксида азота(2), как гетерогенно-каталитического хтп.
- •12 Дать полную характеристику абсорбционной колонне , как реактору получения нак. Материал абсорбционноц колонны.
- •13. Уравнение адиабаты. Зависимость степени превращения оксидов азота в азот для необратимой экзотерм. Реакции (графическая и аналитическая зависимости)
- •14. Дать полную характеристику аппарата типа “кипящий слой”, рассчитать критическую скорость псевдоожижения.
- •15. Интенсификация работы оборудования и пути ее увеличения.
- •17.Охт. Дать полную характеристику экстрактору, как реактру для получения эфк.
68. Производство диаммонийфосфата, особенности технологии. Требования на даф
Наименование показателя |
Норма |
1. Массовая доля общих фосфатов, % |
47 ± 1 |
2. Массовая доля общего азота, % |
18 ± 1 |
3. Массовая доля воды, % |
1,5 ± 0,3 |
4. Гранулометрический состав Массовая доля гранул размером: менее 1 мм, %, не более от 1 до 6 мм, %, не менее менее 6 мм, % |
3 97 100 |
5. Статическая прочность гранул, МПа (кгс/см2), не менее |
3,0 (30) |
6. Рассыпчатость, % |
100 |
Технологическая схема производства диаммонийфосфата
Удобр-е ДАФ сост из 85-90% диам-са и 10-15% ам-са. Оно менее расп-но из-за сложн технологии. Для пр-ва ДАФ пригодна только ЭФК из аппатита. Тех сх. В трубчатых реакторах 3 (2шт) подается жид NH3 и частично нейтр-ая ЭФК с добавлением серной кис-ы из сборника 1. Температура смеси сост 50 гр. Сер к-та дозир-ся 25 м3 на 340 м3 ЭФК. Из тр реак вых пульпа с мол отн NH3:ФК= 1,45, влажн 10-15% и t = 130-170гр. Пульпа подаётся в аммонизатор-гранултор (АГ) и распыливается на завесу ретура. АГ раб под разряж 20Па. Для продолж-я нейтр фосфорную кислоту в АГ под-ся жид NH3. Из АГ выход пульпа с мол соот 1,7-1,85, влаж 2,5% и темп 90гр и напр в сушильный барабан. В СБ потоки пульпы из АГ и тр реак 4 смеш-ся и суш-ся топоч газами, подав-ми из топки 5. СБ раб под разряж. Потоки могут подав-ся раздельно. Из СБ вых-т гранулы ДАФ с мол отн 1,7-1,85, влажн 1,5 % и 90град, кот-ый элеватором (10) подается в классификатор 11. Товарная фракция подается в холод-к ''КС''. Готовый продукт обрабатывается маслом и напр-ся на склад. Мелкие гранулы и продукт из дробилки , а т/ж пыль ДАФ из циклонов подается на конвеер 15. Газы, образующиеся в процессе очищаются от пыли ДАФ и направляются на абсорционную очистку.
Абсор-р большой абсорции орошается частично нейтрализованной фосфорной кислотой из сборника 22. Далее газ проходит брызгоуловитель и выбрасывается в атм-ру. Вода из брыз-ля сбрас-ся в сборник очищенных стоков 26. Паро-газовая смесь из трубчатого реактора 3 вместе с пульпой поступает в АГ. Эта смесь в АГ объединяется с подсас-м воз-м, в рез-те образуется газо-возд смесь, которая направляется в сист малой абсорбции. Газ из системы малой аб-и напр в брызгоул-ль 30 и выбр-ся вентил-м 33 в атмосф ч/з выхл трубу 200м.
ОХТ
1. Привести расчет величин δн и δg для I ступени паровой конверсии природного газа.
Первая ступень паровой конверсии ПГ протекает по реакциям:
СН4 + Н2О = СО + 3Н2 Н = 206 кДж (1)
СН4 + СО2 = 2СО + 2Н2 Н = 248 кДж (2)
СО + Н2О = СО2 + Н2 Н = -41 кДж (3)
Тепловой эффект реакции находится как разность между стандартными энтальпиями продуктов реакции и исходных веществ с учетом стехиометрии:
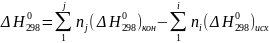
где
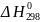 - тепловой эффект реакции при
стандартных условиях (Т = 298 К; р
= 101325 Па), кДж;
-
стандартная мольная энтальпия образования
вещества, кДж/моль, табл. значения; ni
и nj
- стехиометрические коэффициенты в
уравнении реакции при исходных и конечных
веществах. Энтальпия простых веществ
равна нулю.
- тепловой эффект реакции при
стандартных условиях (Т = 298 К; р
= 101325 Па), кДж;
-
стандартная мольная энтальпия образования
вещества, кДж/моль, табл. значения; ni
и nj
- стехиометрические коэффициенты в
уравнении реакции при исходных и конечных
веществах. Энтальпия простых веществ
равна нулю.
Энтропия химической реакции находится как разность между стандартными энтропиями продуктов реакции и исходных веществ с учетом стехиометрии:
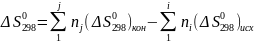
Энтропия простых веществ не равна нулю.
Энергия
Гиббса определяется разностью между
энтальпией H и произведением энтропии
S на термодинамическую температуру Т.
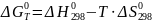
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При G<0 – процесс идет в прям направлении, G>0 – процесс идет в обратном направлении, G=0 – устанавливается равновесие.
№2. Дать полную характеристику трубчатой печи, как реактору паровой конверсии природного газа. Материал трубчатой печи.
по хар-ру пр-са: обратим, равновесн.
по фаз сост-ву: гетерог каталитич.
по тепловому эфф-ту в трубном пространстве – эндотермич ,межтрубном - экзотермич.
по Т - высокотемпера-й.
по Р – повыш.
по степ перемеш-я –РИВ(реактор идеал вытеснения).
по Т режиму: адиабатический.
по времени – непрерыв .
Материал – жаропрочная легирующая сталь Х20Н25С2.
№3. Ускоряющее действие катализаторов в результате изменения реакционного пути для эндо- и экзотермич-х р-ий.
Катализ - избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. Кt – в-во, кот-е ускоряет протекание реакции, идущие с малой скоростью. При отсутствии кt-ов наиболее эффективным фактором, служащим для повыш-я скорости хим. р-ии, явл-ся темп-ра: чем выше темп-ра, тем больше активных столкновений, тем больше скорость хим-го взаим-вия в-в.
Но для обратимых экзотермических реакций увел-ние темп-ры снижает выход продуктов р-ции (принцип Ле-Шателье). Это противоречие разрешается прим-нием кt-ов. Последние при данных температурных условиях, не оказывая никакого влияния на выход продуктов реакции, очень сильно изменяют ее скорость (как прямую, так и обратную). След-но, чем > кt ускоряет р-цию, тем > произв-ть апп-та при той же т-ре.
Кt-ры бывают положительные и отрицательные(ингибиторы): 1-е увел-ют скорость р-ции, 2-е умен-ют. На скорость р-ции сильное влияние оказывает природа самого кt-ра, его структура, добавки к нему (активаторы) и т. Д. Кроме того, состав реаг-щих в-в, посторонние примеси в них и т. п. также сильно влияют на каталитическую способность данного Кt-ра.
Мех-м пр-сса без Кт: А+В=[AB]* - промежут-е нестойкое соед-ие.
Мех-м пр-сса с Кт: А+В+Кт=[A…B…Кт]*=AB+Кт
1) кт-р ускоряет только термодинамически возм-ые для протекания р-ции. 2) не влияет на состоя-е равн-я, ускоряет и прям и обрат р-цию. 3) при гетерог катализе Кт и реагенты нах-ся в разных фазах, а р-ция идет на пов-ти раздела фаз (внутри кт-ра).4.) Проявление каталитического действия выражается в умен-ии энергии активации Еа предэкспоненциального множителя ko под влиянием Кт 5) кт-р участвует в образ-и промежуточ прод-в, изменяет число стадий, кажд имеет свою Еа, но макс-ная из них не превышает Еа при некаталитеч-ом протекании р-ции. Он умен-ет Еа и k0, а чем < Еа тем больше ск-ть.


Чем < Еа,тем < Т пр-са, т.е практич позволяет вести пр-с при более низ т-рах.
Кинетическое ур-ие в общем виде:
аА+вВ=dD
r=K*CaA*CbB ; ,без Кт: К=k0*e-Ea/RT; с Кт: К=k0*e-Eakt/RT
След-но, Еаkt<Ea, значит константа скорости реакции с Кт> чем без него.
№4. Дать полную характеристику конвертору монооксида углерода, как реактору. Материал конвертора.
СО +Н2О ↔СО2 +Н2 +41.70кДж
1)по хар-ру пр-са в апарате: обратимая; равновесная
2) по фаз составу: гетерог.-каталитический (обязательное присутствие Kt -
для 1 ступ примен-ют среднетемпер-ый Fe-Cr , на 2 ступ низкотемпер-ый Zn-Cr-Cu Kt.)
3) по тепловому эф-ту: экзотермич.
4) по темп-ре: среднетемп-й. (темпер-ра 1ступ=480-530°С, темп-ра 2 ступ=400-450°С)
5) по давл-ию: (3,3Мпа) – повыш.
6) по гидро-динам-ой структуре (по степ перемеш-я): РИВ (реактор идеал вытеснения)
7) по темпер-ому режиму: ап-ат работает в адиобатич-ом режиме
8) по режиму работы: непрерыв.
Материал - сталь легирован хром, никель, титан.
Задача: Равнов-е реакции конверсии СО:
lgК=2485,5/Т+1,565*lgТ-0,066*10-3*Т+0,207 *105/ Т2 –6,946.
Напишите эту р-цию, рассч-те К при 400гр.
Расчет: СО+Н2ОСО2+Н2О, Н = -41. Т=400+273=673 К. lgК = 1,0829 К=12,103.
№5. Дать полную характеристику абсорберу и регенератору, как реакторам очистки конвертированного газа от диоксида углерода. Материал реакторов.
Характеристика абсорбера как реактора очистки конвертированного газа от диоксида углерода:
1) по характеру пр-са - обратимый, равновесный пр-сс;
2) по фазов состоянию - гетерогенный (г-ж);
3) по тепловому эффекту - экзотермич. р-ция;
4) по темп-ре - низкотемпературный;
5) по давлению - повышенное (2,8 МПа);
6) по гидро-динам-ой структуре (по степ перемеш-я) реактор идеального вытеснения (РИВ);
7) по темпер-му режиму – политермический в целом. Если тарельчатый, то на тарелках – изотермич, если насадочный, то на насадке - адиабатич;
8) по режиму работы - непрерывный.
Материал - углеродистая сталь.
Характеристика регенератора как реактора очистки конвертированного газа от диоксида углерода:
1) по характеру пр-са - обратимый, равновесный пр-с;
2) по фазов состоянию - гетерогенный;
3) по тепловому эффекту - эндотермич. р-ция;
4) по темп-ре - низкотемпературный;
5) по давлению - повышенное;
6) по гидро-динам-ой структуре (по степ перемеш-я) реактор идеального вытеснения (РИВ);
7) по темпер-му режиму политермический.
Материал – низколегированная сталь 16ГС.
№6. Влияние Т и Р на скорость и степень превращения обратимой экзо-й р-ии с-за NH3. ЛОТ.
Синтез аммиака из N2 и Н2: N2+3 Н22NH3, Н= - 92 относ-тся к числу равнов-х обратимых реакций, протекающих с выделением тепла и уменьш-м объема. Согласно принц Ле-шателье, равновесие реакции синтеза аммиака смещ-ся вправо с повышением Р и понижением t. Синтез NH3 без примен-я кат-ра даже при высок t протек-т медленно. В произв-х услов-х для получ-я требуем-й скор-ти реакции синтез NH3 ведут при t-х не ниже 400-500гр и при участии твердых кат-в.
Скор-ть обратим-й реакции синтеза ам-ка опис-ся урав-ем: U=k*Р3H2РN2 Для увелич-я скор-и необходимо k и Р. Константа скор-ти реакции k опис-ся уравнением Аррениуса: k=k0*e-E/RT. Из анализа ур-я видно, что с Т (даже незначительно) возрастает конст ск-ти. Для выбора оптимал условий проц-са необх-мо совместно учит-ть кинетику и равновесие.
Т.о. для реакции синтеза NH3 установлены след-е зав-ти:


k
K*
Графически перемножая эти графики получим:
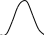
U

T
T
Tопт
T
Кривая U=f(T) построена из условия, что степень превращения Х во всем диапазоне изменен-я тем-р явл-ся постоянной. Если с измен тем-ры меняется степень превращ-я Х (пример - синтез аммиака), то получаем серию кривых в координатах U и T. ЛОТ – линия, связ-я максимумы отдельных кривых. Оптимал-ми наз-ся темпер-ры, при кот обеспеч-ся максим-ные ск-ти проведения ХТП для достижения заданных степеней превращ-я.


U
T


Х3
Х1
Х2
Р2
Р1
Р3
U1
U2
U3
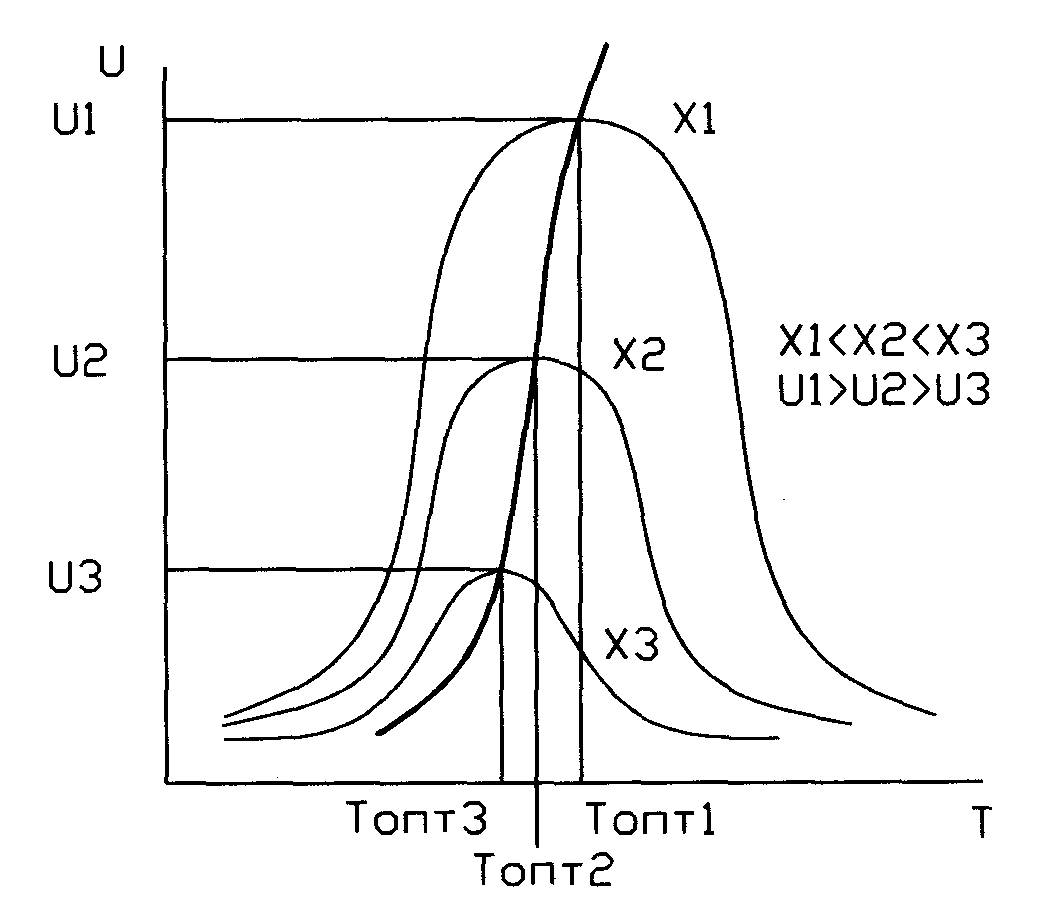
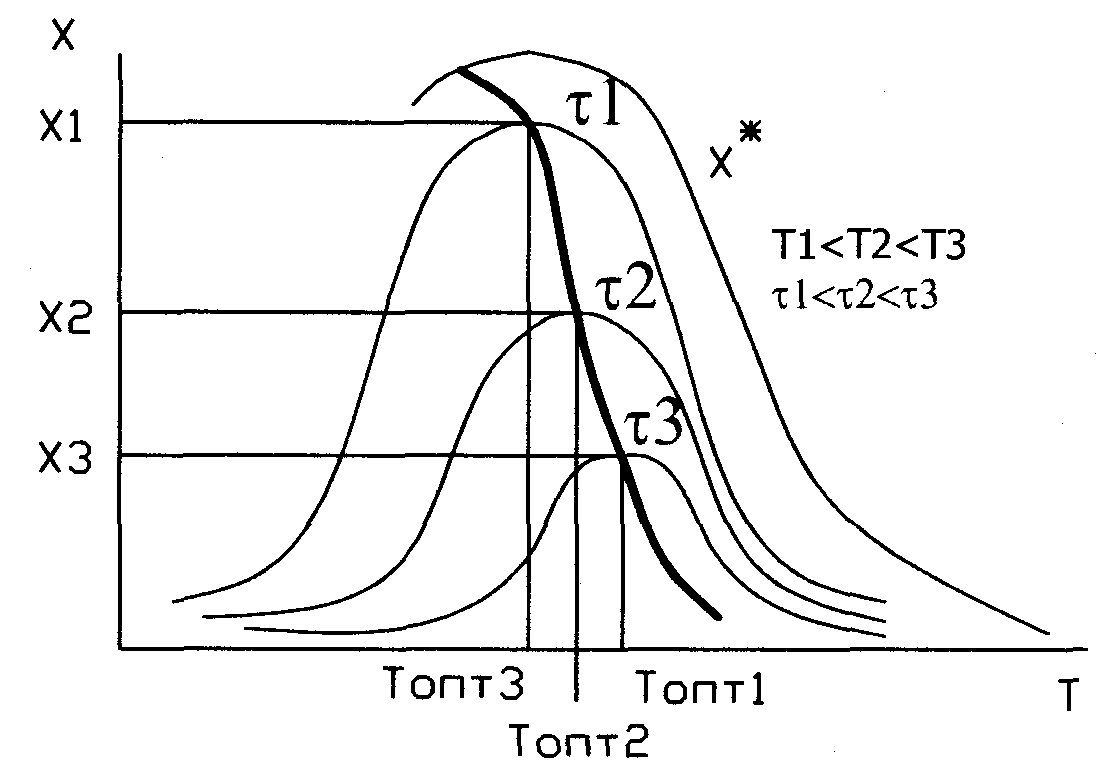
Критерием оптимизации служит максим-я ск-ть реакции или макс-ная степень превращ-я.
№7. Стадии гетерогенного катализа, область протекания процесса.
Стадии гетерогенного катализа:
1) диффузия реагирующих веществ из ядра потока к поверхности зерен катализатора;
2) диффузия реагентов в порах зерна катализатора;
3) активированная адсорбция (хемосорбция) веществ на поверхности катализатора с образованием поверхностных непрочных хим. соединений – активированных комплексов: реагенты - катализатор;
4) перегруппировки атомов с образованием поверхностных комплексов: продукт - катализатор;
5) десорбция продукта с поверхности;
6) диффузия продукта в порах зерна катализатора;
7) диффузия продукта от поверхности зерна катализатора в ядро потока.
Общая скорость гетерогенного каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Иногда наиболее медленной стадией является оказывается одно из химических взаимодействий на поверхности катализатора, а иногда диффузионные процессы.
В зависимости от определяющей стадии различают каталитические процессы, происходящие в кинетической, внешнедиффузионной и внутридиффузионных областях. Область протекания процесса.
В кинетической области константа скорости процесса не зависит от коэффициентов диффузии. В кинетической области протекают процессы на малоактивных катализаторах с малыми размерами зерен и крупными порами при турбулентном режиме потока реагентов и при сравнительно низких температурах. Увеличение скорости каталитических процессов в кинетической области достигается повышением температуры. Общая скорость процесса определяется соотношением скоростей 3-5 стадий катализа.
Во внешнедиффузионной области (лимитирует 1 и 7 стадия) скорость процесса определяется коэффициентами диффузии реагентов и продуктов реакции. Во внешнедиффузионной области протекают процессы на высокоактивных катализаторах, обеспечивающих большую скорость хим. р-ций. Для ускорения применяют высокие линейные скорости потока реагентов, т.е. создают турбулизацию потока.
Во внутридиффузионной области общая скорость процесса лимитируется скоростью диффузии реагентов (продуктов) в порах зерен катализатора. Эта область характерна для проведения катализа в фильтрующем слое катализатора. Можно ускорить уменьшением размера зерен катализатора и увеличением радиуса пор. Однако при увеличении размеров пор уменьшается их количество и внутренняя поверхность → надо находить оптимальную структуру, при которой поры достаточно широки для полного использования внутренней поверхности при выбранном размере зерен.
