
- •Теми лабораторних занять
- •Загальні правила виконання лабораторного практикуму.
- •Хімічні реактиви, їх зберігання та робота з ними
- •Хімічний посуд
- •Посуд загального призначення
- •Посуд спеціального призначення
- •Мірний посуд
- •Нескляний посуд
- •Лабораторна робота № 2. Основні закони хімії. Визначення еквівалентної маси цинку
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результату
- •Контрольні питання та завдання
- •Хід виконання роботи.
- •Обробка результатів
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Дослід 2. Вивчення впливу каталізатора (інгібітору) на швидкість реакції
- •Хід виконання роботи.
- •1. Каталітична дія іонів купруму на швидкість окиснення калій йодиду пероксидом водню в кислому середовищі
- •2. Уповільнення взаємодії нітратної кислоти з міддю за допомогою тіосечовини.
- •Контрольні питання та завдання
- •Лабораторна робота № 4. Визначення теплового ефекту реакції нейтралізації
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •2. Розрахуйте кількість речовини (кислоти) в молях, що знаходиться у заданому об’ємі розчину:
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 5 Приготування розчинів певної концентрації.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 6.
- •Слабкої кислоти
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 7. Гідроліз солей
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 8. Окисно – відновні реакції.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 9. Вивчення методів добування неорганічних сполук різних класів та їх властивостей
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 10. Хімія елементів та їх сполуки. Елементи I та II групи, головної підгрупи.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 11. Твердість води. Визначення зальної твердості води комплексонометричним методом.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 12. Хімія елементів та їх сполуки. Дослідження властивостей нітрогенвмісних сполук
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 13. Хімія елементів та їх сполуки. Дослідження властивостей сульфурвмісних сполук
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 14. Хімія елементів та їх сполуки. Дослідження властивостей сполук мангану та хрому.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 15. Вивчення властивостей елементів підгрупи феруму. Синтез сполук феруму, кобальту, нікелю.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 16. Комплексні сполуки. Методи отримання та їх хімічні властивості
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Додаток
- •Рекомендована література.
Лабораторна робота № 6.
рН-метричне визначення ступеню та константи дисоціації
Слабкої кислоти
Мета роботи: навчитися з допомогою приладу вимірювати рН розчинів, обчислювати ступінь і константу дисоціації слабкого електроліту.
Матеріали і обладнання: рН-метр, мірна колба місткістю 100 мл, бюретка, склянки місткістю 50мл, колба-промивалка, фільтрувальний папір, розчини хлоридної та оцтової кислот з концентрацією 0,01н, розчини оцтової кислоти для контрольного завдання.
Теоретичний мінімум.
При розчиненні електролітів (солей, кислот та основ) у воді відбувається їх електролітична дисоціація – розкладання на позитивні та негативні іони.
Сильні електроліти дисоціюють необоротно, повністю. Отже, в розчинах сильних електролітів немає молекул, а існують тільки іони.
Слабкі електроліти дисоціюють частково. Число, яке показує, яка частина розчиненого електроліту продисоціювала, називається ступенем дисоціації α. Його значення подається в частках одиниці або у відсотках і змінюється від 0 (для неелектролітів) до 1(100%) при повній дисоціації електроліту.
Ступінь електролітичної дисоціації (α) залежить:
а) від концентрації електроліту (з ростом концентрації зменшується);
б) температури;
в) природи електролітів;
г) наявності в розчинах сторонніх іонів.
Таблиця 6.1 – Розподіл електролітів за ступенем дисоціації
Електроліти |
Слабкі α < 3 % |
Середні 3 % <α < 30 % |
Cильні α > 30 % |
Кислоти |
HCN, H2S, H2SiO3, H2CO3, HNO2, CH3COOH |
HF, H2SO3, H3PO4 та інші |
HNO3, H2SO4, HCI, HCIO4, HJ, HBr |
Основи |
NH4OH, нерозчинні |
- |
Луги-гідратні форми оксидів металів І«А» гр. і з ІІ «А»гр. Са(ОН)2, Ba(OH)2, Sr(OH)2 |
Солі |
HgCl2, Hg2Cl2 |
- |
Розчинні |
Концентрація кожного утвореного при дисоціації іона
сіон = αnс,
де с – концентрація електроліту, n – число іонів даного типу, утворених при дисоціації однієї молекули.
Процес дисоціації слабкого електроліту оборотний. У розчині молекули та іони перебувають у рівновазі:
НА Н+ + А МОН М+ + ОН
Слабка кислота Слабка основа
Константа рівноваги процесу дисоціації слабкого електроліту називається -
константою дисоціації K.
[H+] [A] [M+] [OH]
Для слабкої кислоти K = , для слабкої основи K = .
[HA] [MOH]
Константа дисоціації змінюється при нагріванні і не залежить від концентрації.
Ступінь і константа дисоціації математично зв’язані залежністю, відомою як закон розведення Оствальда:
α2
K = с.
1 – α
Для дуже слабких електролітів (α << 1) закон розведення має вигляд:
K = α2·с.
Закон розведення описує дисоціацію слабких бінарних електролітів, тобто електролітів, які дисоціюють на два йони.
Вода – дуже слабкий електроліт, який слабо дисоціює з утворенням іонів Н+ і OH- . Для характеристики процесу дисоціації води можна застосувати закон діючих мас.
Н2О ↔ Н + + ОН -, тоді :
К (Н2О) = [Н+][ОН-] = 1∙10-14 моль/л, або точніше К (Н2О) = а(Н+)∙а(ОН-) = 1∙10-14 моль/л. Константа К (Н2О) називається іонним добутком або константою автоіонізації води.
Тобто в чистій воді або любому водному розчині при сталій температурі добуток концентрацій (активностей) гідроген- та гідроксид- іонів є величина стала, яка називається іонним добутком води.
Константа К (Н2О) залежить від температури: при підвищенні температури К (Н2О) зростає.
В чистій воді активності а(Н+) = а(ОН-) = 1∙10-7 моль/л:
а(Н+)
= а(ОН-)
=
![]() =
1∙10-7
=
1∙10-7
Знаючи концентрацію одного з цих іонів, завжди можна розрахувати концентрацію іншого іона. Як правило, для характеристики кислотності середовища використовують від’ємний десятковий логарифм активності (концентрації) гідроген- іонів, який називається водневим покажчиком рН середовища:
рН = -lg а(Н+)
Нейтральне середовищрН=7, кисле - рН < 7, лужне – рН >7.(рис.32)
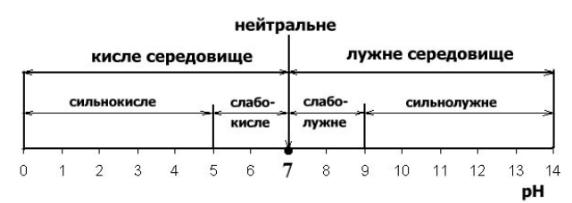
Рис.32. Воднева шкала середовища
Реакцію середовища можна характеризувати й гідроксидним покажчиком : рОН = -lg а(ОН-), або наближено рОН = -lg а[ОН-]
Тоді логарифмування виразу іонного добутку води дасть рН + рОН = 14.
Існує два основних методи визначення показника рН різноманітних розчинів:
1. Метод потенціометрії. Цей метод ґрунтується на вимірюванні потенціалів водневого, гіпгідронного та скляного електрода, які перебувають у стані рівноваги з іонами гідрогену. Для цього використовують прилади: іономери (рис.33) та рН-метри (рис.34).

Рис. 33. Іономер Рис. 34. pH – метр
2. Індикаторний метод. Визначення рН розчинів цим методом ґрунтується та тому, що індикатори змінюють своє забарвлення при різних значеннях рН. Індикатори - це слабкі основи або кислоти (барвники органічного походження), які при зміні рН розчину змінюють свою структуру і відповідно забарвлення.
Наприклад:
Н Іnd = Н + + Іnd -
забарвлення І забарвлення ІІ
або
Іnd ОН = Іnd + + ОН -
забарвлення І забарвлення ІІ
Кожний індикатор має певний інтервал рН, в якому відбувається зміна його забарвлення. Цей інтервал називається інтервалом переходу індикатора.
Якщо інтервал переходу знаходиться в межах рН<7, індикатор може використовуватися для визначення кислотного середовища (метилоранж), якщо рН>7 - для визначення лужного середовища (фенолфталеїн).
Таблиця 6.2. – Характеристика індикаторів
Назва індикатору |
Забарвлення індикатору |
Інтервал індикатора в рН |
|
Кислотна форма |
Лужна форма |
||
Метилоранж |
Червона рН< 3,1 |
Жовта pH>4,4 |
3,1 - 4,4 |
Метил червоний |
Червона pH < 4.2 |
Жовта pH>6.2 |
4,2 – 6,2 |
Лакмус |
Червона рН<5 |
Синя pH>8 |
5,0 – 8,0 |
Фенолфталеїн |
Безбарвна рН< 8.0 |
Малинова pH>9.8 |
8,0 – 9,8 |
