
- •Теми лабораторних занять
- •Загальні правила виконання лабораторного практикуму.
- •Хімічні реактиви, їх зберігання та робота з ними
- •Хімічний посуд
- •Посуд загального призначення
- •Посуд спеціального призначення
- •Мірний посуд
- •Нескляний посуд
- •Лабораторна робота № 2. Основні закони хімії. Визначення еквівалентної маси цинку
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результату
- •Контрольні питання та завдання
- •Хід виконання роботи.
- •Обробка результатів
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Дослід 2. Вивчення впливу каталізатора (інгібітору) на швидкість реакції
- •Хід виконання роботи.
- •1. Каталітична дія іонів купруму на швидкість окиснення калій йодиду пероксидом водню в кислому середовищі
- •2. Уповільнення взаємодії нітратної кислоти з міддю за допомогою тіосечовини.
- •Контрольні питання та завдання
- •Лабораторна робота № 4. Визначення теплового ефекту реакції нейтралізації
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •2. Розрахуйте кількість речовини (кислоти) в молях, що знаходиться у заданому об’ємі розчину:
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 5 Приготування розчинів певної концентрації.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 6.
- •Слабкої кислоти
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 7. Гідроліз солей
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 8. Окисно – відновні реакції.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 9. Вивчення методів добування неорганічних сполук різних класів та їх властивостей
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 10. Хімія елементів та їх сполуки. Елементи I та II групи, головної підгрупи.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 11. Твердість води. Визначення зальної твердості води комплексонометричним методом.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 12. Хімія елементів та їх сполуки. Дослідження властивостей нітрогенвмісних сполук
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 13. Хімія елементів та їх сполуки. Дослідження властивостей сульфурвмісних сполук
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 14. Хімія елементів та їх сполуки. Дослідження властивостей сполук мангану та хрому.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 15. Вивчення властивостей елементів підгрупи феруму. Синтез сполук феруму, кобальту, нікелю.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 16. Комплексні сполуки. Методи отримання та їх хімічні властивості
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Додаток
- •Рекомендована література.
Теоретичний мінімум.
При підвищенні температури швидкість реакції та константа швидкості реакції збільшуються. Згідно з емпіричним правилом Вант-Гоффа, при підвищенні температури на кожні 10 градусів швидкість реакції збільшується приблизно в 2-4 рази. Математично ця залежність визначається співвідношенням:
![]() або
або
![]()
де v1 та k1 – швидкість та константа швидкості реакції при початковій температурі Т1;
v2 та k2 – швидкість та константа швидкості реакції при кінцевій температурі Т2;
γ – температурний коефіцієнт швидкості, який показує в скільки разів збільшується швидкість реакції при підвищенні температури на кожні 10 градусів.
За рівнянням Арреніуса константа швидкості реакції:
![]()
де A = p·z0 – передекспоненційний множник, який не залежить від температури;
z0 – загальне число зіткнень молекул в секунду в одиниці об’єму;
p – стеричний множник, який характеризує ймовірність реалізації сприятливих для взаємодії орієнтацій молекул;
EА – енергія активації хімічної реакції, кДж/моль;
R – універсальна газова стала (R = 8,3110-3 кДж/(мольК))
T – абсолютна температура, К.
Енергія активації – це мінімальна надлишкова енергія (порівняно з середньою енергією молекул при даній температурі), яка необхідна для здійснення акту хімічної взаємодії. Вона витрачається на послаблення або розрив зв’язків між атомами молекул реагентів і на перехід молекул у активований стан. Чим більша енергія активації реакції, тим меншими є швидкість реакції та константа швидкості.
Хід виконання роботи.
При кімнатній температурі в одну пробірку влийте з бюретки 3 мл розчину натрій тіосульфату 0,1 н, в іншу – 3 мл розчину сульфатної кислоти 1 н. Прилийте розчин сульфатної кислоти до розчину натрій тіосульфату, визначте час, який пройшов з моменту зливання розчинів до моменту помутніння. Результати експерименту запишіть до таблиці 3.2.
Щоб провести аналогічний дослід при 40 С, пробірки з 3 мл розчину натрій тіосульфату та 3 мл розчину сульфатної кислоти вміщують у водяну баню з температурою 40 С. Протягом 5 хвилин обидві пробірки термостатують, а потім до розчину солі доливають розчин сульфатної кислоти (причому, пробірку з натрій тіосульфатом не виймають при цьому з бані).
Визначте час, який пройшов з моменту зливання розчинів до моменту помутніння. Результати експерименту запишіть до таблиці.
Аналогічно проведіть експеримент при 60 С. Результати також запишіть до таблиці.
Таблиця 3.2. – Залежність швидкості реакції від температури
Температура |
Час до початку помутніння, τ, c |
Величина 100 , c1 τ пропорційна швидкості |
Температурний коефіцієнт, |
Енергія активації ЕА, кДж/моль |
|
t ,C |
T, К |
||||
Обробка результатів
1. Обчисліть відносну швидкість реакції при кожній з температур:
![]()
2. Побудуйте графік залежності швидкості реакції від температури vt(t), відкладаючи на осі абсцис температуру, а на осі ординат – відносну швидкість.
3. Розрахуйте температурний коефіцієнт швидкості реакції для кожного інтервалу температур (γі) та середнє його значення (γсер):
∆ T/10
T/10
γ1 = √ VT2/VT1 ∆T1 = T2 – T1, К;
∆ T/10
γ2 = √ VT3/VT2 ∆T2 = T3 – T2, К;
∆ T/10
γ3 = √ VT3/VT1 ∆T3 = T3 – T1, К;
4. За рівнянням Арреніуса визначте енергію активації реакції:
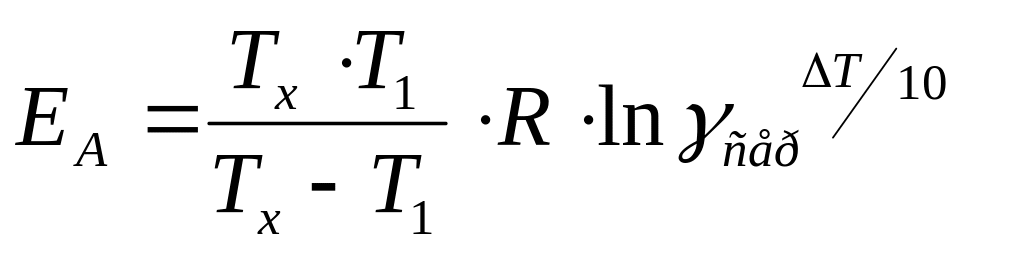 ,
кДж/моль
,
кДж/моль
R – універсальна газова стала (8,3110-3 кДж/(мольК), де Тх дорівнює Т2 або Т3.
5. Результати обчислень занесіть до таблиці та поясніть збільшення швидкості хімічної реакції при збільшенні температури.
