
5. Степень и константа диссоциации.
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации (ионизации). Степень электролитической диссоциации равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества. Величина показывает долю молекул электролита, распавшихся на ионы.
= N/N 100% (или в долях)
Если = 2%, то это означает, что из 100 растворенных молекул 2 распалось на ионы.
По степени диссоциации в не очень разбавленных растворах электролиты разделяют на сильные, слабые и средней силы. Принято считать сильными электролитами те, для которых > 30%, слабыми - если < 3% и средней силы - если 3%< <30%, причем все указанные значения относятся к децимолярному раствору (0,1 М). Более строгое разделение электролитов на сильные и слабые основано на значениях констант диссоциации.
К сильным электролитам в водных растворах относятся почти все соли, многие неорганические кислоты (НNОз, H2SО4, НСlО4, НС1, HBr, HI и др.) и гидроксиды щелочных и щелочноземельных металлов (Ca, Sr, Ba).
Диссоциация - обратимый процесс (исключение составляют растворы очень сильных электролитов), поэтому для диссоциации веществ в растворе вводят константу равновесия - константа диссоциации или ионизации (см. вопрос 6 этой лекции).
Связь между степенью и константой диссоциации показывает закон разбавления Оствальда (1888 г.)
При растворении слабого электролита КА в растворе установится равновесие
КА К+ + А-
Тогда К = [K+] [A-]/[KA]
Если принять, что исходная молярная концентрация равна с, а степень диссоциации , то [K+] = [A-] = с, а [KA] = (1- ) с. Подставляя в выражение получим
К = с . с /(1- )с = с2/1-
Если
1, то
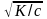
6. Частные случаи константы химического равновесия для растворов.
Константа ионизации.
Электролитическая диссоциация веществ в растворе - процесс обратимый.
Процесс распада электролита на ионы при растворении их в полярных растворителях называется электролитической диссоциацией.
Применив закон действующих масс к процессу распада соединения АnВm в растворе на ионы Аm+ и Bn-
АnВm (р) = nАm+ (р) + mВn- (р),
получим К = [Am+]n [Bn-]m/ [AnBm]
В этом случае константа равновесия характеризует ионизацию вещества в растворе, поэтому ее называют константой ионизацией. Очевидно, чем больше константа ионизации, тем более ионизировано соединение. Поскольку константа равновесия от концентрации не зависит, константа ионизации дает более общую характеристику силы электролита, чем степень ионизации.
Однако это верно лишь для слабых электролитов, растворы которых содержат сравнительно немного ионов. У сильных же электролитов вследствие большого числа ионов заметно сказывается электростатическое взаимодействие ионов друг с другом. Это лишает ион возможности вести себя независимо от других. Свойства электролита оказывается такими, как будто бы концентрация его ионов иная, чем на самом деле. Результатом этого является отклонение концентрации растворенного вещества (в частности, при разбавлении раствора).
Для распространения закона действующих масс на сильные электролиты вместо концентрации вещества в выражение константы равновесия подставляют его эффективную концентрацию (т.е. проявляющую себя в действии) - так называемую активность а. Например, для сильного электролита АnВm
К = an Am+ am Bn- / a AnBm
Как и концентрацию, активность выражают в моль/л. Соотношение между активностью а и концентрацией с дается выражением а = fс, где f- коэффициент активности. Он характеризует отличие свойств растворов сильных электролитов от свойств разбавленных растворов слабых электролитов. В предельно разбавленных растворах (близких к «идеальным») практически отсутствует электростатическое взаимодействие ионов из-за их удаленности друг от друга. В этом случае коэффициент активности близок к единице, т.е. а с. Активность и коэффициент активности определяют на основании экспериментальных данных.
Константы ионизации кислот и оснований.
При упрощенной форме записи:
СН3СООН = Н+ + СН3СОО-
Ка = [H+] [CH3COO-] / [CH3COOH] = 1,754 * 10-5
Многоосновные кислоты ионизируются ступенчато, и каждая ступень ионизации характеризуется своим значением константы ионизации, например:
Н3РО4 = Н+ + Н2РО4-
Ка1 = [Н+] [Н2РО4-] / [Н3РО4] = 7,25 * 10-3;
Н2РО4- = Н+ + НРО42-
Ка2 = [Н+] [НРО42-] / [Н2РО4-] = 6,31 * 10-8
НРО42- = Н+ + РО43-
Ка3 = [Н+] [РО43-] / [НРО42-] = 1,26 * 10-12
Первый ион водорода отрывается от молекулы кислоты легче, а последующие все труднее, так как возрастает отрицательный заряд кислотного остатка.
Сила кислородсодержащих кислот зависит от строения молекулы. Формула кислородсодержащих кислот в общем виде можно записать ЭОm(ОН)n, имея в виду, что в их молекулах имеются связи Н-О-Э и Э=О. Как показывают исследования, сила кислот практически не зависит от n (числа ОН- групп), но заметно возрастает с увеличением m (числа несвязанных в ОН- группы атомов кислорода, т.е. со связями Э=О. По первой ступени ионизации кислоты типа Э(ОН)n относятся к очень слабым (Ка1 = 10-8 - 10-11), типа ЭО(ОН)n - к слабым (Ка1= 10-2 - 10-4), типа ЭО2(ОН)n - к сильным и типа ЭО3(ОН)n - к очень сильным.
(Объяснить как пользоваться справочными таблицами).
Резкое возрастание силы в ряду кислот с увеличением можно объяснить оттягиванием электронной плотности от связи Н-О на связь Э=О.
С увеличением степени окисления центрального атома Э изменение состава образуемых им кислородсодержащих кислот отвечает увеличению m, например: H2SO3 и H2SO4; HNO2 и HNO3 . Поэтому с увеличением степени окисления центрального атома сила кислот обычно возрастает, например:
HClO - HClO2 - HClO3 - HClO4
В этом проявляется общая закономерность: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, кислотные - усиливаются, например:
Mn (OH)2 Mn(OH)3 Mn(OH)4 H2MnO4 HMnO4
основание средней основание амфотерное кислота кислота
силы очень слабое соединение сильная очень сильная
О силе оснований можно судить по значению константы ионизации оснований, которую обозначают Кb. К числу сильных оснований относят гидроксиды щелочных металлов и гидроксиды кальция, стронция, бария.
Константа ионизации воды.
Применим закон действующих масс к самоионизации воды:
Н2О = Н+ + ОН-
Константа ионизации воды
К298 = [Н+] [ОН-] / [Н2О] = 1,8 *10-16
Как видно из выражения константы ионизации, вода в обычных условиях ионизирована крайне мало. Поэтому можно считать, что концентрация воды - величина постоянная; она равна 1000г/л / 18г/моль = 55,56 моль/л. Уравнение для константы ионизации воды можно записать следующим образом:
К [Н2О] = [Н+] [ОН-]
Следовательно, и произведение К [Н2О] для данной температуры постоянно: К [Н2О] = 1,8 * 10-16 * 55,56 = 10-14. Обозначим произведение К[Н2О] = Кw. Следовательно, Кw = [Н+] [ОH-] = 10-14.
Величина Kw называется ионным произведением воды и является постоянной не только для чистой воды, но и для разбавленных водных растворов любых веществ. С повышением температуры К увеличивается, с понижением - уменьшается. Однако для расчетов, относящихся к комнатной температуре, можно во всех случаях принимать Кw = 10-14.
Ионное произведение воды - весьма важная величина, так как позволяет для любого водного раствора найти концентрацию Н+ при известной концентрации ОН-, и наоборот. Для чистой воды концентрация ионов Н+ равна концентрации ОН-, т.е. среда нейтральная: [Н+] = [ОН-]= Кw = 10-7 моль/л.
Если концентрация ионов Н+ выше 10-7 моль/л, а концентрация ОН- ионов ниже этой величины, то раствор будет кислым. Наоборот, щелочной раствор соответствует концентрации ионов ОН- выше 10-7 моль/л при концентрации ионов Н+ ниже этой величины.
Количественное обозначение реакции среды можно упростить, если принять за основу так называемый водородный показатель рН, определяемый как десятичный логарифм концентрации водородных ионов, взятый с обратным знаком: рН = -lg [Н+]. Тогда
Нейтральная среда ................рН = 7
Кислая среда ..........................рН 7
Щелочная среда .....................рН 7
Практически реакцию среды удобно определять с помощью индикаторов - веществ, меняющих свой цвет в зависимости от относительной концентрации ионов Н+ и ОН-
Кислотность некоторых распространенных растворов.
Вещество |
рН |
Вещество |
рН |
Желудочный сок |
1,4 |
Дождевая вода |
6,5 |
Лимонный сок |
2,1 |
Молоко |
6,9 |
Апельсиновый сок |
2,8 |
Кровь |
7,4 |
Вино |
3,5 |
Раствор пищевой соды |
8,5 |
Томатный сок |
4,1 |
Известковая вода |
10,5 |
Черный кофе |
5,0 |
Аммиак, применяемый для бытовых нужд |
11,9 |
Задача 1. Вычислить рН 0,05М раствора серной кислоты, считая ее диссоциацию полной
Решение: H2SO4 = 2H+ + SO42- Тогда концентрация Н+ будет См = 2* 0,05 = 0,1(М)
Следовательно рН = -lg [10-1] = 1
Задача 2. Вычислить рН 0,1 М раствора гидроксида калия, считая диссоциацию полной.
Решение ...
Произведение растворимости.
Применим закон действующих масс к гетерогенной системе - насыщенному раствору малорастворимого соединения, находящегося в равновесии с твердой фазой. Если малорастворимое соединение АmВn распадается на катионы Аn+ и анионы Вm-, то между твердой фазой и раствором установится равновесие:
АmВn (т) = mАn+ (р) + nВm- (р).
При равновесии насыщенный раствор переходит в единицу времени столько ионов, сколько их вновь возвращается в осадок. Это равновесие характеризуется величиной константы равновесия, которую называют произведением растворимости и обозначают ПР:
ПР = [An+]m [Bm-]n
Таким образом, в насыщенном растворе малорастворимого соединения произведение концентрации его ионов в степени стехиометрических коэффициентов при данной температуре есть величина постоянная.
Произведением растворимости называется произведение концентраций ионов в насыщенном растворе малорастворимого электролита при данной температуре.
Произведение растворимости многих малорастворимых соединений определены и сведены в таблицы. Произведение растворимости характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
Пример: СаСО3 = Са2+ + СО32-
ПР = [Са2+] [СО32-] = 4,8 * 10-9
Из понятия ПР вытекает условие образования и растворения осадков. Когда [Са2+] [СО32-] = ПР, система находится в равновесии. Если же [Са2+] [СО32-] ПР или [Са2+] [СО32-] ПР, то система стремится к новому состоянию равновесия, приводящему в первом случае к выпадению осадка, во втором - к его растворению. Иными словами, труднорастворимый электролит выпадает в осадок, когда произведение концентраций его ионов в растворе становится больше величины ПР. Этого можно достигнуть прибавлением избытка электролита, содержащего ионы (для данного случая) Са2+ или СО32-. Такой прием используется для наиболее полного осаждения веществ.
Растворение осадка происходит тогда, когда произведение концентрации его ионов в растворе станет меньше величины ПР, т.е. в нашем примере, когда [Са2+] [СО32-] ПР. Этого можно достигнуть, связывая один из ионов, посылаемых осадком в раствор, в какое-либо другое соединение.
