
3. Разбавленные растворы неэлектролитов.
Неэлектролит - это вещество раствор или расплав которого не проводит электрический ток.
Рассмотрим законы, которым подчиняются разбавленные растворы неэлектролитов. При этом следует принять: растворы очень разбавленные (приближаются к идеальным); при изменении температуры испаряется или кристаллизуется только один компонент - растворитель.
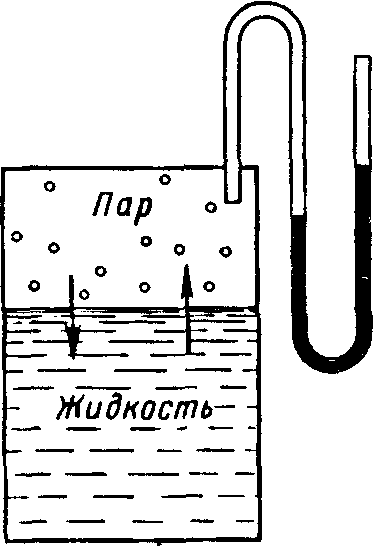
Рис. Схема измерения давления насыщенного пара
1). Давление пара над раствором.
В результате естественного процесса испарения над жидкостью образуется пар, давление которого можно измерить с помощью манометра (рис.). Эндотермический процесс испарения обратим: одновременно протекает экзотермический процесс конденсаций. При определенных условиях устанавливается равновесие (G = 0). Равновесное состояние системы жидкость - пар при данной температуре характеризуется давлением насыщенного пара.
Представим себе, что в равновесную систему жидкость-пар введено нелетучее вещество (его переход в паровую фазу невозможен). При образовании раствора концентрация жидкости-растворителя уменьшается, его мольная доля х становится меньше единицы; это вызывает нарушение равновесия жидкость - пар. В соответствии с принципом Ле Шателье начинает протекать процесс, стремящийся ослабить влияние воздействия, т. е. происходит конденсация пара. Это означает снижение давления пара. Таким образом, можно заключить, что давление пара над раствором р меньше, чем над чистым растворителем р°.
Понижение давления над раствором тем значительнее, чем больше вещества содержится в растворе или чем меньше мольная доля растворителя в растворе.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (одна из формулировок первого закона Рауля, 1887 г. строго применимого для идеальных растворов неэлектролитов).
(р0 - р)/ р0 = хв-ва,
где р0 - давление растворителя над чистым растворителем; р - давление растворителя над раствором; хв-ва - мольная доля растворенного вещества.
Температуры кипения и замерзания растворов.
В прямой зависимости от давления насыщенного пара над раствором нелетучего вещества находится температура кипения раствора.
Температурой кипения жидкости является температура, при которой давление ее насыщенного пара равно внешнему давлению (так, при 101 кПа температура кипения воды равна 100 °С).
Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры кипения раствора для восстановления нарушенного равновесия жидкость - пар. Тогда давление насыщенного пара будет доведено до атмосферного. Таким образом, температура кипения раствора выше температуры кипения растворителя.
С понижением давления пара над раствором связана также более низкая температура отвердевания раствора, чем у чистого растворителя.
Повышение температуры кипения и понижение температуры замерзания раствора пропорциональны числу частиц растворенного вещества и не зависят от его природы (второй закон Рауля).
Ткип. = ЕСm,
Тзам. = КСm.
Сm - моляльная концентрация раствора.
Коэффициенты пропорциональности Е и К называются соответственно эбулиоскопической и криоскопической постоянной. Постоянные Е и К не зависят от природы растворенного вещества, а характеризуют лишь растворитель. Значения постоянных Е и К для многих растворителей определены и сведены в таблицы.
Осмотическое давление.
Явление осмоса.
Тепловому движению в растворах в равной мере подвержены частицы как растворенных веществ, так и растворителя. В результате этого происходит взаимная диффузия частиц растворителя и растворенных веществ, что приводит к выравниванию концентрации во всем объеме раствора. Так, при наличии в растворе двух участков с разными концентрациями С1 С2 происходит диффузия растворенного вещества из области 1 (с большей концентрацией) в область 2 (с меньшей концентрацией), а растворителя - из области 2 в область 1. Если эти области отделить друг от друга перегородкой, проницаемой только для частиц растворителя и задерживающей частицы растворенного вещества, то диффузия будет односторонней. Но и в этом случае она направлена на выравнивание концентрации во всем объеме системы.
Перегородку, способную задерживать растворенные вещества, но проницаемую для растворителя, называют полупроницаемой (полупроницаемые мембраны). Одни из мембран пропускают воду, но не позволяют пройти ионам солей. Другие, с большими порами, пропускают воду, соли и небольшие молекулы, но задерживают белки или макромолекулы, имеющие молекулярную массу порядка нескольких тысяч.
Такими свойствами по отношению к водным растворам обладают целлофан, пергамент, стенки кишечника, мочевой пузырь и т.п.
Явление самопроизвольного переноса растворителя через полупроницаемую перегородку называют осмосом. Он сопровождает многие биологические процессы и находит широкое применение в лабораторной практике. Благодаря ему происходят обменные процессы в растениях и животных организмах.
Создавая в более концентрированном растворе давление, можно воспрепятствовать осмотическому переходу растворителя через полупроницаемую перегородку. Давление, которое требуется создать в растворе, чтобы остановить осмос из чистого растворителя в раствор, называется осмотическим давлением этого раствора. Очевидно, что осмотическое давление - результат осмоса.
Рассмотрим на примере.
Рис.1. Опыт, демонстрирующий осмотическое давление
а - начало опыта: уровень раствора внутри трубки ниже уровня чистого растворителя во внешнем резервуаре; |
б- постепенное повышение уровня жидкости в трубке по мере проникновения в нее растворителя; |
в - равновесие: уровень раствора в трубке перестает повышаться. |
Допустим, что в стакане (рис.1, а) находится чистая вода, а в нее погружена расширяющаяся в нижней части трубка, закрытая снизу мембраной. В трубку налит водный раствор вещества А. Далее, предположим, что молекулы воды могу беспрепятственно проходить сквозь мембрану, но она не пропускает молекулы вещества А. Скорость просачивания молекул воды в трубку из раствора в стакане не зависит от наличия вещества А, но скорость поступления молекул воды обратно из трубки в стакан уменьшается из-за присутствия вещества А. Поскольку в трубку просачивается больше воды, чем одновременно уходит из нее, раствор в трубке поднимается, как это изображено на рис.1, б.
По мере повышения давления в трубке (это давление может измеряться высотой столба раствора) способность к просачиванию молекул воды в трубке повышается. В конце концов достигается такое состояние, когда результирующая скорость вытекания воды из трубки становится такой же, какой она должна быть в отсутствие растворенного вещества, и равновесие с водой в открытом стакане снова восстанавливается (рис.1, в).
Изучая осмотические явления, Вант-Гофф в 1887 г. установил, что осмотическое давление не зависит от природы растворителя. В сильно разбавленных растворах неэлектролитов, сообщающихся через полупроницаемую перегородку с чистым растворителем, осмотическое давление Росм. пропорционально молярной концентрации раствора См: Росм. = СмRТ
Отметим, что уравнение для осмотического давления напоминает закон состояния идеального газа. Идеальным считается такой газ, молекулы которого не притягиваются друг к другу; в идеальном растворе, для которого выполняется уравнение осмотического давления, все молекулы характеризуются одинаковым притяжением друг к другу.
