
- •3. Хімічний аналіз ґрунтів
- •342 Гранулометричний аналіз
- •Гігроскопічна вода
- •Втрати при прожарюванні (впп)
- •Загальний вміст мінеральних речовин
- •35 2 Визиаченнявуглецю
- •Діоксид вуглецю карбонатів
- •Визначення гумусових речовин
- •3 54 Визначенняфосфору
- •3 56 Мікроелементи
- •Мікроелементів
- •155 Список рекомендованої літератури
3 54 Визначенняфосфору
Фосфор у грунтах може бути присутнім як в неорганічному, так і в органічному вигляді, що відрізняються за розчинністю та реакційною здатністю. Органічна фракція може складати від 5 до 90% від загального фосфору. Принципові форми неорганічного фосфору в Грунті - це ортофосфат кальцію, адсорбовані ортофосфати й оклюдовані фосфати. Ґрунти, у яких міститься багато оксиду кальцію, мають високий вміст кальцію і високе значення рН, фосфат кальцію - домінуюча стабільна форма в них. Загальна кількість фосфору в грунті може змінюватися в широкому інтервалі(від 0,1 - 0,8 г Р/кг до 5 - 20 г Р/кг сухого ґрунту). Фосфор, доступний для рослин, складає лише маленьку частину загального фосфору. Концентрації розчинного фосфору у воді коливаються в межах 0,03 - 3 мг/кг сухого фунту.
В усіх грунтах вміст фосфору в нижніх шарах фунту набагато менший, ніж у верхніх. Значна частина фосфору знаходиться в фунті у вигляді фосфорорганічних сполук. Збільшення вмісту фосфору в нижніх горизонтах деяких фунтів пов'язане зі зміною складу гірських порід.
Екстрагують фосфор із фунтів за методом Мекліха, при якому використовується багатокомпонентний розчин. Цей розчин містить 0,2 М НАс, 0,25 М NH4NO3, 0,015 MNH4F, 0,015 М HNO3 і 0,001 М EDTA.
![]()
105
Часто необхідно визначити вміст загального й органічного фосфору. Для визначення загального фосфору використовують сплавку зразка з карбонатом натрію та розкладання хлоратною кислотою. Також для розкладання фосфорвмісних сполук у ґрунтах використовують суміші NaBr/NaOH чи H2SO4 /H2O/HF.
Метод
сплавки з![]() широко
застосовується для визначення загального
широко
застосовується для визначення загального
фосфору в ґрунтах. Але цей метод довготривалий і вимагає використання дорогих платинових тиглів. Тому для рутинних аналізів частіше застосовують метод розкладу фосфорвмісних сполук з нітратною й хлоратною кислотами. Розкладання проводять у колбі Ерленмейєра чи в автоклаві.
Органічний фосфор можна визначати за процедурою Мехта. При цьому зразки фунтів послідовно обробляють концентрованою хлоридною кислотою, 0,5 М NaOH при кімнатній температурі й 0,5 М NaOH при 90 °С. Неорганічний фосфор визначають відразу після екстракції, загальний - після окиснення органічних речовин за допомогою НСЮ4. Органічний фосфор визначають за різницею між загальним фосфором і неорганічним. Можна проводити розкладання фосфорорганічних речовин сумішшю НСЮ4 і NaOH. Також для визначення фосфору можна проводити спалювання зразків фунту при низьких (250 °С) і високих (550 °С) температурах, щоб окиснити неорганічний і органічний фосфор. Але екстракційний варіант більш поширений для видалення фосфору з фунту.
Визначення фосфору можна проводити гравіметричним, титриметричним і фотометричним методами. Усі методи визначення фосфору основані на здатності фосфору утворювати гетерополікислоти з молібденовою кислотою в кислому середовищі (рН 0,8-0,9): Н3РО4 + 12(NH4)2MoO4 + 21HNO3 = (1ЧН4)3[Р(.МозОІ0)4] + 21NH4NO3 + 12Н2О
При дії відновника, наприклад сульфіту, аскорбінової кислоти, гідразину, молібден (VI) у гетерополікислоті відновлюється до середнього ступеня окиснення +5,5, що дорівнює суміші еквівалентних кількостей молібдену (V) і молібдену(УІ). Унаслідок цього утворюється молібденова синь. Фосфор визначають фотометричним методом у вигляді фосфорномолібденової сині у фільтраті після відділення силікатної кислоти. Велика концентрація іонів феруму (III) заважає визначенню, тому їх попередньо відновлюють до феруму (II).
Цю реакцію проводять для визначення неорганічного фосфору - суми ортофосфатів і поліфосфатів після гідролітичного розкладання останніх у кислому середовищі. Вміст поліфосфатів знаходять як різницю між неорганічним фосфором і ортофосфатами.
Методика визначення
Фосфор визначають фотометричним методом у вигляді фосфорномолібденової сині у фільтраті після відділення силікатної кислоти. Велика концентрація іонів Fe3" заважає аналізу, тому їх попередньо відновлюють до Fe2+ металічним алюмінієм. Для цього відбирають у стакан 10 мл або менший об'єм аліквоти, додають 10—15 мл дистильованої води, нагрівають до кипіння і вносять невелику кількість порошку металевого алюмінію. При цьому жовте
106
забарвлення розчину, зумовлене наявністю хлориду феруму (III), зникає внаслідок відновлення іонів Fe3^. Якщо в стакані залишилась тверда фаза металевого алюмінію, то розчин фільтрують, збираючи фільтрат і промивні води в стакан місткістю 100 мл. Загальний об'єм цього розчину не повинен перевищувати 25 — ЗО мл. У разі необхідності розчин випарюють до вказаного об'єму. Додають 20% розчин аміаку до появи слабкої каламуті гідроксидів, які розчиняють додаванням кількох краплин 10% хлоридної кислоти. До 50 мл профільтрованої проби води доливають 2 мл розчину молібденової суміші й через кілька хвилин 0,5 мл 10% розчину аскорбінової кислоти. Суміш перемішують. Одночасно проводять холостий дослід із 50 мл води. Через 15 хв вимірюють оптичну густину розчину при 670—690 нм. Вміст фосфору знаходять за градуювальним графіком, для побудови якого в мірні колби на 50 мл вносять 0; 1,0; 2,5; 5,0; 10,0; 25,0 мл стандартного розчину (0,01 мг РО437л) і доводять об'єм водою до мітки. Далі роблять, як зазначено вище. В одержаних розчинах концентрація фосфатів у перерахунку на досліджувану пробу води дорівнює 0; 0,2; 0,5; 1,0; 2,0; 5,0 мгРО437л.
Вміст Р2О5, %, обчислюють за формулою
а -V, 1.4946-100
![]()
V2gl000 де а —кількість РО43", знайдена за градуювальним графіком в аліквоті, мг,
V, — об'єм фільтрату після відділення силікатної кислоти, мл;
V2— аліквота, взята для аналізу, мл;
g — маса наважки сухої проби, г;
\ 000 —перерахунок міліграмів на грами;
1,4946 — коефіцієнт перерахунку РО43" на РгО5.
і калій (NPK) відкладень основними іони NH4", NO2\ NO3,
Доступні для споживання рослинами нітроген, фосфор характеризують забезпеченість фунтів і донних речовинами живлення рослин. До цієї групи входять легкогідролізуючі нітрогеновмісні органічні сполуки, водорозчинні фосфати й іони К+ (табл. 23). Інтенсивність споживання цих речовин рослинами залежить від багатьох факторів, серед яких головним є природа рослини — її біологічні особливості й фізіологічний стан, у якому вона знаходиться на час відбору проб для аналізу. Тому одноразовий хімічний аналіз ґрунту чи донних відкладень не дає можливості належною мірою характеризувати їх забезпечення поживними речовинами. Для цього слід проводити аналіз фунтів і донних відкладень, а також рослин протягом усього вегетаційного періоду.
107
. Таблиця 23 Умови одержання витяжок із ґрунтів і донних відкладень для визначення NPK
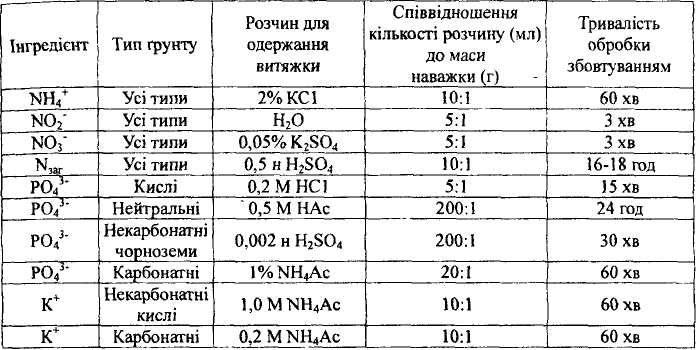
Результати визначення NPK виражають у міліграмах на 100 г сухого зразка. 355 ВИЗНАЧЕННЯ МІНЕРАЛЬНОЇ ЧАСТИНИ
Основну частину грунтів і донних відкладень складають практично нерозчинні у воді силікати. Для визначення силікатів використовують сплавку грунтів з різними плавнями, зокрема сумішшю карбонатів калію і натрію, й отриманий сплав розкладають хлоридною кислотою:
![]()
Також
силікати![]() можна
розкладати фторидною кислотою:
можна
розкладати фторидною кислотою:
SiF4
при
випарюванні видаляється з розчину.
Присутність сульфатної кислоти
допомагає повному видаленню силіцію,
оскільки вона перешкоджає гідролізу:![]()
Крім
того, сульфатна кислота розкладає
фториди металів, що утворилися, і
переводить
їх у сульфати:![]()
При розкладанні плавня хлоридною кислотою силіцій випадає в осад у вигдаді гідратованої силікатної кислоти, а в розчині залишаються в іонній формі
108
ферум, алюміній, манган, титан, кальцій, магній, натрій і калій, сульфат- і ортофосфат-іони.
Після переведення силіцію в нерозчинну силікатну кислоту SiO2nH2O її визначають гравіметричним методом за зважуванням прожареного SiO2 чи різницею у вазі прожареного SiO2 і залишку в тиглі після обробки осаду в тиглі HF і видалення SiF4.
Сума полуторних оксидів. Полуторні оксиди - це оксиди алюмінію, феруму, титану, а також фосфати алюмінію і феруму. За кількісним вмістом полуторні оксиди займають друге місце після SiO2, оскільки алюмосилікати, феросилікати й алюмоферосилікати є найбільш поширеними сполуками силіцію в земній корі.
Алюміній, ферум й титан осаджують розчином гідроксиду амонію у вигляді гідроксидів. Одночасно осаджують нерозчинні фосфати цих елементів. Осадження полуторних оксидів проводять при рН 3-5. Потім осад фільтрують, промивають водою, відмивають від хлоридів і прожарюють при температурі 900 -1 000 °С до постійної маси.
Вміст А12О3 у верхніх шарах ґрунту коливається в межах 6 - 15 %. Униз за ґрунтовим профілем вміст А12О3 звичайно збільшується. Вміст Fe2O3 у верхньому горизонті ґрунту коливається в межах 1,5 - 6,0 %. У піщаних підзолистих ґрунтах вміст Fe2O3 може знижуватися до 0,3%, а в бурому гірсько-лісовому ґрунті Криму - збільшуватися до 12%. Усередині ґрунтового профілю вміст Fe2O3 збільшується для деяких ґрунтів чи залишається на сталому рівні.
Брутто-формула для визначення полуторних оксидів
![]()
Вміст
полуторних оксидів,![]() %,
обчислюють за формулою .:
%,
обчислюють за формулою .:
де а - маса прожареного осаду полуторних оксидів, г; g - маса наважки сухої проби, г.
Прожарений осад полуторних оксидів завжди забруднений невеликою кількістю діоксиду силіцію, для кількісного визначення якого осад переносять у конічну колбу на 100 мл, додають 10 - 30 мл сульфатної кислоти (1:2) і нагрівають до розчинення основної маси осаду. Не розчиненим залишається лише осад оксиду силіцію. Його фільтрують, промивають гарячою водою до повного вилучення іонів феруму, фільтр переносять у тигель і прожарюють. Визначену масу оксиду силіцію віднімають від маси полуторних оксидів і додають до основної маси діоксиду силіцію.
Фільтрат із промивними водами після відділення полуторних оксидів доводять дистильованою водою в мірній колбі до 250 мл і використовують для подальшого визначення іонів кальцію, магнію та сульфід-іонів.
Ферум.
Для
комплексонометричного визначення іонів
феруму відбирають 25
мл фільтрату від силіцевої кислоти,
вносять у конічну колбу на 250 мл, додають
7-8 крапель концентрованої нітратної
кислоти й нагрівають до кипіння для
окиснення іонів Fe2+,
що![]() частково
відбувається в процесі сплавки проби:
частково
відбувається в процесі сплавки проби:
109
Розчин нейтралізують 10% аміаком до появи слабкої каламуті, додають 10 мл 1 моль/л розчину хлоридної кислоти й доводять об'єм до 100 мл дистильованою водою. При подальшому перемішуванні розчину каламуть полуторних оксидів розчиняється і створюється рН 1 - 1,5, що є оптимальним для взаємодії іонів Fe3+ з комплексоном III. Нагрівають розчин до 50-55 °С, додають 1 мл 10% розчину індикатора сульфосаліцилової кислоти й титрують 0,01 моль/л розчином комплексону III до переходу бузково-червоного кольору моносаліцилатного комплексу феруму до лимонно-жовтого кольору, характерного для комплексонату феруму. Чітка зміна кольору індикатора спостерігається при вмісті 1—100 мг Fe2O3 у 100 мл розчину.
Вміст іонів феруму у фільтраті від силікатної кислоти визначають також фотометричним сульфосаліцилатним методом.
При великій концентрації іонів алюмінію, кальцію і магнію аміачний розчин трисаліцилатного комплексу феруму може помутніти внаслідок утворення відповідних гідроксидів. У такому випадку додають більший надлишок сульфосаліцилової кислоти, що зв'язує іони зазначених металів у безбарвні комплекси. При фотометричному визначенні феруму вміст Fe2O3, %, визначають за формулою
a Vj 1.4298 100
![]()
V2 -g-1000 ' де а - кількість феруму, знайдена за градуювальним графіком у аліквоті, мг;
1 000 - перерахунок з міліграмів на грами;
Vt - об'єм фільтрату після відділення силікатної кислоти, мл;
V2 - об'єм аліквоти, відібраної для аналізу, мл;
g - маса наважки сухої проби, г;
1,4298 - коефіцієнт перерахунку Fe на Fe2C>3.
Алюміній. Після комплексонометричного визначення іонів феруму до розчину додають 0,5 мл концентрованої хлоридної кислоти й нагрівають до кипіння для руйнування гідроксокомплексів алюмінію і переведення його в реакційноздатну форму. До гарячого розчину додають з бюретки точно виміряний об'єм 0,01 моль/л розчину комплексону III з таким розрахунком,- щоб його надлишок після утворення комплексоната алюмінію складав 10 мл або більше. Для цього звичайно досить додати 15 - 20 мл розчину комплексону III. Нагрівають розчин до кипіння, кидають у нього шматочок індикаторного папірця конто, нейтралізують 10% розчином ацетату амонію до зміни синього кольору індикаторного папірця на червоний і ще додають 10 мл цього ж розчину. При цьому у розчині рН = 4,5, що є оптимальним для утворення комплексонату алюмінію. Охолоджують розчин до кімнатної температури й титрують 0,01 моль/л робочим розчином FeClj до переходу зеленувато-жовтого кольору розчину, властивого комплексонату феруму (III), до червоного кольору, який виникає внаслідок утворення дисалщилатного комплексу феруму (III) після повного зв'язування надлишку комплексону Ш іонами Fe3*.
Вміст алюмінію, виражений через А12О3,%, визначають за формулою
![]()
і де V) — об'єм фільтрату після відділення силіцієвої кислоти, мл; ■ . >■ • V2 —об'єм аліквоти, взятий для аналізу, мл; -■ >4 ■
V3 — об'єм 0,01 моль/л розчину комплексону НІ, доданий до проби
після титрування феруму, мл; к3 —коефіцієнт для перерахунку концентрації розчину комплексону III
на 0,01 моль/л, якщо його концентрація була іншою; V4 — об'єм 0,01 моль/л розчину FeCl3, витрачений на титрування
надлишку комплексону НІ, мл; к4 — коефіцієнт для перерахунку концентрації розчину FeCl3 на 0,01
моль/л, якщо його концентрація була іншою; g — маса наважки сухої проби, г;
0,0005098 — титр 0,01 моль/л розчину комплексону НІ по А12О3. Манган. Манган визначають у фільтраті після відділення силікатної кислоти. Іони Мп2* окиснюють персульфатом амонію до МпО4\ який визначають за фотометричною методикою. Необхідно стежити за повнотою відділення іонів СГ та маскуванням іонів Fe3+.
Методика визначення
Фільтрат нагрівають до кипіння, додають 0,1 г персульфату амонію та кип'ятять протягом 10 хв для зруйнування органічних сполук. Потім додають 2—З краплини 1% розчину AgNO3) ще невелику кількість персульфату амонію і кілька хвилин кип'ятять. При цьому розчин набуває рожевого забарвлення, що зумовлено утворенням іонів МпО'4- Розчин у колбі охолоджують і переносять у мірну колбу на 100 мл, доводять до риски бідистилятом і вимірюють оптичну густину при 540 нм у кюветі з товщиною шару 5 см відносно бідистиляту.
Концентрацію мангану (мг/л) знаходять за градуювальним графіком. Для його побудови у мірні колби на 100 мл доливають 0,5; 1; 2; 5; 10 мл стандартного розчину перманганату калію з концентрацією 0,01 мг Mn/мл, доводять об'єм водою до риски й перемішують. Вміст мангану в цих розчинах відповідно дорівнює 0,005; 0,010; 0,020; 0,050; 0,100 мг. Вміст МпО, % розраховують за формулою
![]()
де а — кількість мангану, знайдена за градуювальним графіком, мг,
Vt -об'єм фільтрату, мл;
Уг - об'єм аліквоти, відібраної для аналізу, мл, g - маса наважки сухої проби, г;
1,2912 - коефіцієнт перерахунку Мп на МпО.
Титан. Титан визначають у фільтраті після відділення силіцієвої кислоти фотометрично у вигляді жовтого комплексу з пероксидом водню, Іони Fe3+, які у великих кількостях заважають аналізу, маскують додаванням 1 мл
Ill
концентрованої фосфорної кислоти на 50 мл розчину, оптичну густину якого вимірюють. Таку ж кількість фосфорної кислоти вводять у розчин для побудови градуювального графіка. J. \
Методика визначення
У мірну колбу на 50 мл вносять 10 мл проби води, яка містить 10-200 мкг титану, доливають 0,5 мл 1% розчину аскорбінової кислоти, Юмл 1 % свіжовиготовленого водного розчину хромотропової кислоти й 10 мл мурашиноформіатного буферного розчину (до 57 мл 98—100% мурашиної кислоти додають 200 мл води, 28 г гідроксиду натрію та розбавляють водою до 1 л). За допомогою рН-метра перевіряють рН розчину, що має бути в межах 2,9— 3,2. Розбавляють розчин дистильованою водою до риски, залишають на 30 хв і вимірюють оптичну густину при 465 нм. За градуювальним графіком знаходять вміст титану в пробі.
Для побудови градуювального графіка в мірні колби на 50 мл вносять 0; 0,5; 1,0; 2,0; 4,0; 6,0: 8,0; 10,0 мл стандартного розчину титану з концентрацією 10 мкг/мл, доливають дистильованої води до 10 мл і далі проводять операції відповідно до методики.
Вміст ТіОг розраховують за формулою
я-Vf 1,6680-100
![]()
де а - кількість титану, знайдена за градуювальним графіком і аліквотою, мг;
1 000 - перерахунок з міліграмів на грами;
V, - об'єм фільтрату після відділення силікатної кислоти, мл;
V2 - об'єм аліквоти, відібраної для аналізу, мл;
g - маса наважки сухої проби, г;
1,6680 - коефіцієнт перерахунку Ті на ТіО2.
Кальцій та магній. Іони кальцію та магнію визначають комплек-сонометрично у фільтраті після виділення полуторних оксидів. До аліквоти додають 10 мл 2% розчину NaOH і розбавляють дистильованою водою приблизно до 200 мл. Додають 0,2% розчин індикатора кислотного хрому темно-синього (0,2 г розчиняють в 10 мг аміачного буферного розчину з рН 10 і розбавляють до 100 мл етанолом) до рожевого забарвлення розчину й титрують 0,01—0,025— 0,05 моль/л розчином комплексону III, залежно від вмісту кальцію, до стійкого фіолетового забарвлення, яке виникає в точці еквівалентності. При цьому титруються тільки іони кальцію, а іони магнію з комплексоном НІ не взаємодіють. При значній концентрації Mg2+ утворюється осад Mg(OH)2, який заважає титруванню. У такому випадку визначення іонів кальцію повторюють, додаючи попередньо до аліквоти 0,1—0,2 г сахарози.
Для визначення магнію до відтитрованого розчину кидають шматок індикаторного папірця конго і додають краплинами розчин НС1(1 : 1) до переходу забарвлення індикаторного папірця від червоного до синього. При цьому з'являється рожеве забарвлення розчиненого індикатора кислотного хрому темно-синього. Додають 25% розчин аміаку до зміни забарвлення розчину на синє і папірця
112
конго на червоне і 20 мл аміачного буферного розчину з рН 10 (25 г NH4C1 розчиняють у 100 мл дистильованої води, додають 200 мл 20% розчину аміаку й доводять об'єм до 1 л дистильованою водою). За наявності іонів магнію розчин набуває рожево-червоного забарвлення. Титрують робочим розчином комплексону III до появи синювато-фіолетового забарвлення. Вміст СаО, %, обчислюють за Формулою
•t![]()
де V — об'єм робочого розчину комплексону III, витрачений на титрування іонів і • кальцію, мл;
t Vj — об'єм фільтрату після відділення полуторних оксидів, мл;
V2 — об'єм аліквоти, взятий для титрування, мл; * g — маса наважки сухої проби, г;
0,0005608 — титр 0,01 моль/л розчину комплексону за СаО (при збільшенні
концентрації розчину комплексону III відповідно наростає його титр). Вміст MgO розраховують за цією ж формулою, враховуючи, що V — об'єм 0,01 моль/л робочого розчину комплексону НІ, витрачений на титрування магнію, мл, а його титр за MgO дорівнює 0,0004032.
Сульфур. Сульфур у вигляді сульфат-іонів визначають гравіметричним методом у фільтраті після відділення полуторних оксидів.
Методика визначення
У
склянку на 400—600 мл переносять пробу з
вмістом 5—50 мг SO42\
розбавляють
дистильованою водою до 250 мл і додають
2 мл хлоридної кислоти (1:1). Нагрівають
до кипіння при перемішуванні оплавленою
скляною паличкою та повільно краплинами
додають 3 мл 10% розчину хлориду барію.
Розчин з осадом нагрівають на водяній
бані протягом 1 год й залишають
відстоюватись протятом 8-12 год при
кімнатній температурі Осад відфільтровують
крізь фільтр
із синьою смужкою та промивають
декантацією. Частки сульфату барію, які
прилипли до стінок стакана, знімають
маленькими шматочками вологого
фільтрувального
паперу, приєднують їх до маси осаду на
фільтрі й промивають стакан
дистильованою водою. Осад промивають
гарячою дистильованою водою до
відсутності реакції хлорид-іонів у
фільтраті (проба з 1,7% розчином нітрату
срібла).
Промитий осад разом із фільтром висушують
у сушильній шафі до вологого
стану, переносять у зважений тигель,
спалюють фільтр і прожарюють осад
при 750 °С кілька разів до постійної маси.
Вміст SO3,
%,
визначають![]() за
формулою
за
формулою
де а —маса прожареного осаду BaSO.», г;
V/ — об'єм фільтрату після виділення полуторних оксидів, мл;
V2 — об'єм аліквоти, відібраної для аналізу, мл;
g —маса наважки сухої проби, г;
0,343 — коефіцієнт перерахунку BaSO4 на SO3.
113
Калій і натрій визначають методом фотометрії полум'я ~^в розчині, отриманому після розкладу силікатів (мінеральної частини грунтів і донних відкладів) сумішшю фторидної та сульфатної кислот:
К2О • А12О3 • 6SiO2 + 24HF + 4H2SO4 = 6SiF41+ K2SO4 + A12(S OA)2 + 16H2O.
Кількість калію та натрію у верхніх пластах грунтів відносно невелика й коливається для К2О в межах 1,3 - 2,5 %, для Na2O - 0,6 - 2,0%. У більшості випадків кількість калію перевищує кількість натрію в фунтах і тільки для засолених грунтів характерна зміна співвідношення зі збільшенням вмісту натрію.
Калій та натрій входять до складу полевих шпатів та інших мінералів. Із розчинних мінералів, які вміщують калій та натрій, відомі карналіт MgCl2-KCl-6H2O, каїніт KMg(SO4)Cl-3H2O, галіт NaCl, сода Na2CO3-10H2O та ін. Присутність великої кількості натрію в грунті обумовлює його солонцюватість та пов'язане з цим погіршення фізичних властивостей фунтів.
Методика визначення
У попередньо зважену платинову чашку на 50 — 75 мл вносять 0,5 — 0,6 г лабораторної проби повітряно-сухого фунту або висушених при 100—105 °С донних відкладів і прожарюють у муфельній печі протягом 1—2 год при температурі 400—500 °С для руйнування органічних речовин. Охолоджують, додають 1—1,5 мл концентрованої сульфатної кислоти й перемішують Додають 20 мл фторидної кислоти й обережно випарюють під витяжкою до появи густої білої пари SO3. За необхідності повторюють обробку фторидною кислотою до повного розчинення проби. Чашку із залишком поступово нагрівають на пальнику до темно-червоного розжарення для повного вилучення фторидної та сульфатної кислот.
Чашку охолоджують і залишок обробляють при нагріванні декількома мілілітрами розведеної хлоридної кислоти (1 : 1). Додають 5—10 мл дистильованої води, перемішують і фільтрують через фільтр «синя стрічка», збираючи фільтрат і промивні води в мірну колбу на 25 або 50 мл і доводять об'єм розчину до риски. Вміст калію та натрію у розчині визначають методом фотометрії полум'я.
Розчини КС1 або NaCl для побудови градуювального графіка готують в таких же мірних колбах.
Вміст оксидів калію та натрію, %, обчислюють за формулою
a-VK KjlOO
![]()
де С — концентрація іонів К+ або Na\ знайдена за градуювальним графіком, мг/л; V— об'єм мірної колби з розчином для аналізу, мл; g— маса наважки повітряно-сухого фунту, г; К — коефіцієнт перерахунку на сухий фунт; 1 000 —перерахунок концентрації К+ або Na^ на 1 мл; 1 000 — коефіцієнт для перерахунку міліграмів на грами; Кі — коефіцієнт для перерахунку К7 на К.2О (2,4092) або Na+ на Na2O (2,6959). При аналізі сухої проби донних відкладів К=І < - -;», *н*і -.»*»<», <
114
Катіонообмінна здатність грунтів і донних відкладень відіграє важливу роль у кореневому живленні рослин. Обмінна поглинальна здатність грунтів за іонами Са2+, Mg2+, Na+ і Н+ указує на рівень забезпеченості грунту елементами так званого зольного живлення рослин. Обмінна здатність грунтів обумовлює спрямованість ґрунтових процесів і має великий вплив на кореневе живлення рослин, тому вміст обмінних катіонів у ґрунті, а також їх склад і загальна ємність поглинання вважаються важливими показниками хімічних і фізичних властивостей фунтів
Обмінною ємністю грунтів академік К.К. Гедройц назвав властивість ґрунтів обмінювати катіони ґрунтового поглинального комплексу (ПК) на катіони нейтральних сольових розчинів чи іони водню кислоти. Катіони колоїдного комплексу, що вступають в обмінні реакції із зазначеними розчинами, називають обмінними чи поглинальними катіонами. Сумарна ємність поглинання за іонами Са2+, Mg2+ і Na+ при рН 7 для різних фунтів змінюється в межах від 2 -5 ммоль-екв./ІОО г (підзолисті піщані та супіщані) до 70 - 100 ммоль-екв./100 г (торф'яні).
Катіонообмінна (поглинальна) здатність включає визначення обмінних катіонів, ємності поглинання, солонцюватості й кислотності.
Основні закономірності іонного обміну фунтів, установлені К.К. Гедройцем, такі:
Поглинений катіон може бути витиснутий іншим катіоном.
Катіонний обмін у розчинах мінеральних солей відбувається швидко й в еквівалентних кількостях.
При підвищенні концентрації катіона-витиснювача збільшується кількість витиснутих іонів, але ця залежність не прямопропорційна.
Здатність фунтів поглинати різні катіони зростає зі збільшенням величини заряду катіона та його
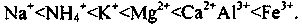 атомної
маси:
атомної
маси:
Іон водню займає особливе місце, оскільки він поглинається фунтом краще, ніж інші одно- й двозарядні іони. Якщо порівняти іони натрію й амонію, то солі амонію витісняють із фунтів більшу кількість обмінних катіонів, ніж солі натрію. Тому вміст обмінних катіонів визначають з використанням амонійних витяжок.
Витиснення обмінних катіонів 1 моль/л розчином NH4C1 методом Гедройца відбувається за схемою
![]()
У приведеній схемі ПК означає органомінеральний поглинальний комплекс. Вміст обмінних катіонів виражають у ммолях-екв./ 100 г фунту чи донних відкладень. Якщо проби містять значну кількість обмінних іонів водню, то при такій обробці в розчин частково переходять й іони полуторних оксидів, що заважає визначенню іонів кальцію і магнію. Тому іони полуторних оксидів необхідно відокремлювати перед аналізом.
Для витиснення обмінних катіонів крім 1 М розчину хлориду амонію використовують 1 М розчин ацетату амонію і 0,1 М розчин хлороводневої кислоти. Визначення обмінних катіонів у карбонатних ґрунтах ускладнюється
115
тим, що при взаємодії цих ґрунтів із сольовими розчинами відбувається часткове розчинення СаСОз і MgCC>3.
Солонцюватість. Насичення фунтів розчинними хлоридми сприяє кращому зростанню рослин, але може збільшувати й вміст токсичних речовин.
Основні солі, що відповідають за солонцюватість грунтів, містять катіони натрію, кальцію і магнію й аніони сульфату й хлориду. Також у грунтах можуть бути присутні іони калію, бікарбонату, карбонату й нітрату. Ці іони присутні в менших кількостях, ніж основні іони. Висока концентрація натрію в фунтах є причиною підвищення дисперсності фунтів і заважає руху води та повітря в фунтах. Найпоширеніший метод визначення вмісту розчинних солей - метод електропровідності.
Ступінь
солонцюватості фунтів характеризується
відношенням кількості обмінних
іонів натрію до ємності поглинання. Для
визначення обмінних іонів натрію
суху пробу обробляють 0,5 моль/л розчином
NaCl,
після чого визначають обмінні
іони натрію, витісняючи їх іонами кальцію
гіпсової води, тобто насиченим
розчином![]()
![]() за
схемою
за
схемою
Вміст гіпсу
Визначення вмісту гіпсу (CaSO4) у фунтах необхідно робити для оцінки гіпсоносності фунтів і внесення виправлень при розрахунку ємності поглинання гшсоносних фунтів. Гіпс витягають із фунтів дією хлоридної кислоти: CaSO4 + 2НС1 = СаС12 + H2SO4
В отриманому розчині визначають іони SO42" і віднімають кількість сульфат-іонів водної витяжки. Кількість. іонів кальцію і кількість гіпсу CaSO42H2O еквівалентна кількості знайдених іонів SO42".
Обмінна кислотність і рН сольової витяжки грунтів
Кислотність кислих фунтів визначають витисненням іонів водню 1 моль/л розчином КС1 при рН 5,6 - 6,0:
![]()
Після одержання сольової витяжки розчину дають постояти 18-24 год, а потім визначають рН цього розчину потенціометричним методом.
За величиною рН отриманого розчину з'ясовують ступінь кислотності досліджуваної проби фунту й залежно від неї встановлюють дози СаО, що необхідні для нейтралізації обмінної кислотності.
За ступенем кислотності розрізняють сильнокислі фунти (рН<4,5); середньокислі (рН=4,6 - 5,0); слабкокислі (рН=5,1 - 5,5) та нейтральні (рН>5,6).
Рухливі форми силікатної кислоти й полуторних оксидів є важливими характеристиками геохімічних і біологічних процесів при створенні фунтів і донних відкладень різних типів. Рухливі форми силіцію й алюмінію визначають після обробки проб розчином КОН, а феруму - розчином оксалату амонію при рН 3,2.
Визначення рухливих форм силікатної кислоти й тугоплавких оксидів (в основному алюмінію) базується на утворенні розчинних метасіликату й алюмінату калію при взаємодії фунту чи донних відкладень із розчином КОН.
116
Накопичення
у витяжці![]() силіцію
чи алюмінію в кількостях, які перевищують
вміст,
що відповідає формулі каоліну 2SiO2
А12О3,
свідчить про наявність у пробі рухливих
форм силікатної кислоти чи алюмінію
відповідно.
силіцію
чи алюмінію в кількостях, які перевищують
вміст,
що відповідає формулі каоліну 2SiO2
А12О3,
свідчить про наявність у пробі рухливих
форм силікатної кислоти чи алюмінію
відповідно.
Аналіз водної витяжки дає інформацію про вміст у грунтах водорозчинних речовин. У водних витяжках із Грунтів визначають ті ж інгредієнти, що й у природних водах, — рН, сольові компоненти, біогенні елементи, мікроелементи та вуглець органічних сполук. Іноді визначають також перманганатну окиснюваність водяних витяжок.
На технічних вагах зважують таку кількість повітряно-сухого ґрунту, що відповідає 100 г сухого грунту. Для цього визначають у ґрунті гігроскопічну воду (див. п. 3.3.1) і відповідно збільшують його наважку. Додають 500 мл дистильованої води, збовтують 3 хв і фільтрують. Якщо фільтрат мутний, його перефільтровують крізь той же фільтр до прозорого розчину.
В
аліквотних частинах фільтрату визначають
рН, сухий залишок, прожарений
залишок, мінералізацію, вміст іонів
Са2*
і НСО' (загальну лужність), іони![]() ,
силікатів, фосфатів,
,
силікатів, фосфатів,![]()
NO3' і вуглецю органічних сполук за наведеними методиками. Вуглець органічних сполук визначають за тією ж методикою, що й хімічне споживання кисню, беручи що 1 мл дихромату калію з концентрацією С(1/6 КгСггСЬ) =0,1 моль/л відповідає 0,0003 г вуглецю. Щоб результат був більш близький до істинного, знайдену величину множать на емпіричний коефіцієнт 1,3.
Результати аналізу водної витяжки виражають у відсотках чи ммолях еквівалентів на 100 г сухого продукту.
