
- •Реакцию раствора удобнее выражать показателями рН или рОн, каждый из которых является отрицательным логарифмом концентрации соответствующего иона.
- •Таким образом, общая жесткость воды равна сумме кальциевой и магниевой жесткостей, с одной стороны, и сумме карбонатной и некарбонатной жесткостей с другой.
- •Глава вторая
- •Б) Влияние внутренних и внешних факторов на скорость коррозии
- •Наличие в воде угольной кислоты и растворенного кислорода обусловливает коррозию железа, протекающую одновременно с кислородной и водородной деполяризацией.
- •И конденсатопроводов
- •В) «Стояночная» коррозия парогенераторов
- •Глава 3
- •Поверхностях нагрева парогенераторов с многократной циркуляцией и теплообменников
- •Б) Условия образования щелочноземельных накипей
- •В) Условия образования ферро- и алюмосиликатных накипей
- •Г) Условия образования железоокисных и железофосфатных накипей
- •Д) Условия образования медных накипей
- •Е) Условия образования отложений легкорастворимых соединений
- •Б) Предпусковая химическая очистка парогенераторов и тракта питательной воды
- •Б) Избирательный унос
- •С многократной циркуляцией
- •Б) Предотвращение кальциевого и магниевого накипеобразования
- •В) Предотвращение образования бескальциевых силикатных, железных и медных накипей
- •Г) Шламовая продувка парогенераторов
- •Д) Непрерывная продувка парогенераторов с многократной циркуляцией
- •E) Ступенчатое испарение и промывка пара
- •Удаление коррозионноагрессивных газов из питательной воды
- •Б) Типы и конструкции термических деаэраторов
- •В) Факторы, влияющие на повышение эффекта термической деаэрации
- •Глава седьмая
- •В) Фильтрующие материалы
- •Г) Эксплуатация осветлительных фильтров
- •Глава восьмая
- •А) Снижение щелочности и умягчение воды известкованием
- •Глава девятая
- •Б) Водород-катионирование
- •В) Анионирование
Глава вторая
КОРРОЗИЯ МЕТАЛЛА ПАРОСИЛОВОГО ОБОРУДОВАНИЯ И МЕТОДЫ БОРЬБЫ С НЕЙ
2-1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Металлы и сплавы, употребляемые для изготовления теплоэнергетического оборудования, обладают способностью вступать во взаимодействие с соприкасающейся с ними средой (вода, пар, газы), содержащей те или иные коррозионноагрессивные примеси ( кислород, угольная и другие кислоты, щелочи и др.). В результате воздействия агрессивной среды происходит коррозионное разрушение металла или сплава вследствие электрохимических и химических процессов, которое обычно начинается с поверхности и более или менее быстро продвигается вглубь.
При появлении на поверхности металла макро- или микрогальванических элементов на тех участках, где он соприкасается с растворами электролитов и влажным паром, протекает электрохимическая коррозия, которая наиболее часто встречается в практике эксплуатации тепловых электростанций. Этому виду коррозии подвержены водоподготовительное оборудование; все элементы тракта питательной воды и трубопроводы, возвращающие конденсат с производства, парогенераторы; атомные реакторы; конденсаторы паровых турбин и тепловые сети.
При эксплуатации указанного паросилового оборудования всегда существуют условия для протекания электрохимической коррозии, в том числе: контакт различных металлов, неоднородность поверхности, нарушение кристаллической решетки металла, неравномерность температурного поля, различие концентрации примесей в слоях раствора, контактирующих с металлом, и ряд других факторов.
Химическая коррозия происходит в результате непосредственного окисления котельного металла высокоперегретым паром.
В практике эксплуатации энергоустановок наблюдаются также комбинированные случаи разрушений металла, т. е. совместное протекание химической и электрохимической коррозии. В результате коррозионного воздействия агрессивных агентов на металл непосредственно на его поверхности и в тесном контакте с ним образуется защитная микропористая окисная пленка, которая представляет собой продукт коррозии металла и тормозит дальнейшее развитие коррозионного процесса. Чем полнее и равномернее окисная пленка покрывает поверхность металла, чем меньше в ней трещин, тем более высокими защитными свойствами она обладает.
В практических условиях защитные свойства пленки определяются не только тем сопротивлением, которое она оказывает коррозионноагрессивному агенту, но и ее сохранностью. Наибольшую целостность имеют защитные пленки, обладающие хорошим сцеплением с металлом, достаточно прочные и пластичные, с минимальной разницей в коэффициентах линейного расширения по сравнению с металлом.
Повреждения защитной пленки могут быть вызваны механическими, химическими или термическими процессами. Коробление барабанов парогенераторов, резкие колебания температуры стенки парообразующих труб вследствие попеременного омывания их водой и паром, воздействие на поверхность котельного металла концентрированных растворов NaOH при глубоком упаривании котловой воды и т. п. — все эти процессы могут разрушать защитную окисную пленку. Если защитная пленка по тем или иным причинам растрескивается и отслаивается от металла, то процесс коррозии развивается дальше с повышенной скоростью, которая постепенно замедляется, пока вновь не произойдет очередное разрушение защитной пленки. Следствием коррозии элементов парогенератора и тракта питательной воды является отложение окислов металлов как в парообразующих и пароперегревательных трубах, так и в проточной части паровой турбины.
Статистические данные свидетельствуют о том, что больше половины аварий и значительное число эксплуатационных неполадок, происходящих на тепловых электростанциях из-за дефектов водного режима, вызваны коррозионными повреждениями основного и вспомогательного оборудования.
Основными источниками появления окислов железа и меди в теплоносителе являются:
а) коррозия элементов водопарового тракта, в том числе водоподготовительного оборудования, трубных пучков регенеративных подогревателей и конденсаторов турбин, конденсатопроводов, баков для хранения обессоленной воды и конденсатов и др.;
б) коррозия водяных экономайзеров;
в) стояночная коррозия находящихся в резерве парогенераторов и вспомогательного оборудования при отсутствии их эффективной консервации;
г) разрушение слоя окалины и окисных отложений на внутренних поверхностях барабанов, парообразующих и пароперегревательных труб;
д) неэффективная шламовая продувка парогенераторов.
На электростанциях сверхвысокого и сверхкритического давлений наблюдается коррозионное растрескивание элементов оборудования, выполненных из аустенитных сталей. В практике известны случаи, когда этот опасный вид коррозии приводит за очень короткий срок к аварийному выходу из строя агрегатов. Коррозия элементов проточной части паровой турбины приводит к увеличению радиального зазора между лопатками и корпусом, что влечет за собой ухудшение к. п. д. турбины.
Последствия коррозии паровых турбин, находящихся в резерве, весьма опасны. Поэтому защита их от коррозии во время простоев является таким же обязательным мероприятием, как и защита в процессе эксплуатации.
Необходимо учитывать, что коррозионные повреждения (свищи, трещины) конденсаторных труб как с паровой стороны (под действием NH3 и О2), так и с водяной стороны (под действием агрессивной охлаждающей воды) могут привести к опасным загрязнениям конденсата из-за присосов охлаждающей воды.
Сужение поперечного сечения теплофикационных сетей вследствие образующихся при коррозии бугров или наростов окислов железа приводит к увеличению гидравлического сопротивления и снижению пропускной способности сетей. При работе тепловых сетей немалые неприятности причиняет обогащение воды продуктами коррозии, что может вызвать скопление их в застойных местах или на участках с малыми скоростями движения. Забивание коррозионными отложениями местных систем отопления целиком выводит из работы отдельные приборы и стояки.
Актуальность борьбы с коррозией в теплофикационных системах централизованного горячего водоснабжения связана со значительным ростом протяженности коммуникаций. Предотвращение возникновения коррозии оборудования паротурбинных установок и теплофикационных систем, а также поддержание длительной сохранности защитной окисной пленки на поверхности металла являются сложной задачей, для решения которой необходимо применять современные средства подготовки добавочной воды, обработки котловой воды, а также умело подбирать коррозионностойкие металлы и защитные покрытия .
2-2. ФОРМЫ ПРОЯВЛЕНИЯ КОРРОЗИИ
Различают общую и местную разрушений металла.
Общая (равномерная) коррозия охватывает всю или почти всю поверхность металла, находящуюся под действием агрессивной среды. Равномерная коррозия протекает примерно с одинаковой скоростью по всей поверхности металла.
Местная (неравномерная) коррозия протекает с неодинаковой скоростью по поверхности металла, в результате чего коррозионные разрушения концентрируются на определенных участках. При этом различают следующие типы местной коррозии: пятнами, язвинами, точечную и сквозную. Язвины малого диаметра (до 4—5 мм) присущи коррозионному воздействию на металл кислорода как во время простоя, так и во время работы парогенераторов. С язвинами кислородной коррозии имеют большое внешнее сходство повреждения металла вследствие гак называемой «ракушечной» коррозии, развивающейся на стенках парообразующих труб в виде язвин большого диаметра, прикрытых плотным слоем окислов железа.
Следует указать, что чем больше степень локализации коррозии, тем она опаснее из-за большой скорости проникновения в глубь металла. На поверхности энергетического оборудования, соприкасающегося с водой и паром, могут иметь место все указанные формы коррозионных разрушений, причем на практике встречаются различные модификации и сочетания этих форм местной коррозии. В заклепочных швах, развальцованных концах парообразующих труб и в теле барабана парогенератора при определенных неблагоприятных условиях возникает межкристаллитная коррозия, или так называемая «каустическая хрупкость» металла, которая приводит к значительной потере его механической прочности. Начальные весьма тонкие и незаметные для глаза трещины и ответвления от них проходят между кристаллитами металла; основные же трещины обычно имеют транскристаллитный характер, т. е. проходят через зерна кристаллитов (рис. 2-1). Межкристаллитная коррозия приводит к кольцевым трещинам в завальцованных концах труб. Продукты межкристаллитной коррозии располагаются здесь же, оставаясь, таким образом, заключенными внутри металла. Корозионному растрескиванию особенно подвержены аустенитные нержавеющие стали, а также латунь, причем разрушение структуры металла может иметь как транскристаллитный, так и межкристаллитный характер..
Особое место занимают повреждения, возникающие при явлении коррозионной усталости, когда агрессивное действие внешней среды сочетается с переменными по величине и знаку механическими напряжениями металла. Разрушения, происходящие в результате коррозионной усталости, почти не сопровождаются пластической деформацией детали. Трещины часто имеют ветвистый (древовидный) характер и проходят обычно по телу зерна, т. е. имеет место транскристаллитное разрушение металла (рис. 2-2). Пароводяная коррозия котельных труб и пароперегревателей, возникающая под действием высокоперегретого пара, обычно имеет равномерный характер и приводит к уменьшению толщины стенки трубы.

Рис. 2-2. Транскристаллитная коррозия котельного металла.
Резко выраженных язвин при этом не получается, хотя глубина разъедания металла может сильно изменяться по длине и окружности трубы в зависимости от характера расслоения пароводяной смеси и теплонапряженности поверхности металла.
Водородная коррозия наблюдается в различных зонах парогенератора, но только на участках, подвергающихся местной коррозии с усиленным выделением водорода. Она проявляется обычно в форме неглубоких язвин или углублений, под которыми обнаруживается хрупкий обезуглероженный металл. Парообразующие трубы в местах разрыва имеют толстые края без заметного утоньшения стенки, а над сварными швами имеются только язвинки.
Наиболее распространенной формой повреждения латунных труб конденсаторов паровых турбин, охлаждаемых высокоминерализованной пресной или морской водой, является избирательная коррозия, характеризующаяся потерей этим сплавом цинка, который уходит в раствор. Латунь, лишенная цинка, становится хрупкой, и конденсаторные трубы легко ломаются. Нередко имеют место осповидные разрушения конденсаторных труб с образованием сквозных свищей диаметром в булавочную головку (пробочное обесцинкование).
Разнообразие форм коррозионных разрушений металла паросилового оборудования обусловлено сложностью процесса коррозии и влиянием большого количества факторов на его развитие.
2-3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
а) Механизм и условия протекания коррозионных процессов
К электрохимической коррозии относятся процессы разрушения металла, сопровождающиеся протеканием электрического тока от одной части металла к другой. Электрохимическая коррозия возникает в результате взаимодействия металла и раствора электролита, являющегося проводником электричества, либо под действием внешнего электрического тока (например, блуждающих токов). Гальванический элемент, за счет работы которого идет коррозионный процесс, называют коррозионным элементом. Действие коррозионного элемента может быть пояснено на примере гальванической пары (рис. 2-3), состоящей из железного и медного электродов, погруженных в электролит (например, в раствор NaCl).
При замыкании электродов внешним проводником отмечается прохождение тока по этому проводнику, обусловленное перемещением электронов от железного электрода (анода) к медному, являющемуся «приемщиком» электронов, т. е. катодом. Отвод электронов от железного электрода вызывает освобождение соответствующего им (по количеству зарядов) числа ионов-атомов железа с переходом последних в раствор. Таким образом, вторым следствием замыкания электродов является переход железа в раствор, или, иными словами, коррозия этого элемента. Третьим следствием является усвоение поступающих к катоду электронов, находящихся в электролите, ионами или молекулами.
Описанная модель коррозионного элемента в основном воспроизводит характер действия на металл или сплав коррозионной среды— электролита. При погружении такого металла или сплава в водный раствор вся поверхность его разделяется на большое количество анодных и катодных участков, создающих условия для протекания коррозионного процесса.
Коррозионные элементы, электроды которых имеют размеры, хорошо различаемые невооруженным глазом, называют макрогальваническими элементами, а электроды, которые могут быть обнаружены лишь при помощи микроскопа, — микрогальваническими элементами. При наличии микроэлементов некоторые участки поверхности металла играют роль растворяющихся анодои, а другие участки являются катодами. На поверхности корродирующего металла имеется множество микроанодов и микрокатодов, непосредственно замкнутых между собой и представляющих поэтому так называемый многоэлектродный коррозионный элемент. Потенциалы металлов, погруженных в 1 н. раствор своих ионов, называются нормальными электродными потенциалами. Если построить гальванический элемент из двух различных металлов, погруженных в 1 н. растворы своих ионов, то знак заряда в таком элементе будет определяться относительным положением этих металлов в ряду напряжений (таб. 2-1).
37
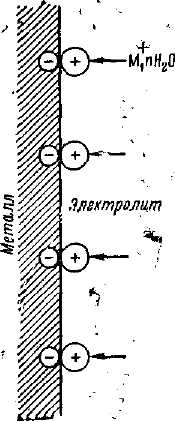 Рис. 2-3. Схема коррозионного элемента
Рис. 2-3. Схема коррозионного элемента
Таблица 2-1 Нормальные электродные потенциалы металлов (при 25 °С)
Электрод, в |
Электрод, е |
Электрод, s |
|||
Li/Li2+ |
—2,96 |
Cr/Cr2 + |
—0,56 |
Fe/Fc3+ |
—0,05 |
К/К+ |
—3,93 |
Fe/Fea+ |
—0,44 |
H/H + |
+0,00 |
Mg/Mg2+ |
— 1,87 |
Cd/Cd2+ |
—0,40 |
Cu/Cu2+ |
+0,34 |
А1/АН+ |
— 1,33 |
Ni/Ni2+ |
-0,23 |
Ag/Ag2+ |
+0,80 |
Mn/Mn2+ |
— 1,10 |
Sn/Sn2+ |
—0,14 |
Hg/Hg2+ |
+ 10,86 |
Zn/Zn2+ |
—0,76 |
Pb/Pb2 + |
—0,12 |
Au/Au + |
+ 1,50 |
Каждый металл — член этого ряда — будет катодом в отношении всех металлов, стоящих до него, и анодном в отношении всех последующих членов ряда. При отсутствии влияния других факторов каждый металл, стоящий в ряду напряжений, будет вытеснять из раствора ионы всех последующих металлов, а сам переходить в раствор. Таким образом, при электрохимической коррозии металла разрушающимися анодными участками являются участки с наименьшим электродным потенциалом растворения. Неразрушающиеся катодные участки характеризуются более высоким электродным потенциалом растворения. На анодных участках металл переходит в раствор в виде положительно заряженных ионов. Освобождающиеся на аноде электроны протекают к катодным участкам, где они разряжают положительно заряженные ионы электролита или же ионизируют кислород, образуя гидроксильные ионы. Следовательно, у анодных участков создается повышенная концентрация ионов металла, а у катодных вследствие разряда ионов водорода или восстановление содержащегося в воде молекулярного кислорода накапливаются ионы ОН-. Там, где встречаются продукты катодной и анодной реакций, образуется гидрат закиси корродирующего металла— вторичный продукт коррозии. Например:
Fe2+ + 2OH- → Fe(OH)2.
В некоторых случаях продукты коррозии могут претерпевать дальнейшие изменения, вступая во взаимодействие, например, с кислородом с образованием гидрата окиси железа либо с крепкой щелочью с образованием феррита натрия (NaFeO2). Продукты коррозии образуют на поверхности разрушаемого металла достаточно плотный слой, который может в значительной мере снизить интенсивность коррозии или вовсе прекратить ее.
Электродвижущая сила любой гальванической пары равна алгебраической разности электродных потенциалов катода и анода:
ЭДС=Е=εк - εа ,
где εк — электродный потенциал электрода, на котором протекает катодная реакция и который в цепи является положительным электродом; εа — электродный потенциал электрода, на котором протекает анодная реакция и который в цепи является отрицательным электродом.
Эта разность тем больше, чем дальше друг от друга расположены металлы в ряду напряжений. Например, в паре медь—-цинк разность электродных потенциалов 1,10 в, в паре железо—-цинк 0,32 в. Таким образом, электрохимический заряд напряжений дает важные указания относительно поведения металла в гальванической паре с другим металлом и в соприкосновении с раствором ионов другого металла. В условиях эксплуатации металлы большей частью не находятся в растворах собственных ионов; средой может служить конденсат, химически обработанная или котловая вода. Электродные потенциалы металлов в этих случаях отличаются от нормальных потенциалов.
На электродные потенциалы металлов с защитными пленками большое влияние оказывают характер этих пленок и, в частности, их электропроводность, количество и величина пор, толщина слоя. При наличии в защитной пленке многочисленных слабых мест, легко подвергающихся разрушению в электролите, в этих местах (порах) образуются гальванопары, где обнаженный металл, находящийся в контакте с раствором электролита, играет роль анода.
Неравномерное распределение продуктов коррозии на поверхности металла вызывает образование макропар. При этом процесс ржавления сосредоточивается под окислами железа, так как металл в этом месте выполняет роль анода, а вся остальная поверхность, лишенная окислов, является катодом. Чем меньше площадь, занятая продуктами коррозии, тем сильнее будет действовать образовавшаяся макрогальванопара по отношению к корродированным участкам, выполняющим роль анодов.
Скорость разрушения металла в язвинах за счет тока указанной макропары в несколько раз превышает скорость общей коррозии металла.
Из изложенного выше следует, что
одним из основных условий протекания коррозионного процесса является наличие электрохимической неоднородности поверхности раздела металл — электролит, качественно выражающееся разностью потенциалов на различных участках, образующих гальванические цепи.
Если бы электродные потенциалы анодных и катодных участков корродирующего металла сохраняли свою первоначальную величину, то разрушения металла в десятки, сотни и тысячи раз превышали бы действительно наблюдаемые. Эксперимент показывает, что действительная скорость коррозии во много раз меньше вычисленной по законам Ома и Фарадея на основании начальной разности потенциалов анода и катода. Оказывается, что уже через очень короткое время после замыкания электродов э. д. с. значительно уменьшается по сравнению с первоначальной. Уменьшение тока (и соответственно скорости коррозии) связано с изменением потенциалов сразу же после замыкания, т. е. как только пары начинают работать.
Уменьшение начальной разности потенциалов электродов гальванического коррозионного элемента, приводящее к уменьшению интенсивности коррозии, называется поляризацией. Поляризация тормозит работу коррозионных элементов и может уменьшать скорость коррозии в десятки и сотни раз.
Некоторые вещества, содержащиеся в питательной или котловой воде, могут вызывать усиление коррозии. Такие вещества называются ускорителями или стимуляторами коррозии, наоборот, вещества, заметно снижающие скорость коррозии, называются замедлителями или ингибиторами коррозии.
Типичными стимуляторами коррозии являются ионы хлора, которые ослабляют защитные свойства пленок. Механизм их разрушающего действия состоит в следующем. Ионы хлора способны адсорбироваться (поглощаться) окисными пленками, расположенными на металле, и вытеснять из последних ионы кислорода. В результате такой замены ионов кислорода ионами хлора в точках абсорбции получается растворимое в воде хлористое железо, что приводит к увеличению площади анодных участков. К замедлителям коррозии стали следует причислить щелочи, например NaOH, Na3PO4, Na2HPO4 и (NaPO3)6.
