
- •Конспект лекцій з дисципліни «Біохімічні основи мікробного синтезу» для студентів напряму 6.051401 «Біотехнологія»
- •Тема 1. Транспорт компонентів середовища в клітині мікроорганізмів
- •Тема 2. Компоненти середовища, які містять азот та їх асиміляція мікроорганізмами.
- •Тема 6. Асиміляція вуглеводів мікроорганізмами
- •Тема 10. Основні принципи регуляції обміну речовин у мікроорганізмів
- •Тема 14. Метаболічний фонд мікроорганізмів
- •Тема 15. Мікробіологічний синтез органічних кислот
- •Тема 9. Біосинтези через ацил-КоА
- •Тема 10. Біосинтез циклічних структур через гексозомонофосфатний шлях обміну вуглеводів
- •Тема 12. Біосинтез амінокислот
- •Тема 14. Мікробіологічний синтез пептидів
- •Тема 15. Синтез нуклеотидів, їх похідних та флавінів
- •Глава 16 біосинтез стрептоміцину
- •2. Біосинтез n-метилглюкозаміну та стрептози
- •Глава 23. Коферменти та їх функції
- •Оксиредуктази
- •Трансферази
- •Гідролази
- •Лігази (синтетази)
- •Тема т26. Типи бродіння
- •26.1 Спиртове бродіння
- •26.2 Молочнокисле бродіння
- •26.2.1 Гомоферментативне молочнокисле бродіння
- •26.2.2 Гетероферментативне молочнокисле бродіння
- •26.3 Пропіоновокисле бродіння
- •26.4 Мурашинокисле бродіння
- •26.5. Маслянокисле та ацетоно-бутилове бродіння.
- •19. Перенесення електронів в анаеробних умовах (анаеробне дихання)
- •27.1Денітрифікауія та відновлення нітрату
- •27.2. Утворення сірководню у процесі відновлення сульфату
- •27.3 Утворення метану у процесі відновлення карбонату
- •27.4. Утворення ацетату у процесі відновлення карбонату
- •27.5. Утворення сукцинату у процесі відновлення фумарату
- •27.6 Відновлення іонів Fe (III) до Fe (II)
- •51918, М. Дніпродзержинськ, вул. Дніпробудівська,2
Глава 16 біосинтез стрептоміцину
БІОСИНТЕЗ СТРЕПТИДИНУ
Синтез стрептоміцину здійснюють культури, що відносяться до актиноміцетів, головним чином різні мутанти Actinomyces streptomyces. Молекула стрептоміцину складається з двох частин: стрептидину та стрептобіозаміну. Стрептидин є похідним інозиту, що містить гуанідинові групи. Стрептобіозамін уявляє собою дисахарид. Він складається із стрептози (пентози) та N-метил-L-глюкозаміну. В стрептобіозаміні залишок N-метил-L-глюкозаміну з’єднаний з залишком стрептози глікозидного зв’язку, а зв’язок між залишками стрептидину та стрептобіозаміну здійснюється за рахунок глікозидного гідроксилу стрептозної частини стрептобіозаміну.
Окрім стрептоміцину (рис.23-1) серед продуктів метаболізму продуцента зустрічається дві близьких за структурою сполуки. Одна з них –

дигидрострептоміцин, в молекулі якого замість альдегідної групи стрептози знаходиться оксиметильна група; інша – маннозидострептоміцин. Останній відрізняється від стрептоміцину наявністю D-маннози, з’єднаною глікозидним зв’язком з 4-м вуглецевим атомом N-метилглюкозаміну.
Тут будуть розглянуті біохімічні механізми синтезу структурних одиниць, що входять до складу молекули стрептоміцину. Вони цікаві та важливі не тільки стосовно синтезу стрептоміцину, але і тому, що зустрічаються в ряду інших природних сполук, які синтезуються мікроорганізмами.
Вихідним продуктом синтезу стрептидину (рис.24-2) є глюкоза (1), яка підлягає фосфорилюванню з утворенням глюкозо-6-фосфата (2). В результаті активності глюкозо-6-фосфатциклази утворюється міо-інозитол-фосфат (3), який під дією специфічної інозитом-1-фосфатази дефосфорилюється до міо-інозитолу (4). Останній підлягає дегідруванню завдяки активності інозитом-2-дегідрогенази при одночасному відновленню НАД+ з утворенням кето-сцило-інозитолу, що містить кето-групу (5), важливу для наступної трансаміназної реакції. Донором аміногрупи тут слугує глютамін, що віддає свою амінну групу.
В реакції приймає участь піридоксальфосфатзалежний фермент L-глутамін кето-сцило-інозитол амінотрансфераза. Продуктами реакції є 1-аміно-1-дезокси-сцило-інозитол (6) та 2-кетоглутарамід. Характерною особливістю реакції, яка призводить до утворення N-амідинопохідного, є необхідність мати в якості акцепторного з’єднання фосфорильованого похідного. Таким фосфорильованим похідним є п-фосфорил-сцило-інозамін (7), який з’являється в результаті активності сцилоінозамінкінази (АТФ, інозамін фосфотрансфераза). В реакції трансамідування приймає участь аргінін. Він віддає аміди нову групу. Допускають, що амідинотрансфераза (L-аргінін: інозамінфосфат амінотрансфераза) обирає в якості акцептору аміногрупу, яка розташована в пара-положенні відносно фосфатної групи. В результаті утворюється п- фосфорил-N-амідо-сцило-інозамін (8) та орнітин.
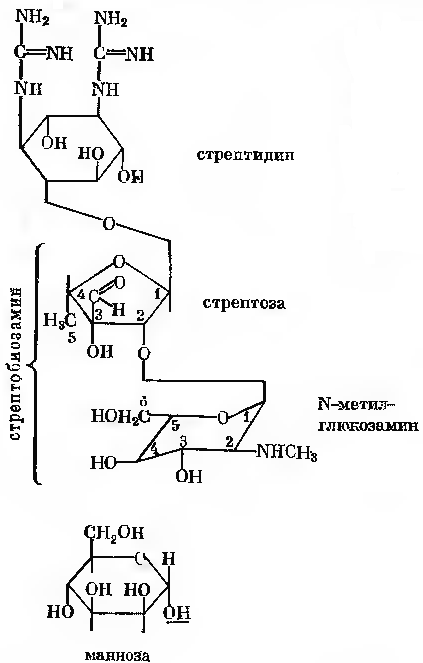
Рис. 24-1. Стрептоміцин, дигідрострептоміцин та маннозидостренцин. Дигідрострептоміцин містить -СН2ОН- групу при з-С-атомі стрептози. Маннозидострептоміцин містить маннозу, що приєднана через ОН-групу 1-С-атома до 4-С-атому N-метилглюкозаміну
Далі прямують реакції, які мали місце раніше: дефосфорилювання, продуктом якого був N-амідино-сцило-інозамін (9), дегідрування з утворенням кето-похідного, N-амідино-3-кето-сцило-інозаміну (10).
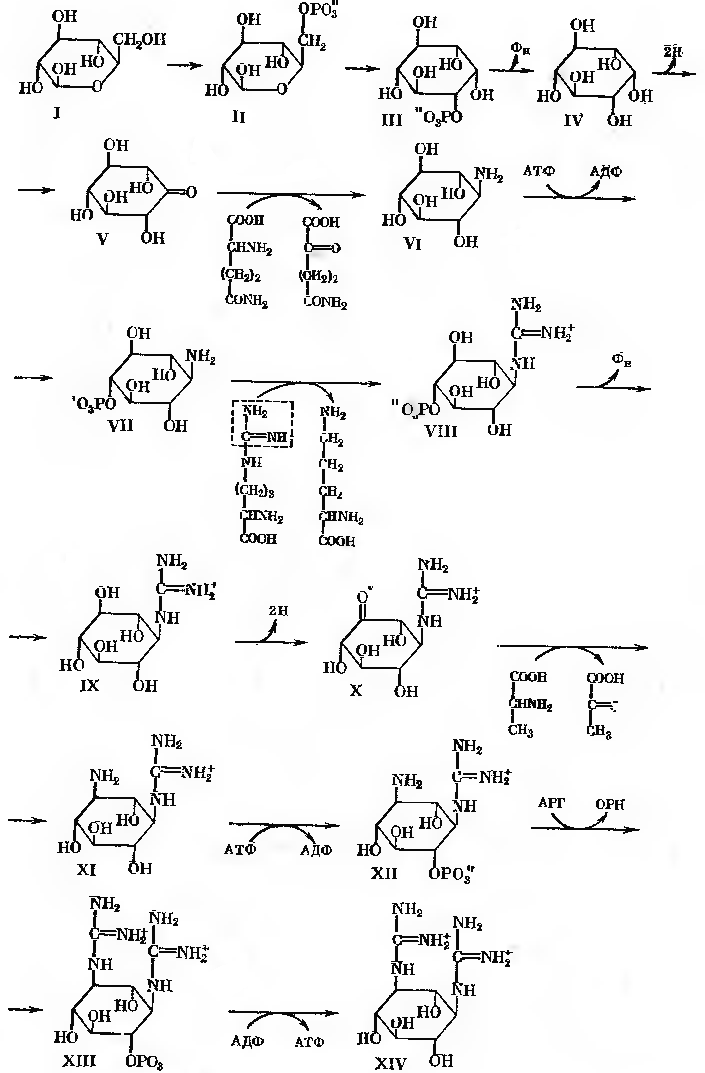
Рис. 24-2. Біосинтез молекули стрептидину
В реакції трансамінування кето-похідного на цьому етапі приймає участь α-аланін. Завдяки активності L-аланіну: 1-D-1-гуанідино-1дезокси-3кето-сцило-інозитол амінотрансферази відбувається синтез N-амідинострептаміну (11). Потім знову відбувається фосфорилювання; фосфатний залишок розташовується в пара-положенні відносно аміногрупи (п-фосфорил-N-амідинострептамін, 12). Трансаміназа та фосфатаза закінчують формування молекули стрептидину (13-14). Однак в реакції синтезу молекули стрептоміцину, можливо, приймає участь не вільний стрептидин, а його фосфат.
Треба звернути увагу на емпіричне спостереження, яке стосується інгібуючого ефекту фосфату на біосинтез стрептоміцина за його ферментації. Тепер відомо, що фосфат інгібує дефосфорилювання фосфорилюючих прміжних продуктів синтеза стрептоміцину, в результаті чого вони акумулюються в середовищі або в клітині. Цей факт дає можливість припустити, що вільний стрептидин, зокрема, не є фізіологічно нормальною проміжною сполукою, хоча не виключно, що стрептидиновий залишок повторно підлягає фосфорилюванню на рівні сформованої молекули стрептоміцину.
