
- •1. Какие параметры системы определяют скорость химических реакции
- •Модели ферментативного катализа
- •11. Как зависит скорость ферментативной реакции от концентрации субстрата?
- •12. Уравнение Михаэлиса-Ментена
- •15. Конкурентное ингибирование (определение, схемы уравнеийхарактеризующих процесс)
- •Неконкурентное обратимое ингибирование
- •16. Выражение для скорости реакции при конкурентном ингибировании
- •Аллостерические ферменты
1. Какие параметры системы определяют скорость химических реакции
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
![]()
выражение для скорости будет выглядеть так:
![]() .
.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
природа реагирующих веществ,
наличие катализатора,
температура (правило Вант-Гоффа),
давление,
площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
2. Реакции нулевого порядка (кинетическое уравнение с решением)
Кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
3. Реакции первого порядка (кинетическое уравнение с решением)
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
4. Реакции второго порядка (кинетическое уравнение без решения)
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
5. Кинетическое уравнение для реакции в виде линейной трехзвенной цепи (без решения, график) 6. Кинетическое уравнение для реакции идущей по разветвленной цепи (без решения)
7. Схема реакций протекающих в отрытой системе в стационарном состоянии 8. Условие стационарного состояния с точки зрения кинетики процессов 9. Зависят ли стационарные концентрации от начальных концентраций веществ в системе? 10. Модель ферментативного катализа(структура реакции, пояснить), кинетическая кривая
Модели ферментативного катализа
Ферменты
представляют собой высокоспециализированные
белковые катализаторы, ускоряющие
течение биохимических реакций в сотни
тысяч, миллионы раз. Любое ферментативное
превращение начинается со связывания
молекул субстратов с активным центром
фермента и завершается разрывом этих
связей. Гипотеза
об образовании лабильного субстрат-ферментного
комплекса была впервые высказана в 1902
г. Брауном и Анри. Пытаясь дать
количественное толкование явлению
насыщения амилазных реакций субстратами
Анри в 1904 г. допустил, что реакция
образования фермент-субстратного
комплекса находится в равновесии и
вывел уравнение начальной скорости
реакции
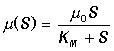
К этому же уравнению пришли в 1914 г. Михаэлис и Метен, а позднее в 1925 г. Бриггс и Холдейн, которые получили аналогичное выражение в предположении квазистационарности реакции образования фермент-субстратного комплекса. В 1943 г. Чанс экспериментально подтвердил образование такого комплекса спектрофотометрическим методом и проследил за изменением его концентрации в ходе реакции, катализируемой гемосодержащим ферментом пероксидазой. В 1930 г. Холдейн распространил теоретические представления о фермент-субстратном комплексе на случай двусубстратных и обратимых реакций и постулировал существование различных фермент-субстратных, фермент-продуктных и фермент-ингибиторных промежуточных комплексов. В настоящее время множество таких комплексов экспериментально изучено.
Учет
наличия ингибиторов в системе, в частности
в случае, когда в качестве ингибитора
выступают молекулы субстрата, образующие
как активные, так и неактивные комплексы
с субстратом, приводит к более сложным
нелинейным выражениям для скорости
реакции:
![]()
Наличие такого типа нелинейности обусловливает важные свойства ферментативных систем:
множественность стационарных состояний;
колебательный характер изменения переменных;
квазистохастические режимы
Кинетическая кривая – зависимость концентрации или количества вещества от времени.
Основные типы элементарных реакций:
– гомолитические – с образованием и/или разрывом электронных пар;
– гетеролитические – разрушение и образование связей идёт без образования и разрыва электронных пар;
– согласованные (концертные) – синхронное превращение нескольких молекулярных орбиталей в новые МО.
