
- •Перечень условных обозначений
- •Введение
- •Глава 1 анионная полимеризация с раскрытием цикла
- •1.1 «Живая» контролируемая анионная полимеризация с раскрытием цикла
- •1.2 Анионная полимеризация с раскрытием цикла -капролактама
- •1.2.1 Особенности механизма и кинетики
- •1.2.2 Катализаторы анионной полимеризации лактамов
- •1.2.3 Роль активатора в реализации анионной полимеризации -капролактама
- •1.2.4 Применение метода анионной активированной полимеризации лактамов в промышленности: технология реакционного инжекционного формования
- •1.3 Полимеризация сложных циклических эфиров
- •1.3.1 Механизм анионно-координационной полимеризации
- •1.3.2 Катализаторы «живой» анионно-координационной полимеризации с раскрытием цикла ε-капролактона, d,l- и l-лактида
- •Salen-типа
- •1.4 Сополимеризация сложных циклических эфиров
- •1.4.1 Получение статистических сополимеров
- •1.4.2 Получение блок-сополимеров
- •1.5 Применение биодеградируемых материалов на основе полимеров сложных циклических эфиров
- •1.5.1 Материалы медицинского назначения
- •1.5.2 Материалы технического назначения
- •1.6 Выводы к главе 1
1.3.1 Механизм анионно-координационной полимеризации
Для объяснения механизма анионно-координационной полимеризации существует два основных подхода:
1. Катализатор активирует мономер посредством координации с атомом кислорода карбонильной группы, образуя с мономером циклический сложноэфирный комплекс. Рост цепи осуществляется за счет нуклеофильной атаки концевой гидроксильной группой макромолекулы атома углерода карбонильной группы комплекса (рисунок 1.19) [71].

Рисунок 1.19 – Механизм анионно-координационной полимеризации ε-капролактона в присутствии Sn(Okt)2 [71]

Рисунок 1.20 – Альтернативный механизм анионно-координационной полимеризации ε-капролактона в присутствии Sn(Okt)2 [73]
2. На рисунке 1.20 представлен альтернативный механизм анионно-координационной полимеризации ε-капролактона с 2-этилгексаноатом олова в качестве катализатора. На первой стадии (А) при взаимодействии инициатора (вода, спирт) происходит образование диалкоксида олова (1) с последующей координацией Sn(OR)2 с атомом кислорода карбонильной группы мономера (В1). Образование активных центров (2) происходит, за счет перераспределения электронной плотности в комплексе (В2, В3) с последующим внедрением алкокси-группы катализатора по месту связи ацил-кислород ε-капролактона.
Большинство исследователей склоняются к протеканию полимеризации -капролактона по второму механизму [72-77].
1.3.2 Катализаторы «живой» анионно-координационной полимеризации с раскрытием цикла ε-капролактона, d,l- и l-лактида
Известно, что ε-капролактон и D,L- и L-лактид имеют много общего как в механизме полимеризации, так и во влиянии условий полимеризации на скорость процесса, глубину его протекания, молекулярно-массовые характеристики полимеров. В свою очередь, анионно-координационная полимеризация сложных циклических эфиров может быть инициирована множеством соединений, в том числе алкоксидами или алкилалкоксидами, арилоксидами, карбоксилатами, ацетилацетонатами металлов, карбенами, энзимами [4]. Подбирая катализатор полимеризации – варьируя комплексообразователь и лиганд, а также сокатализатор, можно контролировать скорость полимеризации, молекулярную массу полимера, молекулярно-массовое распределение, природу концевых групп.
1.3.2.1 Органические соединения олова (Sn(II), Sn(IV)). К настоящему моменту синтезирован ряд катализаторов анионно-координационной полимеризации циклических эфиров на основе олова [71-85]: 2-этилгексаноат олова [71-80], Bu2SnCl2 [81], бензилалкокси-бис-(2,4,6-триизопропилфенил) олова [82], а также циклические алкоксиды олова, например, дибутил-2-олово-1,3-диоксоциклопентан и др. [83-85]. Несмотря на широкий спектр соединений олова (Sn(II), Sn(IV)) способных инициировать анионно-координационную полимеризацию, на сегодняшний день, 2-этилгексаноат олова (Sn(Okt)2) является наиболее распространенным катализатором полимеризации лактонов (-капролактон, -валеролактон) [71-75] и D,L- и L-лактида [76-80] как в фундаментальных исследованиях, так и при промышленном производстве материалов на основе биодеградируемых полимеров. Это обусловлено тем, что Sn(Okt)2 является недорогим высокоэффективным катализатором, который в ряде случаев инициирует «живую»/контролируемую полимеризацию циклических эфиров и позволяет синтезировать (со)полиэфиры с высокой молекулярной массой (Mn до 100000 г/моль) в течение нескольких часов [71-80]. Для контроля над молекулярной массой синтезируемых полимеров необходимо использовать сокатализаторы, в качестве которых обычно выступают спирты:1,4-бутандиол, 1,2-этандиол, 1-бутанол, 1,3-пропандиол, 2-(2-метоксиэтокси)этанол и др. [4, 5, 62-85].
Полимеризацию ε-капролактона в присутствии Sn(Okt)2 проводят либо в растворе, либо в массе [72-75]. В качестве растворителей чаще всего используют тетрагидрофуран или толуол [72, 74]. Получены поли(ε-капролактон)ы (~100% за 15 часов) с высокой малекулярной массой (Mn до 280000 г/моль) и относительно узким ММР (Mw/Mn =1,4). Было показано, что после введения в полимеризационную смесь инициатора (бутиловый спирт) скорость реакции увеличивается ~ в 20 раз, а синтезированные полиэфиры характеризуются контролируемой соотношением [мономер]/[спирт] молекулярной массой до 17700 г/моль и ММР ~1,43, которое расширяется до 1,77 с увеличением концентрации инициатора [74].
Полимеризацию ε-капролактона с Bu2SnCl2 проводят в растворе толуола при температуре 100ºС, в качестве инициатора используют 1-пропанол. Среднечисловая молекулярная масса полимера увеличивается с конверсией мономера и достигает 12400 г/моль в течение 94 часов. ММР поли(ε-капролактона) составляет 1,77 [81].
Активность бензилалкокси-бис-(2,4,6-триизопропилфенил) олова (IV) была исследована в полимеризации ε-капролактона в растворе толуола при температуре 75ºС. Было показано, что практически полная конверсия мономера (84%) достигается в течение 24 ч, а полимеризация протекает по механизму «живых цепей». Синтезированные полимеры характеризуются молекулярной массой до 19700 г/моль и достаточно узким ММР (Mw/Mn=1,1–1,4) [82].
Полимеризацию в массе проводят при значительно более высокой температуре – 130ºС. Молекулярная масса поли(ε-капролактона), полученного в массе в присутствии Sn(Okt)2 и 1,2-этандиола в качестве инициатора, составляет ~10000 г/моль и хорошо согласуется с теоретически рассчитанной из предпосылки, что одна молекула спирта генерирует две полимерные цепи, а молекулярно-массовое распределение очень узкое (~ 1,1), что свидетельствует о протекании в системе «живой» полимеризации. Полная конверсия мономера достигается за 40 минут [73].
Образцы поли(D,L-лактид)а и поли(L-лактид)а, характеризующиеся высокой молекулярной массой (Mn = 50000 г/моль) были синтезированы в растворе толуола при 70ºС в присутствии Sn(Oct)2 и 2-(2-метоксиэтокси)этанола в качестве катализатора и инициатора, соответственно [74]. Варьируя соотношение [мономер]/[инициатор], можно сократить время полимеризации с 48 до 24 часов, что, однако, приведет к заметному уменьшению молекулярной массы полимеров до 1400–4400 г/моль и расширению молекулярно-массового распределения до 1,4 [79].
Полимеризацию D,L- и L-лактида в массе с Sn(Oct)2 проводят при температуре 110–180ºС, причем как с инициатором, так и без него. Так, при температуре 140ºС и соотношении [D,L-лактид]/[Sn(Oct)2] = 5000 полная конверсия мономера достигается в течение 5 часов, а синтезированные образцы полиэфиров обладают исключительно высокими молекулярными массами (Mn ≤ 450000 г/моль), но относительно широким ММР (Mw/Mn=1,2–1,6). Показано, что поли(L-лактид)ы, полученные в присутствии Sn(Okt)2, являются оптически чистыми [78].
Циклические алкоксиды олова, такие как дибутил-2-олово-1,3-диоксоциклопентан, дибутил-2-олово-1,3-дисолан и др., так же оказались достаточно активными в полимеризации D,L- и L-лактида [83-85]. Полиэфиры с высокими молекулярными массами до 28000 г/моль и 25000 г/моль и широким ММР (Mw/Mn> 2) были синтезированы в течение 2–4 часов при соотношении [D,L- и L-лактид]/[дибутил-2-олово-1,3-диоксоциклопентан] = 100.
Таким образом, соединения олова (Sn(II), Sn(IV)) позволяют получать полиэфиры с высокой молекулярной массой (до 450000 г/моль), но достаточно широким молекулярно-массовым распределением (~1,6–3) [73, 84]. Основными недостатками катализаторов на основе соединений олова являются:
●необходимость использования инициаторов, в роли которых чаще всего выступают спирты. Их присутствие в системе увеличивает скорость полимеризации, улучшает контроль над молекулярной массой полимеров, но приводит к расширению ММР;
●токсичность соединений олова по отношению к клеткам живых организмов. Поэтому для получения полимеров медицинского назначения такие катализаторы малопригодны.
1.3.2.2 Алкоксиды и комплексы алюминия. Немалый интерес в качестве катализаторов анионной полимеризации с раскрытием цикла представляют алкоксиды и комплексы алюминия. Они являются достаточно перспективными для получения полимеров на основе сложных циклических эфиров ввиду того, что их активность заметно выше по сравнению с соединениями олова, а синтезированные полимеры характеризуются контролируемыми молекулярно-массовыми характеристиками (молекулярные массы пропорциональны соотношению [мономер]/[(со)катализатор]) и узким ММР [60, 61, 86-97]. Чаще всего алкоксиды алюминия синтезируют непосредственно in situ, используя для этого органические соединения алюминия в качестве прекурсоров [61, 86, 87 93, 95]. Например, соединение общей формулы Et3-pAl(OCH2X)p получают взаимодействием Et3Al со спиртом соответствующей структуры, где Х = (СH3)2, CH2Br, (CH2)2CH=CH2, (CH2)2NEt2, и др. Необходимо отметить, что одним из достоинств предложенных систем является то, что в их присутствии получают полиэфиры, имеющие функциональную концевую группу, позволяющую впоследствии использовать их в качестве «строительных блоков» при синтезе сложных макромолекулярных структур.
Алкоксиды алюминия общей формулы Et3-pAl(OCH2X)p инициируют полимеризацию ε-капролактона уже при 0ºС в растворе толуола или ТГФ. Было показано, что полимеризация ε-капролактона в присутствии Et2AlO(CH2)3CH=CH2 в толуоле при 0ºС протекает по механизму «живых цепей», т.е. одна молекула Et2Al(OCH2X) генерирует одну полимерную цепь. Поли(ε-капролактон)ы, характеризующиеся контролируемой молекулярной массой до 28500 г/моль и узким ММР (Mw/Mn=1,05–1,2), были синтезированы в среде толуола в течение 5 часов [61].
В случае инициирования полимеризации ε-капролактона триалкоксидами алюминия (Al(O(CH2)3CHCH2)3) в системе также реализуется «живая» полимеризация, которая протекает с высокой скоростью (полная конверсия мономера достигается за 50 минут), а синтезированные полиэфиры характеризуются контролируемой молекулярной массой (до ~33500 г/моль) и узким ММР (Mw/Mn=1,1–1,2) [61].
К недостаткам алкоксидов алюминия относят их склонность к агрегации, приводящей к уменьшению активности катализатора. Поэтому исследования последних лет направлены на поиск новых хелатных комплексов алюминия с объемными лигандами различного строения, среди которых наиболее распространенными являются анилидо-(1) [86] и фенокси-иминные (2) [87, 88] (рисунок 1.21).
Как было показано в [86], комплексы 1a – 1f (рисунок 1.21) в присутствии бензилового спирта проявляют высокую активность в полимеризации с раскрытием цикла лактонов и по своей активности располагаются в следующий ряд 1a >1b >1c >1d >1e >1f. Таким образом, активность комплексов уменьшается с увеличением объема заместителей в бензольном кольце, то есть с уменьшением доступности атома алюминия в комплексе. Таким образом, с наиболее активным комплексом 1а полная конверсия мономера достигается за 2 минуты при температуре 70ºС в среде толуола, а среднечисловая молекулярная масса полимеров контролируется соотношением [ε-КЛН]/[BnOH] и достигает ~107000 г/моль. Молекулярно-массовое распределение заметно расширяется от 1,14 до 1,64 с увеличением содержания мономера в полимеризационной смеси.
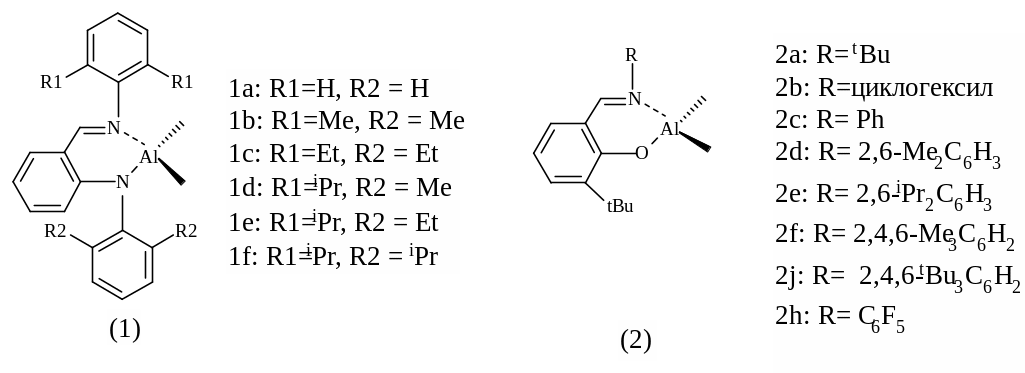
Рисунок 1.21 – Катализаторы анионно-координационной полимеризации
ε-капролактона на основе анилидо - и фенокси-иминных комплексов алюминия
Комплексы алюминия 2a–2h (рисунок 1.21) также были исследованы в полимеризации ε-капролактона [88]. Их каталитическая активность зависит от объема заместителей иминных лигандов и уменьшается в ряду 2h >2g >2d >2f >2e >2c >2b >1a. Наиболее эффективным соединением в полимеризации лактонов различного строения считают каталитический комплекс 2h – в толуоле реакция протекает с высокой скоростью (полная конверсия мономера достигается в течение 30 минут при 60ºС), а синтезируемые полиэфиры характеризуются высокой молекулярной массой до 54000 г/моль ([ε-КЛН]/[BuOH]/[Al] =1000/1/1), но достаточно широким ММР (Mw/Mn ~ 1,66), что свидетельствует о протекании в системе побочных реакций.
Одним из основных недостатков использования в полимеризации D,L- и L-лактида простых алкоксидов алюминия, например Al(OiPr)3, является их предрасположенность к агрегации. Более того, полимеризация в данном случае характеризуется наличием индукционного периода (10 и более минут), который обусловлен равновесием между тетрамером (А4) и тримером (А3) (рисунок 1.22). Причем А4 в отличие от А3 не является активным и не инициирует рост цепи [3, 4, 61]. Диалкилалюминий алкоксид в растворе не агрегирует, однако его активность в полимеризации D,L- и L-лактида невелика.
Также показано, что с повышением температуры, которое приводит к увеличению скорости реакции, в системе преобладают побочные реакции, что приводит к образованию циклических олигомеров и уширению ММР [61].
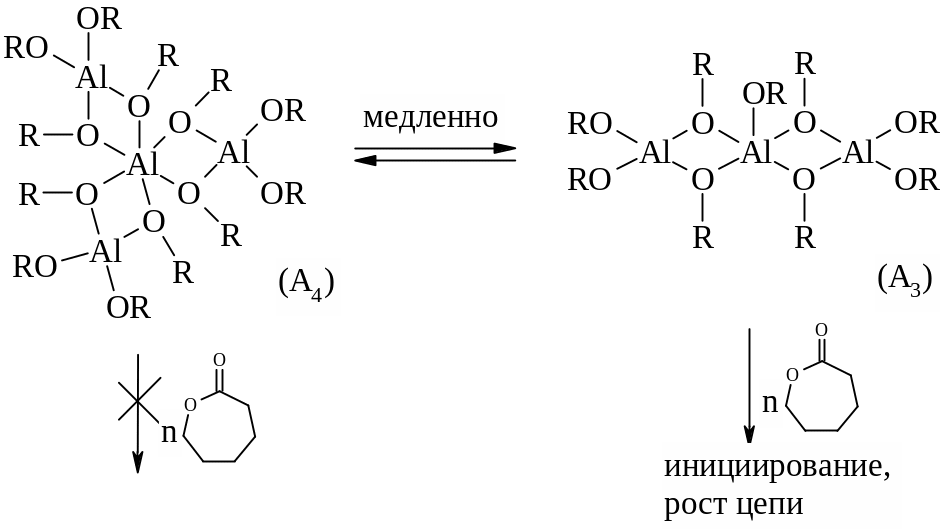
Рисунок 1.22 – Равновесие между тетрамером (A4) и тримером (A3) Al(OR)3
Эффективность комплексов алюминия 2a–2h (рисунок 1.21) также была исследована в полимеризации D,L-лактида [87, 88]. Соединения алюминия 2h и 2g показали достаточно высокую активность в полимеризации с раскрытием цикла D,L- и L-лактида в растворе толуола при 70ºС (94% в течение 24 минут). Получены полимеры с контролируемой молекулярной массой до 41800 г/моль и узким ММР ≤1,2 для поли(L-лактид)ов, тогда как синтезированные поли(D,L-лактид)ы характеризуются молекулярной массой до 31300 г/моль и молекулярно-массовым распределением ≤1,3. Цепи полимеров, полученных в присутствии предложенных катализаторов, не обладают стереорегулярностью, т.е. являются атактическими.
Комплексы алюминия с бис-иминофенильными лигандами такими как (2,6-(C6H5N=CH)2C6H3)AlEt2 (3a), (2,6-(2,6-Me2C6H3N=CH)2C6H3)AlEt2 (3b), (2,6-(2,6-Et2C6H3N=CH)2C6H3)AlEt2 (3c), (2,6-(2,6-iPr2C6H3N=CH)2C6H3)AlEt2 (3d) также были исследованы в [90] в полимеризации с раскрытием цикла L-лактида в растворе толуола при 70ºС. В присутствии бензилового спирта ([L-лактид]/[спирт]/[Al]=100/2/1) в течение 24 часов были получены полимеры с выходом 93%, молекулярной массой 5100–6800 г/моль и очень узким молекулярно-массовым распределением 1,04–1,09. Молекулярная масса синтезированных полиэфиров хорошо согласуется с теоретически рассчитанной и контролируется соотношением [L-лактид]/[спирт].
Известно, что физические и механические свойства поли(L-лактида) напрямую зависят от его микроструктуры. Получать синдиотактический и изотактический полимер позволяют алкоксиды алюминия общей формулы LnAl–OR (рисунок 1.23), обладающие объемным лигандом, который представляет собой основание Шиффа с различными заместителями [89, 91-97].
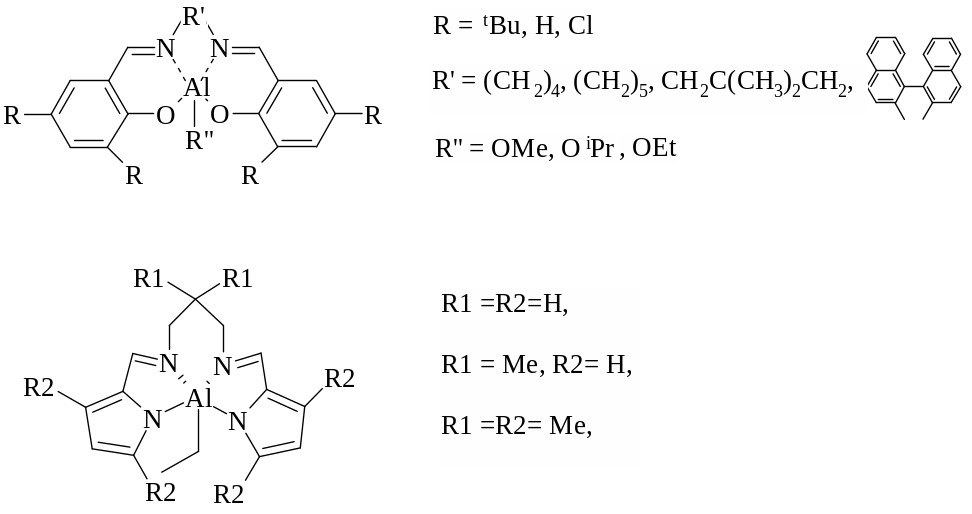
Рисунок 1.23 – Катализаторы стереорегулярной полимеризации
D,L-лактида
Показано, что заместители в лиганде влияют на активность и стереоселективность комплекса. Удлинение мостика (R') наряду с электроно-акцепторными заместителями в орто- и пара- положениях (R) у бензольного кольца приводят к заметному увеличению скорости реакции и позволяют получать в растворе толуола при 70ºС полимеры с высокой степенью изотактичности (до 91%), молекулярной массой до 59000 г/моль и узким ММР 1,1 [3, 86]. Комплексы алюминия с бис-пирролидольными лигандами (рисунок 1.23) также были исследованы в полимеризации D,L- и L-лактида (в качестве инициатора использовали пропанол-2). В среде толуола при 70ºС получен поли(L-лактид) с высокой степенью изотактичности (до 74%), характеризующийся контролируемой молекулярной массой до 14000 г/моль и ММР ~ 1,0, а также синдиотактический поли(D,L-лактид) со степенью синдиотактичности > 50%, молекулярной массой до 13000 г/моль и ММР ≤1,16 [96].
1.3.2.3 Соли висмута и комплексы железа, кальция, магния, цинка. Несмотря на то, что висмут является тяжелым металлом он широко применяется для изготовления препаратов медицинского назначения как внутреннего, так и наружного применения [98-102], поэтому различные соединения висмута выступают интересной альтернативой вышеперечисленным катализаторам. Большое внимание уделяется соединениям, содержащим в своем составе ионы металлов, которые участвуют в метаболизме человека: натрий, литий [103, 104], магний [104-106], кальций [107,108], железо [109-111]. Комплексы цинка также малотоксичны для клеток живых организмов и поэтому считаются перспективными катализаторами получения материалов медицинского назначения [90, 105, 112-114].
Был исследован ряд соединений (солей) висмута – BiX3 (X = Br,Cl, I), BiPh3, Ph2BiBr, Ph2BiOEt в полимеризации ε-капролактона [98-102].
Активность галогенидов висмута была исследована в полимеризации -капролактона в массе при температуре 120ºС. Получены поли(ε-капролактон)ы (95% конверсии за 54 часа) с молекулярной массой до 80000 г/моль и широким ММР (Mw/Mn=1,55–1,85). По активности галогениды висмута можно расположить в ряд BiCl3<BiBr3<BiI3 [98].
Трифенилвисмут (BiPh3) также инициирует полимеризацию ε-капролактона в массе при температуре 120ºС. Полиэфиры с выходом 85%, молекулярной массой около 150000 г/моль, но достаточно широким ММР (Mw/Mn>2) были синтезированы за 42 часа. При введении в полимеризационную систему инициатора время реакции сокращается до 24 часов, а синтезированный полимер характеризуется контролируемой соотношением [ε-КЛН]/[спирт] молекулярной массой и более узким ММР (Mw/Mn< 2) [100].
Дифенил висмут бромид (Ph2BiBr) инициирует полимеризацию ε-капролактона в массе при температурах ниже 40ºС, однако, для увеличения скорости реакции, полимеризацию чаще всего проводят при более высоких температурах. Так, полиэфиры, синтезированные в массе с Ph2BiBr при температуре 120ºС (время полимеризации составило 6 часов), характеризуются высокой молекулярной массой (Mn=280000 г/моль) и широким молекулярно-массовым распределением (Mw/Mn≥2,0) [101]. После введения в полимеризационную смесь тетраэтиленгликоля в качестве инициатора среднечисловая молекулярная масса поли(ε-капролактон)а увеличивается линейно с конверсией мономера, контролируется соотношением [мономер]/[спирт] и достигает 25000 г/моль, а молекулярно-масовое распределение заметно сужается до 1,45. Дифенил висмут этоксид (Ph2BiOEt) [102] также активен в полимеризации с раскрытием цикла -капролактона в массе. При температуре 120ºС в течение 6 часов получены поли(-капролактон)ы с контролируемой соотношением [ε-КЛН]/[Ph2BiOEt] молекулярной массой (Mn=18500 г/моль) и ММР ~ 1,87.
Таким образом, предложенные соединения висмута по активности в полимеризации -капролактона можно расположить в ряд BiX3 <BiPh3<Ph2BiBr<Ph2BiOEt.
Активность комплекса магния (рисунок 1.24) [(MCIMP)2Mg2(ТГФ)]2 (4a) была исследована в полимеризации ε-капролактона в толуоле при 56ºС. Синтезированные поли(ε-капролактон)ы характеризуются контролируемой соотношением [ε-КЛН]/[Mg]/[BuOH] молекулярной массой до 24100 г/моль и узким ММР (Mw/Mn≤1,19) [106].

Рисунок 1.24 – Схематическое изображение лигандов
Эффективными катализаторами полимеризации -капролактона с раскрытием цикла являются алкоксиды кальция, полученные in situ взаимодействием Ca[N(SiMe3)2(ТГФ)2] со спиртом (МеОН, EtOH, i-PrOH) [108]. Ca[N(SiMe3)2(ТГФ)2] инициирует полимеризацию -капролактона в массе при температуре 120ºС. В течение 10 минут получены поли(ε-капролактон)ы с молекулярной массой до 22200 г/моль и узким молекулярно-массовым распределением (Mw/Mn~1,25). Полная конверсия ε-капролактона достигается за 10 минут в том числе и при полимеризации в растворе ТГФ при температуре 18ºС, причем синтезированный полимер характеризуется молекулярной массой до 9000 г/моль и узким ММР ~ 1,29.
Комплекс цинка (5a) (рисунок 1.25) инициирует полимеризацию ε-капролактона (100% конверсия мономера за 60 минут) при температуре 110ºС в массе. Синтезированы образцы поли(ε-капролактон)ов с высокими молекулярными массами до 20000 г/моль и относительно узким молекулярно-массовым распределением (Mw/Mn=1,23–1,56) [112].
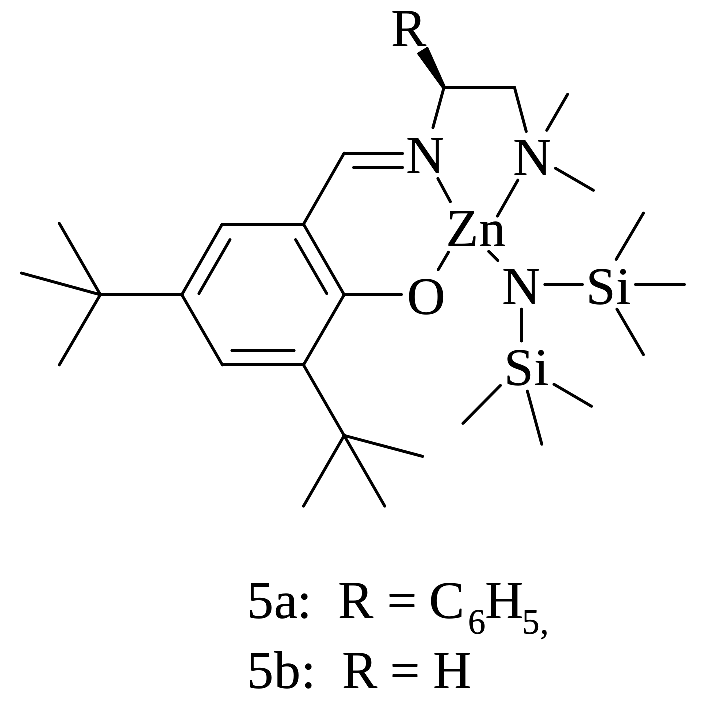
Рисунок 1.25 – Комплексы на основе цинка в полимеризации
ε-капролактона и L-лактида
Эффективность комплексов цинка с бис-иминофенильными NCN-лигандами, таких как (2,6-(C6H5N=CH)2C6H3)2Zn (6a), (2,6-(2,6-Me2C6H3N=CH)2C6H3)2Zn (6b), (2,6-(2,6-Et2C6H3N=CH)2C6H3)2Zn (6c), (2,6-(2,6-iPr2C6H3N=CH)2C6H3)ZnEt (6d) была исследована в полимеризации L-лактида в растворе толуола в присутствии бензилового спирта при температуре 70ºС. Молекулярная масса полученных полиэфиров увеличивается с конверсией мономера, контролируется соотношением [мономер]/[спирт] и достигает 81400 г/моль. Молекулярно-массовое распределение синтезированных полимеров относительно узкое (1,09–1,40), однако заметно расширяется (до 1,65) при высоких степенях конверсий (≥ 85%), что может быть связано с протеканием в системе реакций переэтерификации [90].
Димерные алкоксиды цинка с NNO-тридентатными лигандами (основаниями Шиффа) (7a–7e), представленными на рисунке 1.26, проявляют высокую активность в полимеризации D,L- и L-лактида: полная конверсия мономера достигается за 30 – 240 минут при комнатной температуре в растворе толуола [112-114].
Следует отметить, что активность комплексов заметно снижается, если лиганд содержит в своем строении электронодонорные (7c, 7d) или объемные заместители (7e). Однако наличие объемных заместителей наряду с низкой температурой полимеризации (0ºС) позволяет проводить контролируемую стереоселективную полимеризацию D,L-лактида и синтезировать полиэфиры с высокой молекулярной массой (Mn до 45000 г/моль) и узким ММР (Mw/Mn~1,03–1,1).
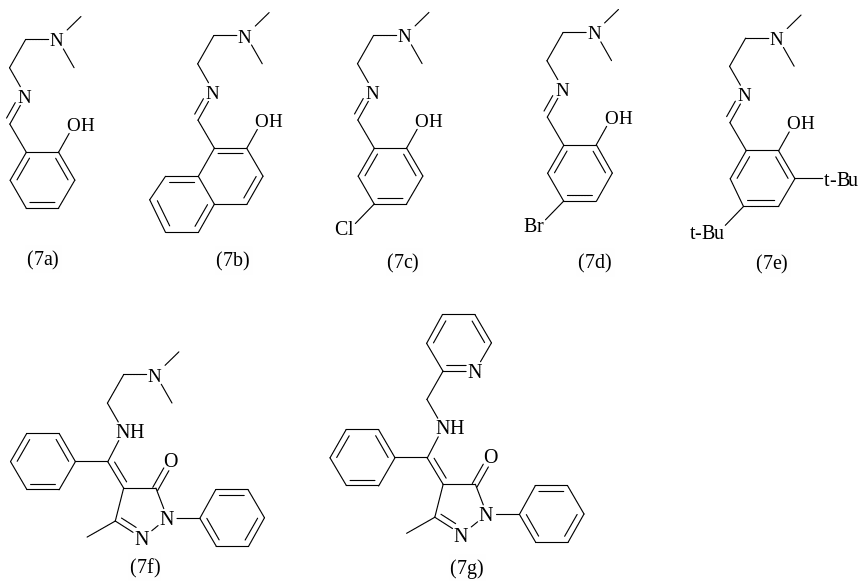
Рисунок 1.26 – Схематическое изображение лигандов – прекурсоров комплексов цинка (7a–7g) и магния (7f–7g)
Алкоксиды цинка с кетиминными лигандами, которые содержат пиразольную компоненту (7f, 7g), являются не только активными катализаторами (полная конверсия мономера достигается менее чем за 1 час при [D,L-лактид]/[Zn] = 200 в растворе хлористого метилена при 0ºС), но и инициируют контролируемую (Mn=13000 г/моль, Mw/Mn~1,05) стереоселективную полимеризацию D,L-лактида (степень стереоселективности достигает 70%). Показано, что скорость полимеризации и молекулярно-массовые характеристики полимеров зависят не только от заместителей в кетиминном лиганде, но и от природы комплексообразователя. Например, аналогичные комплексы магния менее активны в полимеризации D,L-и L-лактида (70% конверсия мономера за 12 часов при температуре 30ºС), однако характеризуются более высокой стереоселективностью до 87% [114].
Комплексы магния с лигандами, представленными на рисунке 1.24, [(MCIMP)2Mg2(ТГФ)]2 (4a) [(EDBP)Mg(Et2O)]2 (4b) были исследованы в полимеризации L-лактида. Наиболее активным оказался [(EDBP)Mg(Et2O)]2, – 83 % конверсия мономера была достигнута за 2 часа в растворе C2H4Cl2 при температуре 83ºС. Синтезированные полимеры характеризуются молекулярной массой до 26000 г/моль и узким ММР (Mw/Mn≤1,19) [106].
Алкоксиды кальция, полученные in situ взаимодействием Ca[N(SiMe3)2(ТГФ)2] со спиртами различного строения также инициируют полимеризацию с раскрытием цикла L-лактида как в массе, так и в растворе ТГФ. В растворе при температуре 18ºС в течение 18 часов получены полимеры с высокой молекулярной массой до 12700 г/моль, но ММР ~ 1,36 [108].
Комплексы Li и Na с ООО-тридентатными бис-фенолятными лигандами инициируют «живую» полимеризацию L-лактида в растворе хлористого метилена и толуола при достаточно низких температурах от 0 до 60ºС. Синтезированы полимеры с хорошим выходом, контролируемой молекулярной массой до 31000 г/моль и узким ММР ≤1,3 в широком диапазоне соотношений [L-лактид]/[катализатор] [103]. Но большинство катализаторов на основе щелочных металлов приводят к рацемизации L-лактида и являются непригодными для получения блок-сополимеров -капролактона и L-лактида [71].
Различные соли железа (C2H3O2Fe, C2F3O2Fe, C4H7O2Fe, C4H6O6Fe, C6H10O6Fe и др.) были исследованы в полимеризации L-лактида в массе при температуре 150-210ºС. Синтезированы полиэфиры с молекулярными массами свыше 50000 г/моль и широким ММР (Mw/Mn=1,54–5,44) [109, 110]. Алкоксиды железа хоть и проявляют активность в полимеризации лактонов, но характеризуются низкой термической стабильностью, поэтому непригодны для промышленного получения поли(-капролактон)а и поли(L-лактид)а [109-111].
1.3.2.4 Комплексы редкоземельных металлов. Комплексы редкоземельных металлов [65, 66, 69, 70, 111, 115-124] являются одними из наиболее активных катализаторов полимеризации сложных циклических эфиров. Подавляющее большинство таких катализаторов инициирует «живую» полимеризацию ε-капролактона, D,L-и L-лактида.
Использование алкоксидов переходных металлов La(OiPr)3, (La5(-О)(ОiPr)13) (8a), боргидридов (Ln(BH4)3(ТГФ)3, где Ln = La (8b), Nd (8c), Sm (8d), Y (8e),), а также моногидридов редко-земельных металлов (Сp)*Sm(BH4)(ТГФ) (8f), где Сp* = (5-С5Me5) позволяет синтезировать поли(-капролактон)ы с контролируемой молекулярной массой до Mn 60000 г/моль и достаточно узким молекулярно-массовым распределением (Mw/Mn=1,1 – 1,4) [65]. Необходимо также отметить, что полная конверсия мономеров в случае использования катализаторов 8a – 8e достигается менее чем за 15 минут, а в присутствии катализатора (8f) менее чем за 30 минут.
Перфторалканосульфонаты и перфторалканосульфоимиды редкоземельных металлов (Sc, Sm, Tm, Nd) [115, 116] также инициируют контролируемую полимеризацию ε-капролактона при невысоких температурах полимеризации (25–60ºС). Получены поли(ε-капролактон)ы с молекулярной массой 2600 – 9800 г/моль и достаточно узким молекулярно-массовым распределением (Mw/Mn=1,12 – 1,40).
Алкоксиды и комплексы редкоземельных металлов также были успешно исследованы в полимеризации с раскрытием цикла D,L- и L-лактида [66, 70, 119-124]. Так, алкоксиды общей формулы Ln(OiPr)3, где Ln = La, Sm, Y и Yb позволяют получать поли(D,L-лактид) с высоким выходом (82–96%), низкой молекулярной массой (1000 – 5000 г/моль) и узким молекулярно-массовым распределением (Mw/Mn=1,14–1,57), которое заметно расширяется при высоких степенях конверсии. Активность комплексов уменьшается в ряду La> Sm> Y> Yb [66, 70]. Склонность алкоксидов к агрегации, а также необходимость синтеза полиэфиров с большей молекулярной массой, привели к появлению большого количества работ по синтезу и исследованию в полимеризации сложных циклических эфиров комплексов редкоземельных металлов.
Перспективными катализаторами в полимеризации D,L-лактида являются комплексы иттрия с аминоалкокси-бис(фенолятными) лигандами (9а, 9b, 10а, 10b), представленные на рисунке 1.27. Указанные комплексы инициируют полимеризацию D,L-лактида в растворе в ТГФ при комнатной температуре в присутствии различных спиртов в качестве инициаторов и позволяют синтезировать полиэфиры c контролируемой молекулярной массой (до 160000 г/моль) и узким молекулярно-массовым распределением (1,06 – 1,4). Полная конверсия D,L-лактида достигается за 6 часов при температуре 20ºС и соотношении [D,L-лактид]/[катализатор] = 1000) [119].

Рисунок 1.27 – Катализаторы полимеризации D,L- и L-лактида на основе редкоземельных металлов
Трис-(2,6-ди-трет-бутилфенолят)ы лантана и иттрия (11a и 11b на рисунке 1.28) в присутствии спиртов (2-пропанол, трет-бутанол, 1,2-этандиол) также проявляют высокую активность в полимеризации L-лактида и позволяют получать поли(L-лактиды) с контролируемой молекулярной массой до 24000 г/моль и узким ММР до 1,37. Более того, предложенные системы не приводят к рацемизации L-лактида [66, 120].
Эффективными катализаторами контролируемой полимеризации с раскрытием цикла L-лактида являются гетерометаллические производные иттроценов, например, Li[Y(51-C5R4SiMe2NCH2OMe)2], где R = Me (12a), H (12b) (рисунок 1.28), полимеризующие L-лактид в растворе хлористого метилена при 25ºС с образованием поли(L-лактид)а, характеризующегося контролируемой молекулярной массой до 44000 г/моль и узким ММР (Mw/Mn≤1,2) [121].
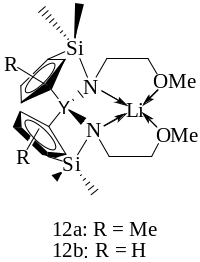
Рисунок 1.28 – Катализаторы полимеризации D,L- и L-лактида на основе комплексов иттрия
Би- и три-металлические комплексы иттрия с мультидентатными лигандами [121, 122] инициируют полимеризацию D,L-лактида в растворе хлористого метилена при комнатной температуре. Синтезированы полиэфиры с высокой молекулярной массой (Mn = 66900 г/моль) и относительно широким ММР ~ 1,62.
Комплексы редкоземельных металлов с бис-фенолятными лигандами, соединенными метиленовым мостиком с гетероатомом (S) (рисунок 1.29), проявили высокую активность и стереоселективность в полимеризации D,L-лактида. Так, при комнатной температуре в растворе толуола полная конверсия мономера достигается за 30 минут, а полученные в результате полимеризации синдиотактические поли(D,L-лактид)ы (степень синдиотактичности 88–93%) обладают молекулярной массой 8500 – 57000 г/моль, но достаточно широким ММР (Mw/Mn ~ 1,29–2,34). Такое широкое молекулярно-массовое распределение объясняется протеканием побочных реакций (переэтерификация, макроциклизация) [124].

Рисунок 1.29 – Катализатор анионно-координационной полимеризации D,L- и L-лактида на основе Sc (13a) и Y (13b)
Таким образом, алкоксиды и, особенно, комплексы редкоземельных металлов проявляют высокую активность в полимеризации с раскрытием цикла сложных циклических эфиров, а полимеры, полученные в их присутствии, обладают контролируемой молекулярной массой и узким молекулярно-массовым распределением.
1.3.2.5 Комплексы на основе титана и других металлов 4 группы. В последние годы особое внимание уделяется исследованию комплексных соединений металлов 4 группы в качестве катализаторов полимеризации циклических эфиров (гафний, цирконий и титан) [62-64, 69, 125-142]. Комплексные соединения титана являются одними из наиболее перспективных катализаторов получения биодеградируемых материалов медицинского назначения, так как они нетоксичны, достаточно стабильны, хорошо растворимы в органических растворителях, мономерах и имеют невысокую стоимость. На активность и эффективность таких комплексов, а также на молекулярно-массовые характеристики получаемых полиэфиров, большое влияние оказывает лигандное окружение [125-128, 134-139, 140, 141].
Алкоксиды титана (Ti(O–nPr)4 и Ti(O–nPh)4) [62-63, 132, 133] позволяют получать с высокой скоростью поли(ε-капролактон) в массе при температуре 100ºС. При соотношении [ε-капролактон]/[Ті] = 300 полная конверсия мономера достигается за 3,5 и 6 минут, а синтезированные полимеры характеризуются молекулярными массами до 9400 г/моль и 21550 г/моль в присутствии Ti(O–nPr)4 и Ti(O–nPh)4, соответственно. Однако молекулярно-массовое распределение полимеров очень широкое (1,89 и 3,13), что связано с протеканием в системе реакций переэтерификации. Кроме того, возможно, это связано с тем, что соединение Ti(O–nPh)4, в отличие от Ti(O–nPr)4, полностью не растворимо в мономере, и полимеризацию инициируют не все O–nPh группы. Соответственно, на начальных стадиях синтеза полимеризация протекает в гетерогенной смеси.
Соединения титана Ti(OCH2CCl3)4 и Ti[O(CH2)4OC=CH2] были использованы в качестве макромономеров для получения сополимеров с винильными акрилатами [130, 131]. Например, полиэфиры с контролируемой молекулярной массой до 10000 г/моль были синтезированы с Ti[O(CH2)4OC=CH2] при температуре 90ºС за 6 часов. Показано, что с увеличением температуры полимеризации до 150ºС время полимеризации сокращается до 15 минут.
Моно- и дициклопентадиенильные комплексы титана [128, 129], такие как Ti(5-C5H5)Cl2(OCH3) и Ti(5-C5H5)2Cl2, также являются эффективными катализаторами «живой» анионной полимеризации с раскрытием цикла сложных циклических эфиров и позволяют получать полимеры как в растворе толуола, так и в массе при температуре > 100ºС. Полиэфиры, синтезированные в толуоле в присутствии Ti(5-C5H5)Cl2(OCH3) при температуре 100ºС (80% конверсии мономера за 18 часов), характеризуются контролируемой молекулярной массой до Mn=34000 г/моль и относительно узким молекулярно-массовым распределением (1,04–1,49) [128].
Комплексы титана с ONNO-тетрадентатными амино-бис-фенолятными лигандами [135], представленные на рисунке 1.30, характеризуются низкой активностью в полимеризации ε-капролактона в растворе толуола при комнатной температуре. Молекулярные массы полученных образцов не превышают 9700 г/моль, а молекулярно-массовое распределение очень широкое (Mw/Mn~2,6).
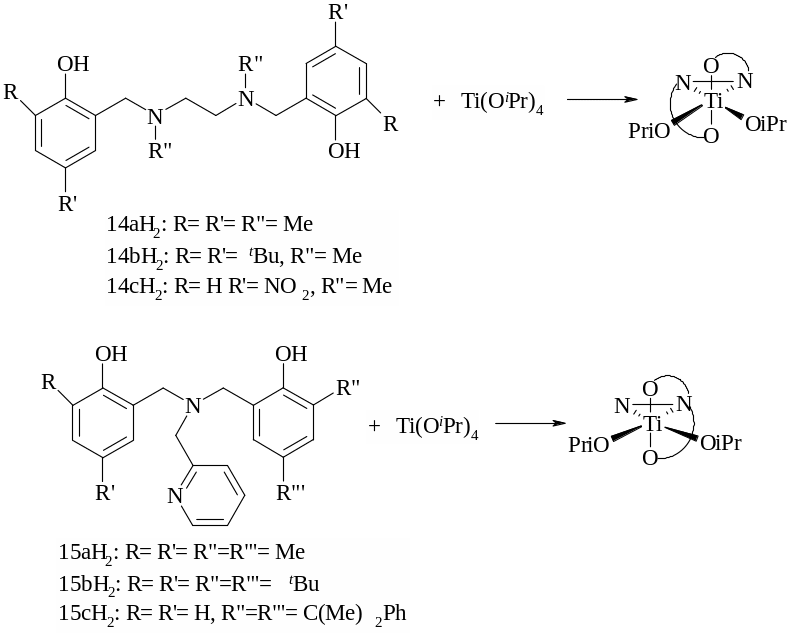
Рисунок 1.30 – Синтез комплексов титана с ONNO-тетрадентатными амино-бис-фенолятными лигандами
Было показано [125-127], что комплексы титана с бис-фенолятными лигандами, представленные на рисунке 1.31, инициируют «живую» полимеризацию -капролактона: полиэфиры обладающие узким молекулярно-массовым распределением 1,1–1,25 и высокой молекулярной массой, которую легко можно варьировать соотношением [мономер]/[катализатор] от 5600 до 53000 г/моль были получены в растворе CH2Cl2 при комнатной температуре. Основываясь на анализе спектров ЯМР 1Н можно сделать вывод, что реакция протекает за счет внедрения мономера по связи Ti–O катализатора, а лиганд не принимает участия в полимеризации. Природа заместителей в лиганде существенно влияет на скорость полимеризации и ММР, а наличие мостиковой связи (–СН2–, S, Te) в лиганде является необходимым условием для осуществления контроля за молекулярной массой синтезированных полимеров.

Рисунок 1.31 – Комплексы титана с бис-фенолятными лигандами
Инициирующая способность таких комплексов титана и циркония как ((CH)3CCOCHCONEt2)2Ti(OMe)2 (19a), ((CH)3CCOCHCONMe2)2Ti(OMe)2 (19b), (CH3CCOCHCONMe2)2Ti(OC(CH3)3)2 (19c) и ((CH)3CCOCHCONEt2)2ZrCl2 (19d) также была исследована в полимеризации лактонов [136]. Поли(ε-капролактон), синтезированный при температуре 120ºС в массе (94% конверсия мономера за 18 часов [мономер]/[19c] = 600) характеризуется высокой молекулярной массой (Mn ≤70000 г/моль) и относительно широким ММР~1,59. Показано, что комплекс (19d) наиболее активный из всех предложенных (практически полная конверсия мономера достигается за 6 часов). Полученные полимеры обладают молекулярной массой Mn=62000 г/моль, но достаточно широким молекулярно-массовым распределением ~1,64.
Наряду с различными по строению комплексами титана, комплексы других металлов 4 группы c ONNO-тетрадентатными и циклопентадиенильными лигандами также проявляют активность в полимеризации ε-капролактона [136-138]. Например, биметаллические соединения Zr и Hf с лигандами salen-типа (рисунок 1.32) позволили синтезировать в массе при температуре 80ºС с высокой скоростью (100% конверсия мономера за 60 минут) полиэфиры с молекулярными массами >20000 г/моль и очень узким ММР (1,02 – 1,08) [137].
Cледует отметить, что комплексы циркония с ONNO-тетрадентатными амино-бис-фенолятными лигандами обладают высокой каталитической активностью (94% конверсия за 24 часа при комнатной температуре) и позволяют синтезировать полиэфиры с высокой молекулярной массой (Mn 17000 г/моль) и относительно узким молекулярно-массовым распределением (Mw/Mn ~1,35), которое увеличивается с ростом конверсии до 1,48 [135].

Рисунок 1.32 – Комплексы циркония (20а) и гафния (20b) с лигандами
