
- •1. Степень окисления
- •2. Природа окислительно-восстановительных процессов
- •3. Простые и сложные вещества в качестве окислителей и восстановителей.
- •4 Составление уравнений овр методом электронного баланса.
- •5.Влияние различных факторов на овр.
- •6. Окислительно-восстановительный эквивалент.
- •I. Качественный анализ
«Окислительно-восстановительные реакции» (ОВР)
1. Степень окисления
Степень окисления (с.о.) элемента–это условный заряд, который приобрёл бы атом, если бы е, участвующие в образовании химической связи, были бы полностью смещены к более электроотрицательному атому.
Значение с.о. определяется числом е, смещенных от атома данного элемента к атому другого элемента.
Элементы с постоянной с.о.
S-эл. I гр (Li, Na, K, Rb, Cs, Fr):+1
S-эл. II гр (Ве, Mg, Ca, Sr, Ba, Ra):+2
p-эл. III гр. (Al):+3
Кислород: –2 (искл.H+2O-2, O+2F-2)
Водород: +1 (искл. Li+H-и другие гидриды Ме)
Фтор: –1 Другие галогены: –1 сМе и Н.
Атомы в простых веществах 0 (H02, Na0, S0).
Элементы с переменной с.о.
При определении с.о. таких элементов пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов.
K+Mn x O-24 или K+1 Mnх=+7 O-24 Fex=+3 (SуO-24)-23 (SУО-24)-2
+1+x+4(-2)=0 +1+7 -8 +6 –6 у+4(-2)=-2
x=+7 +8 у=+6
. С.о. не всегда совпадает с величиной валентности В.
Аммиак Гидразин Гидроксиламин
NH3 N2H2 NH2OH
H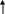
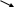
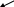 N-3H H H H
N-3H H H H
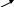
 N-2–N-2 N-1OH
N-2–N-2 N-1OH
H H H H
B(N)=3 B(N)=3 B(N)=3
С.о.(N)=-3 С.о.(N)=-2 С.о.(N)=-1
2. Природа окислительно-восстановительных процессов
Окислительно-восстановительными называются реакции, сопровождающиеся изменениями с.о. элементов за счет передачи е от атомов или ионов одного элемента к атомам или ионам другого элемента.
Процесс отдачи атомом, молекулой или ионом электронов, называют окислением:
Fe2+–еFe3+ Сами эти частицы (например, Fe2+) называют
в-ль (повышает с.о.) восстановителями (они окисляются)
Процесс присоединения электронов атомом, молекулой или ионом электронов, называют окислением.
Мn+7
+5![]() Mn+2 Сами
эти частицы (например Mn7+)
называют
Mn+2 Сами
эти частицы (например Mn7+)
называют
о-ль(понижает с.о.) окислителями (они восстанавливаются).
Окисление одних веществ (частиц) всегда сопровождается восстановлением других и наоборот, т.е. эти два процесса протекают одновременно. Основу этих процессов составляет передача и прием электронов. Число отдаваемых восстановителем электронов всегда равно числу электронов, присоединяемых окислителем.
3. Простые и сложные вещества в качестве окислителей и восстановителей.
О способности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом элемента в своей высшей степени окисления не может ее повысить (т.е. отдать е) и проявляет только окислительные свойства, а в своей низшей степени окисления не может её понизить (принять е) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
Например:
N-3 N-2 N-1 N0 N+1 N+2 N+3 N+4 N+5
NH3 N2H4 NH2OH N2 N2O NO HNO2 NO2 HNO3
только проявляют и окислительные, и только
восстановитель восстановительные свойства окислитель
Восстановители (доноры-электронов):
1) атомы всех элементов, кроме благородных газов и фтора. Наиболее активны -щелочные и щелочноземельные Me.
2) все отрицательно заряженные простые ионы:
J-, Br-, Cl-, S2-, Se2-
3) ионы, которые могут увеличивать положительную степень окисления 2+ 2+ 4+
Sn2+ Fe2+ S4+ SnCl2 FeSO4, H2SO3
Sn2+Sn4+, Fe2+Fe3+, S4+S+6
4)электрический ток на катоде! (сильный восстановитель).
Окислители (акцепторы электронов)
1) только атомы неметаллов: самые сильные F2, Cl2, Br2, J2, самые слабые – неметаллы IV группы.
2) ионы металлов.
Наиболее активны d-элементы в их высшей валентности (MnO4-, Cr6+) наименее активны ионы щелочных и щелочноземельных металлов (Na+, Са2+ и т.д.).
оксиды, кислородные кислоты и их соли:
MnO2, H2O2, SO2, NO2, PbO2, HNO3, HclO4, KMnO4, K2Cr2O7
В концентрированных кислотах окислителем выступает кислотообразующий элемент (S6+, Cl7+, N5+), а в разбавленных – ион Н+, который изменяет свою степень окисления.
электрический ток на аноде.
