Федеральное агентство по образованию и науке
филиал государственного образовательного учреждения
высшего профессионального образования
«Московский энергетический институт
(технический университет)»
в г. Волжском
Кафедра «Промышленная теплоэнергетика»
Шамина Г.З.
«Определение показателя адиабаты воздуха»
Методические указания к лабораторной работе
по дисциплине «Термодинамика»
Волжский 2007
Цель работы
Экспериментальное
определение среднего показателя адиабаты
![]() для воздуха в диапазоне комнатных
температур.
для воздуха в диапазоне комнатных
температур.
2. Теоретические основы работы
Адиабатным (адиабатическим) называют термодинамический процесс, происходящий в термодинамической системе без подвода теплоты. Первое начало термодинамики для произвольного термодинамического процесса имеет вид:
![]() [2,с.56] (2.1)
[2,с.56] (2.1)
Где
![]() - бесконечно малое количество теплоты,
подводимое к термодинамической системе;
- бесконечно малое количество теплоты,
подводимое к термодинамической системе;
![]() - бесконечно малое изменение внутренней
энергии системы;
- бесконечно малое изменение внутренней
энергии системы;
![]() - бесконечно малая работа, совершаемая
термодинамической системой в результате
данного процесса.
- бесконечно малая работа, совершаемая
термодинамической системой в результате
данного процесса.
Для адиабатного процесса уравнение (2.1) принимает вид:
![]() (2.2)
(2.2)
Для 1 кг. идеального газа справедливы соотношения:
![]() , (2.3)
, (2.3)
![]() . (2.4)
. (2.4)
Здесь ![]() - молярная теплоёмкость при постоянном
объёме газа;
- молярная теплоёмкость при постоянном
объёме газа;
![]() - давление;
- давление;
![]() - бесконечно малое изменение температуры.
- бесконечно малое изменение температуры.
![]() - бесконечно малое изменение удельного
объёма.
- бесконечно малое изменение удельного
объёма.
Подставляя (2.3) и (2.4) в (2.2), получим:
![]() (2.5)
(2.5)
Запишем уравнение Менделеева-Клапейрона: pV=RT, где
R
– газовая постоянная для заданного
идеального газа.![]() ,
,
![]() -
универсальная газовая постоянная; V
– удельный объём газа.
-
универсальная газовая постоянная; V
– удельный объём газа.
Дифференцируя
его, найдём связь между
![]() ,
и
:
,
и
:
d(pV)
=
![]() ; (2.6)
; (2.6)
Из (2.6) получим:
![]() ;
(2.7)
;
(2.7)
Подставляя (2.7) в (2.5), получим дифференциальное уравнение, связывающее объём и давление идеального газа в адиабатном процессе:
![]() .
(2.8)
.
(2.8)
Используя
связь теплоёмкости при постоянном
давлении - СР
с теплоёмкостью
при постоянном объёме - CV
в уравнении Майера
![]() ,
и вводя обозначение
,
и вводя обозначение
[2,с.71] (2.9)
получим:
![]() (2.10)
(2.10)
Для идеального газа теплоёмкости СР и CV не зависят от температуры и величина остаётся постоянной.
Проинтегрируем уравнение (2.10), получим:
![]() или
или
![]() (2.11)
(2.11)
Используя свойство логарифмов, получим:
![]() или
или
![]() (2.12)
(2.12)
Уравнение (2.12) называют уравнением адиабаты или уравнением Пуассона, которое определяет упругость идеального газа и зависимость давления газа от различных величин объёмов, занимаемых при любой температуре. Величину «k» называют показателем адиабаты или показателем Пуассона. Численное значение показателя адиабаты лежит для разных газов в пределах 1,33 – 1,67. Оно зависит от числа атомов в молекуле газа и химической структуры их соединения в молекуле.
Для одноатомных идеальных газов – k=1,67. Из реальных газов к ним можно уподобить инертные газы – гелий, аргон, ксенон.
Для двухатомных идеальных газов - k=1,4. Из реальных газов к ним можно уподобить двухатомные газы – азот, кислород, водород и т.д.
Для трёхатомных и многоатомных идеальных газов с линейной структурой молекулы- k=1,4 ( Н2S , CO2, H2O); с нелинейной структурой - k=1,33 (NH3, CH4, SO3).
Согласно молекуллярно-кинетической теории (МКТ) энергетические параметры движения той или иной молекулы газа учитываются числом её возможных степеней свободы ‘i’ из трёх поступательных и трёх вращательных по осям х, у, z в пространстве [ 1 ]. При этом :
![]() ;
;
![]() (2.13)
(2.13)
(i – число возможных степеней свободы молекулы идеального газа);
Уподобляя воздух при атмосферном давлении и комнатной температуре идеальному газу, можно сказать что все приведенные формулы справедливы и для воздуха. Кроме того, учитывая что воздух в основе состоит из азота и кислорода, молекулы которых двухатомные, теоретическая величина показателя адиабаты для него составляет: k=1,4.
Описание установки и вывод расчётных формул

Состав и функционирование установки (Рис. 3.1):
I – лабораторный модуль (ЛМ) и II – приборный модуль (ПМ).
ЛМ состоит из баллона (1), наполненного воздухом. Баллон соединён с манометром (3). Через клапан (9) «напуск» и через резиновый шланг (6) баллон соединён с компрессором (7) приборного модуля. Клапан (5) предназначен для соединения баллона (1) с атмосферой, а так как его поперечное сечение достаточно велико, то процесс установления атмосферного давления в сосуде происходит достаточно быстро. Изменение давления происходит практически без теплообмена с окружающей средой, поэтому процесс можно считать адиабатным.
С помощью
насоса (7) в баллон (1) накачивается воздух,
затем закрывают кран (9). Температура в
баллоне, при этом, повышается. Через
несколько минут температура воздуха в
баллоне становится равной температуре
окружающего воздуха в лаборатории.
Обозначим эту температуру
![]() ,
а давление в баллоне
,
а давление в баллоне
![]() при этом равно:
при этом равно:
![]() ; (3.1)
; (3.1)
Здесь:
![]() - атмосферное
давление;
- атмосферное
давление;
![]() - избыточное
давление воздуха, определить которое
можно по показанию манометра.
- избыточное
давление воздуха, определить которое
можно по показанию манометра.
Выберем в сосуде
мысленно замкнутую область (2) вдали от
клапана. Будем считать, что масса газа
(или число молекул) сосредоточенная в
этой «области» неизменна, а параметры
газа (давление, температура и объём) в
этой области изменяются и соответствуют
равновесным параметрам газа в баллоне
(1), Начальное состояние воздуха в
выделенной области баллона характеризуется
параметрами
,
![]() ,
,
![]() .
.
Если клапан (5)
открыть на короткое время (![]() ),
часть воздуха выйдет из баллона и
давление в нём упадет и станет
),
часть воздуха выйдет из баллона и
давление в нём упадет и станет
![]() ,
выбранная нами «область» увеличится в
объёме до значения
,
выбранная нами «область» увеличится в
объёме до значения
![]() .
Температура воздуха в баллоне понизится,
так как при вытекании из него воздух
совершает работу против давления
окружающего атмосферного воздуха.
.
Температура воздуха в баллоне понизится,
так как при вытекании из него воздух
совершает работу против давления
окружающего атмосферного воздуха.
Итак, непосредственно
когда клапан (5) закрывают,
![]() и состояние воздуха в «области» баллона
характеризуется параметрами
и состояние воздуха в «области» баллона
характеризуется параметрами
![]() ,
,
![]() ,
.
Считая процесс переход воздуха из
состояния 1 в состояние 2 адиабатным
процессом, из уравнения (2.12) получим:
,
.
Считая процесс переход воздуха из
состояния 1 в состояние 2 адиабатным
процессом, из уравнения (2.12) получим:
![]() ; (3.2)
; (3.2)
После закрытия клапана (5), объём в баллоне не меняется и потому происходит изохорный процесс теплообмена воздуха во времени с окружающей средой. Температура воздуха в баллоне приближается к температуре воздуха в лаборатории , давление по окончании этого процесса становится равным р3 :
![]() ; (3.3)
; (3.3)
![]() - избыточное
давление в баллоне измеряется по
манометру. Параметры воздуха после
окончания изохорного процесса
- избыточное
давление в баллоне измеряется по
манометру. Параметры воздуха после
окончания изохорного процесса
![]() ,
,
,
,
![]() ,
причём
,
причём
![]() .
.
Так как температуры
воздуха в первом и третьем состоянии
можно считать одинаковыми, а масса газа
в выбранной нами «области» постоянной
(объём V
выбран вдали от клапана), то для состояний
1 и 3 можно применить закон Бойля-Мариотта
![]() [3,
с.150]:
[3,
с.150]:
![]() ; (3.4)
; (3.4)
Решая систему уравнений (3.2) и (3.4), исключая величины объёмов, получим:
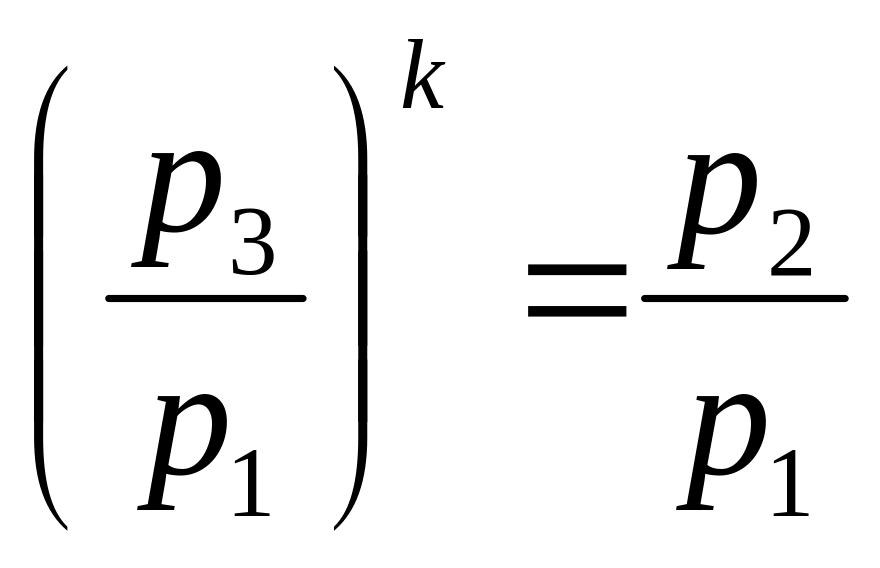 ;
;
Прологарифмировав это соотношение и выразив показатель адиабаты, получим:
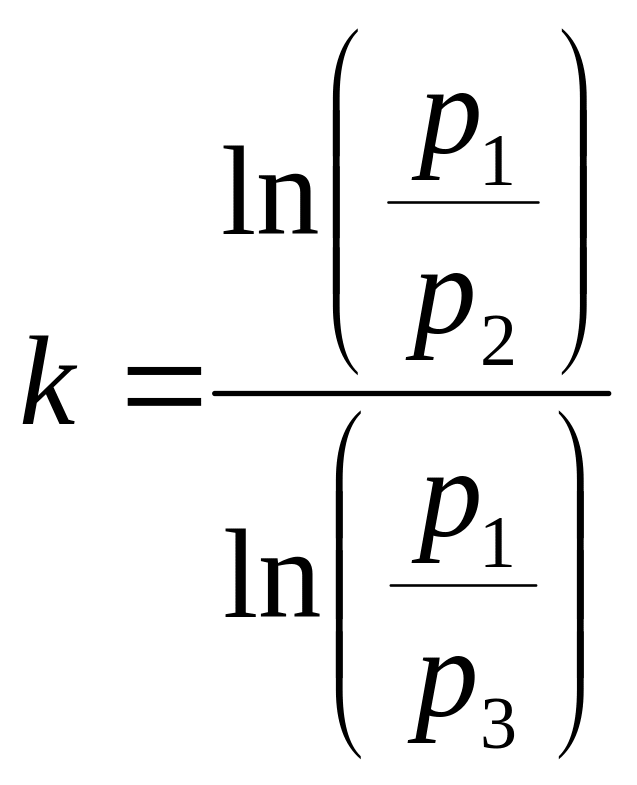 ;
;
Используя соотношения (3.1) и (3.3), получим:
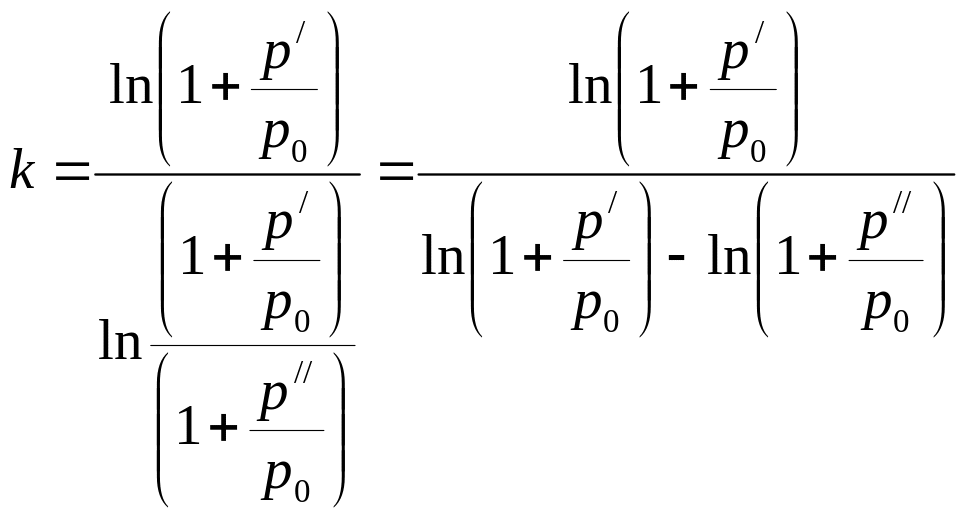 ; (3.5)
; (3.5)
Так как избыточные
давления
и
весьма малы по сравнению с атмосферным
давлением
,
то для данной логарифмической зависимости
можно использовать разложение функции
типа
![]() в сумму числового ряда, ограничившись
первым членом разложения (при
в сумму числового ряда, ограничившись
первым членом разложения (при
![]() ):
):
![]() ;
;
Отсюда из (3.5) следует зависимость показателя адиабаты только от величин избыточных давлений:
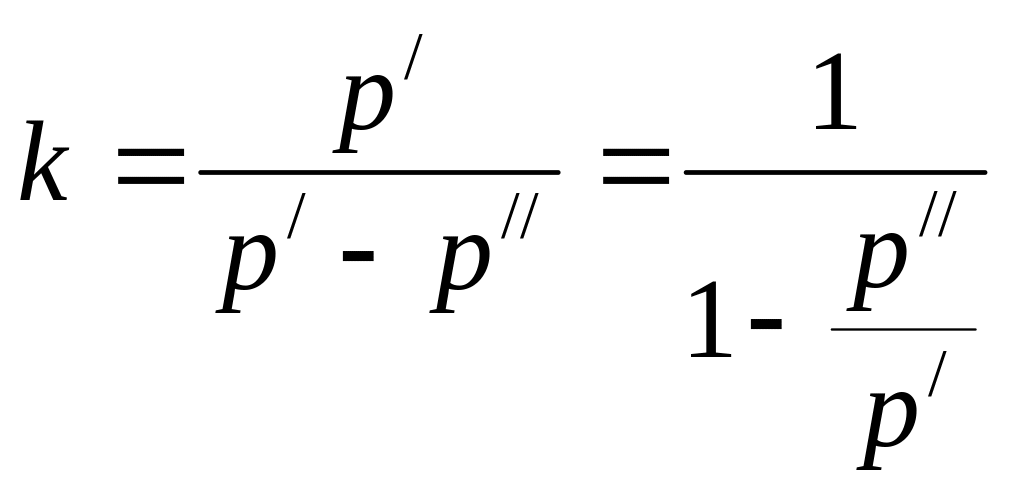 ; (3.6)
; (3.6)
Избыточные давления, определяемые по U-образному манометру, можно выражать соотношением разницы высот уровней жидкости в коленах:
![]() , где
(3.7)
, где
(3.7)
![]() - постоянный для
данного манометра постоянный коэффициент,
зависящий от плотности жидкости -
- постоянный для
данного манометра постоянный коэффициент,
зависящий от плотности жидкости -![]() и ускорения свободного падения – g.
и ускорения свободного падения – g.
Тогда из выражений (3.6) и (3.7) получаем зависимость:
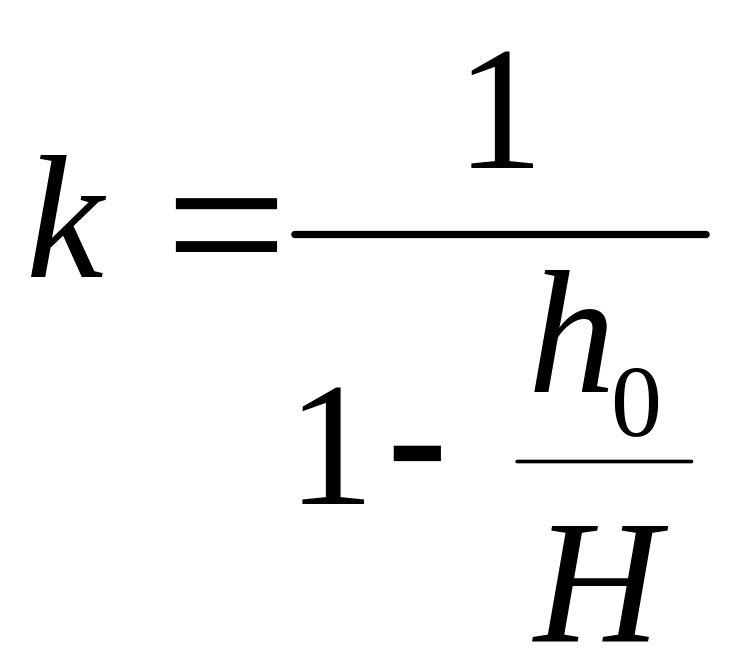 ; (3.8)
; (3.8)
где
![]() и
и
![]() - разности уровней жидкости в манометре
в первом и третьем состояниях.
- разности уровней жидкости в манометре
в первом и третьем состояниях.
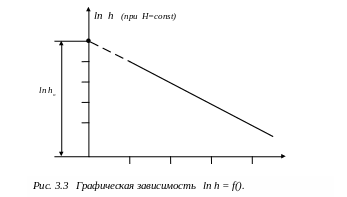
Отметим, что значение соответствует условию, что клапан (5) закрыли точно в момент окончания адиабатного процесса. Если закрыть клапан (5) раньше (до выравнивания давлений), или спустя некоторое время после адиабатного процесса, то результат вычислений по формуле (3.8) даст в первом случае завышенное, во втором – заниженное значение k.. Для получения наиболее точного экспериментального значения k необходимо закрыть клапан точно в момент окончания адиабатного процесса. Т.к. это выполнить вручную во времени технически трудно на данной установке, значение разности уровней определяют косвенным графическим методом.
П р и м е ч а н и е. Процессы, происходящие в сосуде, не являются квазиравновесными, поэтому графики, строго говоря, строить нельзя (в случае неравновесного процесса нельзя говорить о давлении и температуре газа, так как в разных частях баллона эти величины могут иметь различные значения).
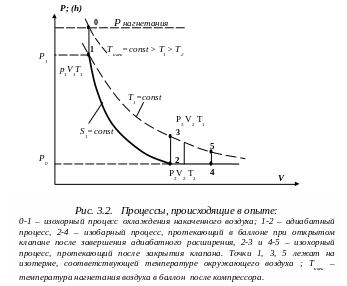
Пусть клапан
(5) остаётся открытым в течение некоторого
времени
.
В этом случае процессы, происходящие в
объёме V,
можно условно изобразить графически
(Рис. 3.2). Очевидно, что с ростом
разность уровней жидкости в манометре
![]() будет уменьшаться. При
будет уменьшаться. При
![]() получим
получим
![]() ,
при
,
при
![]() (длительность адиабатного расширения
весьма мала) получим
(длительность адиабатного расширения
весьма мала) получим
![]() .
Измеряя h
при различных значениях
и строя график логарифмической зависимости
изменения давлений ln
(h/H)
= f(
),
можно найти значение
.
Измеряя h
при различных значениях
и строя график логарифмической зависимости
изменения давлений ln
(h/H)
= f(
),
можно найти значение
![]() экстраполяцией экспериментальной
прямой. При постоянных величинах давлений
в точке 1 (Н=const)
в проводимых экспериментах функцию
можно представить в виде ln
h
= f(
),
характер которой представлен на рис.
3.3.
экстраполяцией экспериментальной
прямой. При постоянных величинах давлений
в точке 1 (Н=const)
в проводимых экспериментах функцию
можно представить в виде ln
h
= f(
),
характер которой представлен на рис.
3.3.