
- •4. Расчет горения топлива
- •3. Расчет горения топлива
- •3.1. Расчет горения газообразного топлива.
- •1. Расчет горения топлива (Примеры).
- •1.1 Расчет горения жидкого топлива
- •1.1.1 Рабочий состав топлива:
- •1.1.2. Определение количества воздуха необходимого для полного сгорания топлива.
- •1.1.3. Определение температуры горения топлива:
- •1.2 Расчет горения газообразного топлива
- •1.2.1. Определение количества воздуха необходимого для полного сгорания топлива
- •1.2.2 Количество и состав продуктов горения (пг):
- •1.2.3 Определение температуры горения топлива:
4. Расчет горения топлива
Положения теории горения
Горение – процесс быстрого химического соединения горючих элементов топлива с окислителем (кислородом), сопровождающееся выделением тепла.
В нагревательных печах используется жидкое и газообразное топливо.
Оно сжигается в форсунках и горелках. Метод горения – факельный. Факел образуется при подаче в рабочее пространство горючей смеси (воздух+топливо) струями.
При движении струи происходит:
1. – Перемешивание топлива с воздухом;
2. – Подогрев смеси;
3. – Воспламенение смеси;
4. – Горение;
5. – Передача тепла.
Горение бывает:
1. – Гомогенное – с поверхности отдельных капель;
2. – Гетерогенное – в объеме.
Этапы горения жидкого топлива:
1. – Распыление мазута;
2. – Смешивание с воздухом;
3. – Подогрев до температуры вспышки;
4. – Воспламенение;
5. – Горение капли;
6. – Горение твердого остатка.
Этапы горения (газообразного топлива):
1. – Перемешивание топлива с воздухом;
2. – Подогрев смеси до температуры воспламенения;
3. – Горение.
Тепло расходуется для:
Подогрева новых порций смеси;
Нагрева продуктов горения;
Расхода тепла на нагрев заготовок и потери:
Нагрев металла в рабочем пространстве печи;
Передача тепла в окружающую среду;
Нагрев стен, пода, свода печи;
Потери тепла через окна и т.д.
Часто используется предварительный подогрев воздуха и топлива.
Температура подогрева (tоС) зависит от вида топлива и способа смешивания.
Дать примеры:
– Горение мазута;
– Горение газа.
Различают следующие виды смешивания топлива с воздухом:
Предварительное смешивание;
Внутреннее смешивание;
Частичное (внутреннее + внешнее) смешивание;
Внешнее смешивание.
Важным параметром топлива является тепловое напряжение РП печи –
количество тепла, выделяющееся при сжигании топлива в единицу времени, отнесенное к 1м³ топки или рабочего пространства печи. Для жидкого топлива норма – 600кВт/м³; для газа – 1200кВт/м³.
Гомогенное горение может происходить в 2х режимах:
– Кинетическом – заранее подготовленной горючей смеси;
– Диффузионном – смешивание, подогрев горючей смеси и горение её происходит одновременно (теория горения Н.Н. Семенова и Я.Б. Зельдовича).
Расчеты горения топлива необходимы для определения:
– Расхода воздуха (L0 и Lα) или (LТ Lд);
– Количества и состава продуктов горения (Vo,Vα);
– Температуры горения(tТ ,tК).
Для расчетов используют следующие величины:
1.
–
![]() – отношение % содержания азота в воздухе
к % содержанию кислорода.
– отношение % содержания азота в воздухе
к % содержанию кислорода.
2. – Молекулярная масса химических элементов:
H2=2, N2=28, O2=32, S=32, C=12.
![]() 3.
– Объем 1к моль газа при НФУ Vкм=22.4
.
3.
– Объем 1к моль газа при НФУ Vкм=22.4
.
4. – Расчеты Lα и Vα отнесены к нормальным физическим условиям
(н.ф.у.) – t=0оC, p=760мм ртутного столба или I0I кПа.
Горение жидкого топлива.
Состав: CP+Hp+Op+Np+Sp+Ap+Wp=100%
По формуле Менделеева или из таблицы определяем Qнр.
При необходимости предварительно осуществляем перерасчет на рабочее топливо.
Записываем реакции горения:
C+O2+KN2=CO2+KN2+Q1;
2H2+O2+KN2=2H2 O+KN2+Q2;
S+O2+KN2=SO2+KN2+Q3.
Определяем количество молей кислорода необходимое для горения соответствующего количества молей горючих элементов топлива.
При горении с каждым молем O2 вносится 3,76 молей N2, который переходит в продукты горения, т.е. является балластом. При горении каждого из молей топлива выделяется определенное количество тепла.
Разделив 22,4/12=1,867 м³/кг – получим количество кислорода необходимое для горения 1 кг углерода (С2).
Аналогично 22,4/(2*2)=5,6 м³/кг – горение 1 кг водорода (Н2);
22,4/32=0,7м3 /кг – горение 1 кг серы (S).
Т.к. в горении участвует кислород топлива (О2р), определяем его количество в м3
32 – 22,4
![]()
![]()
![]()
![]() =*
м3.
=*
м3.
Т.е. кислород топлива уменьшает потребность в кислороде воздуха.
Топливо – смесь горючих элементов. Общий расход кислорода равен сумме расхода на горение всех горючих элементов.
Для горения 1кг жидкого топлива потребуется следующее количество кислорода:
VО2=0,01*(1,86*Cp+5,6*Hp+0,7*Sp-0,7*О2р )
Состав топлива задан в %, что соответствует количеству кг кислорода на 100кг топлива.
Тогда теоретический расход воздуха:
L0 = (1 + K)*VO2
А с учетом влажности воздуха
![]() ,
,
![]() влажного воздуха
на 1кг топлива составит
влажного воздуха
на 1кг топлива составит
![]()
где: – 22,4 – объем 1 кмоля пара, м3
– g – содержание паров Н2О в воздухе г/м3;
– 18 – молекулярная масса пара;
– 1000 – коэффициент перевода из граммов в килограммы.
Аналогичным образом расчет выполняется для газообразного топлива.
Расчет горения газообразного топлива следующего состава:
Рассмотрим горение топлива следующего состава
CH4+CmHn+CO+H2+H2 S+SO2+O2+N2=100%
Реакции горения углеводородов.
-

-
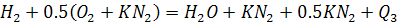
-
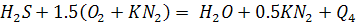
СmHn + (m + n/4) (O2+KN2) = mCO2+0,5nH2O+(m + n/4)*KN2 + Q5.
Тогда теоретически необходимое количество кислорода:
![]()
![]()
![]() =0.01(0,5()+(m+n/4));
=0.01(0,5()+(m+n/4));
где содержание горючих составляющих подставляется в %. Расчет ведется на 100м3 топлива. Коэффициент – 0,01 – служит для перехода к расчету горения 1м3 топлива.
Теоретический расход воздуха составит:
Lo=(1+K)Vo2
Действительный расход воздуха, необходимого для полного горения, больше теоретического. Объясняется это несовершенством перемешивания топлива характеризуется коэффициентом избытка воздуха.
α=Lα/Lo тогда Lα= α*Lo;
где: – Lα и Lo – действительный и теоретический расход воздуха в м3/кг или м3;
– α – коэффициент избытка воздуха из табл.
Таблица 4.1.Значения коэффициентов избытка воздуха.
Вид топлива |
α |
Твердое Простая топка Полугазовая |
1,4 – 1,7 1,3 – 1,6 |
Жидкое Форсунка |
1,1 – 1,25 |
Газообразное Горелка частичного и внешнего смешивания Горелка внутреннего смешивания |
1,05 – 1,2 1,0 – 1,05 |
Т.е величина α – зависит от вида топлива, конструкция топливо – сжигающего устройства и наличия подогрева топлива и воздуха.
При недостатке воздуха происходит неполное сгорание его. Различают: химическую и механическую неполноту сгорания.
При высоких температурах происходит диссоциация ПГ (расщепление) прежде всего СО2 и Н2О на СО – Н2 – О2.
На диссоциацию затрачивается значительное количество тепла, которое определяется по tоC и Р (парциальному давлению ) с помощью специальных графиков (составляет 5 – 6% при 1600оС).
При наличии горючих составляющих в ПГ определяют химическую неполноту горения – химический недожог. При расчете его принимают равным
(2 – 3)% для мазута и природного газа.
Значительное увеличение α приводит к снижению температуры t печи, т.к возрастает количество П.Г. – требуется дополнительная энергия для их нагрева и перемещения, большое количество тепла уносится с дымовыми газами (см. рис.4.1.).
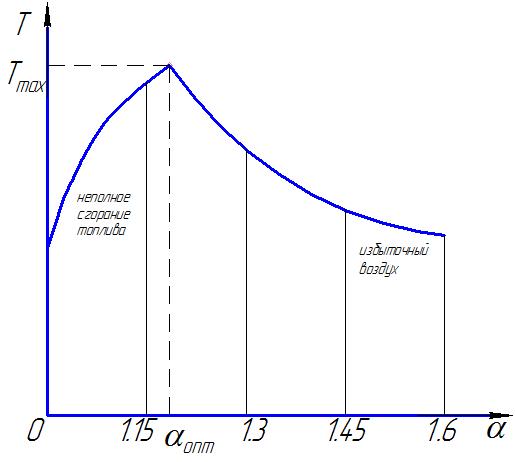
Рис.4.1.
Задача сводится к выбору оптимального значения коэффициента избытка воздуха. Состав ПГ при полном сгорании СО2, Н2О (пар), SО2 (сернистый газ), и N2(азот).
Обычно количество сернистого и углекислого газов находят одновременно RO2 = СО2 + SО2
Определение состава и количества П.Г.
С помощью реакций горения при α= 1 (теоретически необходимый воздух) П.Г. состоят из СО2, SО2, Н2О, N2.
Для расчета необходимо определить объемы этих газов и просуммировать.
![]()
![]()
![]() C++=СО2++
C++=СО2++
![]() 2H2++KN2=2Н2О++
2H2++KN2=2Н2О++
![]() S++KN2=SО2++
S++KN2=SО2++
![]() 1K
моль С →1к моль СО2
=22.4 м³.
1K
моль С →1к моль СО2
=22.4 м³.
Из 1кг С образуется 22,4/12=1,867 м³ СО2.
Из 1кг S – 22,4/32=0,7 м³ SО2.
Тогда суммарно получим:
![]()
Количество влаги: на 1кг Н2 образуется 2*22,4/2*2=11,2м³(пара).
В топливе содержится влага Wp. Из 1 кг влаги образуется 22,4/18=1,24 м³ пара.
Нужно учитывать влагу распыляющего пара (Wф) и количество влаги, вносимое воздухом. При заданных условиях – g г/м³ пара(Wф):
![]()
Суммарное количество водяного пара:
![]() м³/кг
м³/кг
![]()
![]() Кроме
и в П.Г. содержится азот N2:
Кроме
и в П.Г. содержится азот N2:
азот топлива 22,4/28=0,8[м³];
азот воздуха в количестве К*[м³].
Тогда суммарный азот в м³/кг:
![]()
![]() Np
+К*
Np
+К*
При α=1 теоретическое количество П. Г. составит:

Если α >1, объем П.Г. возрастает из за дополнительного кислорода, азота и водяного пара.
Тогда объем влажных П.Г. при α>1 составит:
VαB=

где: 1 – избыточный кислород;
2 – азот, вводимый с избыточным кислородом;
3 – влага, вносимая с избыточным воздухом.
Пример (Телегин стр.23 – 24, методичка).
Зная состав и количество ПГ, можно определить их состав в %.
Зная состав и количество П.Г. можно определить % состав сухих и влажных ПГ:

Результаты заносим в таблицу.
Состав сухих и влажных ПГ в %
|
СО2 |
Н2О |
SО2 |
N2 |
|
|
Сухие |
|
|
|
|
|
|
Влажные |
|
|
|
|
|
|
Формула для расчёта содержания данной составляющей в сухих или влажных ПГ в %:
![]() X%=.
X%=.
Для газообразного топлива количество продуктов горения V – определяем исходя из реакций горения:
![]()
где: – (CO2+SO2)=RO2.
![]()
![]() N2
+K
N2
+K
Тогда объем влажных продуктов горения при коэффициенте избытка воздуха α=1:
 V0В=
V0В=
При сжигании газа с коэффициентом избытка воздуха α>1:
![]()
Таблица 4.2.Эмпирические формулы расчёта количества воздуха и П.Г.
Вид топлива |
|
|
||
|
Lo |
Vo |
Lα |
Vα |
мазут |
|
|
0 |
Vα=V0+(α-1)L0 |
|
|
|
||
Газ |
|
|
||
Определение теоретической температуры горения топлива:

![]()
![]() где:
- средняя теплоемкость П.Г. в интервале
температур от 00С
до tТ0С.(кДж/0С);
где:
- средняя теплоемкость П.Г. в интервале
температур от 00С
до tТ0С.(кДж/0С);
qт qв qм – тепло вносимое в печь подогретым воздухом, топливом и металлом;
![]() – потери
тепла в результате диссоциации П.Г.
– потери
тепла в результате диссоциации П.Г.
![]()
Дать анализ формулы (1) и оценить влияние компонент числителя и знаменателя на температуру горения.
Выделить наиболее существенные резервы повышения температуры горения:
Подогрев воздуха
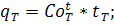
Подогрев топлива
где: - средняя теплоемкость воздуха и топлива при подогреве до заданной температуры.
Можно преобразовать уравнение (1):

Iоб=iх+iв+iТ+iм-iдис
Iоб+ iдис=i= iх+iв+iТ+iм
где: i теплосодержание П.Г.: iв+iТ+iм – за счет подогрева воздуха, топлива и металла соответственно;
tT – теоретическая температура горения топлива.
Существуют графики и таблицы зависимости Iоб – tT (см. Телегин стр.89, методичка).
Зная Iоб определяем tТ с помощью таблицы, после чего определяем температуру горения с учётом потерь:
Iоб |
кДж/м3 |
2785 |
2955 |
3170 |
3385 |
3625 |
3890 |
4190 |
4520 |
5015 |
tТ |
оС |
1700 |
1800 |
1900 |
2000 |
2100 |
2200 |
2300 |
2400 |
2500 |
;
где: – действительная (пирометрическая) температура печи, с учетом потерь тепла;
=(0.65…0.75) – пирометрический коэффициент.
меньшее значение – щелевые камерные печи;
большее – методические печи, печи с вращающимся подом и т.д.
В практических расчетах для определения температуры горения используют эмпирические формулы.
Итоговые формулы для расчётов.
Объем П.Г. при α=1:
![]() V0=0.01;
V0=0.01;
При α>1:
Vα=V0+(α-1)*(α-1).
Количество кислорода и воздуха
необходимое для горения 1кг топлива:
.
Количество теоретически необходимого воздуха:
.
Количество действительно необходимого воздуха:
.
4) Объем П.Г. при α=1 (теоретический):
V0=0.01;
При α>1 (действительный):
Vα=V0+(α-1)*(α-1).
Пример расчета процесса горения
Дано топливо – мазут следующего состава:
![]()
Влажностью воздуха пренебречь
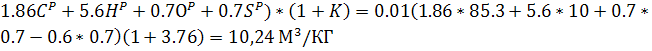 L0=Приближенный
расчет:
L0=Приближенный
расчет:
![]()
![]()
Количество кислорода в м3:
![]()
Состав и количество П.Г.
Количество П.Г.:

Vα=V0+(α-1)*(α-1)=10.83+0.2*2.148+3.76*0.2*2.148 = 12.87м3;
Объем П.Г. при НФУ Vα=12.87м3.
При температуре ПГ =1000⁰С плотность П.Г. снижается в несколько раз, а объем увеличивается в 4,5 раза.
Объем отдельных составляющих продуктов сгорания:
![]()
![]() м3/кг|
м3/кг|
![]()




![]() Состав
ПГ Х=:
Состав
ПГ Х=:
Таблица 4.3.
-
Сухие




Влажные
12.34
9.00
0.04
3.34
75.28
Плотность ПГ:
![]()
Теплота сгорания мазута:
![]()
Определение температуры горения топлива.
Теплосодержание ПГ за счёт горения топлива (химическое):

![]()
Воздух подогреваем до температуры t = 3000С (физическое).
![]()
![]()
3426 - 3385=41(см. Телегин)
3625 – 2100- 240 – 1000С
3385 – 2000 41 – х
240 100
![]() Температура
горения
Температура
горения
Практическая температура горения (пирометрическая):
![]()
Учитывает потери тепла в окружающую среду
Теплосодержание ПГ
Воздух подогреваем до температуры = 3000С
Приложение. Методичка – теория. Примеры расчёта.
