
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
Декарбоксилирование аминокислот и их производных
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
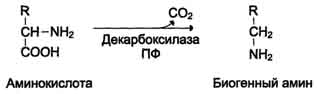
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать вместо ПФ остаток пирувата - гистидиндекарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза Е. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
Орнитиновый цикл
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота (рис. 9-15). Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина). В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта".
Реакции синтеза мочевины
Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I (см. схему А ниже).
![]() Далее
под действием орнитинкарбамоилтрансферазы
карбамоильная группа карбамоилфосфата
переносится на α-аминокислоту орнитин,
и образуется другая α-аминокислота -
цитруллин (см. схему Б на с. 483).
Далее
под действием орнитинкарбамоилтрансферазы
карбамоильная группа карбамоилфосфата
переносится на α-аминокислоту орнитин,
и образуется другая α-аминокислота -
цитруллин (см. схему Б на с. 483).
В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины (см. схему А на с. 483).
Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина (см. схему Б ниже).
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента:
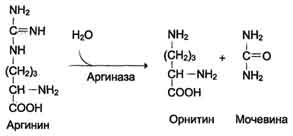
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7.
Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень с кровью ворот-вены. Роль других источников, в том числе гсительного дезаминирования глутаминовой эты в печени, существенно меньше.
Аспартат, необходимый для синтеза аргининокцината, образуется в печени путём трансаминирования
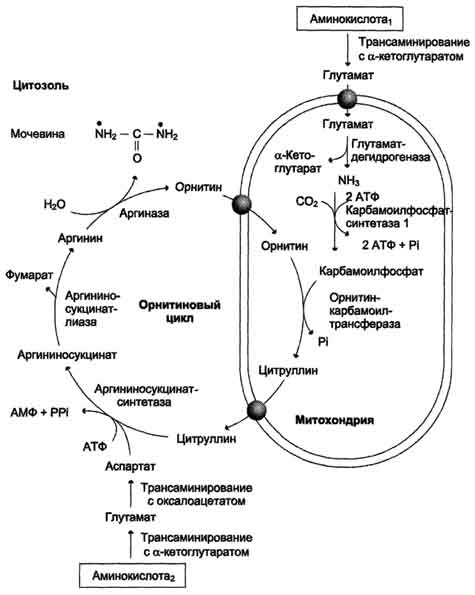
аланина с оксалоацетатом. Алании поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат (рис. 9-17). Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пиру ват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Ещё одним источником аспартата для орнитинового цикла является Трансаминирование глутамата с оксалоацетатом.
