
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
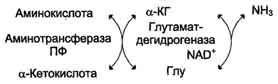
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы (рис. 9-9), что обеспечивает как катаболизм аминокислот (рис. 9-9, А), так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты (рис. 9-9, Б).
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
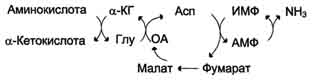
Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом (см. схему А на с. 476).
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы (см. схему Б на с. 476).
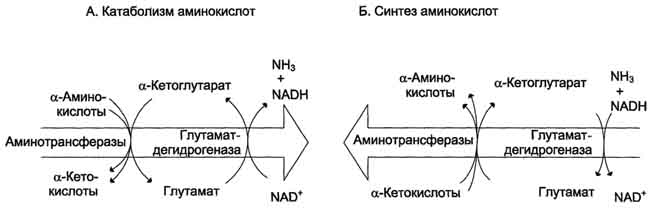
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
