
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат. Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в
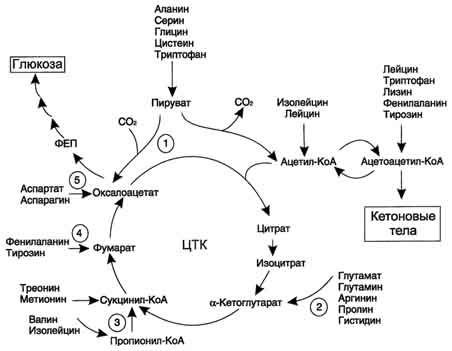
Рис. 9-22. Включение безазотистого остатка аминокислот в общий путь катаболизма.
процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, илигликокетогенными (рис. 9-22, табл. 9-5).
Анаплеротические реакции
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке 9-22 выделены пять анаплеротических реакций:
1. ![]()
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.
Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
окислительное;
непрямое (трансдезаминирование);
неокислительное;
внутримолекулярное.

Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат.
