
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
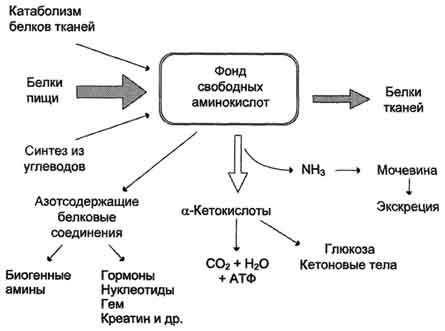
Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35-65 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг.
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1).
Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных.
В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
Биосинтез заменимых аминокислот.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про (рис. 9-23). Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты (см. схему А на с. 492).
Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой.
Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.
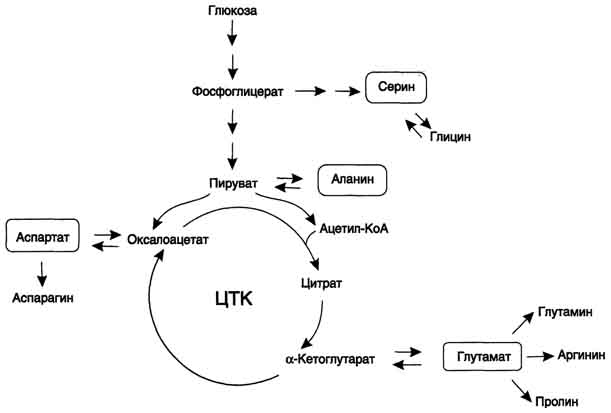
Рис. 9-23. Пути биосинтеза заменимых аминокислот.
Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп (см. схему А).
Серин образуется из 3-фосфоглицерата - промежуточного продукта гликолиза, который окисляется до 3-фосфопирувата и затем трансаминируется с образованием се-рина (см. схему Б).
Существует 2 пути синтеза глицина:
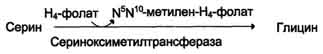
1) из серина с участием производного фолиевой кислоты в результате действия се-риноксиметилтрансферазы:
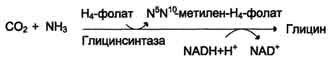
2) в результате действия фермента глицинсинтазы в реакции:
Пролин синтезируется из глутамата в цепи обратимых реакций. Эти же реакции используются и при катаболизме пролита (см. схему В на с. 494).
Кроме восьми перечисленных заменимых аминокислот, в организме человека могут синтезироваться ещё четыре аминокислоты.
Частично заменимые аминокислоты Apr и Гис синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
Синтез аргинина происходит в реакциях орнитинового цикла (см. выше подраздел IV);
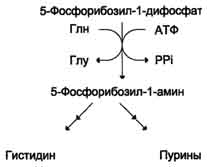
Гистидин синтезируется из АТФ и рибозы. Часть имидазольного цикла гистидина - N=CH-NH- образуется из пуринового ядра аденина, источником которого служит АТФ, остальная часть молекулы - из атомов рибозы. При этом образуется 5-фосфорибозиламин, который кроме синтеза гистидина необходим для синтеза пуринов.
Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно (см. подразделы VIII и IX).
