
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
37. Конъюгация - вторая фаза обезвреживание веществ
Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и умеНbшающих токсичность ксенобиотиков (табл. 12-2).
1. Участие трансферам в реакциях конъюгации
Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы
Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления (рис. 12-4).
В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы
Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам (рис. 12-5).
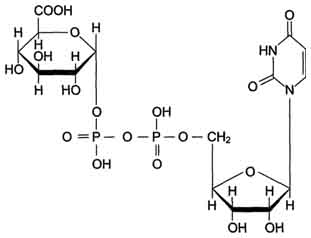
Рис. 12-4. Уридиндифосфоглюкуроновая кислота (УДФ-C6H9O6).
Реакция с участием сульфотрансферазы в общем виде записывается так:
ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы
Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ.
Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH) (рис. 12-6).
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
путём конъюгации субстрата R с глутатионом (GSH):
R + GSH → GSRH,
в результате нуклеофильного замещения:
RX + GSH → GSR + НХ,
восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
Рис. 12-6. Глутатион (GSH).
Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма (рис. 12-7).
ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином.
