
- •Роль белков в питании, нормы, азотистый баланс, коэффициент изнашивания, физиологический белковый минимум. Белковая недостаточность.
- •Переваривание белков в жкт. Характеристика пептидаз желудка, образование и роль соляной кислоты.
- •Характеристика пептидаз поджелудочной железы и тонкого кишечника. Защита клеток от действия пептидаз.
- •Всасывание продуктов переваривания в кишечнике. Γ-глутамильный цикл в гепатоцитах., его биологическое значение. Медицинское определение γ-глутамилтранспептидазы в крови.
- •Пул аминокислот в клетке, общая схема поступления и расходования аминокислот. Общая схема путей распада аминокислот. Особенности распада 3,4,5-углеродных аминокислот.
- •Биосинтез заменимых аминокислот.
- •Кетогенные и гликогенные аминокислоты. Анаплеротические реакции, синтез заменимых аминокислот.
- •Дезаминирование аминокислот: прямое (окислительное, гидролитическое, внутримолекулярные, восстановительное). Схемы реакции, биороль.
- •Окислительное дезаминирование глутамата: уравнение реакции, кофактор, место протекания, регуляция процесса, биороль.
- •Трансаминирование: схема процесса, ферменты, биороль. Биороль АдАт и АсАт и клиническое значение их определения в сыворотке крови.
- •Непрямое дезаминирование: схема процесса, ферменты, кофакторы, биороль.
- •Декарбоксилирование аминокислот. Общий вид реакций, ферменты, кофактор. Синтез и биороль: путресцина, кадаверина, спермидина, спермина.
- •20. Синтез мочевины. Орнитиновый цикл. Субклеточная локализация. Энергетика процесса.
- •2. Энергетический баланс процесса
- •21. Гипераммониемии. Виды причины. Симптомы протекания заболевания.
- •18. Токсичность аммиака, его образование и обезвреживание.
- •22. Метод количественного определения мочевины в сыворотке крови.
- •23. Метаболизм фенилаланина и тирозина. Альбинизм, базедова болезнь. Реакция обнаружения фенилпирувата в моче.
- •24. Метаболические дефекты при классической и атипичной фенилкетонурии. Основные проявления, терапевтическая практика.
- •25. Общая схема синтеза гемма. Нарушения синтеза гема-порфирии. Интоксикации свинцом.
- •26. Регуляция синтеза гема. Регуляция активности фермента алк-синтазы гемом, железом и лекарственными препаратами.
- •27. Распад гема - многостадийный процесс
- •Что такое прямой и непрямой билирубин?
- •28. Желтухи
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •29. Обмен железа
- •30. Нарушения метаболизма железа
- •35. Витамины, обладающие антиоксидантным действием
- •36. Механизмы обезвреживания ксенобиотиков
- •39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
- •20. Связывание, транспорт и выведение ксенобиотиков
- •37. Конъюгация - вторая фаза обезвреживание веществ
- •1. Участие трансферам в реакциях конъюгации
- •41. Метаболизм и обезвреживание этанола
- •Основные функции
39. Гниение аминокислот в кишечнике. Обезвреживание и выведение продуктов гниения из организма
Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот.
Образование и обезвреживание n-крезола и фенола
Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами (рис. 12-9).
Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфе-раза (рис. 12-10).
Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФ-глюкуронилтрансферазы (рис. 12-11). Продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике.
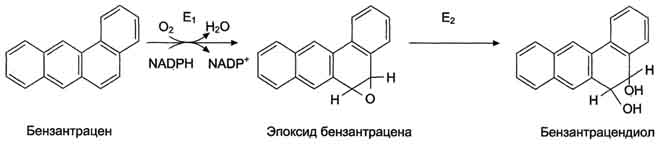
Рис. 12-8. Обезвреживание бензантрацена. Е1 - фермент микросомальной системы; Е2 - эпоксидгидратаза.
Образование и обезвреживание индола и скатола
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру.
Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина (рис. 12-12).
Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана (рис. 12-13).
Обезвреживание бензойной кислоты
Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени (рис. 12-14). Скорость этой реакции отражает функциональное состояние печени.
В клинической практике используют определение скорости образования и выведения гиппуровой кислоты после введения в организм ксенобиотика бензойной кислоты (бензойнокислого натрия) - проба Квика.
20. Связывание, транспорт и выведение ксенобиотиков
В плазме крови множество как эндогенных, так и экзогенных липофильных веществ транспортируются альбумином и другими белками.
Альбумин - основной белок плазмы крови, связывающий различные гидрофобные вещества. Он может функционировать в качестве белка-переносчика билирубина, ксенобиотиков, лекарственных веществ.
Помимо альбуминов, ксенобиотики могут транспортироваться по крови в составе липопротеинов, а также в комплексе с кислым α1-гликопротеином. Особенность этого гликопротеина состоит в том, что он является индуцируемым белком, участвующим в ответной реакции организма на изменения, происходящие в состоянии стресса, например, при инфаркте миокарда, воспалительных процессах; его количество в плазме увеличивается наряду с другими протеинами. Связывая ксенобиотики, кислый α1-гликопротеин инактивирует их и переносит в печень, где комплекс с белком распадается, и чужеродные вещества обезвреживаются и выводятся из организма.
Участие Р-гликопротеина в выведении ксенобиотиков
Очень важный механизм выведения из клетки гидрофобных ксенобиотиков - функционирование Р-гликопротеина (транспортная АТФ-аза). Р-гликопротеин - фосфогликопротеин с молекулярной массой 170 кД, присутствующий в плазматической мембране клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ-связывающих центра (рис. 12-15). В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток.
Когда гидрофобное вещество (например, противоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р-гликопротеином с затратой энергии (рис. 12-16). Уменьшение количества лекарства в клетке снижает эффективность его применения при химиотерапии онкологических заболеваний.
Д. Индукция защитных систем
Многие ферменты, участвующие в первой и второй фазе обезвреживания, - индуцируемые белки. Ещё в древности царь Митридат знал, что если сисгематически принимать небольшие дозы яда, можно избежать острого отравления. "Эффект Митридата" основан на индукции определённых защитных систем (табл. 12-3).
В мембранах ЭР печени цитохрома Р450 содержится больше (20%), чем других мембрано-связанных ферментов. Лекарственное вещество фенобарбитал активирует синтез цитохрома Р450, УДФ-глюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90% всех мембранных структур клетки, и, как следствие, - увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения.
При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает. Более того, развивается множественная лекарственная устойчивость, т.е. устойчивость не только к этому лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-гликопротеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих или активирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии.
Металлы являются индукторами синтеза глутатиона и низкомолекулярного белка металлотионеина, имеющих SH-группы, способные связывать их. В результате возрастает устойчивость клеток организма к ядам и лекарствам.
Повышение количества глутатионтрансфераз увеличивает способность организма приспосабливаться к возрастающему загрязнению внешней среды. Индукцией фермента объясняют отсутствие антиканцерогенного эффекта при применении ряда лекарственных веществ. Кроме того, индукторы синтеза глутатионтрансферазы - нормальные метаболиты - половые гормоны, йодтиронины и кортизол. Катехол-амины через аденилатциклазную систему фосфорилируют глутатионтрансферазу и повышают её активность.
Ряд веществ, в том числе и лекарств (например, тяжёлые металлы, полифенолы, S-алкилы глутатиона, некоторые гербициды), ингибируют глутатионтрансферазу.
