
- •Химия. Основные понятия и законы
- •Волгоград
- •1. Основные понятия и законы химии
- •Закон эквивалентов
- •Закон сохранения массы и энергии
- •Закон постоянства состава
- •Закон кратных отношений
- •2. Правила техники безопасности при работе в лаборатории
- •3. Лабораторная работа. Определение эквивалентной и молярной массы металла
- •4. Контрольные задания
- •400131, Волгоград, просп. Им. В.И.Ленина, 28.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ВОЛЖСКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ (филиал)
ГОСУДАРСТВЕННОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"ВОЛГОГРАДСКОИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ"
КАФЕДРА "ХИМИЯ И ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ"
Химия. Основные понятия и законы
Методические указания

Волгоград
2010
УДК 546 (076.1)
Химия. Основные понятия и законы: Методические указания / Сост. М. Ю. Романова, О. К. Жохова - ВПИ (филиал) ВолгГТУ - Волгоград, 2010. - 20 с.
Содержат пояснительный теоретический материал и описаниие методики проведения эксперимента к лабораторной работе.
Приведены варианты индивидуальных заданий, нацеливающих студента на глубокую осознанную проработку рекомендуемой литературы.
Предназначены для студентов 1 курса политехнических вузов, изучающих дисциплины “Химия” и “Общая и неорганическая химия”.
Ил. 1. Табл. 2. Библиогр.: 7 назв.
Рецензент к.х.н. Г. И. Зорина
Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета.
© Волгоградский
государственный
технический
университет, 2010
1. Основные понятия и законы химии
Химический элемент – вид атомов с одинаковым положительным зарядом ядра.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства.
Молекула – наименьшая частица вещества, способная к самостоятельному существованию, обладающая его основными свойствами и состоящая из атомов одного или нескольких элементов.
Относительная атомная масса (Аr)
химического элемента показывает, во
сколько раз средняя масса атома больше
1/12 массы атома углерода
![]() :
:
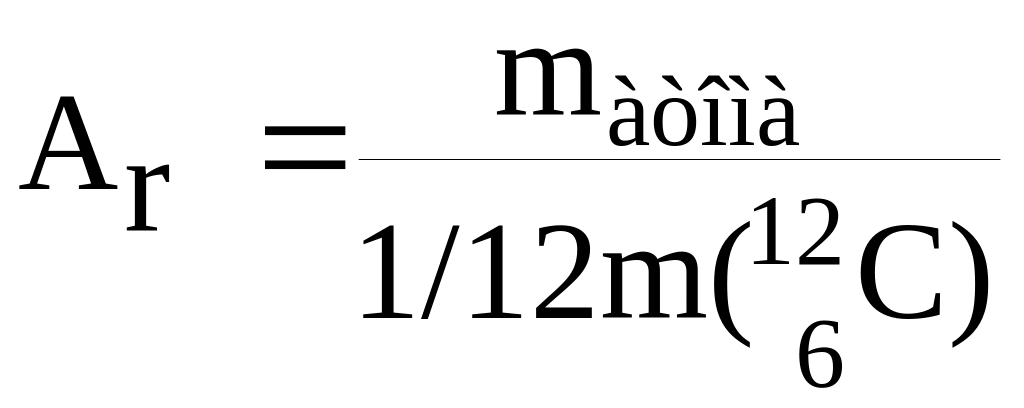
![]() Относительная
молекулярная масса (Мr)
простого или сложного вещества
показывает, во сколько раз средняя масса
молекулы вещества больше 1/12 массы атома
углерода
:
Относительная
молекулярная масса (Мr)
простого или сложного вещества
показывает, во сколько раз средняя масса
молекулы вещества больше 1/12 массы атома
углерода
:
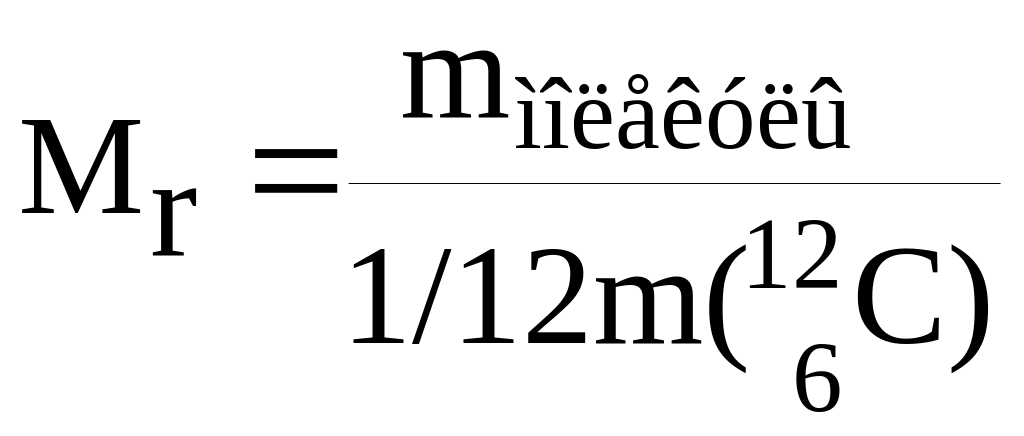
Аr и Мr - безразмерные величины.
Количество вещества () – это число структурных элементов (атомов, молекул, ионов и др.) в системе. Единицей измерения количества вещества является моль.
Моль – это количество вещества системы, которое содержит столько же структурных единиц, сколько содержится атомов в 0,012 кг углерода .
Число структурных единиц в одном моле называется постоянной Авогадро (NА) и составляет 6,02·1023 моль–1.
Молярная (мольная) масса (М) – масса одного моля данного вещества. Единица измерения молярной массы г/моль. Молярная масса вещества численно равна его относительной молекулярной массе.
Эквивалент (Э) – это некая реальная или условная частица вещества, которая соответствует одному атому или иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквивалентная масса (МЭ) – масса 1 моль эквивалентов элемента (вещества), т.е. молярная (мольная) масса эквивалента элемента (вещества).
Эквивалент и эквивалентную массу химического элемента или вещества можно рассчитать по формулам:
а) для элемента и простого вещества
![]() ;
;
![]() ,
,
где W – валентность элемента;
б) для сложного вещества
![]() ;
;
![]() ,
,
где k – число катионов (анионов) в молекуле;
z – заряд катиона (аниона);
в) для окислительно-восстановительных реакций
![]() ;
;
![]()
![]() ;
;
![]()
где n – число электронов, отданных или принятых молекулой (атомом, ионом)
в окислительно-восстановительных реакциях.
Например,
![]() ,
,
![]() ;
;
![]() ,
,
![]() 32,67
г/моль ;
32,67
г/моль ;
![]() ,
,
![]() 26,67
г/моль.
26,67
г/моль.
Эквиваленты элементов и их соединений могут быть переменными величинами, поэтому для правильного определения эквивалента вещества надо исходить из конкретной реакции, в которой участвует данное вещество.
Например, рассмотрим две реакции, в которых участвует дихромат калия:
K2Cr2O7 + Pb(CHCOO)2 = PbCr2O7↓ + 2 CHCOOK (1.1)
K2Cr2O7 + 3 SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O (1.2)
Эквивалентные массы дихромата калия в этих реакциях различны. В обменной реакции (1.1)
![]() г/моль,
г/моль,
а в окислительно-восстановительной реакции (1.2)
![]() г/моль,
г/моль,
т.к. дихромат-ион приобретает 6 электронов.
