
- •Кафедра «химия и общая химическая технология»
- •Основы кинетики химических реакций
- •Канд. Хим. Наук, доцент о.М. Иванкина
- •1. Основные понятия химической кинетики
- •2. Зависимость скорости реакции от концентрации реагентов
- •3. Зависимость скорости реакции от температуры
- •Исходные Активированный Продукты
- •4. Влияние катализаторов на скорость реакции
- •5. Химическое равновесие. Принцип Ле-Шателье-Брауна
- •Лабораторная работа
- •2. Влияние температуры на скорость реакции
- •3. Влияние катализатора на скорость реакции
- •Химическое равновесие
- •Список рекомендуемой литературы
- •400131, Г. Волгоград, пр. Ленина, 28, корп. 1.
3. Зависимость скорости реакции от температуры
Повышение температуры ускоряет большинство химических реакций. Согласно правилу Вант-Гоффа при повышении температуры на каждые 100С скорость реакций увеличивается в 2-4 раза.
![]() (5)
(5)
2 и 1 – скорости реакций, соответствующих температуре t2 и t1,
где - постоянное для данной реакции число, называемое температурным коэффициентом реакции. Для большинства реакций имеет значение от 2 до 4.
Пример 3: Температурный коэффициент скорости реакции равен 2,6. Во сколько раз возрастет скорость реакции при повышении температуры от 15 до 50 0С ?
Решение:
Поскольку t= t2 - t1=50 - 15=350C, то, обозначив скорость реакции при 15 0 и 50 0С соответственно через 1 и 2, можем записать:
 =
28.
=
28.
В 28 раз возрастет скорость реакции.
Пример 4. Реакция при температуре 50 0С протекает за 2 минуты 15 секунд. За сколько времени закончится эта реакция при температуре а) 70 0С; б) 20 0С, если в данном температурном интервале температурный коэффициент скорости реакции равен 3 ?
Решение:
а) При увеличении температуры с 50 до 70 0С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
 ,
,
то есть скорость реакции увеличивается в 9 раз.
В соответствии с определением скорость реакции обратно пропорциональна времени реакции, следовательно:
 ;
;
б) При уменьшении температуры с 50 до 20 0С скорость реакции в соответствии с правилом Вант-Гоффа уменьшается:
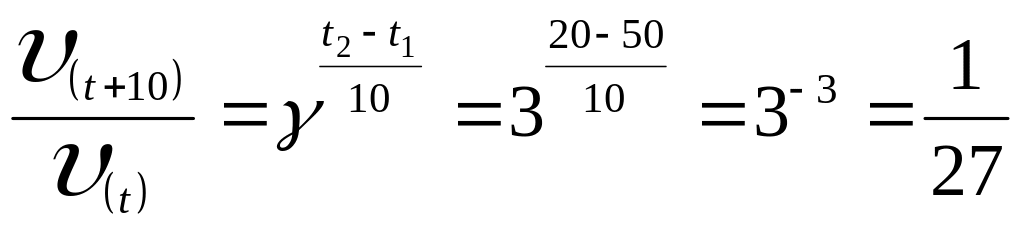 ,
,
то есть скорость реакции уменьшилась в 27 раз.

Более точно влияние температуры на скорость реакции описывается уравнением Аррениуса:
k = k0e (-Ea/RT) , (6)
где k – константа скорости реакции;
k0 – предэкспоненциальный множитель, отражает частоту столкновений и ориентацию реагирующих частиц;
e – основание натурального логарифма;
Ea – постоянная, называемая энергией активации, определяемая природой реакции. Значения Ea для химических реакций лежат в пределах 40 - 400 кДж/моль.
Уравнение (6) можно представить в виде:
ln k = ln k0 – Ea/RT (6.1)
или
lg k = lg k0 - Ea/(2,3 RT) = B - Ea/(2,3 RT) (6.2)
Ea/(2,3
RT) = tg
= lg
k/(1/T).
Рис.2
Уравнение Аррениуса позволяет проводить более точные расчеты изменения скорости реакции с увеличением температуры, чем уравнение (5). Приведем уравнение Аррениуса для двух температур:
lg k1 = lg k0 – Ea/(2,3 RT1);
lg k2 = lg k0 – Ea/(2,3 RT2).
Вычитая из второго уравнения первое, получаем:
 (7.1)
(7.1)
или
 . (7.2)
. (7.2)
Из уравнений (5) и (7) следует, что = (k2/k1) и T = 10.
 .
.
Расчеты показывают, что , равное 2-4, соответствует Еа = 57 - 114 кДж/моль для Т1 = 300К и Еа = 236 - 472 кДж/моль для Т2 = 500К.
Отсюда следует, что правило Вант-Гоффа (5) соблюдается для ограниченного круга реакций, протекающих при температурах, близких к комнатным.
Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) реакции при различных температурах.
В ходе химической реакции разрушаются одни и возникают другие молекулы и соединения, происходит изменение химических связей, то есть перераспределение электронной плотности. Если бы старые химические связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование так называемого активированного комплекса. Например, ход реакции AB + DC = AD + BC можно представить схемой:
A B A - - - B A B
¦ ¦
D C D - - - C D C
