
- •П.Б. Разговоров методы анализа качества пищевого сырья и продукции
- •Оглавление
- •Введение
- •1. Классы и группы веществ, входящих в состав пищи
- •1.1. Применение основных групп физико-химических методов анализа продуктов питания
- •2. Спектроскопические и спектрофотометрические методы анализа
- •Взаимосвязь между видом возбуждения, длиной волны и энергией для некоторых спектроскопических методов
- •2.1. Закон Бугера–Бэра для количественного анализа продуктов питания
- •2.2. Применение закона Бугера–Бера для анализа растительных масел
- •Определение прозрачности масла
- •Определение степени прозрачности масла (гост 5472 - 50)
- •Визуальный метод определения цветности растительных масел (гост 5477 – 93)
- •Фотоколориметрическое определение цветности масел
- •Колориметрический метод определения массовой доли фосфоросодержащих веществ маслах и жирах (гост 7824 – 80)
- •2.3. Теоретические основы инфракрасной спектроскопии. Использование метода для анализа пищевых продуктов
- •Основные полосы поглощения говяжьего, свиного и костного жиров в ик спектрах
- •2.4. Анализ содержания жиров, степени их окисленности и количества транс-изомеров в жирах и жирных кислотах
- •2.5. Атомно-абсорбционная спектроскопия
- •2.5.1. Атомно-абсорбционный метод определения тяжелых металлов и токсичных элементов в пищевых продуктах и пищевом сырье
- •2.5.2. Способы минерализации органических проб
- •Сравнение результатов уз-обработки образца (1) и «сухой» (2) минерализации его в муфельной печи
- •2.6. Спектроскопия ядерного магнитного резонанса
- •Значения химических сдвигов для различных групп пищевых продуктов
- •2.6.1. Компонентный анализ жиров и влаги в пищевых продуктах методом ямр
- •3. Определение влажности пищевых продуктов
- •3.1. Спектральный метод анализа влаги в пищевых продуктах
- •Колебания молекулы воды в инфракрасном спектре
- •Определение влажности муки
- •Определение влажности эмульсии теста
- •Определение влажности кондитерского теста
- •Определение влажности кондитерского крема по ик спектрам
- •Определение влажности продуктов овощесушильной и консервной промышленности
- •Влажность некоторых продуктов воды в инфракрасном спектре
- •3.2. Гравиметрический метод определения содержания влаги
- •3.3. Метод определения влаги титрованием по Фишеру
- •3.4. Метод определения воды в жирах и маслах (метод Дина–Старка)
- •4. Хроматографические методы анализа
- •Классификация хроматографических методов по агрегатному состоянию фаз
- •4.1. Газо-жидкостная хроматография
- •4.1.1. Использование гжх для изучения состава жирных кислот природных масел, жиров и липидов
- •Время, мин
- •4.1.2. Использование гжх для анализа жирорастворимых витаминов в составе масел (жиров)
- •4.2. Тонкослойная хроматография
- •4.2.1. Использование метода тонкослойной хроматографии для разделения углеводов
- •4.2.2. Анализ пестицидов и ядохимикатов в растительном сырье
- •4.2.3. Анализ микотоксинов т-2, ф-2 и охратоксина а в фуражном зерне, продуктах его переработки и всех видах комбикормов
- •4.3. Ионообменная хроматография
- •4.3.1. Определение аминокислот в пищевых продуктах
- •Время, мин
- •4.4. Гель-хроматография
- •5. Масс-спектрометрический метод
- •5.1. Сочетание масс-спектрометрии и хроматографии для определения аминокислотного состава белка
- •1 2 3 4 5 6 Время, мин
- •6. Полярографический метод
- •6.1. Анализ токсичных элементов в пробе пищевого продукта
- •7. Реологические методы анализа
- •7.1. Типы приборов и оборудования для изучения реологических свойств пищевых продуктов
- •8. Сводная таблица методов контроля качества пищевых продуктов
- •Классификация методов контроля состава и свойств продуктов питания
- •Литература
5.1. Сочетание масс-спектрометрии и хроматографии для определения аминокислотного состава белка
Методика анализа включает следующие операции.
К 50–100 мкг белка добавляют 16 меченных (дейтерированных) 18O амино-кислот в качестве внутреннего стандарта и высококонцентрированную соляную кислоту, содержащую 0,5–1,0 мас.% фенола, смесь выдерживают в вакууме при температуре t = 100ºС, упаривают и высушивают. Затем к остатку добавляют н-бутанол, воздействуют ультразвуком в течение 1 мин, запаивают в ампулу и выдерживают в масляной бане. После вскрытия ампулы проводят обработку смеси ангидридом трифторуксусной кислоты. Хроматографирование проводят на спиральной колонке, заполненной хромосорбом W.
В качестве примера на рис. 5.2 приведена хроматограмма, полученная при разделении гидролизата инсулина.
Сигнал
1 2 3 4 5 6 Время, мин

Рис. 5.2. Пики н-бутиловых эфиров аминокислот: 1 – аланин; 2 – треонин;
3 – глицин; 4 – валин; 5 – лейцин; 6 – пролин
В ХХ столетии были сняты полные масс-спектры всех компонентов и по характерному для каждой аминокислоты фрагменту качественно определены изотопные отношения. Для количественного анализа использовали набор внут-ренних стандартов – меченых аминокислот.
Меченые аминокислоты могут быть получены по способу Мерфи. Он за-ключается в нагревании при 60–70 ºС 1–4 мг той или иной аминокислоты с 0,1–0,2 мл подкисленной Н218О в течение нескольких суток. Включение метки со-ставляет 90% [5].
6. Полярографический метод
Фундаментальные основы метода были заложены Гейровским в 1922 г.
Установка для полярографического анализа представлена на рис. 6.1.
В электролизер 3 помещают анализируемый раствор 2. Через электролизер протекает ток с непостоянным напряжением, что достигается за счет делителя напряжения 7 и фиксируется с помощью гальванометра 6.
Анодом служит слой ртути 1 на дне ячейки, а в качестве катода выступает ртутный капельный электрод 4, через который проходит ртуть из резервуара 5.
Если повышать напряжение до достижения потенциала восстановления, ионы анализируемого вещества разряжаются на ртутном катоде, что приводит в итоге к возрастанию силы тока (I) в цепи.
Поскольку к катоду непрерывно доставляются новые количества ионов, даже в условиях снижения концентрации ионов у поверхности ртутного катода, сила тока не падает, а принимает постоянное значение, не зависящее от напряжения. Это явление реализуется при условии, что скорость катодного вос-становления равна скорости диффузии.
Зависимость силы тока (I) от приложенного напряжения (Е) представлена на рис. 6.2.
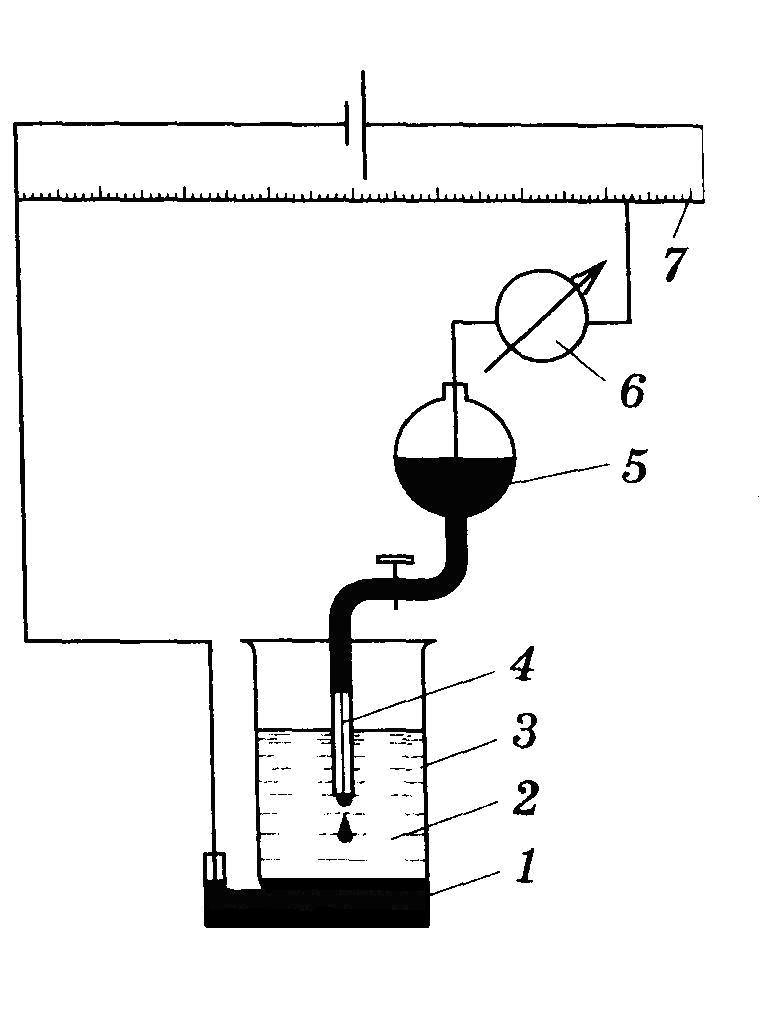
Рис. 6.1. Схема установки для полярографии:
1 – слой ртути; 2 – анализируемый раствор; 3 – электролизер; 4 – ртутный капающий электрод; 5 – резервуар ртути; 6 – гальванометр; 7 – реохорд (делитель напряжения)
Как видно из рис. 6.2, остаточный ток (0,1 мкА) реализуется при относительно небольшом потенциале катода, а подавление избыточного миграционного тока достигается введением в анализируемый раствор так назы-ваемого индифферентного электролита, имеющего более отрицательный по-тенциал выделения и экранирующего электрод своими катионами.
Зависимость I от E при обратимом электродном процессе, в соответствии с уравнением полярографической волны, подчиняется выражению:
E
= E1/2![]() ,
(6.1)
,
(6.1)
где E1/2 – потенциал полуволны;
Id – диффузионный ток.
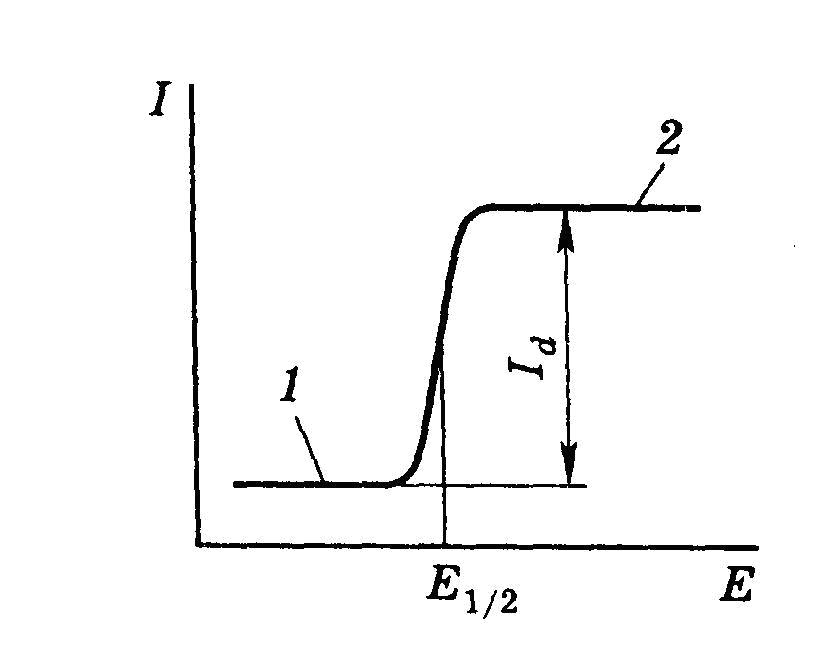
Рис. 6.2. Общий вид полярограммы при анализе пищевых продуктов: 1 – остаточный ток; 2 – диффузионный ток
Для необратимых процессов уравнение (6.1) имеет более сложную форму, однако при условии I = 1/2 Id:
E = E1/2 , (6.2)
и,
таким образом, потенциал полуволны не
зависит от тока и E1/2
![]() f
(c),
где c
–
концентрация восстановленного иона.
f
(c),
где c
–
концентрация восстановленного иона.
Поэтому определение потенциала полуволны лежит в основе проведения качественного анализа в полярографии. Если в растворе находится n веществ, способных к восстановлению на ртутном катоде, полярограмма будет содер-жать n «ступеней» (см. рис. 6.3).
По измеренному потенциалу полуволны E1/2 можно идентифицировать не-известный ион относительно того или иного фонового электролита.
В основе количественного анализа лежит уравнение, связывающее диффу-зионный ток (Id) с концентрацией иона (c), коэффициентом диффузии (D), массой ртути (m), вытекающей из капилляра за 1 с, и временем образования капли (τ):
Id = 605 z D1/2 m3/2 τ1/6 с , (6.3)
где z – заряд иона.
С учетом постоянных условий полярографирования, z, D, m и τ – величины постоянные, и тогда уравнение (6.3) приобретает вид:
Id = κ с. (6.4)
В соответствии с выражением (6.4) градуировочный график в координатах высота полярографической волны (Id) – концентрация восстановленного иона (с) представляет собой прямую линию, проходящую через начало координат.
График строится по стандартным растворам в количестве n ≥ 3. Однако следует отметить, что точность метода высока лишь в том случае, когда усло-
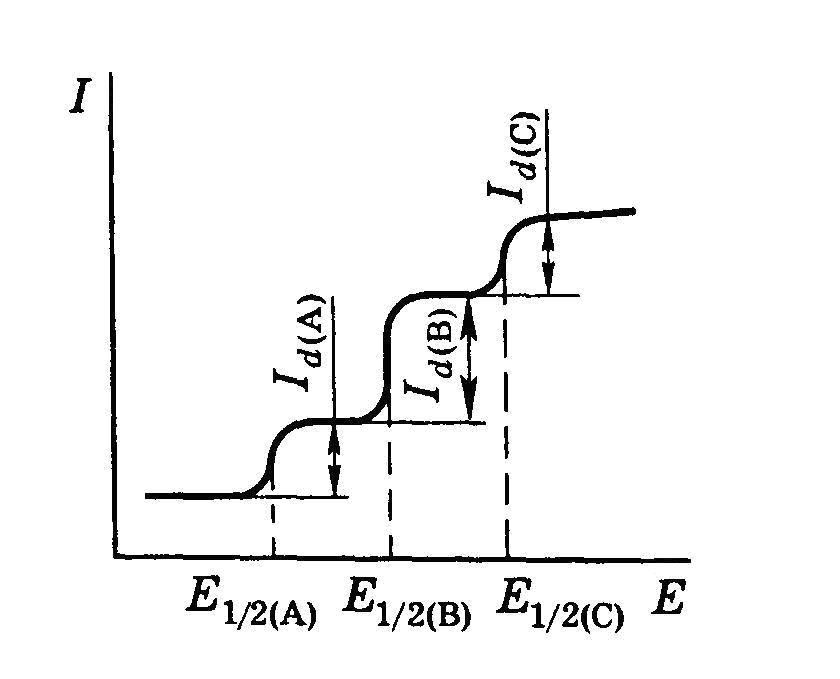
Рис. 6.3. Вид полярограммы при наличии в растворе трех восстанавливающихся веществ А,В и С: А – Cd; B – Ni; С – Zn
вия полярографирования для стандартных растворов и анализируемой пробы абсолютно идентичны, т.е. соблюдается равенство:
![]() .
(6.5)
.
(6.5)
