
- •П.Б. Разговоров методы анализа качества пищевого сырья и продукции
- •Оглавление
- •Введение
- •1. Классы и группы веществ, входящих в состав пищи
- •1.1. Применение основных групп физико-химических методов анализа продуктов питания
- •2. Спектроскопические и спектрофотометрические методы анализа
- •Взаимосвязь между видом возбуждения, длиной волны и энергией для некоторых спектроскопических методов
- •2.1. Закон Бугера–Бэра для количественного анализа продуктов питания
- •2.2. Применение закона Бугера–Бера для анализа растительных масел
- •Определение прозрачности масла
- •Определение степени прозрачности масла (гост 5472 - 50)
- •Визуальный метод определения цветности растительных масел (гост 5477 – 93)
- •Фотоколориметрическое определение цветности масел
- •Колориметрический метод определения массовой доли фосфоросодержащих веществ маслах и жирах (гост 7824 – 80)
- •2.3. Теоретические основы инфракрасной спектроскопии. Использование метода для анализа пищевых продуктов
- •Основные полосы поглощения говяжьего, свиного и костного жиров в ик спектрах
- •2.4. Анализ содержания жиров, степени их окисленности и количества транс-изомеров в жирах и жирных кислотах
- •2.5. Атомно-абсорбционная спектроскопия
- •2.5.1. Атомно-абсорбционный метод определения тяжелых металлов и токсичных элементов в пищевых продуктах и пищевом сырье
- •2.5.2. Способы минерализации органических проб
- •Сравнение результатов уз-обработки образца (1) и «сухой» (2) минерализации его в муфельной печи
- •2.6. Спектроскопия ядерного магнитного резонанса
- •Значения химических сдвигов для различных групп пищевых продуктов
- •2.6.1. Компонентный анализ жиров и влаги в пищевых продуктах методом ямр
- •3. Определение влажности пищевых продуктов
- •3.1. Спектральный метод анализа влаги в пищевых продуктах
- •Колебания молекулы воды в инфракрасном спектре
- •Определение влажности муки
- •Определение влажности эмульсии теста
- •Определение влажности кондитерского теста
- •Определение влажности кондитерского крема по ик спектрам
- •Определение влажности продуктов овощесушильной и консервной промышленности
- •Влажность некоторых продуктов воды в инфракрасном спектре
- •3.2. Гравиметрический метод определения содержания влаги
- •3.3. Метод определения влаги титрованием по Фишеру
- •3.4. Метод определения воды в жирах и маслах (метод Дина–Старка)
- •4. Хроматографические методы анализа
- •Классификация хроматографических методов по агрегатному состоянию фаз
- •4.1. Газо-жидкостная хроматография
- •4.1.1. Использование гжх для изучения состава жирных кислот природных масел, жиров и липидов
- •Время, мин
- •4.1.2. Использование гжх для анализа жирорастворимых витаминов в составе масел (жиров)
- •4.2. Тонкослойная хроматография
- •4.2.1. Использование метода тонкослойной хроматографии для разделения углеводов
- •4.2.2. Анализ пестицидов и ядохимикатов в растительном сырье
- •4.2.3. Анализ микотоксинов т-2, ф-2 и охратоксина а в фуражном зерне, продуктах его переработки и всех видах комбикормов
- •4.3. Ионообменная хроматография
- •4.3.1. Определение аминокислот в пищевых продуктах
- •Время, мин
- •4.4. Гель-хроматография
- •5. Масс-спектрометрический метод
- •5.1. Сочетание масс-спектрометрии и хроматографии для определения аминокислотного состава белка
- •1 2 3 4 5 6 Время, мин
- •6. Полярографический метод
- •6.1. Анализ токсичных элементов в пробе пищевого продукта
- •7. Реологические методы анализа
- •7.1. Типы приборов и оборудования для изучения реологических свойств пищевых продуктов
- •8. Сводная таблица методов контроля качества пищевых продуктов
- •Классификация методов контроля состава и свойств продуктов питания
- •Литература
4.2.1. Использование метода тонкослойной хроматографии для разделения углеводов
Метод ТСХ позволяет быстро и эффективно разделить и количественно анализировать сахара даже при малом их содержании.
Разделение происходит в 2 этапа – в зависимости от применяемой системы растворителей. Вначале при поднятии фронта на 9 см используют одну систему растворителей, затем – другую, поскольку при l ≥ 15 см моносахара разде-ляются на глюкозу и фруктозу (см. рис. 4.7).
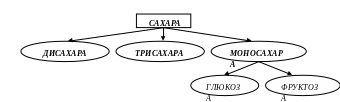

Рис. 4.7. Схема разделения простых сахаров
Рис. 4.8. Последовательность проявления разделенных сахаров на пластине:
1 – рафиноза; 2 – малибиоза; 3 – мальтоза; 4 – сахароза;
5 – глюкоза; 6 – фруктоза; 7 – ксилоза
Системы растворителей здесь не называются; для каждого, отдельно взято-го, случая они табулированы. Пятна разделенных сахаров имеют характерную темно-синюю окраску.
Последовательность проявления пятен продуктов разделения представлена на рис. 4.8.
Наиболее эффективно разделение сахаров происходит в тонком (δ = 0,1– 0,2 мм) слое бумажной целлюлозы, нанесенной на стеклянные пластины.
Однако следует учитывать, что процесс движения восходящего потока рас-творителей занимает не менее 5–10 ч (требует временных затрат).
Количественное определение проводят по методу сравнения площади пят-на и интенсивности его окраски с таковыми для стандартных растворов (метод «свидетелей»).
4.2.2. Анализ пестицидов и ядохимикатов в растительном сырье
Методика определения фосфорорганических пестицидов в воде (жидкостях) методом ТСХ
Разделение пестицидов происходит в тонком слое силикагеля с различ-ными подвижными растворителями – гексаном, ацетоном, хлороформом.
Обнаружение зон локализации фосфорорганических соединений на хрома-тограммах осуществляют с помощью следующих реагентов: бромфенолового синего, нитробензилпиридина и др.
Предел обнаружения исследуемых пестицидов (антио, афугана, метафоса, карбофоса, валексона, фозалона и др.) составляет 0,2–0,5 мкг. Мешают опреде-лению соединения, содержащие серу.
Количественная оценка при анализе методом ТСХ с различными условиями проявления проводится путем сравнения площадей пятен пробы и стандартов на одной пластинке.
Методика сводится к следующему.
1. Последовательно проводят экстракцию из анализируемой пробы той или иной группы пестицидов путем обработки ее гексаном либо хлороформом, а затем экстракт очищают.
2. Упаренную (до 0,3 мл) пробу микропипеткой количественно переносят на хроматографическую пластинку. Также наносят различные количества (0,05; 0,10; 0,15 мл) стандартного раствора, и помещают пластину в камеру с органи-ческим растворителем.
3. После подъема фронта растворителя на 10 см пластинку вынимают, высушивают и опрыскивают проявляющим агентом – раствором AgNO3 (или PdCl2).
Под действием источника УФ света (лампы ПРК) через 10–15 мин на хроматограмме проявляются пестициды в виде пятен определенного цвета – се-рого, желто-коричневого либо лилового (цвет зависит от вида проявителя). При необходимости осветляют фон пластины с помощью 2%-го раствора лимонной кислоты.
Величины Rf пестицидов при различных системах растворителей известны и сведены в специальные таблицы.
Количественное определение проводят путем сравнения площади пятен пробы и стандартов.
Содержание пестицида в пробе (X, мг/мл) рассчитывают:
![]() ,
(4.17)
,
(4.17)
где А – содержание препарата в стандарте с наиболее близкой к пробе пло-щадью пятна, мкг;
S1 – площадь пятна стандарта, мм2;
S2 – площадь пятна пробы, мм2;
p – объем пробы для анализа, мл.
Метод ТСХ успешно применяют также для количественного обнаружения и определения некоторых пестицидов (антио, фосфамида) в меде – с пределом измерения 0,1 мг/кг. Метод практически аналогичен представленному выше и основан на извлечении антио и фосфамида из меда гексаном, очистке экстрак-тов от восков и пигментов и последующем хроматографировании в тонком слое силикагеля, закрепленного гипсом.
Подвижная фаза – смесь ацетона и гексана в соотношении 1:2.
Для обнаружения зон локализации пестицидов используют смесь ацето-новых растворов бромфенолового синего и AgNO3 с последующей обработкой лимонной кислотой.
