
Tema_5
.docxЕлектронегативність хімічних елементів і хімічний зв’язок. Типи хімічних зв’язків.
Хімічний зв’язок між атомами утворюється:
А. За рахунок електростатичного притягання електронних орбіталей сусідніх атомів.
В. Внаслідок взаємодії спарених електронів.
С. За допомогою взаємодії ядер.
D. За допомогою валентних електронів.
Перекривання електронних орбіталей характерне для:
A. Йонного зв’язку.
B. Дисперсійного зв’язку.
C. Металічного зв’язку.
D. Ковалентного зв’язку.
Однією рискою у графічній формулі речовини позначається:
A. Ковалентний неполярний зв’язок.
B. Власна неподілена пара електронів.
C. Одинарний зв’язок.
D. Водневий зв’язок.
Зв’язок між позитивно поляризованим атомом Гідрогену і негативно поляризованим атомом іншого високо електронегативного елементу є:
A. Донорно-акцепторним.
B. Неполярним.
C. Водневим.
D. Йонним.
Напрямленість і просторова будова молекул не властива:
A. Одинарному зв’язку.
B. Неполярному зв’язку.
C. Донорно-акцепторному зв’язку.
D. Металічному зв’язку.
Крапками між різними молекулами або в одній молекулі позначається:
A. Донорно-акцепторний зв’язок.
B. Водневий зв’язок.
C. Йонний зв’язок.
D. Ковалентний зв’язок будь-якої кратності.
Для металічного зв’язку, на відміну іншим типам зв’язків, є характерним:
A. Існування електронного газу.
B. Перекривання електронних орбіталей сусідніх атомів.
C. Відсутність електростатичних взаємодій.
D. Відсутність вільних електронів.
Насичуваність – здатність утворювати обмежене число хімічних зв’язків, характерна для:
A. Усіх видів хімічного зв’язку.
B. Ковалентного зв’язку.
C. Металічного зв’язку.
D. Йонного зв’язку.
Виберіть речовину, в якій є йонний зв’язок:
A. K2O.
B. H2O.
C. F2.
D. H2S.
Металічний зв’язок здійснюється:
A. Між типовим металом і типовим неметалом.
B. Між металами.
C. У будь-якій сполуці, яка містить атоми металу.
D. Між неполярними молекулами.
Яка молекула є утворена ковалентним неполярним зв’язком?
A. H2SO4.
B. H2O.
C. HF.
D. H2.
Між молекулами води існує взаємодія, яка називається:
A. Йонний зв’язок.
B. Водневий зв’язок.
C. Неполярний зв’язок.
D. Кратний зв’язок.
Міжмолекулярний водневий зв’язок виникає між молекулами:
A. HF.
B. H2.
C. N2.
D. K2S.
Найбільш полярним є:
A. Ковалентний зв’язок.
B. Йонний зв’язок.
C. Металічний зв’язок.
D. Водневий зв’язок.
Насичуваність – це:
A. Здатність атомів брати участь в утворенні ковалентного неполярного донорно-акцепторного зв’язку.
B. Здатність хімічного зв’язку певним чином розташовуватись у просторі.
C. Здатність атомів брати участь в утворенні обмеженої кількості ковалентних зв’язків.
D. Властивість полярних молекул.
Яке твердження є неправильним?
A. Водневий зв’язок характеризується ненапрямленістю.
B. Ковалентний зв’язок характеризується ненасичуваністю.
C. Водневий зв’язок є слабшим за ковалентний.
D. Йонний зв’язок є найполярніший.
При гібридизації атомних орбіталей:
A. Кількість гібридних орбіталей дорівнює кількості вихідних орбіталей.
B. Кількість гібридних орбіталей зростає.
C. Енергія гібридних орбіталей стає різною.
D. Зберігається симетрія початкових орбіталей.
Сполуці NaCl є характерним:
A. Неполярний зв’язок.
B. Водневий зв’язок.
C. Йонний зв’язок.
D. Будь-який зв’язок.
Які молекули мають кратний зв’язок?
A. Будь-яка полярна молекула.
B. H2.
C. N2.
D. HCl.
Яке з тверджень є неправильним?
A. Молекула азоту має подвійний зв’язок.
B. При утворенні катіона амонію реалізується донорно-акцепторний механізм утворення ковалентного зв’язку.
C. Енергія кратного зв’язку більша енергії одинарного зв’язку між тими ж атомами.
D. У молекулі СH4 реалізується sp3 гібридизація атомних орбіталей Карбону.
Скільки орбіталей гібридизуються при sp3-гібридизації?
A. Всі.
B. Тільки одна s-орбіталь.
C. Всі s-орбіталі атома.
D. Одна s-орбіталь і три р-орбіталі.
За донорно-акцепторним механізмом утворюються:
A. H3O+.
B. NH4+.
C. CH3-CH3.
D. H3O+, NH4+.
При обмінному механізмі утворення ковалентного зв’язку:
A. Кожен із взаємодіючих атомів дає для утворення одного зв’язку по 2 електрони.
B. Кожен із взаємодіючих атомів дає для утворення одного зв’язку по 1 неспареному електрону.
C. Кожен із взаємодіючих атомів дає для утворення одного зв’язку по 1 неподіленій електронній парі.
D. Кожен із взаємодіючих атомів дає для утворення одного зв’язку по 2 неспарених електрони.
Сигма (-) зв’язок утворюється, якщо перекривання електронних орбіталей:
A. Не відбувається.
B. Відбувається по лінії зв’язку.
C. Відбувається в площині зв’язку над і під лінією зв’язку.
D. Відбувається по всьому об’єму простору орбіталей.
При утворенні хімічного зв’язку енергія:
A. Виділяється.
B. Не виділяється.
C. Тільки поглинається.
D. Всіх взаємодіючих атомів суттєво не змінюється.
Хімічний зв’язок утворюється за допомогою:
A. Неспарених і спарених електронів атома взагалі.
B. Валентних електронів.
C. Тільки спарених електронів.
D. Валентних і спарених електронів.
При утворенні хімічного зв’язку за обмінним механізмом взаємодіють:
A. Електрони з паралельними спінами.
B. Електрони неподілених електронних пар.
C. Електрони з будь-якими спінами.
D. Електрони з антипаралельними (протилежними) спінами.
До кратних зв’язків належать:
A. Тільки подвійні зв’язки.
B. Подвійні і потрійні зв’язки.
C. Одинарні і подвійні зв’язки.
D. Одинарні і потрійні зв’язки.
Іонний зв’язок утворюється, як правило, між:
A. Неактивним металом і неактивним неметалом.
B. Двома неактивними неметалами.
C. Активним металом і активним неметалом.
D. Двома активними неметалами.
Якщо спільна електронна пара розміщується симетрично між ядрами атомів, то це:
A. Ковалентний полярний зв’язок.
B. Йонний зв’язок.
C. Ковалентний неполярний зв’язок.
D. Металічний зв’язок.
Який тип зв’язку в молекулі Р2О5?
A. Ковалентний неполярний.
B. Йонний.
C. Металічний.
D. Ковалентний полярний.
Який тип зв’язку в молекулі СО2?
A. Металічний.
B. Йонний.
C. Ковалентний полярний.
D. Водневий.
Серед наведеного переліку вибрати сполуки із ковалентним полярним зв’язком:
A. HCl, HBr, H2O.
B. Cl2, H2, Br2.
C. NaCl, KCl.
D. H2SO4, K2SO4.
Вибрати рядок формул речовин з ковалентним неполярним зв’язком:
A. HCl, HBr.
B. Cl2, O2, Br2.
C. NaCl, CaCl2.
D. K2S, HNO3.
Вибрати рядок формул речовин з йонним зв’язком:
A. HCl, HBr.
B. Cl2, SO2.
C. NaCl, KCl.
D. K2S, H2SO3.
Диполь – це:
A. Система з двох однакових зарядів.
B. Система з трьох зарядів.
C. Заряджена частинка.
D. Система з двох зарядів, однакових за величиною і протилежних за знаком.
Під яким кутом розміщені полярні зв’язки у молекулі води?
A. 104,5.
B. 180.
C. 109 28/.
D. 120.
Електронегативністю елемента називають:
A. Властивість атома віддавати електрон.
B. Властивість атома не взаємодіяти з іншими елементами.
C. Здатність атома набувати негативного заряду.
D. Властивість атома притягувати до себе спільні електронні пари порівняно з іншими елементами сполуки.
Чим вища електронегативність елемента, тим яскравіше виражені:
A. Металічні властивості.
B. Неметалічні властивості.
C. Основні властивості.
D. Кислотні властивості.
Який елемент найбільш електронегативний?
A. Флуор.
B. Цезій.
C. Астат.
D. Кобальт.
Який елемент найменш електронегативний?
A. Флуор.
B. Цезій.
C. Астат.
D. Кобальт.
Як змінюється електронегативність елементів із збільшенням заряду ядра атомів у періоді?
А. Зростає.
В. Спадає.
С. Не змінюється.
D. Спочатку зростає потім спадає.
Вкажіть елемент, який має найменшу електронегативність.
А. O.
В. S.
С. F.
D. C.
У якій парі елементів металічні властивості зменшуються:
А. Li — Na.
В. Na — Mg.
С. Mg — Ca.
D. K — Rb.
Серед наведених формул вкажіть сполуку з ковалентним неполярним зв’язком:
А. PCl5.
В. NaCl.
С. O2.
D. CO.
Серед наведених формул вкажіть сполуку з ковалентним полярним зв’язком:
А. Cl2.
В. NaCl.
С. HCl.
D. Mg.
Серед зазначених формул вкажіть сполуку з йонним типом зв’язку:
А. KF.
В. H2S.
С. PH3.
D. N2.
Який тип зв’язку в молекулі води?
А. Ковалентний полярний.
В. Йонний.
С. Ковалентний неполярний.
D. Металічний.
Який тип зв’язку в молекулі N2?
А. Ковалентний полярний.
В. Йонний.
С. Ковалентний неполярний.
D. Металічний.
В якій з перелічених сполук полярність зв’язку найбільша.
А. HF.
В. HCl.
С. HI.
D. HBr.
В якій з перелічених сполук полярність зв’язку найбільша?
А. HF.
В. H2S.
С. H2O.
D. NH3.
У сполуці СsCl зв’язок:
А. Металічний.
В. Водневий.
С. Ковалентний полярний.
D. Йонний.
Як змінюється електронегативність елементів із збільшенням заряду ядра атомів у головних підгрупах:
А. Зростає.
В. Спадає.
С. Не змінюється.
D. Спочатку спадає, потім зростає.
У парах яких елементів металічні властивості збільшуються:
А. Ca — K.
В. Ca — Mg.
С. Li — Be.
D. Na — Li.
Вкажіть елемент, який має найбільшу електронегативність:
А. Si.
В. P.
С. Br.
D. Cl.
Як змінюється полярність зв’язку в ряді молекул H2O → H2S → H2Se → H2Te?
А. Не змінюється.
В. Зростає.
С. Зменшується.
D. Спочатку зростає, потім зменшується.
В яких молекулах існує ковалентний полярний зв’язок?
А. KBr.
В. Br2.
С. PBr3.
D. CsBr.
Як змінюється полярність зв’язку в ряді молекул: PH3 → H2S → HCl?
А. Зростає.
В. Зменшується.
С. Не змінюється.
D. Спочатку зростає, потім спадає.
Виберіть сполуку до складу якої входить Оксиген, що з’єднаний ковалентним неполярним зв’язком з іншим атомом:
А. O2.
В. CO2.
С. K2O.
D. CaO.
Ковалентний полярний зв’язок характерний для сполуки:
А. O2.
В. NаF.
С. H2S.
D. Ca.
Вкажіть формулу речовини, в якій Гідроген з’єднаний йонним зв’язком?
A. H2.
B. HCl.
C. CsH.
D. CH4.
Прості речовини, що утворені елементами I групи головної підгрупи
A. Мають молекулярну будову.
B. Мають металічну кристалічну гратку.
C. Утворюють кристали з йонною кристалічною граткою.
D. Мають атомну кристалічну гратку.
Кристалічна гратка Карбон (IV)оксиду є:
A. Йонною.
B. Атомною.
C. Молекулярною.
D. Металічною.
Хімічний зв’язок в молекулі Гідроген хлориду:
A. Ковалентний полярний.
B. Донорно-акцепторний.
C. Ковалентний неполярний.
D. Металічний.
Для якої пари речовин структурною одиницею є йон?
A. CH4 і I2.
B. SO2 і H2O.
C. Cl2 і NH3.
D. LiF і KCl.
Вкажіть, які атоми II періоду входять до складу молекул, між якими можуть утворюватися водневі зв’язки:
А. O, N, F.
B. C, Li, Na.
C. Li, Be, P.
D. C, B, Be.
Вода має аномально високу температуру кипіння за рахунок:
А. Металічного зв’язку.
B. Водневих зв’язків.
C. Йонного зв’язку.
D. Ковалентного зв’язку.
В молекулах вуглеводів зв’язок між атомами Карбону і Гідрогену:
А. Ковалентний.
B. Йонний.
C. Металічний.
D. Водневий.
Серед перерахованих речовин найвищу температуру плавлення має:
А. CO2.
B. SO2.
C. SiO2.
D. NO2.
В Калій хлориді хімічний зв’язок
А. Ковалентний полярний.
B. Ковалентний неполярний.
C. Металічний.
D. Йонний.
Наявність водневого зв’язку між молекулами H2O зумовлює:
А. Високу електропровідність.
B. Низьку температуру кипіння.
C. Високу температуру кипіння.
D. Газоподібний стан за нормальних умов.
Наявність металічного зв’язку в металах зумовлює їх:
А. Крихкість.
B. Розчинність у воді.
C. Пластичність.
D. Рідкий агрегатний стан.
Наявність йонного зв’язку в NaCl зумовлює:
А. Пластичність.
B. Теплопровідність.
C. Здатність його розчину проводити електричний струм.
D. Непрозорість.
Ковалентний полярний зв’язок характерний для речовини:
А. CaCl2.
B. Na.
C. Вr2.
D. PBr3.
Ковалентний неполярний зв’язок має речовина, формула якої:
A. NH3.
B. KCl.
C. Cl2.
D. Ca.
Оксид силіцію(IV) має високу температуру плавлення (17280С), високу твердість, не розчиняється у воді і не проводить електричного струму, оскільки у нього кристалічна решітка:
A. Металічна.
B. Молекулярна.
C. Йонна.
D. Атомна.
Ковалентний полярний зв’язок має речовина:
A. Md.
B. KCl.
C. H2S.
D. C.
В твердому стані хлор має низьку температуру плавлення (-1010С) і не проводить електричний струм, оскільки у нього кристалічна решітка:
A. Молекулярна.
B. Металічна.
C. Йонна.
D. Атомна.
Йонний зв’язок характерний для речовини, формула якої:
A. LiF.
B. Cl2.
C. H2O.
D. Na.
Сірка має низьку температуру плавлення (1130С), крихка, не розчиняється у воді, не проводить електричного струму, оскільки у неї кристалічна гратка:
A. Атомна.
B. Молекулярна.
C. Йонна.
D. Металічна.
Подвійний зв’язок в молекулі має речовина, формула якого:
A. C2H4.
B. CH4.
C. C2H6.
D. C2H2.
Твердий карбон (ІV) оксид є крихкий, не проводить електричного струму, легко переходить в газоподібний стан, оскільки у нього кристалічна гратка:
A. Атомна.
B. Молекулярна.
C. Йонна.
D. Металічна.
Потрійний зв’язок характерний для речовини, формула якої:
A. С2Н4.
B. С2Н6.
C. С2Н2.
D. СН4.
Натрій хлорид має високу температуру плавлення (8010С), крихкий, добре розчиняється у воді, оскільки його кристалічна гратка:
A. Атомна.
B. Йонна.
C. Молекулярна.
D. Металічна.
Ковалентний неполярний зв’язок характерний для сполуки, формула якої:
A. С(алмаз).
B. КОН.
C. CCl4.
D. MgO
Алмаз має високу твердість, не розчиняється у воді, не проводить електричний струм, оскільки він має кристалічну гратку:
A. Атомну.
B. Йонну.
C. Молекулярну.
D. Металічну.
Тільки одинарні (-зв’язки) є в молекулі речовини, формула якої:
A. N2.
B. C2H6.
C. CO2.
D. C2H4.
Бром має низьку температуру плавлення (-7,250С), не проводить електричного струму, оскільки у нього кристалічна гратка:
A. Йонна.
B. Атомна.
C. Молекулярна.
D. Металічна.
Атом Оксигену у гідроксильній групі карбонових кислот:
A. Не має заряду.
B. Має частковий позитивний заряд.
C. Має частковий негативний заряд.
D. Має повний позитивний заряд.
В молекулі аміаку хімічний зв’язок:
A. Ковалентний полярний.
B. Ковалентний неполярний.
C. Йонний.
D. Донорно-акцепторний.
Зв’язок у сполуці, що утворена атомом Гідрогену і елементом з електронною формулою (1s22s22p4) є:
A. Йонний.
B. Ковалентний полярний.
C. Ковалентний неполярний.
D. Металічний.
Найбільшою електронегативністю серед елементів V групи головної підгрупи володіє:
A. Фосфор.
B. Нітроген.
C. Арсен.
D. Стибій.
Скільки -зв’язків утворює атом Карбону, відмічений у формулі зірочкою?
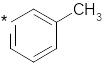
A. 4.
B. 3.
C. 2.
D. 1.
В ковалентних водневих сполуках складу HR число спільних електронних пар дорівнює:
A. 4.
B. 3.
C. 2.
D. 1.
Ступінь окислення Фосфору в ортофосфатній кислоті становить:
A. -3.
B. +3.
C. +5.
D. 0.
Як правило, речовинам з металічним типом хімічного зв’язку не характерним є :
A. Електропровідність.
B. Теплопровідність.
C. Крихкість.
D. Пластичність.
Йонний зв’язок має:
A. Кальцію хлорид.
B. Вода.
C. Озон.
D. Аміак.
Хімічні зв’язки між атомами в молекулах Br2 і HBr відрізняються:
A. Числом спільних електронних пар.
B. Зміщенням спільної електронної пари до атома з більшою електронегативністю.
C. Числом валентних електронів у атомів гідрогену і брому.
D. Числом електронів, що беруть участь в утворенні зв’язку.
Найбільшу електронегативність має атом, електронна формула якого:
A. 1s22s22p1.
B. 1s22s22p6.
C. 1s22s22p4.
D. 1s22s22p2.
Ряду речовин: кухонна сіль - алмаз - вуглекислий газ, - відповідає наступна послідовність типів кристалічних граток:
A. Йонна, металічна, молекулярна.
B. Йонна, атомна, молекулярна.
C. Молекулярна, атомна, йонна.
D. Йонна, молекулярна, атомна.
Електрони, які знаходяться в металічній кристалічній гратці:
A. Вільно переміщуються між всіма йонами і атомами.
B. Жорстко закріплені між всіма йонами і атомами.
C. Попарно закріплені між йонами і атомами.
D. Зв’язують сильно електронегативний елемент та активний атом Гідрогену.
Речовина, у вузлах кристалічної гратки якої знаходяться частинки Mg2+ і Cl-, утворена таким типом зв’язку:
A. Ковалентним полярним.
B. Йонним.
C. Металічним.
D. Водневим.
Між атомами елементів з порядковими номерами 11 і 17 виникає зв’язок:
A. Металічний.
B. Йонний.
C. Ковалентний.
D. Донорно-акцепторний.
Утворення хімічного зв’язку в йоні амонію NH3 + H+ NH4+ відбувається:
A. Внаслідок обміну електронами між молекулою та йоном.
B. За донорно-акцепторним механізмом.
C. В результаті утворення спільної електронної пари атомів Нітрогену і Гідрогену.
