
- •Теория активных столкновений
- •Обработка графической зависимости.
- •Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле
- •(А) можно получить из значения е и любой точки по k.
- •Рассчитаем значение стерического множителя по формуле
- •Теория активированного комплекса для бимолекулярной реакции.
- •Для реакции в газовой фазе
- •Уравнение связи.
Теория активных столкновений
У р а в н е н и е А р р е н и у с а.
Скорость химических реакций обычно
сильно зависит от температуры. Так, по
правилу Вант - Гоффа для реакций в
растворах при повышении температуры
на десять градусов скорость увеличивается
в 2-3 раза. Математически зависимость
константы скорости от температуры
выражается экспоненциальным уравнением
Аррениуса k
= Аexp(-![]() ),
),
параметры которого называются: А - предэкспонентом, Еa - энергией активации.
В логарифмической форме уравнение Аррениуса принимает линейную форму от обратной температуры
ln k
= ln
А
−![]() = a + b*x (1)
= a + b*x (1)
a= ln А и b = – E/R
Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости.
При большем количестве опытных точек, строят график зависимости lnk = f(1/T), угловой коэффициент наклона которого равен -Е/R в соответствии с уравнением (2.2). Так как температурный интервал экспериментальных данных обычно не превышает нескольких десятков градусов, графическое определение предэкспонента А затруднено из-за необходимости далекой экстраполяции. Поэтому величину А рассчитывают аналитически из уравнения 2.1, используя экспериментальные значения k при разных температурах и найденное значение энергии активации.
П р и м е р 1
Для реакции йодистого этила с алкоголятом натрия в этиловом спирте
CH3I + C2H5O- = CH3OC2H5 + I-
найдены следующие значения константы скорости второго порядка
t, 0C |
0 |
6 |
12 |
18 |
24 |
k105, л/(молс) |
5,00 |
11,8 |
24,5 |
48,8 |
100 |
Определить энергию активации реакции и предэкспоненциальный член уравнения Аррениуса, рассчитать константу скорости при 15 о С.
Решение. Рассчитаем необходимые для построения графика величины
T, K |
273 |
279 |
285 |
291 |
297 |
T-1103, К- 1 |
3,663 |
3,584 |
3,508 |
3,436 |
3,367 |
ln k |
1,609 |
2,468 |
3,199 |
3,888 |
4,605 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна учитывать третий знак после запятой, так как область изменения аргумента составляет всего 0,3 единицы и в противном случае точность определения искомой величины не будет соответствовать точности экспериментальных данных)
Построим график ln k - 1/T и найдем угловой коэффициент его наклона (рис. 2.1)
ln k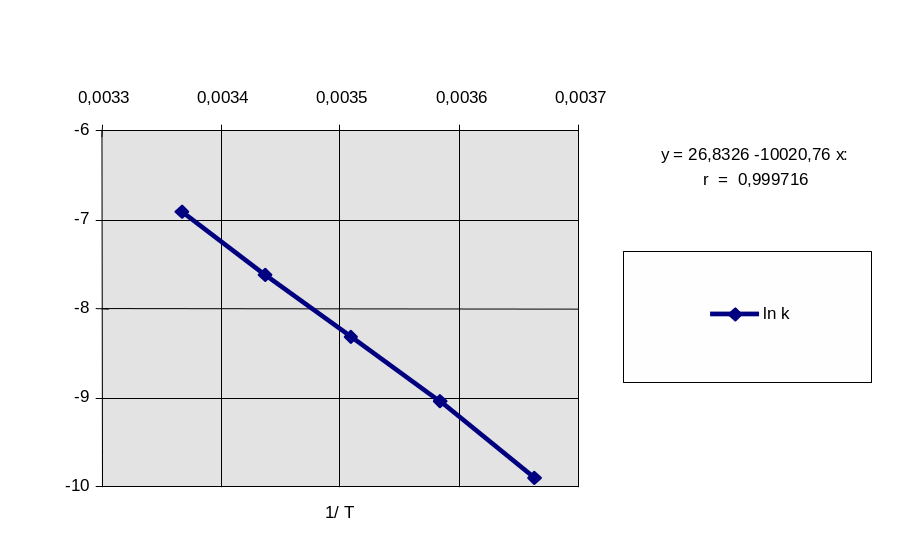
Рис. 2.1. Зависимость логарифма константы скорости реакции от обратной температуры.
Обработка графической зависимости.
Из уравнения прямой у = a + b*x = 26,8326 – 10020,76*х
Отсюда E = - R b = 8,314 Дж/(мольК) 10020,76= 83306 Дж/моль = 83,3 кДж/моль.
lnА = a = 26,83 отсюда А = 4, 50 1011 л/(мольс)
(размерность А совпадает с размерностью константы скорости соответствующего порядка).
