
- •Розділ 3 основи гідрохімії
- •3.1 Ізотопний склад і структура молекул води
- •3.2 Фізичні властивості підземних вод
- •3.3 Хімічний склад підземних вод
- •Газовий склад води
- •3.4 Хімічні аналізи підземних вод
- •3.5 Форми зображення результатів хімічних аналізів
- •3.6 Хімічні властивості води
- •Хімічна класифікація вод
- •Питання для самоперевірки
Розділ 3 основи гідрохімії
Гідрохімія – це хімія природних вод, в тому числі підземних. Всі природні води – це розчини, які вміщують розчинені солі, іони, колоїди, гази. І тому, хімічний склад води – це склад розчинених у воді речовин. Найбільше значення мають іонно-сольовий і газовий склад природних вод.
Вивчення розчинних у водах речовин дуже важливе, оскільки хімічний склад вод є основою для зіставлення, класифікації і встановлення історії природних вод, визначає корисні та шкідливі їх властивості, використовується як пошукова ознака при пошуках багатьох корисних копалин.
3.1 Ізотопний склад і структура молекул води
У воді, крім водню з атомною
вагою 1 і кисню з атомною вагою 16, присутні
водень з атомною вагою 2 (дейтерій D)
і кисень з атомною вагою 19, 18, 17, 15, 14, а
також тритій Т з атомною вагою 3. Тому
можуть утворюватись декілька сполук
кисню і водню, які формують різні види
води. Виділено 42 види води, із них 9 мають
сталий характер. В складі звичайної
води присутня деяка кількість «важкої»
води
![]() і
дуже мала кількість надважкої води
і
дуже мала кількість надважкої води
![]() .
Важка вода має більшу густину (на 10%),
в’язкість (на 20%), розчинність солей в
ній менша, ніж в звичайній, випаровування
її гірше. Тому в тропічних морях і в
глибинних зонах літосфери частка важкої
води зростає.
.
Важка вода має більшу густину (на 10%),
в’язкість (на 20%), розчинність солей в
ній менша, ніж в звичайній, випаровування
її гірше. Тому в тропічних морях і в
глибинних зонах літосфери частка важкої
води зростає.
Особливість будови молекул
води полягає в несиметричності
розташування атомів водню навколо атома
кисню. Два ядра атома водню розташовані
по кутах рівнобедреного трикутника з
ядром кисню в його вершині і поринуті
в електронну хмару з 10 електронів при
загальному радіусі молекули
![]() (рис.3.1). Внаслідок асиметрії
молекули мають два полюси – позитивний
і від’ємний, які як магніт можуть
утворювати навколо молекули силові
поля. Їх називають полярними. При
зближенні молекули притягуються, в
результаті утворюються агрегати –
дигідроль
(рис.3.1). Внаслідок асиметрії
молекули мають два полюси – позитивний
і від’ємний, які як магніт можуть
утворювати навколо молекули силові
поля. Їх називають полярними. При
зближенні молекули притягуються, в
результаті утворюються агрегати –
дигідроль
![]() і тригідроль
і тригідроль
![]() ,
пара складається з поодиноких
молекул-гідролей. Дигідроль – молекула
води в рідкому стані, тригідроль – в
твердому. Отже, формулу води треба давати
в такому вигляді
,
пара складається з поодиноких
молекул-гідролей. Дигідроль – молекула
води в рідкому стані, тригідроль – в
твердому. Отже, формулу води треба давати
в такому вигляді
![]() .
При t
.
При t
![]() вода в значній частині
складається з
,
а при нагріванні до
вода в значній частині
складається з
,
а при нагріванні до
![]() молекули переходять в
,
при цьому збільшується густина. При
підвищенні температури
переважають прості молекули, а густина
поступово зменшується.
молекули переходять в
,
при цьому збільшується густина. При
підвищенні температури
переважають прості молекули, а густина
поступово зменшується.
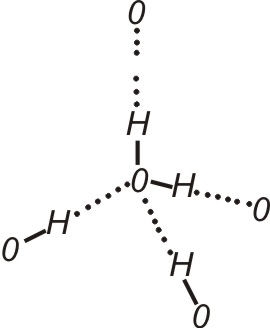
Молекули води у зв’язку із особливостями їх будови і виникненням навколо них силового поля мають здатність притягувати інші молекули. Тому вода є добрим розчинником речовин.
3.2 Фізичні властивості підземних вод
До фізичних властивостей підземних вод відносяться: температура, прозорість, колір, запах, смак, густина, в’язкість, стисливість, електропровідність, радіоактивність.
Температура підземних вод дуже різна і залежить від фізико-географічних умов, геологічної будови, режиму живлення. Температура води впливає на швидкість фізико-хімічних процесів і хімічний склад води. З підвищенням температури розчинність газів у воді зменшується.
Температура підземних вод змінюється у часі. Найбільш сильно вона коливається при неглибокому їх заляганні від поверхні; нижче пояса постійних річних температур температура підземних вод підвищується із глибиною за законом геотермічного ступеня.
Для вимірювання t
води із фонтануючої свердловини, або
свердловини, яку експлуатують глибинним
насосом, застосовують звичайний термометр
з поділкою 0,2![]() .
Для заміру температури в свердловині
застосовують електричні термометри.
.
Для заміру температури в свердловині
застосовують електричні термометри.
Температура неглибоко залягаючих підземних вод змінюється від 5 до 12ºС. Від’ємну температуру (-5ºС і нижче) можуть мати високо мінералізовані води; у районах молодої та сучасної вулканічної діяльності температура води перевищує 100ºС.
Прозорість залежить від кількості розчинених у воді мінеральних і органічних речовин, вмісту механічних домішок.
За ступенем прозорості підземні води поділяються на чотири категорії: 1) прозорі; 2) злегка каламутні; 3) каламутні; 4) дуже каламутні. Частіше підземні води виявляються прозорими.
Для визначення ступеня прозорості води в польових умовах підземну воду наливають в циліндр з прозорого скла, під дном якого розташований стандартний шрифт; прозорість вважається задовільною, якщо при висоті шару води 30 см шрифт чітко проглядається.
Рекомендується також порівнювати досліджувану воду, налиту в циліндр, із прозорою дистильованою водою, яка заповнює такий самий циліндр.
Точніше прозорість води може бути визначена в лабораторних умовах.
Колір підземної води залежить від хімічного складу і наявності домішок. Переважно підземні води безколірні. Води, які мають залізо отримують іржавий колір, сірководень – блакитний, болотні води – жовтий, марганець – чорний.
Колір води, так само як і прозорість, визначають в скляному циліндрі висотою 30-40см, дивлячись на неї зверху, або шляхом співставлення із кольором еталонного платино-кобальтового розчину.
Запах в підземних водах переважно відсутній, але інколи він відчувається. Так, наприклад, сірководень придає воді запах тухлих яєць; неглибокі підземні води, коли вони зв’язані із болотними водами, мають специфічний «болотний» запах. Встановлено, що запах води частіше пов’язаний із діяльністю бактерій, які розкладають органічні речовини.
Питна вода повинна бути без жодного запаху. Для визначення цієї властивості воду рекомендують нагрівати до 40-50º С. Підігріту воду необхідно налити в пляшку до половини, закрити її, сильно струснути 3-5 разів, після чого швидко провести визначення.
Інтенсивність запаху оцінюють за наступною шкалою в балах: 1) 0 – запаху немає; 2) 1 - дуже слабий запах; 3) 2 – слабкий; 4) 3 - помітний; 5) 4 - чіткий; 6) 5 - дуже сильний.
Смак воді придають розчинені в ній мінеральні сполуки, гази та сторонні домішки.
Якщо підземна вода містить гідрокарбонати кальцію і магнію, а також вуглекислоту, то вона має приємний смак. Велика кількість органічних речовин придає воді солодкуватий присмак; солонуватий смак обумовлений розчиненням значної кількості хлористого натрію, а гіркий - наявністю у воді сульфатів магнію та натрію. Іони заліза придають воді своєрідний «металевий» присмак.
Смак визначається у воді, підігрітій до 20-30 ºС.
Густина води ρ – це відношення її маси m до об'єму V.
ρ=![]() ,
кг/м³ .
(3.1)
,
кг/м³ .
(3.1)
За одиницю густини прийнята густина дистильованої води при t . Величина, обернена до густини, тобто відношення одиниці об'єму до одиниці маси, називається питомим об'ємом.
Густина води залежить від температури, кількості мулу, тиску, кількості розчинених газів і вимірюється ареометром або пікнометром.
Відносна густина – це
відношення густини води при
![]() до густини дистильованої води при t
4 ºС - ρ
до густини дистильованої води при t
4 ºС - ρ![]() .
Це безрозмірна величина.
.
Це безрозмірна величина.
На нафтових промислах густину
визначають в градусах солоності Боме,
якщо вода є розсолом і головна розчинена
сіль – NaCl.
1º Боме – це густина води, в 1![]() якої розчинено 10
якої розчинено 10![]() NaCl.
NaCl.
Існує формула для перерахунку солоності в градусах Боме на густину:
ρ![]() =
=![]() ,
(3.2)
,
(3.2)
де n
– солоність в градусах Боме. Визначення
солоності зводиться до визначення
загального вагового вмісту всіх
розчинених в 100![]() води солей. Заміряється ареометром-солеміром
зі шкалою в градусах Боме. Кожний градус
шкали відповідає 1% вагового вмісту у
воді хлористого натрію.
води солей. Заміряється ареометром-солеміром
зі шкалою в градусах Боме. Кожний градус
шкали відповідає 1% вагового вмісту у
воді хлористого натрію.
Стисливість
показує зміну об’єму води під дією
тиску. Ступінь стисливості пластової
води залежить від температури, кількості
газу, розчиненого у воді і хімічного
складу. Коефіцієнт стисливості β
– число, яке показує, на скільки
зменшується об'єм води при збільшенні
тиску на
![]() Па.
Па.
β=![]() ,
(3.3)
,
(3.3)
де
![]() - зміна об'єму, яка відповідає зміні
тиску
- зміна об'єму, яка відповідає зміні
тиску
![]() ;
;
![]() - початковий об'єм води.
- початковий об'єм води.
Для підземних вод величина
β змінюється в межах
(2,7![]() 5)
5)
![]() Па
( В.Н. Щолкачов)
Па
( В.Н. Щолкачов)
В'язкість води
– це здатність часток води чинити опір
її руху. Залежить від мінералізації і
температури. Чим більша мінералізація,
тим більша в'язкість. При зростанні
температури - в'язкість зменшується.
Так, в'язкість природної води при
![]() в 6 разів більша ніж її в'язкість при
100
.
Тому в пластових умовах мінералізовані
води при високих температурах є досить
рухливими. Тиск і газонасиченість мало
впливають на в'язкість води. В'язкість
визначають віскозиметром (шляхом
порівняння часу витікання досліджуваної
води і дистильованої води, які мають
однакові об'єми). В'язкість підземних
вод необхідно знати при визначенні
швидкостей руху підземних потоків.
в 6 разів більша ніж її в'язкість при
100
.
Тому в пластових умовах мінералізовані
води при високих температурах є досить
рухливими. Тиск і газонасиченість мало
впливають на в'язкість води. В'язкість
визначають віскозиметром (шляхом
порівняння часу витікання досліджуваної
води і дистильованої води, які мають
однакові об'єми). В'язкість підземних
вод необхідно знати при визначенні
швидкостей руху підземних потоків.
Розрізняють динамічну і кінематичну в’язкості.
Динамічна в’язкість
![]() в Міжнародній системі
одиниць (СІ) виражається одиницею
паскаль-секунда (Па·с). Ця одиниця досить
велика, тому в практиці в’язкість
частіше заміряють в тисячних долях
паскаль-секунда. В’язкість дистильованої
води при атмосферному тиску і кімнатній
температурі дорівнює 0,001 Па·с.
в Міжнародній системі
одиниць (СІ) виражається одиницею
паскаль-секунда (Па·с). Ця одиниця досить
велика, тому в практиці в’язкість
частіше заміряють в тисячних долях
паскаль-секунда. В’язкість дистильованої
води при атмосферному тиску і кімнатній
температурі дорівнює 0,001 Па·с.
У гідравліці в’язкість рідин
частіше виражають кінематичним
коефіцієнтом в’язкості
![]() ,
який пов’язаний з динамічним коефіцієнтом
залежністю
,
який пов’язаний з динамічним коефіцієнтом
залежністю
![]() ,
,![]() . (3.4)
. (3.4)
Одиниця кінематичної в’язкості,
яка дорівнює
![]() ,
називається стоксом.
,
називається стоксом.
Електропровідність – це здатність природної води проводити струм. Залежить від мінералізації води, її хімічного складу (вмісту електролітних солей), температури.
Дистильована вода не є провідником електричного струму. Природна вода вміщує розчин електролітів і тому вона є провідником струму.
Електропровідність води визначається питомим електричним опором. За одиницю питомого електричного опору приймають Ом·м. Для підземних вод питомий електричний опір змінюється в межах від 0,02 до 1,00 Ом·м; він знижується, коли зростає мінералізація води і температура.
Визначення електропровідності підземних вод має важливе значення для геофізичних досліджень.
Радіоактивність підземних вод викликана наявністю в них урану, радію і радону. За дуже рідким винятком всі підземні води в тій чи іншій мірі радіоактивні.
За основну одиницю вимірювання кількості радону прийнято кюрі, під якою розуміють кількість радону, що знаходиться в радіоактивній рівновазі з 1 г радію. Оскільки ця одиниця дуже велика, то частіше використовують більш дрібні: мілікюрі, мікрокюрі та ін.
